6.1.4化学电池 课件(共27张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.4化学电池 课件(共27张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-14 10:25:06 | ||
图片预览




文档简介
第六章 化学反应与能量
第四课时 化学电池
第一节 化学反应与能量变化
必修第二册
锂电池组
氢燃料电池组
[思考与交流]你能将下列电池进行简单的分类吗?
了解干电池、充电电池、燃料电池等化学电源的特点
【学习目标与核心素养】
PART
01
PART
02
体会提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重经性
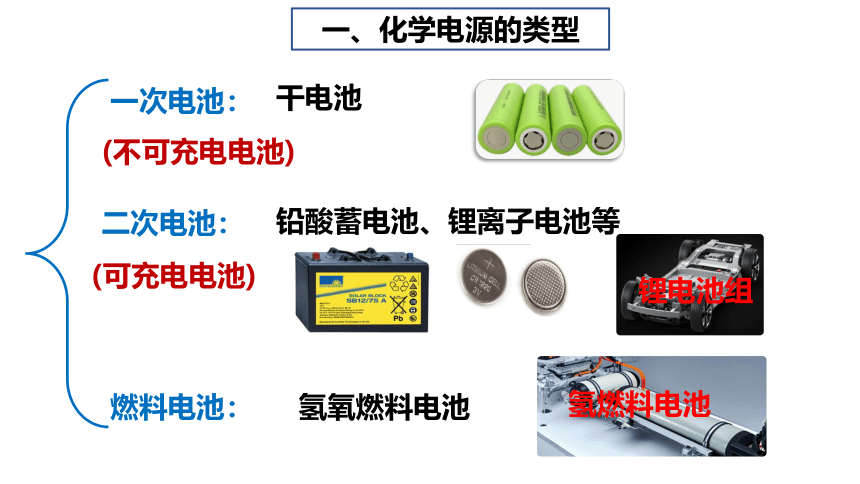
一、化学电源的类型
一次电池:
铅酸蓄电池、锂离子电池等
氢氧燃料电池
干电池
二次电池:
燃料电池:
(可充电电池)
(不可充电电池)
锂电池组
氢燃料电池
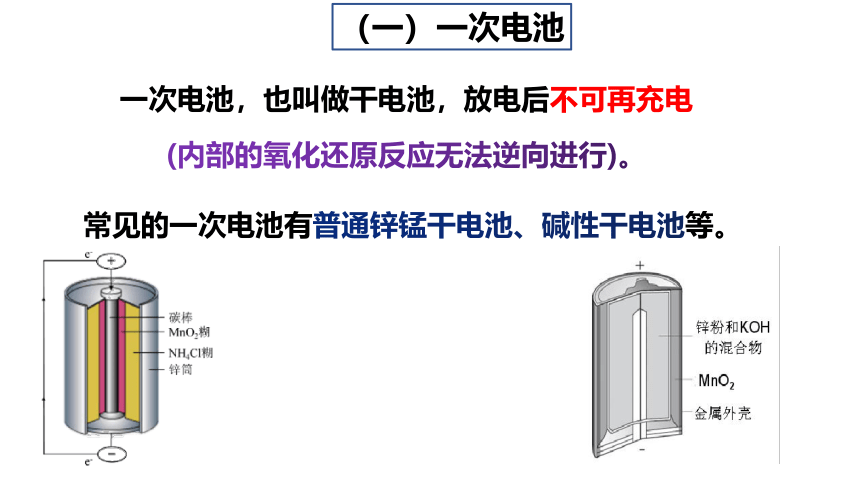
(一)一次电池
一次电池,也叫做干电池,放电后不可再充电
(内部的氧化还原反应无法逆向进行)。
常见的一次电池有普通锌锰干电池、碱性干电池等。
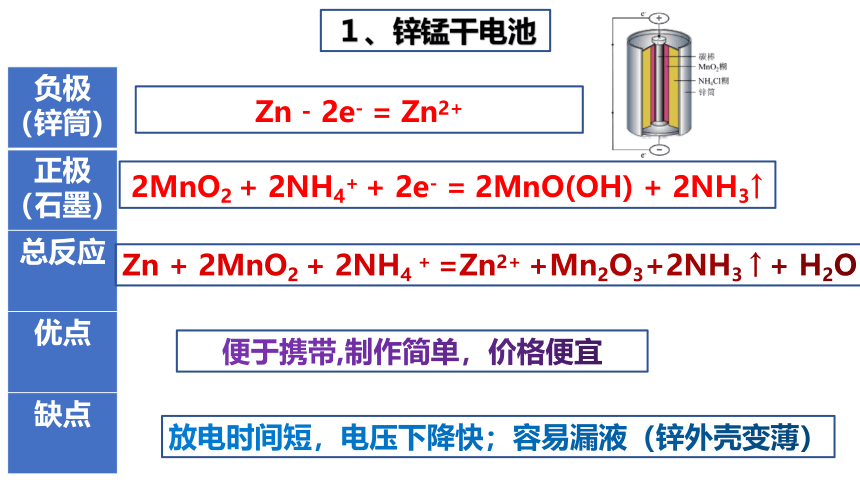
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}负极(锌筒)
正极(石墨)
总反应
优点
缺点
Zn﹣2e- = Zn2+
2MnO2 + 2NH4+ + 2e- = 2MnO(OH) + 2NH3↑
Zn + 2MnO2 + 2NH4 + =Zn2+ +Mn2O3+2NH3 ↑ + H2O
便于携带,制作简单,价格便宜
放电时间短,电压下降快;容易漏液(锌外壳变薄)
1、锌锰干电池
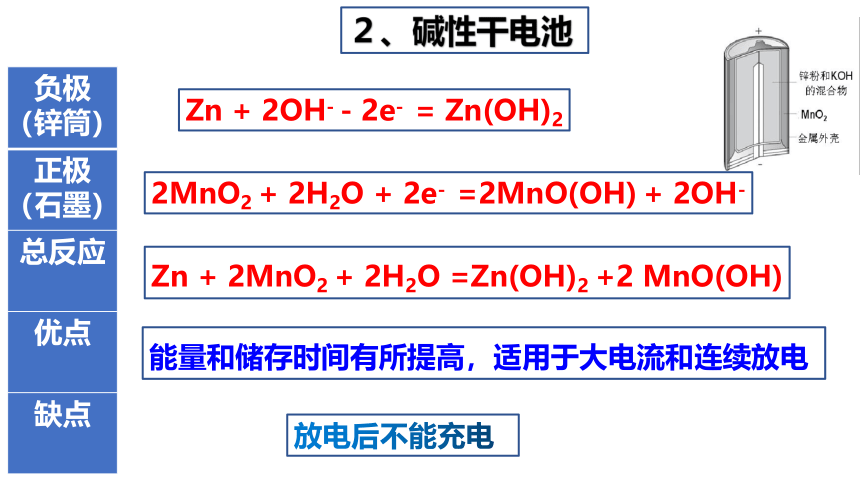
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}负极(锌筒)
正极(石墨)
总反应
优点
缺点
2、碱性干电池
Zn + 2OH- - 2e- = Zn(OH)2
2MnO2 + 2H2O + 2e- =2MnO(OH) + 2OH-
Zn + 2MnO2 + 2H2O =Zn(OH)2 +2 MnO(OH)
能量和储存时间有所提高,适用于大电流和连续放电
放电后不能充电
(二)二次电池
充电电池。也叫充电电池或蓄电池,放电时所进行的氧化还原反应,在充电时又逆向进行,使电池恢复到放电前的状态放电时,负极被氧化。正极材料的氧化物被还原,充电时的电极反应与放电时相反。
常见的充电电池有铅酸蓄电池、镍氢电池、锂离子电池等。
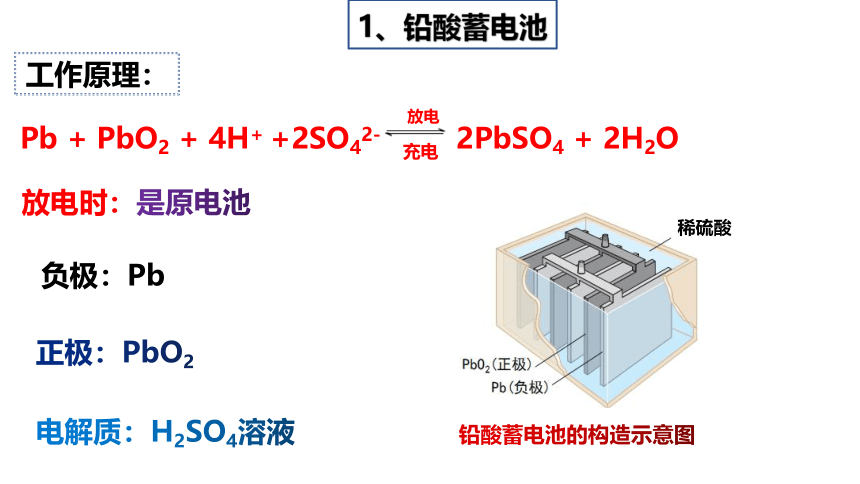
铅酸蓄电池的构造示意图
稀硫酸
负极:Pb
Pb + PbO2 + 4H+ +2SO42- 2PbSO4 + 2H2O
放电
充电
1、铅酸蓄电池
工作原理:
放电时:是原电池
电解质:H2SO4溶液
正极:PbO2
氧化反应
还原反应
放
电
负极
正极
?
总反应
?
Pb+PbO2 +2H2SO4 =2PbSO4 +2H2O
PbO2+4H+ +????????????2- +2e- = PbSO4 +2H2O
?
Pb +?????????????2-﹣2e- = PbSO4
?
用途:目前汽车上使用的电瓶大多仍是铅蓄电池,它还广泛用于国防、生产、生活等领域。
特点:铅蓄电池的电压稳定,使用方便安全可靠。
放
电
负极
正极
?
总反应
?
2、镍氢电池
H2 +2OH- —2e-= 2H2O
2NiO(OH) +2H2O +2e- = 2Ni(OH)2 +2OH-
H2 + 2NiO(OH) = 2Ni(OH)2
特点:能量密度更高,对环境基本没有污染
用途:被普及地应用在消费性电子产品中
3、锂离子电池
正极材料多采用磷酸铁锂(LiFePO4,也称磷酸亚铁锂)或钻酸锂(LiCoO2)等,一般是具有可供锂离子嵌入或脱嵌(即可逆嵌脱)结构的化合物。负极材料大多数是碳素材料,如人工石墨、碳纤维、天然石墨等。电解质溶液是锂离子的载体,是将锂盐溶解在一定的非水、非质子性的有机溶剂中制成的,其作用是在电池内部正、负极之间形成良好的离子导电通道。
放
电
负极
正极
?
总反应
?
钻酸锂—石墨锂电池
工作原理:
Li1-xCoO2 + LixC6 LiCoO2 + 6C
放电
充电
Li1-xCoO2 + LixC6 =LiCoO2 + 6C
LiC6﹣xe- =6C + xLi+
Li1-xCoO2 + xLi+ + xe- LiCoO2
①具有清洁、安全、高效等特点。
②能量转化率可以达到80%以上。
③供电量易于调节
(三)燃料电池
燃料电池是一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置。
原理:
与其他电池的区别:
反应物不储存在电池内部,由外设设备提供燃料和氧化剂
优点:
1、氢氧燃料电池
氢氧燃料电池是一种高效低污染的新型电池,主要用于航天领域。
它的电极材料一般为铂电极,活性炭电极,电解质溶液一般为为稀H2SO4或KOH溶液
电解质
H2SO4溶液
负极
正极
?
总反应
?
2H2 + O2 = 2H2O
2H2 - 4e- = 4H+
O2 + 4H+ + 4e- = 2H2O
H2 O2 (H2SO4)燃料电池
电解质
KOH溶液
负极
正极
?
总反应
?
2H2 + O2 = 2H2O
H2 O2 (KOH)燃料电池
2H2 + 4OH- - 4e- = 4H2O
O2 + 2H2O + 4e- = 4OH-
2、甲烷燃料电池
电解质
H2SO4溶液
负极
正极
?
总反应
?
CH4 + 2O2 = CO2+ 2H2O
CH4 - 8e-+ 2H2O =CO2 +8H+
2O2 + 8e- + 8H+ = 4H2O
2、甲烷燃料电池
电解质
KOH溶液
负极
正极
?
总反应
?
CH4 + 2O2 + 2OH- = CO32- + 3H2O
CH4 + 10OH- - 8e- = CO32- + 7H2O
2O2 + 4H2O + 8e- = 8OH-
【课堂小结】
1、下列几种化学电池中,不属于可充电电池的是( )
A.碱性锌锰电池
B.手机用锂电池
C.汽车用铅蓄电池
D.玩具用镍氢电池
A
【课堂同步练习】
2、下列说法正确的是( )
A.镍氢电池、锂电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.铅蓄电池放电的时候正极材料是Pb,负极材料是PbO2
C
3、LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )
A.a处通入氧气,b处通入氢气
B.通入H2的电极发生反应:H2-2e-=2H+
C.通入O2的电极为电池的正极
D.该装置将化学能最终转化为电能
C
4、银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O=2Ag+Zn(OH)2。下列说法中不正确的是( )
A.原电池放电时,负极上发生反应的物质是Zn
B.负极发生的反应是Zn+2OH--2e-= Zn(OH)2
C.工作时,负极区溶液碱性减弱,正极区溶液碱性增强
D.溶液中的OH-向正极移动,K+、H+向负极移动
D
5、下列说法中正确的是( )
①燃料电池的反应物可不储存在电池的内部
②锌锰干电池是一次电池,铅蓄电池是二次电池
③锂电池是新一代可充电电池
④燃料电池作为汽车驱动能源已研制成功
A.②③④ B.①②③④
C.①②③ D.①③④
B
【知识扩展】化学与职业电池研发人员
电池研发与生产、生活和军事等领域的发展密切相关。电池研发人员的工作包括电池构成材料的研制、电池性能的改进和应用的拓展等。以燃料电池为例,研发中需要研究电极、电解质等电池基本构成材料的性质和材料之间的相容性;研究不同类型的电池构成材料在不同用途时对温度、湿度等环境因素的适应性;还要研究使用什么样的电池材料使电池的容量更大;等等。这些研究工作关系着电池的效率、寿命、安全性、适用性和制造成本。在许多科研机构和生产企业中,都有具备着扎实的化学基础的研究人员从事电池研发工作。
谢谢欣赏
第四课时 化学电池
第一节 化学反应与能量变化
必修第二册
锂电池组
氢燃料电池组
[思考与交流]你能将下列电池进行简单的分类吗?
了解干电池、充电电池、燃料电池等化学电源的特点
【学习目标与核心素养】
PART
01
PART
02
体会提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重经性
一、化学电源的类型
一次电池:
铅酸蓄电池、锂离子电池等
氢氧燃料电池
干电池
二次电池:
燃料电池:
(可充电电池)
(不可充电电池)
锂电池组
氢燃料电池
(一)一次电池
一次电池,也叫做干电池,放电后不可再充电
(内部的氧化还原反应无法逆向进行)。
常见的一次电池有普通锌锰干电池、碱性干电池等。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}负极(锌筒)
正极(石墨)
总反应
优点
缺点
Zn﹣2e- = Zn2+
2MnO2 + 2NH4+ + 2e- = 2MnO(OH) + 2NH3↑
Zn + 2MnO2 + 2NH4 + =Zn2+ +Mn2O3+2NH3 ↑ + H2O
便于携带,制作简单,价格便宜
放电时间短,电压下降快;容易漏液(锌外壳变薄)
1、锌锰干电池
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}负极(锌筒)
正极(石墨)
总反应
优点
缺点
2、碱性干电池
Zn + 2OH- - 2e- = Zn(OH)2
2MnO2 + 2H2O + 2e- =2MnO(OH) + 2OH-
Zn + 2MnO2 + 2H2O =Zn(OH)2 +2 MnO(OH)
能量和储存时间有所提高,适用于大电流和连续放电
放电后不能充电
(二)二次电池
充电电池。也叫充电电池或蓄电池,放电时所进行的氧化还原反应,在充电时又逆向进行,使电池恢复到放电前的状态放电时,负极被氧化。正极材料的氧化物被还原,充电时的电极反应与放电时相反。
常见的充电电池有铅酸蓄电池、镍氢电池、锂离子电池等。
铅酸蓄电池的构造示意图
稀硫酸
负极:Pb
Pb + PbO2 + 4H+ +2SO42- 2PbSO4 + 2H2O
放电
充电
1、铅酸蓄电池
工作原理:
放电时:是原电池
电解质:H2SO4溶液
正极:PbO2
氧化反应
还原反应
放
电
负极
正极
?
总反应
?
Pb+PbO2 +2H2SO4 =2PbSO4 +2H2O
PbO2+4H+ +????????????2- +2e- = PbSO4 +2H2O
?
Pb +?????????????2-﹣2e- = PbSO4
?
用途:目前汽车上使用的电瓶大多仍是铅蓄电池,它还广泛用于国防、生产、生活等领域。
特点:铅蓄电池的电压稳定,使用方便安全可靠。
放
电
负极
正极
?
总反应
?
2、镍氢电池
H2 +2OH- —2e-= 2H2O
2NiO(OH) +2H2O +2e- = 2Ni(OH)2 +2OH-
H2 + 2NiO(OH) = 2Ni(OH)2
特点:能量密度更高,对环境基本没有污染
用途:被普及地应用在消费性电子产品中
3、锂离子电池
正极材料多采用磷酸铁锂(LiFePO4,也称磷酸亚铁锂)或钻酸锂(LiCoO2)等,一般是具有可供锂离子嵌入或脱嵌(即可逆嵌脱)结构的化合物。负极材料大多数是碳素材料,如人工石墨、碳纤维、天然石墨等。电解质溶液是锂离子的载体,是将锂盐溶解在一定的非水、非质子性的有机溶剂中制成的,其作用是在电池内部正、负极之间形成良好的离子导电通道。
放
电
负极
正极
?
总反应
?
钻酸锂—石墨锂电池
工作原理:
Li1-xCoO2 + LixC6 LiCoO2 + 6C
放电
充电
Li1-xCoO2 + LixC6 =LiCoO2 + 6C
LiC6﹣xe- =6C + xLi+
Li1-xCoO2 + xLi+ + xe- LiCoO2
①具有清洁、安全、高效等特点。
②能量转化率可以达到80%以上。
③供电量易于调节
(三)燃料电池
燃料电池是一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置。
原理:
与其他电池的区别:
反应物不储存在电池内部,由外设设备提供燃料和氧化剂
优点:
1、氢氧燃料电池
氢氧燃料电池是一种高效低污染的新型电池,主要用于航天领域。
它的电极材料一般为铂电极,活性炭电极,电解质溶液一般为为稀H2SO4或KOH溶液
电解质
H2SO4溶液
负极
正极
?
总反应
?
2H2 + O2 = 2H2O
2H2 - 4e- = 4H+
O2 + 4H+ + 4e- = 2H2O
H2 O2 (H2SO4)燃料电池
电解质
KOH溶液
负极
正极
?
总反应
?
2H2 + O2 = 2H2O
H2 O2 (KOH)燃料电池
2H2 + 4OH- - 4e- = 4H2O
O2 + 2H2O + 4e- = 4OH-
2、甲烷燃料电池
电解质
H2SO4溶液
负极
正极
?
总反应
?
CH4 + 2O2 = CO2+ 2H2O
CH4 - 8e-+ 2H2O =CO2 +8H+
2O2 + 8e- + 8H+ = 4H2O
2、甲烷燃料电池
电解质
KOH溶液
负极
正极
?
总反应
?
CH4 + 2O2 + 2OH- = CO32- + 3H2O
CH4 + 10OH- - 8e- = CO32- + 7H2O
2O2 + 4H2O + 8e- = 8OH-
【课堂小结】
1、下列几种化学电池中,不属于可充电电池的是( )
A.碱性锌锰电池
B.手机用锂电池
C.汽车用铅蓄电池
D.玩具用镍氢电池
A
【课堂同步练习】
2、下列说法正确的是( )
A.镍氢电池、锂电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.铅蓄电池放电的时候正极材料是Pb,负极材料是PbO2
C
3、LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )
A.a处通入氧气,b处通入氢气
B.通入H2的电极发生反应:H2-2e-=2H+
C.通入O2的电极为电池的正极
D.该装置将化学能最终转化为电能
C
4、银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O=2Ag+Zn(OH)2。下列说法中不正确的是( )
A.原电池放电时,负极上发生反应的物质是Zn
B.负极发生的反应是Zn+2OH--2e-= Zn(OH)2
C.工作时,负极区溶液碱性减弱,正极区溶液碱性增强
D.溶液中的OH-向正极移动,K+、H+向负极移动
D
5、下列说法中正确的是( )
①燃料电池的反应物可不储存在电池的内部
②锌锰干电池是一次电池,铅蓄电池是二次电池
③锂电池是新一代可充电电池
④燃料电池作为汽车驱动能源已研制成功
A.②③④ B.①②③④
C.①②③ D.①③④
B
【知识扩展】化学与职业电池研发人员
电池研发与生产、生活和军事等领域的发展密切相关。电池研发人员的工作包括电池构成材料的研制、电池性能的改进和应用的拓展等。以燃料电池为例,研发中需要研究电极、电解质等电池基本构成材料的性质和材料之间的相容性;研究不同类型的电池构成材料在不同用途时对温度、湿度等环境因素的适应性;还要研究使用什么样的电池材料使电池的容量更大;等等。这些研究工作关系着电池的效率、寿命、安全性、适用性和制造成本。在许多科研机构和生产企业中,都有具备着扎实的化学基础的研究人员从事电池研发工作。
谢谢欣赏
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
