第三章第三节 醛酮 第1课时 乙醛的结构和性质 课件(共22张PPT) 2022-2023学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 第三章第三节 醛酮 第1课时 乙醛的结构和性质 课件(共22张PPT) 2022-2023学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-14 10:41:49 | ||
图片预览








文档简介
(共22张PPT)
走进奇妙的化学世界
选择性必修3
第三章 烃的衍生物
第三节 醛 酮
学习
目标
第1课时
乙醛的结构与性质
PART
01
PART
02
从官能团和化学键可能的断键部位预测乙醛的化学性质,并能在结构分析和实验事实的基础上书写相关反应的化学方程式,强化“结构决定性质”的观念
通过乙醇、乙醛和乙酸之间的相互转化,加深对有机反应中氧化反应和还原反应的理解,初步构建烃的含氧衍生物间的转化关系
自然界的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用。
醛
醛基与烃基(或H原子)直接相连的化合物称为醛。 简写为:R—CHO
-CHO 不能写成-COH
CnH2nO (n≥1 )或CnH2n+1CHO
3.饱和一元醛通式:
2.官能团:
1.定义:
1.乙醛的物理性质与结构
①无色、有刺激性气味的液体;
②密度比水小,沸点是20.8℃;
③易挥发,易燃烧;
④易溶于水、乙醇、乙醚、氯仿等有机溶剂。
一、乙醛
(1)物理性质
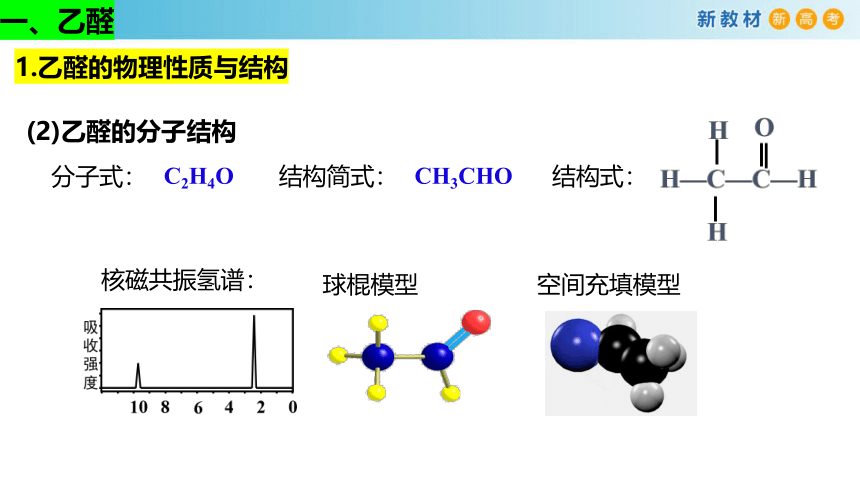
分子式:
C2H4O
结构式:
结构简式:
CH3CHO
空间充填模型
球棍模型
核磁共振氢谱:
1.乙醛的物理性质与结构
一、乙醛
(2)乙醛的分子结构
结构分析
受C=O影响,C-H键极性较强,易断裂
羰基
羰基碳不饱和,C=O双键易断裂,可发生加成反应。
易加成被H2还原为醇(还原反应)
易被氧化成相应羧酸(氧化反应)
氧化性
还原性
(以乙醛为例)
乙醛的化学性质
一、乙醛
1、醛基的加成反应
→
+
+
C
O
δ
δ
-
A—B
δ+
δ-
O
A
C
B
双键变单键,异性相吸
羰基可与H2、HCN、NH3及氨的衍生物、醇发生加成反应。但羰基不能和HX、X2、H2O发生加成反应。
一、乙醛
(以乙醛为例)
乙醛的化学性质
有机物得氢或去氧, 发生还原反应
有机物得氧或去氢, 发生氧化反应
(催化加氢又称为还原反应)
①催化加氢:(条件为催化剂、加热)
CH3CH2OH
【注意】①乙醛不能与X2、HX、H2O进行加成反应
②酯基(-COO-)和羧基 (-COOH) 中的C=O不能与H2发生加成反应
一、乙醛
(以乙醛为例)
乙醛的化学性质
δ+
δ-
+H—CN →
—C—CN
OH
α-羟基腈
②与HCN加成:
应用:醛与氢氰酸加成,在有机合成中可以用来增长碳链。
(以乙醛为例)
乙醛的化学性质
一、乙醛
在醛基中,由于氧原子电负性较大,碳氧双键中电子偏向氧原子,使氧原子带部分负电荷,碳原子带部分正电荷,从而使醛基具有较强的极性。乙醛能和极性试剂发生加成反应。
CH3─C─H
O
δ+
δ
+ H─CN→
δ
δ+
CH3─CH─CN
OH
2 羟基丙腈
当极性分子与醛基发生加成反应时,极性分子中带正电荷的原子或原
子团连接在氧原子上,带负电荷的原子或原子团连接在碳原子上。
能与一些极性试剂(如:H CN、 NH3、R NH2、CH3O H等)发生加成反应。
拓展:与NH3、醇的加成反应:
CH3—C—H+H—NH2→
O
=
CH3—C—H+H—OCH3→
O
=
OH
CH3—CH—NH2
OH
CH3—C—OCH3
H
1、醛基的加成反应
一、乙醛
(以乙醛为例)
乙醛的化学性质
醛基中碳原子具有较强还原性,易被氧化,产物通常为相应的羧酸。
2、醛基的氧化反应
一、乙醛
(以乙醛为例)
乙醛的化学性质
(1)与 O2 的反应
(4)与银氨溶液的反应
(5)与新制Cu(OH)2悬浊液的反应
(2)与KMnO4(H+)的反应
(3)与溴水的反应
弱氧化剂
(1)与 O2 的反应
(2)与KMnO4(H+)的反应
(3)可使溴水褪色
酸性K2Cr2O7溶液: Cr2O72- (橙色) Cr3+(绿色)
褪色
5CH3CHO + 2KMnO4 + 3H2SO4 = 5CH3COOH + 2MnSO4 + 3H2O + K2SO4
但不能使溴的四氯化碳溶液褪色
加入乙醛溶液
2、醛基的氧化反应
一、乙醛
(以乙醛为例)
乙醛的化学性质
加入乙醛溶液
实验方案:在洁净的试管中加入1 mL2% AgNO3溶液,然后边振荡试管边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。再滴入3滴乙醛,振荡后将试管放在热水浴中温热。观察实验现象。
【实验3-7】
(4)与银氨溶液的反应(银镜反应)
2、醛基的氧化反应
一、乙醛
a、配制银氨溶液:
AgNO3溶液+稀氨水
生成白色沉淀
继续滴加氨水
沉淀恰好完全溶解
AgNO3+NH3·H2O = AgOH↓+NH4NO3
AgOH+2NH3·H2O = [Ag(NH3)2] OH+2H2O
(氢氧化二氨合银)
b、水浴加热生成银镜:向配好的银氨溶液中滴入3滴乙醛溶液,振荡后将试管放在热水浴中静置。。
(4)与银氨溶液的反应(银镜反应)
2、醛基的氧化反应
一、乙醛
现象:试管内壁上覆着一层光亮的银镜
银氨络(合)离子
巧记方程式:水银氨123,还有一个羧酸铵
定量:
1mol -CHO ~ 2mol [Ag(NH3)2]OH ~ 2mol Ag
应用:
(4)与银氨溶液的反应(银镜反应)
2、醛基的氧化反应
一、乙醛
①制备银氨溶液时,试剂滴加顺序不能颠倒,且氨水不能过量
②银氨溶液必须是新制的(现用现配)
③试管内壁必须洁净,用水浴加热,不能用酒精灯直接加热;④加热时不能振荡或摇动试管;
⑤可以用稀HNO3清洗做过银镜反应后的试管。
银镜反应实验注意事项:
(1)检验醛基,并测定醛基的个数【牢记】1–CHO~2 [Ag(NH3)2]OH~ 1H2O~ 2Ag~ 3NH3
(2)制镜或水瓶胆
【课堂练习】完成下列化学方程式:
①CH3CH2CHO + [Ag(NH3)2]OH
③ HCHO + [Ag(NH3)2]OH
HCHO+ 4Ag(NH3)2OH (NH4)2CO3+2H2O+4Ag↓+6NH3
△
CH3CH2CHO+ 2Ag(NH3)2OH CH3CH2COONH4+H2O+2Ag↓+3NH3
Δ
② + + [Ag(NH3)2]OH
+2[Ag(NH3)2]OH H2O+ 2Ag↓+3NH3 +
△
COONH4
(4)与银氨溶液的反应(银镜反应)
2、醛基的氧化反应
一、乙醛
实验方案:在试管里加入2 mL 10% NaOH溶液,加入5滴5%CuSO4溶液,得到新制的Cu(OH)2,振荡后加入0.5 mL乙醛溶液,加热。观察实验现象。
【实验3-7】
(5)与新制的Cu(OH)2悬浊液的反应
2、醛基的氧化反应
一、乙醛
A中产生蓝色沉淀
C中产生砖红色色沉淀
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
CH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O
结论:新制的 Cu(OH)2是一种弱氧化剂。能氧化乙醛
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
砖红色沉淀
定量:
1mol —CHO → 2mol Cu(OH)2 → 1mol Cu2O
【注意】
(5)与新制的Cu(OH)2悬浊液的反应
2、醛基的氧化反应
一、乙醛
①氢氧化铜溶液一定要新制
②碱一定要过量
①可以用来检验是否存在醛基并可以确定醛基的个数。
1 –CHO~ 2Cu(OH) 2~ 1NaOH~ 1Cu2O~ 3H2O
②医学上检验病人是否患糖尿病
【应用】
【课堂练习】完成下列化学方程式
①CH3CH2CHO + Cu(OH)2 + NaOH
③ HCHO + Cu(OH)2 + NaOH
② + + Cu(OH)2 + NaOH
CH3CH2CHO + 2Cu(OH)2 + NaOH CH3CH2COONa + Cu2O↓ + 3H2O
+ 2Cu(OH)2 + NaOH
COONa
+ Cu2O↓ + 3H2O
HCHO+4Cu(OH)2+2NaOH Na2CO3 + 2Cu2O↓ + 6H2O
(5)与新制的Cu(OH)2悬浊液的反应
2、醛基的氧化反应
一、乙醛
【小结】醛类的两个特征反应及—CHO的检验
特征反应 银镜反应 与新制的Cu(OH)2反应
现象 产生 。 产生 沉淀
注意事项 ①试管内壁必须洁净 ②银氨溶液随用随配,不可久置 ③ 加热,不可用酒精灯直接加热 ④醛用量不宜太多 ⑤银镜可用 浸泡洗涤除去 ①新制的Cu(OH)2要随用随配,不可久置
②配制新制的Cu(OH)2时,所用NaOH溶液必须过量
③加热至沸腾,但温度不能过高否则会有黑色的氧化铜生成。
共同点 ①两个反应都必须在 性环境中进行 ②-CHO与[Ag(NH3)2]OH或Cu(OH)2均以物质的量比 反应 银镜
砖红色
水浴
稀HNO3
碱
1:2
可以检验醛基的物质:醛类、甲酸、甲酸酯、葡萄糖等还原糖。
拓展补充:乙醛的工业制法
CH≡CH + H2O
催化剂
△
CH3-CHO
2CH2=CH2 + O2
催化剂
2CH3-CHO
加热加压
2CH3CH2OH + O2 + 2H2O
2CH3-CHO
催化剂
△
乙醇氧化法:
乙炔水化法:
乙烯氧化法:
一、乙醛
走进奇妙的化学世界
选择性必修3
第三章 烃的衍生物
第三节 醛 酮
学习
目标
第1课时
乙醛的结构与性质
PART
01
PART
02
从官能团和化学键可能的断键部位预测乙醛的化学性质,并能在结构分析和实验事实的基础上书写相关反应的化学方程式,强化“结构决定性质”的观念
通过乙醇、乙醛和乙酸之间的相互转化,加深对有机反应中氧化反应和还原反应的理解,初步构建烃的含氧衍生物间的转化关系
自然界的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用。
醛
醛基与烃基(或H原子)直接相连的化合物称为醛。 简写为:R—CHO
-CHO 不能写成-COH
CnH2nO (n≥1 )或CnH2n+1CHO
3.饱和一元醛通式:
2.官能团:
1.定义:
1.乙醛的物理性质与结构
①无色、有刺激性气味的液体;
②密度比水小,沸点是20.8℃;
③易挥发,易燃烧;
④易溶于水、乙醇、乙醚、氯仿等有机溶剂。
一、乙醛
(1)物理性质
分子式:
C2H4O
结构式:
结构简式:
CH3CHO
空间充填模型
球棍模型
核磁共振氢谱:
1.乙醛的物理性质与结构
一、乙醛
(2)乙醛的分子结构
结构分析
受C=O影响,C-H键极性较强,易断裂
羰基
羰基碳不饱和,C=O双键易断裂,可发生加成反应。
易加成被H2还原为醇(还原反应)
易被氧化成相应羧酸(氧化反应)
氧化性
还原性
(以乙醛为例)
乙醛的化学性质
一、乙醛
1、醛基的加成反应
→
+
+
C
O
δ
δ
-
A—B
δ+
δ-
O
A
C
B
双键变单键,异性相吸
羰基可与H2、HCN、NH3及氨的衍生物、醇发生加成反应。但羰基不能和HX、X2、H2O发生加成反应。
一、乙醛
(以乙醛为例)
乙醛的化学性质
有机物得氢或去氧, 发生还原反应
有机物得氧或去氢, 发生氧化反应
(催化加氢又称为还原反应)
①催化加氢:(条件为催化剂、加热)
CH3CH2OH
【注意】①乙醛不能与X2、HX、H2O进行加成反应
②酯基(-COO-)和羧基 (-COOH) 中的C=O不能与H2发生加成反应
一、乙醛
(以乙醛为例)
乙醛的化学性质
δ+
δ-
+H—CN →
—C—CN
OH
α-羟基腈
②与HCN加成:
应用:醛与氢氰酸加成,在有机合成中可以用来增长碳链。
(以乙醛为例)
乙醛的化学性质
一、乙醛
在醛基中,由于氧原子电负性较大,碳氧双键中电子偏向氧原子,使氧原子带部分负电荷,碳原子带部分正电荷,从而使醛基具有较强的极性。乙醛能和极性试剂发生加成反应。
CH3─C─H
O
δ+
δ
+ H─CN→
δ
δ+
CH3─CH─CN
OH
2 羟基丙腈
当极性分子与醛基发生加成反应时,极性分子中带正电荷的原子或原
子团连接在氧原子上,带负电荷的原子或原子团连接在碳原子上。
能与一些极性试剂(如:H CN、 NH3、R NH2、CH3O H等)发生加成反应。
拓展:与NH3、醇的加成反应:
CH3—C—H+H—NH2→
O
=
CH3—C—H+H—OCH3→
O
=
OH
CH3—CH—NH2
OH
CH3—C—OCH3
H
1、醛基的加成反应
一、乙醛
(以乙醛为例)
乙醛的化学性质
醛基中碳原子具有较强还原性,易被氧化,产物通常为相应的羧酸。
2、醛基的氧化反应
一、乙醛
(以乙醛为例)
乙醛的化学性质
(1)与 O2 的反应
(4)与银氨溶液的反应
(5)与新制Cu(OH)2悬浊液的反应
(2)与KMnO4(H+)的反应
(3)与溴水的反应
弱氧化剂
(1)与 O2 的反应
(2)与KMnO4(H+)的反应
(3)可使溴水褪色
酸性K2Cr2O7溶液: Cr2O72- (橙色) Cr3+(绿色)
褪色
5CH3CHO + 2KMnO4 + 3H2SO4 = 5CH3COOH + 2MnSO4 + 3H2O + K2SO4
但不能使溴的四氯化碳溶液褪色
加入乙醛溶液
2、醛基的氧化反应
一、乙醛
(以乙醛为例)
乙醛的化学性质
加入乙醛溶液
实验方案:在洁净的试管中加入1 mL2% AgNO3溶液,然后边振荡试管边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。再滴入3滴乙醛,振荡后将试管放在热水浴中温热。观察实验现象。
【实验3-7】
(4)与银氨溶液的反应(银镜反应)
2、醛基的氧化反应
一、乙醛
a、配制银氨溶液:
AgNO3溶液+稀氨水
生成白色沉淀
继续滴加氨水
沉淀恰好完全溶解
AgNO3+NH3·H2O = AgOH↓+NH4NO3
AgOH+2NH3·H2O = [Ag(NH3)2] OH+2H2O
(氢氧化二氨合银)
b、水浴加热生成银镜:向配好的银氨溶液中滴入3滴乙醛溶液,振荡后将试管放在热水浴中静置。。
(4)与银氨溶液的反应(银镜反应)
2、醛基的氧化反应
一、乙醛
现象:试管内壁上覆着一层光亮的银镜
银氨络(合)离子
巧记方程式:水银氨123,还有一个羧酸铵
定量:
1mol -CHO ~ 2mol [Ag(NH3)2]OH ~ 2mol Ag
应用:
(4)与银氨溶液的反应(银镜反应)
2、醛基的氧化反应
一、乙醛
①制备银氨溶液时,试剂滴加顺序不能颠倒,且氨水不能过量
②银氨溶液必须是新制的(现用现配)
③试管内壁必须洁净,用水浴加热,不能用酒精灯直接加热;④加热时不能振荡或摇动试管;
⑤可以用稀HNO3清洗做过银镜反应后的试管。
银镜反应实验注意事项:
(1)检验醛基,并测定醛基的个数【牢记】1–CHO~2 [Ag(NH3)2]OH~ 1H2O~ 2Ag~ 3NH3
(2)制镜或水瓶胆
【课堂练习】完成下列化学方程式:
①CH3CH2CHO + [Ag(NH3)2]OH
③ HCHO + [Ag(NH3)2]OH
HCHO+ 4Ag(NH3)2OH (NH4)2CO3+2H2O+4Ag↓+6NH3
△
CH3CH2CHO+ 2Ag(NH3)2OH CH3CH2COONH4+H2O+2Ag↓+3NH3
Δ
② + + [Ag(NH3)2]OH
+2[Ag(NH3)2]OH H2O+ 2Ag↓+3NH3 +
△
COONH4
(4)与银氨溶液的反应(银镜反应)
2、醛基的氧化反应
一、乙醛
实验方案:在试管里加入2 mL 10% NaOH溶液,加入5滴5%CuSO4溶液,得到新制的Cu(OH)2,振荡后加入0.5 mL乙醛溶液,加热。观察实验现象。
【实验3-7】
(5)与新制的Cu(OH)2悬浊液的反应
2、醛基的氧化反应
一、乙醛
A中产生蓝色沉淀
C中产生砖红色色沉淀
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
CH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O
结论:新制的 Cu(OH)2是一种弱氧化剂。能氧化乙醛
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
砖红色沉淀
定量:
1mol —CHO → 2mol Cu(OH)2 → 1mol Cu2O
【注意】
(5)与新制的Cu(OH)2悬浊液的反应
2、醛基的氧化反应
一、乙醛
①氢氧化铜溶液一定要新制
②碱一定要过量
①可以用来检验是否存在醛基并可以确定醛基的个数。
1 –CHO~ 2Cu(OH) 2~ 1NaOH~ 1Cu2O~ 3H2O
②医学上检验病人是否患糖尿病
【应用】
【课堂练习】完成下列化学方程式
①CH3CH2CHO + Cu(OH)2 + NaOH
③ HCHO + Cu(OH)2 + NaOH
② + + Cu(OH)2 + NaOH
CH3CH2CHO + 2Cu(OH)2 + NaOH CH3CH2COONa + Cu2O↓ + 3H2O
+ 2Cu(OH)2 + NaOH
COONa
+ Cu2O↓ + 3H2O
HCHO+4Cu(OH)2+2NaOH Na2CO3 + 2Cu2O↓ + 6H2O
(5)与新制的Cu(OH)2悬浊液的反应
2、醛基的氧化反应
一、乙醛
【小结】醛类的两个特征反应及—CHO的检验
特征反应 银镜反应 与新制的Cu(OH)2反应
现象 产生 。 产生 沉淀
注意事项 ①试管内壁必须洁净 ②银氨溶液随用随配,不可久置 ③ 加热,不可用酒精灯直接加热 ④醛用量不宜太多 ⑤银镜可用 浸泡洗涤除去 ①新制的Cu(OH)2要随用随配,不可久置
②配制新制的Cu(OH)2时,所用NaOH溶液必须过量
③加热至沸腾,但温度不能过高否则会有黑色的氧化铜生成。
共同点 ①两个反应都必须在 性环境中进行 ②-CHO与[Ag(NH3)2]OH或Cu(OH)2均以物质的量比 反应 银镜
砖红色
水浴
稀HNO3
碱
1:2
可以检验醛基的物质:醛类、甲酸、甲酸酯、葡萄糖等还原糖。
拓展补充:乙醛的工业制法
CH≡CH + H2O
催化剂
△
CH3-CHO
2CH2=CH2 + O2
催化剂
2CH3-CHO
加热加压
2CH3CH2OH + O2 + 2H2O
2CH3-CHO
催化剂
△
乙醇氧化法:
乙炔水化法:
乙烯氧化法:
一、乙醛
