第三章 第三节 醛酮第2课时 醛类 酮的结构与性质 课件 (共19张PPT)2022-2023学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 第三章 第三节 醛酮第2课时 醛类 酮的结构与性质 课件 (共19张PPT)2022-2023学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-14 10:43:03 | ||
图片预览






文档简介
(共19张PPT)
走进奇妙的化学世界
选择性必修3
第三章 烃的衍生物
第三节 醛 酮
学习
目标
第2课时
醛类 酮的结构与性质
PART
01
PART
02
能根据官能团的特点和性质区别醛和酮,以丙酮为例认识酮的主要化学性质
能列举甲醛、苯甲醛和丙酮等代表物在生活中的应用,分析和探讨这些物质对人类健康和社会发展可能带来的双重影响
1、常见的醛和酮
醛分子:羰基碳原子分别与氢原子和烃基(或氢原子)相连。
官能团是醛基( 或 )。
醛和酮都是分子中含有羰基的化合物。
C H
O
酮分子:与羰基碳原子相连的两个基团均为烃基,烃基可以
相同也可以不同。
官能团是酮羰基( )。
C R’
O
R
认识醛和酮
—CHO
命名规则
(1)选取分子中连有醛基或酮羰基的最长碳链作为主链,按照
主链所含碳原子数称为“某醛”或“某酮” 。
(2)从醛基开始或距离酮羰基最近的一端给主链碳原子编号。
(3)在“某醛”或“某酮”之前加上取代基的位次号和名称。
2、醛、酮的命名
O
CH3—CH2—C—CH2—CH3
3-戊酮
CH3—CH—CH2—CHO
CH3
3-甲基丁醛
认识醛和酮
甲醛
HCHO
—CH=CH—CHO
肉桂醛
—CHO
最简单的芳香醛,
俗称苦杏仁油
肉桂醛是一种食用香料,广泛用于牙膏、洗涤剂、糖果和调味品中。
苯甲醛
最简单的醛
生活中常见的醛
二、醛类
1、甲醛
又称蚁醛
无色、有强烈刺激性气味的气体
易溶于水
甲醛水溶液(又称福尔马林),具有杀菌、防腐性能,
可用于消毒和制作标本。
物理性质:
用途
二、醛类
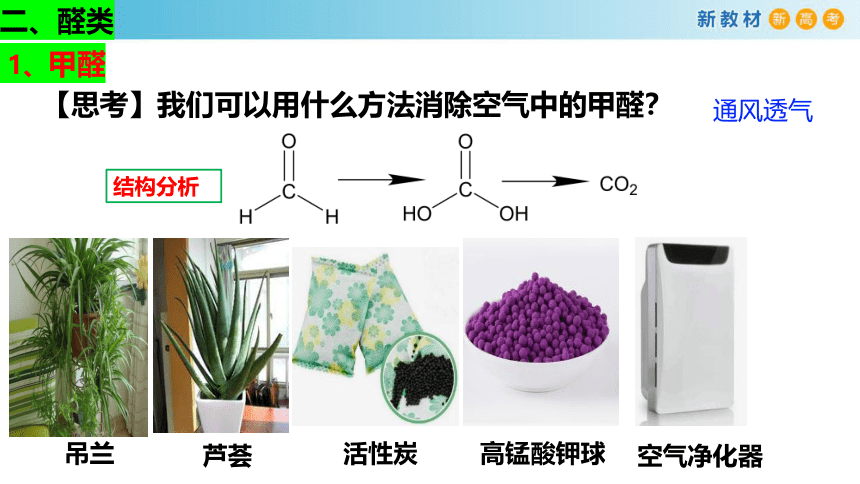
【思考】我们可以用什么方法消除空气中的甲醛?
吊兰
芦荟
活性炭
高锰酸钾球
空气净化器
通风透气
1、甲醛
二、醛类
结构分析
甲醛的银镜反应
HCHO ~ 4Ag
氧化
HCHO+4[Ag(NH3)2]OH 4Ag↓+(NH4)2CO3+6NH3+2H2O
△
甲醛与新制的Cu(OH)2悬浊液的反应
HCHO ~ 2Cu2O
HCHO+4Cu(OH)2+2NaOH 2Cu2O↓+Na2CO3+6H2O
△
(1)氧化反应
1、甲醛
二、醛类
化学性质
(2)加成反应(还原反应)
(3)缩聚反应
+ ;
n +(n-1)H2O。
1、甲醛
二、醛类
化学性质
物理性质及用途
最简单的芳香醛
又称苦杏仁油
有苦杏仁气味的无色液体
制造燃料、香料及药物的重要原料
2.苯甲醛
二、醛类
杏仁中含苯甲醛
苯甲醛在空气中久置,在容器内壁会出现苯甲酸的结晶,这是为什么
—CHO
2 +O2 →2
—COOH
苯甲醛中醛基受到苯环的影响,导致C一H
键极性增强,易被空气中的O2氧化为羧基。
实验室如何保存苯甲醛试剂?
密封,与氧化剂分开存放
思考与讨论:
酮
概念:羰基与两个羟基相连的化合物
代表物:丙酮( )
官能团:羰基( )
通式:
三、酮
1.酮的概念和结构特点
R-C-R′
O
CH3-C-CH3
O
-C-
O
若其中R和R′均为烷基(-CnH2n+1),则为饱和一元酮。
CnH2nO(n≥3)
饱和一元酮的通式为:
2、最简单的酮——丙酮
分子式
用途
沸点
结构简式
颜色状态
挥发性
溶解性
C3H6O
无色透明液体
56.2oC
易挥发
CH3CCH3
O
能与水乙醇等互溶
化学纤维、生产有机玻璃、农药和涂料等
(1)酮的化学性质
①加成反应:能与H2、HCN、NH3、甲醇等发生加成反应
三、酮
CH3—C—CH3+H2 CH3—CH—CH3
O
=
OH
催化剂
△
(酮的催化加氢反应也是它的还原反应)
CH3—C—CH3+H—CN→CH3—CH—CN
O
OH
应用:可用来增长碳链。
②氧化反应:
a、酮类通常情况不能被氧化,但大多数酮能在空气中燃烧。可以发生还原反应。
b、酮中的羰基直接与两个烃基相连,没有与羰基直接相连的氢原子,因此酮不能被
银氨溶液、新制的氢氧化铜等弱氧化剂氧化,但能催化加氢生成醇,
醛 酮
官能团 醛基: 酮羰基:
官能团位置 碳链末端(最简单的醛是甲醛) 碳链中间(最简单的酮是丙酮)
结构通式 (R为烃基或氢原子)
(R、R′均为烃基)
联系 碳原子数相同的饱和一元脂肪醛和饱和一元脂肪酮互为同分异构体 醛和酮的区别与联系
归纳总结
【归纳】使溴水、KMnO4(H+)溶液褪色的有机物及褪色原因的比较
碳碳双键 碳碳三键 苯的 同系物 醇 酚 醛 能否褪色 原因 能否褪色 原因 能否因反应褪色 原因 能否褪色 原因 能否褪色 原因 能否褪色 原因
溴水
KMnO4(H+)
√
×
加成
反应
√
√
√
√
√
√
√
√
√
×
氧化
反应
加成
反应
氧化
反应
氧化反应
取代
反应
氧化反应
氧化反应
氧化反应
氧化反应
官能团
试剂
【课堂小结】
醛的化学性质
R C C H
H
H
O
d
-
d
+
加成反应
(与 H2 、HCN、氨及氨的衍生物、醇类等)
氧化反应
(酸性 KMnO4 溶液)
( O2,催化剂)
(银氨溶液)
(新制氢氧化铜悬浊液)
酮的化学性质
R C R’
O
d
+
d
-
加成反应
(与 H2 、HCN、氨及氨的衍生物、醇类等)
氧化反应
( 比较稳定,只有很强的氧化剂才能将其氧化)
【课堂小结】
(1)甲醛的水溶液俗称福尔马林,可用于浸制生物标本,具有防腐性( )
(2)酮类物质能与氢气发生加成反应,不能被银氨溶液氧化,所以只能发生还原反应,不能发生氧化反应( )
(3)丙酮是结构最简单的酮,也可以发生银镜反应和加氢还原( )
(4)丙酮难溶于水,但丙酮是常用的有机溶剂( )
(5)醛和酮都能与H2、HCN等发生加成反应( )
√
×
正误判断
×
×
√
拓展: 羟醛缩合反应
醛、酮α-C原子上的H原子(α-H)受到羰基的影响变得比较活泼
R-CH-CH2-CHO
+ H-CH2-CHO
OH
R-C-H
O
稀OH-
羟醛缩合反应:至少一种醛含有α-H!可用来成倍增长碳链。
Δ
-H2O
R-CH=CHCHO
在稀碱或稀酸的催化作用下,有 a-H 的醛或酮能与另一分子醛或酮发生加成反应,即一分子醛的 a-H 加到另一分子醛的羰基氧原子上,其余部分加到羰基碳原子上,生成 B-羟基醛。生成的 B-羟基醛易脱水,发生脱水的消去反应。
(1)醛分子间的加成反应(羟醛缩合反应)
由于加成产物的分子中既有羟基又有醛基,故这一反应称为羟醛缩合反应。
上述反应增长碳链,在有机合成中应用比较广泛。
应用:
(2)α-H 的取代反应
上述反应可引入卤素原子,进而引入羟基或碳碳双键,可实现官能团的转化。
上述反应可由醛直接生成醇和羧酸,实现芳香化合物间的转化。
(3)醛的歧化反应
拓展:羟醛缩合反应
R CH2 CHO + Br2
催化剂
R CH CHO + HBr
Br
CHO
2
①浓KOH溶液、Δ
②H+
COOH
CH2OH
+
走进奇妙的化学世界
选择性必修3
第三章 烃的衍生物
第三节 醛 酮
学习
目标
第2课时
醛类 酮的结构与性质
PART
01
PART
02
能根据官能团的特点和性质区别醛和酮,以丙酮为例认识酮的主要化学性质
能列举甲醛、苯甲醛和丙酮等代表物在生活中的应用,分析和探讨这些物质对人类健康和社会发展可能带来的双重影响
1、常见的醛和酮
醛分子:羰基碳原子分别与氢原子和烃基(或氢原子)相连。
官能团是醛基( 或 )。
醛和酮都是分子中含有羰基的化合物。
C H
O
酮分子:与羰基碳原子相连的两个基团均为烃基,烃基可以
相同也可以不同。
官能团是酮羰基( )。
C R’
O
R
认识醛和酮
—CHO
命名规则
(1)选取分子中连有醛基或酮羰基的最长碳链作为主链,按照
主链所含碳原子数称为“某醛”或“某酮” 。
(2)从醛基开始或距离酮羰基最近的一端给主链碳原子编号。
(3)在“某醛”或“某酮”之前加上取代基的位次号和名称。
2、醛、酮的命名
O
CH3—CH2—C—CH2—CH3
3-戊酮
CH3—CH—CH2—CHO
CH3
3-甲基丁醛
认识醛和酮
甲醛
HCHO
—CH=CH—CHO
肉桂醛
—CHO
最简单的芳香醛,
俗称苦杏仁油
肉桂醛是一种食用香料,广泛用于牙膏、洗涤剂、糖果和调味品中。
苯甲醛
最简单的醛
生活中常见的醛
二、醛类
1、甲醛
又称蚁醛
无色、有强烈刺激性气味的气体
易溶于水
甲醛水溶液(又称福尔马林),具有杀菌、防腐性能,
可用于消毒和制作标本。
物理性质:
用途
二、醛类
【思考】我们可以用什么方法消除空气中的甲醛?
吊兰
芦荟
活性炭
高锰酸钾球
空气净化器
通风透气
1、甲醛
二、醛类
结构分析
甲醛的银镜反应
HCHO ~ 4Ag
氧化
HCHO+4[Ag(NH3)2]OH 4Ag↓+(NH4)2CO3+6NH3+2H2O
△
甲醛与新制的Cu(OH)2悬浊液的反应
HCHO ~ 2Cu2O
HCHO+4Cu(OH)2+2NaOH 2Cu2O↓+Na2CO3+6H2O
△
(1)氧化反应
1、甲醛
二、醛类
化学性质
(2)加成反应(还原反应)
(3)缩聚反应
+ ;
n +(n-1)H2O。
1、甲醛
二、醛类
化学性质
物理性质及用途
最简单的芳香醛
又称苦杏仁油
有苦杏仁气味的无色液体
制造燃料、香料及药物的重要原料
2.苯甲醛
二、醛类
杏仁中含苯甲醛
苯甲醛在空气中久置,在容器内壁会出现苯甲酸的结晶,这是为什么
—CHO
2 +O2 →2
—COOH
苯甲醛中醛基受到苯环的影响,导致C一H
键极性增强,易被空气中的O2氧化为羧基。
实验室如何保存苯甲醛试剂?
密封,与氧化剂分开存放
思考与讨论:
酮
概念:羰基与两个羟基相连的化合物
代表物:丙酮( )
官能团:羰基( )
通式:
三、酮
1.酮的概念和结构特点
R-C-R′
O
CH3-C-CH3
O
-C-
O
若其中R和R′均为烷基(-CnH2n+1),则为饱和一元酮。
CnH2nO(n≥3)
饱和一元酮的通式为:
2、最简单的酮——丙酮
分子式
用途
沸点
结构简式
颜色状态
挥发性
溶解性
C3H6O
无色透明液体
56.2oC
易挥发
CH3CCH3
O
能与水乙醇等互溶
化学纤维、生产有机玻璃、农药和涂料等
(1)酮的化学性质
①加成反应:能与H2、HCN、NH3、甲醇等发生加成反应
三、酮
CH3—C—CH3+H2 CH3—CH—CH3
O
=
OH
催化剂
△
(酮的催化加氢反应也是它的还原反应)
CH3—C—CH3+H—CN→CH3—CH—CN
O
OH
应用:可用来增长碳链。
②氧化反应:
a、酮类通常情况不能被氧化,但大多数酮能在空气中燃烧。可以发生还原反应。
b、酮中的羰基直接与两个烃基相连,没有与羰基直接相连的氢原子,因此酮不能被
银氨溶液、新制的氢氧化铜等弱氧化剂氧化,但能催化加氢生成醇,
醛 酮
官能团 醛基: 酮羰基:
官能团位置 碳链末端(最简单的醛是甲醛) 碳链中间(最简单的酮是丙酮)
结构通式 (R为烃基或氢原子)
(R、R′均为烃基)
联系 碳原子数相同的饱和一元脂肪醛和饱和一元脂肪酮互为同分异构体 醛和酮的区别与联系
归纳总结
【归纳】使溴水、KMnO4(H+)溶液褪色的有机物及褪色原因的比较
碳碳双键 碳碳三键 苯的 同系物 醇 酚 醛 能否褪色 原因 能否褪色 原因 能否因反应褪色 原因 能否褪色 原因 能否褪色 原因 能否褪色 原因
溴水
KMnO4(H+)
√
×
加成
反应
√
√
√
√
√
√
√
√
√
×
氧化
反应
加成
反应
氧化
反应
氧化反应
取代
反应
氧化反应
氧化反应
氧化反应
氧化反应
官能团
试剂
【课堂小结】
醛的化学性质
R C C H
H
H
O
d
-
d
+
加成反应
(与 H2 、HCN、氨及氨的衍生物、醇类等)
氧化反应
(酸性 KMnO4 溶液)
( O2,催化剂)
(银氨溶液)
(新制氢氧化铜悬浊液)
酮的化学性质
R C R’
O
d
+
d
-
加成反应
(与 H2 、HCN、氨及氨的衍生物、醇类等)
氧化反应
( 比较稳定,只有很强的氧化剂才能将其氧化)
【课堂小结】
(1)甲醛的水溶液俗称福尔马林,可用于浸制生物标本,具有防腐性( )
(2)酮类物质能与氢气发生加成反应,不能被银氨溶液氧化,所以只能发生还原反应,不能发生氧化反应( )
(3)丙酮是结构最简单的酮,也可以发生银镜反应和加氢还原( )
(4)丙酮难溶于水,但丙酮是常用的有机溶剂( )
(5)醛和酮都能与H2、HCN等发生加成反应( )
√
×
正误判断
×
×
√
拓展: 羟醛缩合反应
醛、酮α-C原子上的H原子(α-H)受到羰基的影响变得比较活泼
R-CH-CH2-CHO
+ H-CH2-CHO
OH
R-C-H
O
稀OH-
羟醛缩合反应:至少一种醛含有α-H!可用来成倍增长碳链。
Δ
-H2O
R-CH=CHCHO
在稀碱或稀酸的催化作用下,有 a-H 的醛或酮能与另一分子醛或酮发生加成反应,即一分子醛的 a-H 加到另一分子醛的羰基氧原子上,其余部分加到羰基碳原子上,生成 B-羟基醛。生成的 B-羟基醛易脱水,发生脱水的消去反应。
(1)醛分子间的加成反应(羟醛缩合反应)
由于加成产物的分子中既有羟基又有醛基,故这一反应称为羟醛缩合反应。
上述反应增长碳链,在有机合成中应用比较广泛。
应用:
(2)α-H 的取代反应
上述反应可引入卤素原子,进而引入羟基或碳碳双键,可实现官能团的转化。
上述反应可由醛直接生成醇和羧酸,实现芳香化合物间的转化。
(3)醛的歧化反应
拓展:羟醛缩合反应
R CH2 CHO + Br2
催化剂
R CH CHO + HBr
Br
CHO
2
①浓KOH溶液、Δ
②H+
COOH
CH2OH
+
