浙教版科学中考复习专题训练:金属的化学性质【word,含答案】
文档属性
| 名称 | 浙教版科学中考复习专题训练:金属的化学性质【word,含答案】 |  | |
| 格式 | docx | ||
| 文件大小 | 380.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-14 11:02:03 | ||
图片预览




文档简介
金属的化学性质
1. 下列不能与稀盐酸反应的金属是( )
A. Cu
B. Zn
C. Al
D. Mg
2. 在学习金属的化学性质时,老师给大家演示了如图所示的实验,下列说法正确的是( )
A. 铜片表面始终没有明显变化
B. 一段时间后溶液由无色变为浅绿色
C. 反应后溶液中一定有硝酸铜,可能有硝酸银
D. 通过实验现象推测银和硫酸铜溶液也可以反应
3. 小丽为确认所回收易拉罐的主要成分是铝还是铁,剪取金属片打磨后,设计了如图所示的两种不同方法进行检验,这样设计的依据是( )
A. 铁、铝有不同的物理性质
B. 活泼金属易与氧气反应
C. 排在氢前面的金属可以把酸中的氢置换出来
D. 活动性较强的金属可把活动性较弱的金属从它的盐溶液中置换出来
4.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式是La2O3,La(OH)3是不溶于水的碱,LaCl3、La(NO3)3都可溶于水。由此推断下列几组物质组合,不能直接反应制取LaCl3的是( )
A. La和稀盐酸
B. La2O3和稀盐酸
C. La(OH)3和稀盐酸
D. La(OH)3和氯化钾溶液
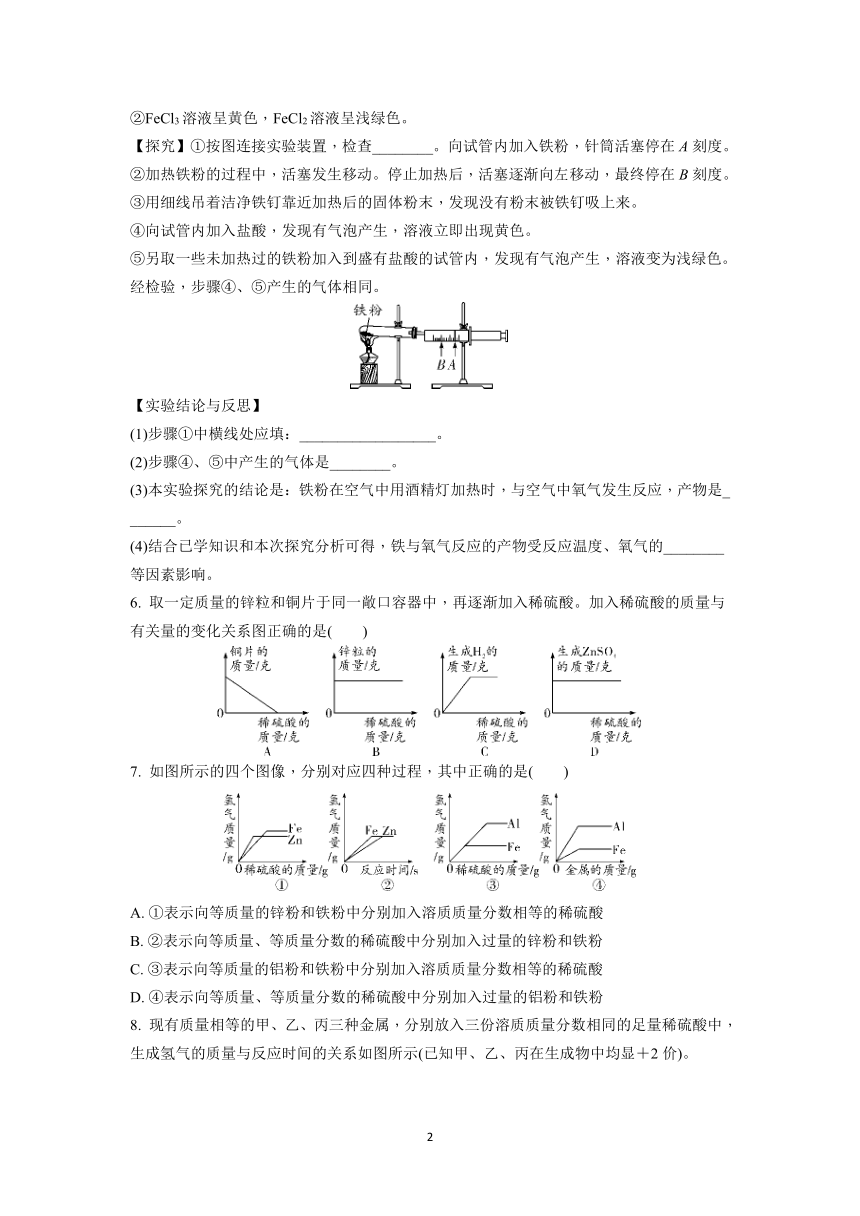
5. 常温下,铁在潮湿的空气中容易生锈,产物主要为Fe2O3·nH2O;铁丝在氧气中燃烧,产物为黑色的Fe3O4。
【提出问题】铁在空气中用酒精灯加热时,是否与空气中氧气发生反应?产物是什么?
【查阅资料】①常见的铁的氧化物有三种:FeO、Fe2O3、Fe3O4,其中Fe3O4是磁性物质。
②FeCl3溶液呈黄色,FeCl2溶液呈浅绿色。
【探究】①按图连接实验装置,检查________。向试管内加入铁粉,针筒活塞停在A刻度。
②加热铁粉的过程中,活塞发生移动。停止加热后,活塞逐渐向左移动,最终停在B刻度。
③用细线吊着洁净铁钉靠近加热后的固体粉末,发现没有粉末被铁钉吸上来。
④向试管内加入盐酸,发现有气泡产生,溶液立即出现黄色。
⑤另取一些未加热过的铁粉加入到盛有盐酸的试管内,发现有气泡产生,溶液变为浅绿色。经检验,步骤④、⑤产生的气体相同。
【实验结论与反思】
(1)步骤①中横线处应填:__________________。
(2)步骤④、⑤中产生的气体是________。
(3)本实验探究的结论是:铁粉在空气中用酒精灯加热时,与空气中氧气发生反应,产物是_
______。
(4)结合已学知识和本次探究分析可得,铁与氧气反应的产物受反应温度、氧气的________等因素影响。
6. 取一定质量的锌粒和铜片于同一敞口容器中,再逐渐加入稀硫酸。加入稀硫酸的质量与有关量的变化关系图正确的是( )
7. 如图所示的四个图像,分别对应四种过程,其中正确的是( )
A. ①表示向等质量的锌粉和铁粉中分别加入溶质质量分数相等的稀硫酸
B. ②表示向等质量、等质量分数的稀硫酸中分别加入过量的锌粉和铁粉
C. ③表示向等质量的铝粉和铁粉中分别加入溶质质量分数相等的稀硫酸
D. ④表示向等质量、等质量分数的稀硫酸中分别加入过量的铝粉和铁粉
8. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。
则下列说法错误的是( )
A. 完全反应所需时间:丙>甲>乙
B. 生成氢气的质量:甲>乙>丙
C. 相对原子质量:乙>丙>甲
D. 消耗硫酸的质量:甲>乙>丙
9. 在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系如图。综合以上信息得到以下结论,合理的是( )
A.从图象可以看出,金属镁比金属锌的活动性强
B.若两种金属都有剩余,二者得到的氢气质量相同
C.若硫酸有剩余,二者得到氢气的质量相同
D.若两种金属完全溶解,二者消耗硫酸的质量相同
10. 现有某铁样品5.6 g,含有的杂质为镁、锌、铜中的两种或三种。向其中逐渐加入溶质质量分数为9.8%的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如图所示,
则下列结论正确的个数是( )
①恰好完全反应时,一定没有固体剩余
②x的值为0.2
③铁样品中可能含有镁
④M点对应的溶液中含有2种或3种溶质
1个
2个
3个
D. 4个
11. 将质量相等的Mg、Al、Zn三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能的是( )
12. 已知镁和铝的相对原子质量之比为8∶9。若镁和铝分别与足量盐酸反应,生成氢气的质量相等,则参加反应的镁和铝的质量比为( )
A. 3∶2
B. 4∶3
C. 1∶1
D. 1∶2
13. 向5.6 g含两种杂质的铁粉样品中加入足量的稀盐酸,充分反应后共产生0.2 g氢气,则该样品中所含杂质可能是( )
A. 锌和铜
B. 锌和镁
C. 铝和镁
D. 碳和铜
14. 将20 g镁、铁的金属混合物加入到一定质量的稀硫酸中,恰好完全反应后,经测定溶液质量增加了19 g,将反应后的溶液蒸干,得到固体的质量为( )
A. 39 g
B. 60 g
C. 68 g
D. 73 g
15. 现有一定质量的由两种金属组成的混合物,加入过量的稀盐酸,充分反应,测得生成H2 0.2 g,将反应后的溶液蒸发,得到11.1 g固体。则金属混合物的组成不可能是( )
A. Mg Fe
B. Fe Zn
C. Zn Mg
D. Al Fe
16.实验室欲测定一包黄铜样品中锌的质量分数(假设样品中只含铜和锌),取50 g黄铜样品粉末于烧杯中,先加入100 g稀硫酸,充分反应后得固液混合物149.8 g,再继续加入200 g相同浓度的稀硫酸,充分反应后过滤,得滤液312.6 g,则黄铜样品中锌的质量分数为( )
A. 39%
B. 74%
C. 61%
D. 26%
17. 某固体由镁、锌、铁三种金属中的一种或几种组成,现取a g固体于烧杯中,再加入足量稀盐酸,充分反应后,将所得溶液小心蒸干(不考虑操作过程中物质的损耗),得到(a+14.2) g不含结晶水的固体,则a的取值范围是( )
A. 4.8≤a≤13.0
B. 11.2C. 3.6≤a≤11.2
D. 4.8≤a<11.2
18.下列物质中,金属活动性最强的是( )
A. 铝
B. 铁
C. 铜
D. 银
19. 现有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上实验事实,判断X、Y和Z的金属活动性顺序为( )
A. Y>X>Z
B. Z>Y>X
C. Y>Z>X
D. X>Y>Z
20. 有甲、乙、丙、丁四种金属,只有丙在自然界能以单质形态存在。含甲化合物的水溶液不能用乙制的容器盛放。将甲和丁分别放入硝酸铜溶液中,在甲表面有铜析出,而丁没有变化。这四种金属活动性顺序由弱到强的是( )
A. 丙<丁<甲<乙
B. 乙<甲<丁<丙
C. 丁<甲<乙<丙
D. 丙<乙<甲<丁
21. 把等质量的X、Y、Z、M四种金属分别加入到等质量、等质量分数的足量稀盐酸中(反应关系如图甲),把金属M加入到足量的Y(NO3)2溶液中(反应关系如图乙)。据此判断四种金属的活动性顺序为( )
X>Z>M>Y
B. Y>M>Z>X
C. X>Z>Y>M
D. Z>X>M>Y
22. 现有Al、Cu、Ag三种金属,限用一种试剂一次性就可以验证它们的金属活动性强弱,则该试剂是( )
A. CuSO4溶液
B. 稀H2SO4
C. AgNO3溶液
D. AlCl3溶液
23.为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是( )
A. 将镁片放入稀盐酸中
B. 将铜片放入稀盐酸中
C. 将镁片放入硝酸银溶液中
D. 将铜片放入硝酸银溶液中
24.为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是( )
A. MgCl2溶液、 Cu、Sn
B. Mg、Cu、SnCl2 溶液
C. Mg、Sn、Cu、盐酸
D. MgCl2 溶液、Sn、 CuCl2溶液
25.探究铁、铜、镁的金属活动性时,下列现象,分析或结论正确的是( )
铜片表面有气泡产生
B. 有镁片的试管外壁发烫
C. 铁片与盐酸反应速率最快
D. 它们的活动性,Cu>Fe>Mg
26. 某同学参加实验操作考试,为验证镁、锌、铜三种金属的活动性顺序,他设计了以下四种实验方案,其中能达到目的的是( )
A. 将镁片、锌片分别放入Cu(NO3)2溶液中
B. 将锌片、铜片分别放入Mg(NO3)2溶液中
C. 将镁片分别放入Zn(NO3)2溶液、Cu(NO3)2溶液中
D. 将镁片、锌片、铜片分别放入稀盐酸中
27.为验证铝、铜、银的金属活动性强弱,小明设计了以下四组实验,下列说法不正确的是( )
A. 通过①②实验,可以证明金属活动性Al>Cu
B. 通过①②③实验,可以证明金属活动性Al>Cu>Ag
C. 若要用实验④证明金属活动性Al>Cu, X可以为Al, Y为CuSO4溶液
D. 若要用实验④证明金属活动性Cu>Ag, X可以为Cu, Y为AgNO3溶液
28. 文宏同学利用“金属树”趣味实验来验证Zn、Cu、 Ag三种金属的活动性顺序。
(1)为确保实验效果,CuCl2溶液和AgNO3溶液需现配。配制50 g质量分数为12%的CuCl2溶液,应称量________g CuCl2,加水时应选用______mL的量筒。除量筒外,配制溶液还需要的玻璃仪器有________________。
(2)向两个放有宣纸的培养皿中分别滴入适量CuCl2溶液、AgNO3溶液,再放入锌粒,一段时间后观察到的实验现象如图。
①形成“铜树”时发生反应的化学方程式是________________________。
②仅用“铜树”和“银树”实验尚不能验证________的金属活动性顺序,需补充一个实验来证明,应选用的药品是________________________(可供选择的药品有:锌粒、铜丝、银丝、稀盐酸、CuCl2溶液、AgNO3溶液)。
29.学习完金属的化学性质,同学们来到实验室进行锌、铜、银三种金属活动性顺序的探究活动。实验桌上老师提供的药品有:锌片、铜片、银片、硫酸锌溶液、硫酸铜溶液、硝酸银溶液和稀硫酸。
【制定计划】在老师的指导下,经过讨论,同学们设计出了以下几种实验方案:
方案一:铜片、硫酸锌溶液、硝酸银溶液;
方案二:锌片、银片、硫酸铜溶液;
方案三:锌片、铜片、硫酸铜溶液、硝酸银溶液;
你的设计方案是______________________________________。
【进行实验】小华同学选用方案三进行如下探究,请你帮他完成表格中的空白(注:表格中实验操作一栏用文字描述或图示表示均可):
实验操作 实验现象 分析与结论
_____________________ 金属活动性:Cu________Ag(填“>”或“<”)
_________________ 锌片表面附着一层红色物质,溶液由蓝色逐渐变为无色 金属活动性:Zn________Cu(填“>”或“<”),反应的化学方程式为____________________________
【解释与结论】根据上述实验,小华得出三种金属活动性由强到弱的顺序是______________。
【反思与评价】探究活动结束后,同学们分享自己的收获与不足,并进行反思:
(1)有同学提出,小华的实验中不用硫酸铜溶液也能得到相同的实验结论。简要说明其验证方法:__________________________________________________________________。
(2)经过讨论,大家一致认为以上实验方案中,方案________较好。
(3)小华提出,试管中的金属可以回收再利用,这样做的意义是______________________。
【拓展与延伸】好奇地小华在老师的指导下,把一定量的锌粒加入硫酸铜和硝酸银的混合溶液中,充分反应一段时间后,过滤,发现滤液呈无色。此时,滤渣中一定含有________,溶液中离子数目增加的是________。
参考答案
1. A 2. C 3. D
4. D 【解析】La的活动性比锌强,能和稀盐酸反应生成LaCl3和氢气;La2O3能和稀盐酸反应生成LaCl3和水;La(OH)3能和稀盐酸反应生成LaCl3和水;La(OH)3不溶于水,不能和氯化钾溶液反应,故选D。
5. (1)装置气密性 (2)氢气(或H2) (3)氧化铁(或Fe2O3或三氧化二铁) (4)浓度
【解析】(2)铁与盐酸反应产生氢气,因此④、⑤中产生的气体是氢气。(3)根据【探究】③发现产物没有被铁钉吸引,即生成物不是四氧化三铁;根据【探究】④溶液出现黄色,可知铁与空气在酒精灯加热的情况下生成的是氧化铁。(4)铁丝在空气中不能燃烧,能在纯氧中燃烧生成四氧化三铁;铁丝在空气中会发生缓慢氧化生成铁锈,因此铁与氧气反应的产物还受氧气浓度的影响。
6. C 【解析】向一定质量的锌粒和铜片中加入稀硫酸,锌粒能与稀硫酸反应生成氢气和硫酸锌,而铜不能与稀硫酸反应,随着稀硫酸质量的增加,铜的质量不变,锌的质量减小,生成氢气的质量和硫酸锌的质量从0开始不断增大,直至锌反应完全后均不再增大,故选C。
7. C
8. C 【解析】图像的拐点表示反应结束,通过拐点的横坐标可确定完全反应所需时间:丙>甲>乙,A正确;根据图像纵坐标确定生成氢气的质量:甲>乙>丙,B正确;由于三种金属在生成物中化合价均为+2价,又因为金属等质量时生成氢气的质量与金属的相对原子质量成反比,即生成氢气的质量越大,金属的相对原子质量越小,因此相对原子质量:丙>乙>甲,C错误;根据质量守恒定律可知,反应消耗稀硫酸的质量和生成氢气的质量成正比,因此消耗稀硫酸的质量:甲>乙>丙,D正确。
9. B 【解析】图像中只给了反应物和生成物的质量关系,从图象中不能确定镁与锌的活动性强弱,A不合理;若两种金属都有剩余,则等质量的稀硫酸完全反应,会产生等质量的氢气,B合理;若硫酸有剩余,说明金属完全反应,则由图可知等质量的镁和锌,镁最终产生的氢气质量大,C不合理;若两种金属完全溶解,则消耗硫酸的质量镁大于锌,D不合理。
10. A 【解析】铜不与稀硫酸反应,杂质中可能含有铜,所以恰好完全反应时,可能会有固体铜剩余,①错误;分析图像信息,恰好完全反应时消耗稀硫酸100 g,100 g稀硫酸中所含溶质质量为100 g×9.8%=9.8 g,反应中稀硫酸与氢气的质量比为98∶2,则此时生成氢气的质量为0.2 g,②正确;反应中的铁与氢气的质量比为56∶2,镁与氢气的质量比为24∶2,锌与氢气的质量比为65∶2,若5.6 g某铁样品反应生成0.2 g氢气,则一定含有镁,可能含有锌、铜中的某一种或两种均有,③错误;M点硫酸有剩余,此时溶液中一定含有硫酸、硫酸亚铁、硫酸镁,可能含有硫酸锌,④错误;A正确。
11. C 【解析】若三种金属过量,则酸完全反应,产生氢气的质量相等,A正确;若酸足量,等质量的三种金属完全反应,铝产生氢气质量最多,镁次之,锌产生氢气质量最少,B正确;等质量的三种金属完全反应,铝产生氢气质量最多,镁次之,锌最少,若酸与锌恰好反应,则金属铝一定有剩余,镁一定有剩余,所以镁和铝可能产生氢气质量相等,但镁和锌产生氢气质量一定不相等,C错误、D正确。
12. B 【解析】设镁的相对原子质量为8x,则铝的相对原子质量为9x,根据Mg+2HCl=== MgCl2+H2↑可知,参加反应的镁与生成氢气的质量比为8x∶2=4x∶1,根据2Al+6HCl=== 2AlCl3+3H2↑可知,参加反应的铝与生成氢气的质量比为18x∶6=3x∶1,所以产生等质量的氢气,参加反应的镁与铝的质量比为4x∶3x=4∶3,B正确。
13. B 【解析】本题需用极值法解答,由化学方程式中各物质的质量关系可知,5.6 g铁完全反应产生氢气质量为0.2 g,5.6 g锌完全反应产生氢气质量小于0.2 g,5.6 g镁完全反应产生氢气质量大于0.2 g,5.6 g铝完全反应产生氢气质量大于0.2 g,碳和铜与稀盐酸不反应,不能产生氢气,所以5.6 g含两种杂质的铁样品加入稀盐酸,产生0.2 g氢气,则所含杂质需含有5.6 g纯金属产生氢气大于0.2 g的和小于0.2 g的两种,故选B。
14. C 【解析】镁与硫酸反应生成硫酸镁和氢气,铁与硫酸反应生成硫酸亚铁和氢气,因此在一定质量的稀硫酸中加入20 g镁、铁的混合物后,溶液质量增加19 g,则生成氢气的质量为20 g-19 g=1 g;由化学反应中元素守恒可知,生成氢气的质量等于反应的硫酸中氢元素的质量,由此可列式计算参加反应的硫酸中SO的质量;而生成硫酸镁、硫酸亚铁的总质量为金属元素的质量与SO的质量总和,从而求得最终所得硫酸镁、硫酸亚铁混合物的质量。设生成1 g氢气的同时,参加反应的SO的质量为x,则
H2~H2SO4~SO
2 96
1 g x
=
x=48 g
即反应后将溶液蒸干,所得固体的质量为:20 g+48 g=68 g,故选C。
15. B 【解析】现有一定质量的由两种金属组成的混合物,加入过量的稀盐酸,充分反应,测得生成H2 0.2 g,生成氢气的质量等于参加反应的盐酸中氢元素的质量,H~Cl,氢和氯的质量比为1∶35.5,所以氯元素的质量为7.1 g,将反应后的溶液蒸发,得到11.1 g固体。则金属混合物的质量为11.1 g-7.1 g=4 g,则相混合的两种金属生成0.2 g氢气时,一种质量小于4 g,一种质量大于4 g;
Zn+2HCl=== ZnCl2+H2↑
65 2
Mg+2HCl=== MgCl2+H2↑
24 2
Fe+2HCl=== FeCl2+H2↑
56 2
2Al+6HCl=== 2AlCl3+3H2↑
54 6
因此,生成0.2 g氢气需要金属的质量:锌是6.5 g,镁是2.4 g,铁是5.6 g,铝是1.8 g;4 g Mg、Fe 混合物可能生成0.2 g氢气,A正确;4g Fe、Zn 混合物生成氢气一定小于0.2 g,B错误;4 g Zn、Mg混合物可能生成0.2 g氢气,C正确;4 g Al、Fe混合物可能生成0.2 g氢气,D正确。
16. D 【解析】黄铜样品中锌与稀硫酸反应,铜不与稀硫酸反应,向50 g样品中加入300 g稀硫酸,反应后得滤液312.6 g,设黄铜样品中锌的质量为x,完全反应产生氢气的质量为y
Zn+H2SO4=== ZnSO4+H2↑
65 2
xy
则y=,则x+300 g-=312.6 g
解得x=13 g,则黄铜样品中锌的质量分数为×100%=26%,D正确。
17. A 【解析】镁、锌、铁分别与足量稀盐酸反应生成氯化物和氢气,反应后将所得溶液蒸干,所得固体的质量即为氯化物的质量;反应的金属的质量为a g,生成氯化物的质量为(a+14.2) g,由反应前后元素质量守恒可知,氯化物中氯元素的质量为14.2 g,则参加反应的HCl的质量为14.6 g。由镁、锌、铁分别与稀盐酸反应的化学方程式可知,14.6 g HCl完全反应所需镁、锌、铁的质量分别为4.8 g、13.0 g、11.2 g,即金属的质量最小为4.8 g,最大为13.0 g,a的取值范围是4.8≤a≤13.0,故选A。
18. A
19. D 【解析】将X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应,说明金属活动性X(>H)>Y;把Y和Z分别放入硝酸银溶液中,在Y表面有银析出,而Z没有变化,说明Y可以置换出硝酸银中的银,Z不可以,则金属活动性Y>Ag>Z,综上所述X、Y、Z三种金属的活动性顺序为X>Y>Z。
20. A
21. A 【解析】甲图中横坐标是时间,纵坐标是生成氢气的质量,能反映出产生氢气的速率,由此可以看出金属的活动性顺序是X>Z>Y、M,由乙图可知,将金属M加入Y(NO3)2溶液中,M可置换出金属Y,故金属活动性M>Y,所以四种金属的活动性顺序为X>Z>M>Y。
22. A
23. C 【解析】A实验中镁与稀盐酸能发生反应,可得出活动性顺序为:Mg>H;B实验中铜不能与稀盐酸发生反应,可得出活动性顺序为:H>Cu;C实验中镁能与硝酸银溶液发生反应置换出银,可得出活动性顺序为:Mg>Ag;D实验中铜能与硝酸银溶液发生反应置换出银,可得出活动性顺序为:Cu>Ag。结合上述实验A、B、D可得出三种金属的活动性顺序为Mg>Cu>Ag,故C实验不必进行。
24. A 25. B
26. D 【解析】镁、锌均能从Cu(NO3)2溶液中置换出铜,说明镁、锌的活动性都比铜强,但该方案无法比较镁、锌的活动性顺序,A错误;锌、铜均不能与Mg(NO3)2溶液发生反应,说明镁的活动性比锌、铜强,但该方案无法比较锌、铜的活动性顺序,B错误;镁能分别与Zn(NO3)2溶液、Cu(NO3)2溶液发生反应,置换出锌和铜,说明镁的活动性比锌、铜强,但该方案无法比较锌、铜的活动性顺序,C错误;镁片、锌片均能与稀盐酸发生反应且镁的反应速率比锌快,说明镁的活动性比锌强;铜不与稀盐酸发生反应,说明三种金属中铜的活动性最弱,D正确。
27. B 【解析】实验①铝可以与稀硫酸反应,可知在金属活动性顺序中Al位于H前,实验②铜不能与稀硫酸反应,可知在金属活动性顺序中Cu位于H后,由此可证明金属活动性Al>Cu,A正确;实验③铝与硝酸银溶液能反应,可证明金属活动性Al>Ag,实验①②③不能比较Cu和Ag的金属活动性,B不正确;实验④中,若X为Al,Y为CuSO4溶液,观察到铝表面有红色固体析出,溶液蓝色变浅,可证明金属活动性Al>Cu,C正确;实验④中,若X为Cu,Y为AgNO3溶液,观察到铜表面有银白色固体析出,溶液由无色变为蓝色,可证明金属活动性Cu>Ag,D正确。
28. (1)6 50 烧杯、玻璃棒 (2)①Zn+CuCl2=== ZnCl2+Cu ②铜和银(或Cu和Ag) 铜丝和AgNO3溶液(或银丝和CuCl2溶液)
【解析】(1)配制50 g质量分数为12%的CuCl2溶液,需要CuCl2的质量为50 g×12%=6 g,水的质量为50 g-6 g=44 g,即需加44 mL水,为了减少误差,量取水时应选用50 mL的量筒。除量筒外,配制溶液在烧杯中进行,用玻璃棒搅拌,所以还需要的玻璃仪器有烧杯、玻璃棒。(2)①锌与氯化铜溶液反应生成铜和氯化锌,则形成“铜树”时发生反应的化学方程式是Zn+CuCl2=== ZnCl2+Cu;②形成“铜树”说明金属活动性顺序锌>铜,形成“银树”说明金属活动性顺序锌>银,仅用“铜树”和“银树”实验不能验证铜和银的金属活动性顺序,需补充一个实验来证明,应选用的药品是铜丝和AgNO3溶液,根据铜丝表面会析出银白色固体,溶液由无色变浅变为蓝色,可判断金属活动性顺序铜>银,还可以选择银丝和CuCl2溶液,无明显现象,也可判断金属活动性顺序铜>银。
29. 【制定计划】锌片、铜片、硝酸银溶液和稀硫酸 【进行实验】铜片表面有银白色固体析出,溶液由无色逐渐变为蓝色 > 将打磨过的锌片加入硫酸铜溶液中 > Zn+CuSO4=== ZnSO4+Cu 【解释与结论】Zn>Cu>Ag 【反思与评价】(1)将打磨过的铜片放入硝酸银溶液中,铜与硝酸银反应生成硝酸铜和银,有银白色固体析出,溶液由无色变为蓝色,说明金属活动性:Cu>Ag;再将打磨过的锌片放入反应后的溶液中,锌与硝酸铜反应生成硝酸锌和铜,有红色固体析出,溶液由蓝色变为无色,说明金属活动性:Zn>Cu (2)一、二 (3)节约金属资源,减少污染(合理即可) 【拓展与延伸】Cu、Ag Zn2+
【解析】【制定计划】还可以设计方案:锌片、铜片、硝酸银溶液和稀硫酸。锌能与稀硫酸反应生成硫酸锌和氢气,有气泡产生,说明在金属活动性顺序里,锌排在氢前,铜与稀硫酸不反应,说明在金属活动性顺序里,铜在氢后,铜能与硝酸银反应有银白色固体析出,溶液由无色变为蓝色,说明在金属活动性顺序里,铜排在银之前,由此可以验证三种金属的活动性顺序。【进行实验】铜能与硝酸银溶液反应生成硝酸铜和银,实验现象为:铜片表面有银白色固体析出,溶液由无色逐渐变为蓝色,说明金属活动性:Cu>Ag;实验现象为:锌片表面附着一层红色物质,溶液由蓝色逐渐变为无色,说明该实验是将打磨过的锌片加入到硫酸铜溶液中,锌与硫酸铜溶液反应生成硫酸锌和铜,该实验说明金属活动性:Zn>Cu,发生反应的化学方程式为Zn+CuSO4=== ZnSO4+Cu。【解释与结论】由以上分析可知,三种金属活动性由强到弱的顺序是Zn>Cu>Ag。【反思与评价】(1)将打磨过的铜片放入硝酸银溶液中,铜与硝酸银反应生成硝酸铜和银,有银白色固体析出,溶液由无色变为蓝色,说明金属活动性:Cu>Ag;再将打磨过的锌片放入反应后的溶液中,锌与硝酸铜反应生成硝酸锌和铜,有红色固体析出,溶液由蓝色变为无色,说明金属活动性:Zn>Cu。(2)方案一、二较好,所选试剂较少,操作简单。(3)试管中的金属回收利用,可以节约金属资源,而且可以减少环境污染。【拓展与延伸】把一定量的锌粒加入硫酸铜和硝酸银的混合溶液中,锌先与硝酸银溶液反应生成硝酸锌和银,待硝酸银完全反应后,锌再与硫酸铜溶液反应生成硫酸锌和铜,充分反应一段时间后,过滤,发现滤液呈无色,说明硫酸铜已经完全反应,锌可能过量,也可能恰好与硫酸铜完全反应,故滤渣中一定含有Cu、Ag;溶液中离子数目增加的是Zn2+,铜离子、银离子数目逐渐减小,硫酸根离子和硝酸根离子数目不变。
(
1
)
1. 下列不能与稀盐酸反应的金属是( )
A. Cu
B. Zn
C. Al
D. Mg
2. 在学习金属的化学性质时,老师给大家演示了如图所示的实验,下列说法正确的是( )
A. 铜片表面始终没有明显变化
B. 一段时间后溶液由无色变为浅绿色
C. 反应后溶液中一定有硝酸铜,可能有硝酸银
D. 通过实验现象推测银和硫酸铜溶液也可以反应
3. 小丽为确认所回收易拉罐的主要成分是铝还是铁,剪取金属片打磨后,设计了如图所示的两种不同方法进行检验,这样设计的依据是( )
A. 铁、铝有不同的物理性质
B. 活泼金属易与氧气反应
C. 排在氢前面的金属可以把酸中的氢置换出来
D. 活动性较强的金属可把活动性较弱的金属从它的盐溶液中置换出来
4.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式是La2O3,La(OH)3是不溶于水的碱,LaCl3、La(NO3)3都可溶于水。由此推断下列几组物质组合,不能直接反应制取LaCl3的是( )
A. La和稀盐酸
B. La2O3和稀盐酸
C. La(OH)3和稀盐酸
D. La(OH)3和氯化钾溶液
5. 常温下,铁在潮湿的空气中容易生锈,产物主要为Fe2O3·nH2O;铁丝在氧气中燃烧,产物为黑色的Fe3O4。
【提出问题】铁在空气中用酒精灯加热时,是否与空气中氧气发生反应?产物是什么?
【查阅资料】①常见的铁的氧化物有三种:FeO、Fe2O3、Fe3O4,其中Fe3O4是磁性物质。
②FeCl3溶液呈黄色,FeCl2溶液呈浅绿色。
【探究】①按图连接实验装置,检查________。向试管内加入铁粉,针筒活塞停在A刻度。
②加热铁粉的过程中,活塞发生移动。停止加热后,活塞逐渐向左移动,最终停在B刻度。
③用细线吊着洁净铁钉靠近加热后的固体粉末,发现没有粉末被铁钉吸上来。
④向试管内加入盐酸,发现有气泡产生,溶液立即出现黄色。
⑤另取一些未加热过的铁粉加入到盛有盐酸的试管内,发现有气泡产生,溶液变为浅绿色。经检验,步骤④、⑤产生的气体相同。
【实验结论与反思】
(1)步骤①中横线处应填:__________________。
(2)步骤④、⑤中产生的气体是________。
(3)本实验探究的结论是:铁粉在空气中用酒精灯加热时,与空气中氧气发生反应,产物是_
______。
(4)结合已学知识和本次探究分析可得,铁与氧气反应的产物受反应温度、氧气的________等因素影响。
6. 取一定质量的锌粒和铜片于同一敞口容器中,再逐渐加入稀硫酸。加入稀硫酸的质量与有关量的变化关系图正确的是( )
7. 如图所示的四个图像,分别对应四种过程,其中正确的是( )
A. ①表示向等质量的锌粉和铁粉中分别加入溶质质量分数相等的稀硫酸
B. ②表示向等质量、等质量分数的稀硫酸中分别加入过量的锌粉和铁粉
C. ③表示向等质量的铝粉和铁粉中分别加入溶质质量分数相等的稀硫酸
D. ④表示向等质量、等质量分数的稀硫酸中分别加入过量的铝粉和铁粉
8. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。
则下列说法错误的是( )
A. 完全反应所需时间:丙>甲>乙
B. 生成氢气的质量:甲>乙>丙
C. 相对原子质量:乙>丙>甲
D. 消耗硫酸的质量:甲>乙>丙
9. 在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系如图。综合以上信息得到以下结论,合理的是( )
A.从图象可以看出,金属镁比金属锌的活动性强
B.若两种金属都有剩余,二者得到的氢气质量相同
C.若硫酸有剩余,二者得到氢气的质量相同
D.若两种金属完全溶解,二者消耗硫酸的质量相同
10. 现有某铁样品5.6 g,含有的杂质为镁、锌、铜中的两种或三种。向其中逐渐加入溶质质量分数为9.8%的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如图所示,
则下列结论正确的个数是( )
①恰好完全反应时,一定没有固体剩余
②x的值为0.2
③铁样品中可能含有镁
④M点对应的溶液中含有2种或3种溶质
1个
2个
3个
D. 4个
11. 将质量相等的Mg、Al、Zn三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能的是( )
12. 已知镁和铝的相对原子质量之比为8∶9。若镁和铝分别与足量盐酸反应,生成氢气的质量相等,则参加反应的镁和铝的质量比为( )
A. 3∶2
B. 4∶3
C. 1∶1
D. 1∶2
13. 向5.6 g含两种杂质的铁粉样品中加入足量的稀盐酸,充分反应后共产生0.2 g氢气,则该样品中所含杂质可能是( )
A. 锌和铜
B. 锌和镁
C. 铝和镁
D. 碳和铜
14. 将20 g镁、铁的金属混合物加入到一定质量的稀硫酸中,恰好完全反应后,经测定溶液质量增加了19 g,将反应后的溶液蒸干,得到固体的质量为( )
A. 39 g
B. 60 g
C. 68 g
D. 73 g
15. 现有一定质量的由两种金属组成的混合物,加入过量的稀盐酸,充分反应,测得生成H2 0.2 g,将反应后的溶液蒸发,得到11.1 g固体。则金属混合物的组成不可能是( )
A. Mg Fe
B. Fe Zn
C. Zn Mg
D. Al Fe
16.实验室欲测定一包黄铜样品中锌的质量分数(假设样品中只含铜和锌),取50 g黄铜样品粉末于烧杯中,先加入100 g稀硫酸,充分反应后得固液混合物149.8 g,再继续加入200 g相同浓度的稀硫酸,充分反应后过滤,得滤液312.6 g,则黄铜样品中锌的质量分数为( )
A. 39%
B. 74%
C. 61%
D. 26%
17. 某固体由镁、锌、铁三种金属中的一种或几种组成,现取a g固体于烧杯中,再加入足量稀盐酸,充分反应后,将所得溶液小心蒸干(不考虑操作过程中物质的损耗),得到(a+14.2) g不含结晶水的固体,则a的取值范围是( )
A. 4.8≤a≤13.0
B. 11.2
D. 4.8≤a<11.2
18.下列物质中,金属活动性最强的是( )
A. 铝
B. 铁
C. 铜
D. 银
19. 现有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上实验事实,判断X、Y和Z的金属活动性顺序为( )
A. Y>X>Z
B. Z>Y>X
C. Y>Z>X
D. X>Y>Z
20. 有甲、乙、丙、丁四种金属,只有丙在自然界能以单质形态存在。含甲化合物的水溶液不能用乙制的容器盛放。将甲和丁分别放入硝酸铜溶液中,在甲表面有铜析出,而丁没有变化。这四种金属活动性顺序由弱到强的是( )
A. 丙<丁<甲<乙
B. 乙<甲<丁<丙
C. 丁<甲<乙<丙
D. 丙<乙<甲<丁
21. 把等质量的X、Y、Z、M四种金属分别加入到等质量、等质量分数的足量稀盐酸中(反应关系如图甲),把金属M加入到足量的Y(NO3)2溶液中(反应关系如图乙)。据此判断四种金属的活动性顺序为( )
X>Z>M>Y
B. Y>M>Z>X
C. X>Z>Y>M
D. Z>X>M>Y
22. 现有Al、Cu、Ag三种金属,限用一种试剂一次性就可以验证它们的金属活动性强弱,则该试剂是( )
A. CuSO4溶液
B. 稀H2SO4
C. AgNO3溶液
D. AlCl3溶液
23.为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是( )
A. 将镁片放入稀盐酸中
B. 将铜片放入稀盐酸中
C. 将镁片放入硝酸银溶液中
D. 将铜片放入硝酸银溶液中
24.为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是( )
A. MgCl2溶液、 Cu、Sn
B. Mg、Cu、SnCl2 溶液
C. Mg、Sn、Cu、盐酸
D. MgCl2 溶液、Sn、 CuCl2溶液
25.探究铁、铜、镁的金属活动性时,下列现象,分析或结论正确的是( )
铜片表面有气泡产生
B. 有镁片的试管外壁发烫
C. 铁片与盐酸反应速率最快
D. 它们的活动性,Cu>Fe>Mg
26. 某同学参加实验操作考试,为验证镁、锌、铜三种金属的活动性顺序,他设计了以下四种实验方案,其中能达到目的的是( )
A. 将镁片、锌片分别放入Cu(NO3)2溶液中
B. 将锌片、铜片分别放入Mg(NO3)2溶液中
C. 将镁片分别放入Zn(NO3)2溶液、Cu(NO3)2溶液中
D. 将镁片、锌片、铜片分别放入稀盐酸中
27.为验证铝、铜、银的金属活动性强弱,小明设计了以下四组实验,下列说法不正确的是( )
A. 通过①②实验,可以证明金属活动性Al>Cu
B. 通过①②③实验,可以证明金属活动性Al>Cu>Ag
C. 若要用实验④证明金属活动性Al>Cu, X可以为Al, Y为CuSO4溶液
D. 若要用实验④证明金属活动性Cu>Ag, X可以为Cu, Y为AgNO3溶液
28. 文宏同学利用“金属树”趣味实验来验证Zn、Cu、 Ag三种金属的活动性顺序。
(1)为确保实验效果,CuCl2溶液和AgNO3溶液需现配。配制50 g质量分数为12%的CuCl2溶液,应称量________g CuCl2,加水时应选用______mL的量筒。除量筒外,配制溶液还需要的玻璃仪器有________________。
(2)向两个放有宣纸的培养皿中分别滴入适量CuCl2溶液、AgNO3溶液,再放入锌粒,一段时间后观察到的实验现象如图。
①形成“铜树”时发生反应的化学方程式是________________________。
②仅用“铜树”和“银树”实验尚不能验证________的金属活动性顺序,需补充一个实验来证明,应选用的药品是________________________(可供选择的药品有:锌粒、铜丝、银丝、稀盐酸、CuCl2溶液、AgNO3溶液)。
29.学习完金属的化学性质,同学们来到实验室进行锌、铜、银三种金属活动性顺序的探究活动。实验桌上老师提供的药品有:锌片、铜片、银片、硫酸锌溶液、硫酸铜溶液、硝酸银溶液和稀硫酸。
【制定计划】在老师的指导下,经过讨论,同学们设计出了以下几种实验方案:
方案一:铜片、硫酸锌溶液、硝酸银溶液;
方案二:锌片、银片、硫酸铜溶液;
方案三:锌片、铜片、硫酸铜溶液、硝酸银溶液;
你的设计方案是______________________________________。
【进行实验】小华同学选用方案三进行如下探究,请你帮他完成表格中的空白(注:表格中实验操作一栏用文字描述或图示表示均可):
实验操作 实验现象 分析与结论
_____________________ 金属活动性:Cu________Ag(填“>”或“<”)
_________________ 锌片表面附着一层红色物质,溶液由蓝色逐渐变为无色 金属活动性:Zn________Cu(填“>”或“<”),反应的化学方程式为____________________________
【解释与结论】根据上述实验,小华得出三种金属活动性由强到弱的顺序是______________。
【反思与评价】探究活动结束后,同学们分享自己的收获与不足,并进行反思:
(1)有同学提出,小华的实验中不用硫酸铜溶液也能得到相同的实验结论。简要说明其验证方法:__________________________________________________________________。
(2)经过讨论,大家一致认为以上实验方案中,方案________较好。
(3)小华提出,试管中的金属可以回收再利用,这样做的意义是______________________。
【拓展与延伸】好奇地小华在老师的指导下,把一定量的锌粒加入硫酸铜和硝酸银的混合溶液中,充分反应一段时间后,过滤,发现滤液呈无色。此时,滤渣中一定含有________,溶液中离子数目增加的是________。
参考答案
1. A 2. C 3. D
4. D 【解析】La的活动性比锌强,能和稀盐酸反应生成LaCl3和氢气;La2O3能和稀盐酸反应生成LaCl3和水;La(OH)3能和稀盐酸反应生成LaCl3和水;La(OH)3不溶于水,不能和氯化钾溶液反应,故选D。
5. (1)装置气密性 (2)氢气(或H2) (3)氧化铁(或Fe2O3或三氧化二铁) (4)浓度
【解析】(2)铁与盐酸反应产生氢气,因此④、⑤中产生的气体是氢气。(3)根据【探究】③发现产物没有被铁钉吸引,即生成物不是四氧化三铁;根据【探究】④溶液出现黄色,可知铁与空气在酒精灯加热的情况下生成的是氧化铁。(4)铁丝在空气中不能燃烧,能在纯氧中燃烧生成四氧化三铁;铁丝在空气中会发生缓慢氧化生成铁锈,因此铁与氧气反应的产物还受氧气浓度的影响。
6. C 【解析】向一定质量的锌粒和铜片中加入稀硫酸,锌粒能与稀硫酸反应生成氢气和硫酸锌,而铜不能与稀硫酸反应,随着稀硫酸质量的增加,铜的质量不变,锌的质量减小,生成氢气的质量和硫酸锌的质量从0开始不断增大,直至锌反应完全后均不再增大,故选C。
7. C
8. C 【解析】图像的拐点表示反应结束,通过拐点的横坐标可确定完全反应所需时间:丙>甲>乙,A正确;根据图像纵坐标确定生成氢气的质量:甲>乙>丙,B正确;由于三种金属在生成物中化合价均为+2价,又因为金属等质量时生成氢气的质量与金属的相对原子质量成反比,即生成氢气的质量越大,金属的相对原子质量越小,因此相对原子质量:丙>乙>甲,C错误;根据质量守恒定律可知,反应消耗稀硫酸的质量和生成氢气的质量成正比,因此消耗稀硫酸的质量:甲>乙>丙,D正确。
9. B 【解析】图像中只给了反应物和生成物的质量关系,从图象中不能确定镁与锌的活动性强弱,A不合理;若两种金属都有剩余,则等质量的稀硫酸完全反应,会产生等质量的氢气,B合理;若硫酸有剩余,说明金属完全反应,则由图可知等质量的镁和锌,镁最终产生的氢气质量大,C不合理;若两种金属完全溶解,则消耗硫酸的质量镁大于锌,D不合理。
10. A 【解析】铜不与稀硫酸反应,杂质中可能含有铜,所以恰好完全反应时,可能会有固体铜剩余,①错误;分析图像信息,恰好完全反应时消耗稀硫酸100 g,100 g稀硫酸中所含溶质质量为100 g×9.8%=9.8 g,反应中稀硫酸与氢气的质量比为98∶2,则此时生成氢气的质量为0.2 g,②正确;反应中的铁与氢气的质量比为56∶2,镁与氢气的质量比为24∶2,锌与氢气的质量比为65∶2,若5.6 g某铁样品反应生成0.2 g氢气,则一定含有镁,可能含有锌、铜中的某一种或两种均有,③错误;M点硫酸有剩余,此时溶液中一定含有硫酸、硫酸亚铁、硫酸镁,可能含有硫酸锌,④错误;A正确。
11. C 【解析】若三种金属过量,则酸完全反应,产生氢气的质量相等,A正确;若酸足量,等质量的三种金属完全反应,铝产生氢气质量最多,镁次之,锌产生氢气质量最少,B正确;等质量的三种金属完全反应,铝产生氢气质量最多,镁次之,锌最少,若酸与锌恰好反应,则金属铝一定有剩余,镁一定有剩余,所以镁和铝可能产生氢气质量相等,但镁和锌产生氢气质量一定不相等,C错误、D正确。
12. B 【解析】设镁的相对原子质量为8x,则铝的相对原子质量为9x,根据Mg+2HCl=== MgCl2+H2↑可知,参加反应的镁与生成氢气的质量比为8x∶2=4x∶1,根据2Al+6HCl=== 2AlCl3+3H2↑可知,参加反应的铝与生成氢气的质量比为18x∶6=3x∶1,所以产生等质量的氢气,参加反应的镁与铝的质量比为4x∶3x=4∶3,B正确。
13. B 【解析】本题需用极值法解答,由化学方程式中各物质的质量关系可知,5.6 g铁完全反应产生氢气质量为0.2 g,5.6 g锌完全反应产生氢气质量小于0.2 g,5.6 g镁完全反应产生氢气质量大于0.2 g,5.6 g铝完全反应产生氢气质量大于0.2 g,碳和铜与稀盐酸不反应,不能产生氢气,所以5.6 g含两种杂质的铁样品加入稀盐酸,产生0.2 g氢气,则所含杂质需含有5.6 g纯金属产生氢气大于0.2 g的和小于0.2 g的两种,故选B。
14. C 【解析】镁与硫酸反应生成硫酸镁和氢气,铁与硫酸反应生成硫酸亚铁和氢气,因此在一定质量的稀硫酸中加入20 g镁、铁的混合物后,溶液质量增加19 g,则生成氢气的质量为20 g-19 g=1 g;由化学反应中元素守恒可知,生成氢气的质量等于反应的硫酸中氢元素的质量,由此可列式计算参加反应的硫酸中SO的质量;而生成硫酸镁、硫酸亚铁的总质量为金属元素的质量与SO的质量总和,从而求得最终所得硫酸镁、硫酸亚铁混合物的质量。设生成1 g氢气的同时,参加反应的SO的质量为x,则
H2~H2SO4~SO
2 96
1 g x
=
x=48 g
即反应后将溶液蒸干,所得固体的质量为:20 g+48 g=68 g,故选C。
15. B 【解析】现有一定质量的由两种金属组成的混合物,加入过量的稀盐酸,充分反应,测得生成H2 0.2 g,生成氢气的质量等于参加反应的盐酸中氢元素的质量,H~Cl,氢和氯的质量比为1∶35.5,所以氯元素的质量为7.1 g,将反应后的溶液蒸发,得到11.1 g固体。则金属混合物的质量为11.1 g-7.1 g=4 g,则相混合的两种金属生成0.2 g氢气时,一种质量小于4 g,一种质量大于4 g;
Zn+2HCl=== ZnCl2+H2↑
65 2
Mg+2HCl=== MgCl2+H2↑
24 2
Fe+2HCl=== FeCl2+H2↑
56 2
2Al+6HCl=== 2AlCl3+3H2↑
54 6
因此,生成0.2 g氢气需要金属的质量:锌是6.5 g,镁是2.4 g,铁是5.6 g,铝是1.8 g;4 g Mg、Fe 混合物可能生成0.2 g氢气,A正确;4g Fe、Zn 混合物生成氢气一定小于0.2 g,B错误;4 g Zn、Mg混合物可能生成0.2 g氢气,C正确;4 g Al、Fe混合物可能生成0.2 g氢气,D正确。
16. D 【解析】黄铜样品中锌与稀硫酸反应,铜不与稀硫酸反应,向50 g样品中加入300 g稀硫酸,反应后得滤液312.6 g,设黄铜样品中锌的质量为x,完全反应产生氢气的质量为y
Zn+H2SO4=== ZnSO4+H2↑
65 2
xy
则y=,则x+300 g-=312.6 g
解得x=13 g,则黄铜样品中锌的质量分数为×100%=26%,D正确。
17. A 【解析】镁、锌、铁分别与足量稀盐酸反应生成氯化物和氢气,反应后将所得溶液蒸干,所得固体的质量即为氯化物的质量;反应的金属的质量为a g,生成氯化物的质量为(a+14.2) g,由反应前后元素质量守恒可知,氯化物中氯元素的质量为14.2 g,则参加反应的HCl的质量为14.6 g。由镁、锌、铁分别与稀盐酸反应的化学方程式可知,14.6 g HCl完全反应所需镁、锌、铁的质量分别为4.8 g、13.0 g、11.2 g,即金属的质量最小为4.8 g,最大为13.0 g,a的取值范围是4.8≤a≤13.0,故选A。
18. A
19. D 【解析】将X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应,说明金属活动性X(>H)>Y;把Y和Z分别放入硝酸银溶液中,在Y表面有银析出,而Z没有变化,说明Y可以置换出硝酸银中的银,Z不可以,则金属活动性Y>Ag>Z,综上所述X、Y、Z三种金属的活动性顺序为X>Y>Z。
20. A
21. A 【解析】甲图中横坐标是时间,纵坐标是生成氢气的质量,能反映出产生氢气的速率,由此可以看出金属的活动性顺序是X>Z>Y、M,由乙图可知,将金属M加入Y(NO3)2溶液中,M可置换出金属Y,故金属活动性M>Y,所以四种金属的活动性顺序为X>Z>M>Y。
22. A
23. C 【解析】A实验中镁与稀盐酸能发生反应,可得出活动性顺序为:Mg>H;B实验中铜不能与稀盐酸发生反应,可得出活动性顺序为:H>Cu;C实验中镁能与硝酸银溶液发生反应置换出银,可得出活动性顺序为:Mg>Ag;D实验中铜能与硝酸银溶液发生反应置换出银,可得出活动性顺序为:Cu>Ag。结合上述实验A、B、D可得出三种金属的活动性顺序为Mg>Cu>Ag,故C实验不必进行。
24. A 25. B
26. D 【解析】镁、锌均能从Cu(NO3)2溶液中置换出铜,说明镁、锌的活动性都比铜强,但该方案无法比较镁、锌的活动性顺序,A错误;锌、铜均不能与Mg(NO3)2溶液发生反应,说明镁的活动性比锌、铜强,但该方案无法比较锌、铜的活动性顺序,B错误;镁能分别与Zn(NO3)2溶液、Cu(NO3)2溶液发生反应,置换出锌和铜,说明镁的活动性比锌、铜强,但该方案无法比较锌、铜的活动性顺序,C错误;镁片、锌片均能与稀盐酸发生反应且镁的反应速率比锌快,说明镁的活动性比锌强;铜不与稀盐酸发生反应,说明三种金属中铜的活动性最弱,D正确。
27. B 【解析】实验①铝可以与稀硫酸反应,可知在金属活动性顺序中Al位于H前,实验②铜不能与稀硫酸反应,可知在金属活动性顺序中Cu位于H后,由此可证明金属活动性Al>Cu,A正确;实验③铝与硝酸银溶液能反应,可证明金属活动性Al>Ag,实验①②③不能比较Cu和Ag的金属活动性,B不正确;实验④中,若X为Al,Y为CuSO4溶液,观察到铝表面有红色固体析出,溶液蓝色变浅,可证明金属活动性Al>Cu,C正确;实验④中,若X为Cu,Y为AgNO3溶液,观察到铜表面有银白色固体析出,溶液由无色变为蓝色,可证明金属活动性Cu>Ag,D正确。
28. (1)6 50 烧杯、玻璃棒 (2)①Zn+CuCl2=== ZnCl2+Cu ②铜和银(或Cu和Ag) 铜丝和AgNO3溶液(或银丝和CuCl2溶液)
【解析】(1)配制50 g质量分数为12%的CuCl2溶液,需要CuCl2的质量为50 g×12%=6 g,水的质量为50 g-6 g=44 g,即需加44 mL水,为了减少误差,量取水时应选用50 mL的量筒。除量筒外,配制溶液在烧杯中进行,用玻璃棒搅拌,所以还需要的玻璃仪器有烧杯、玻璃棒。(2)①锌与氯化铜溶液反应生成铜和氯化锌,则形成“铜树”时发生反应的化学方程式是Zn+CuCl2=== ZnCl2+Cu;②形成“铜树”说明金属活动性顺序锌>铜,形成“银树”说明金属活动性顺序锌>银,仅用“铜树”和“银树”实验不能验证铜和银的金属活动性顺序,需补充一个实验来证明,应选用的药品是铜丝和AgNO3溶液,根据铜丝表面会析出银白色固体,溶液由无色变浅变为蓝色,可判断金属活动性顺序铜>银,还可以选择银丝和CuCl2溶液,无明显现象,也可判断金属活动性顺序铜>银。
29. 【制定计划】锌片、铜片、硝酸银溶液和稀硫酸 【进行实验】铜片表面有银白色固体析出,溶液由无色逐渐变为蓝色 > 将打磨过的锌片加入硫酸铜溶液中 > Zn+CuSO4=== ZnSO4+Cu 【解释与结论】Zn>Cu>Ag 【反思与评价】(1)将打磨过的铜片放入硝酸银溶液中,铜与硝酸银反应生成硝酸铜和银,有银白色固体析出,溶液由无色变为蓝色,说明金属活动性:Cu>Ag;再将打磨过的锌片放入反应后的溶液中,锌与硝酸铜反应生成硝酸锌和铜,有红色固体析出,溶液由蓝色变为无色,说明金属活动性:Zn>Cu (2)一、二 (3)节约金属资源,减少污染(合理即可) 【拓展与延伸】Cu、Ag Zn2+
【解析】【制定计划】还可以设计方案:锌片、铜片、硝酸银溶液和稀硫酸。锌能与稀硫酸反应生成硫酸锌和氢气,有气泡产生,说明在金属活动性顺序里,锌排在氢前,铜与稀硫酸不反应,说明在金属活动性顺序里,铜在氢后,铜能与硝酸银反应有银白色固体析出,溶液由无色变为蓝色,说明在金属活动性顺序里,铜排在银之前,由此可以验证三种金属的活动性顺序。【进行实验】铜能与硝酸银溶液反应生成硝酸铜和银,实验现象为:铜片表面有银白色固体析出,溶液由无色逐渐变为蓝色,说明金属活动性:Cu>Ag;实验现象为:锌片表面附着一层红色物质,溶液由蓝色逐渐变为无色,说明该实验是将打磨过的锌片加入到硫酸铜溶液中,锌与硫酸铜溶液反应生成硫酸锌和铜,该实验说明金属活动性:Zn>Cu,发生反应的化学方程式为Zn+CuSO4=== ZnSO4+Cu。【解释与结论】由以上分析可知,三种金属活动性由强到弱的顺序是Zn>Cu>Ag。【反思与评价】(1)将打磨过的铜片放入硝酸银溶液中,铜与硝酸银反应生成硝酸铜和银,有银白色固体析出,溶液由无色变为蓝色,说明金属活动性:Cu>Ag;再将打磨过的锌片放入反应后的溶液中,锌与硝酸铜反应生成硝酸锌和铜,有红色固体析出,溶液由蓝色变为无色,说明金属活动性:Zn>Cu。(2)方案一、二较好,所选试剂较少,操作简单。(3)试管中的金属回收利用,可以节约金属资源,而且可以减少环境污染。【拓展与延伸】把一定量的锌粒加入硫酸铜和硝酸银的混合溶液中,锌先与硝酸银溶液反应生成硝酸锌和银,待硝酸银完全反应后,锌再与硫酸铜溶液反应生成硫酸锌和铜,充分反应一段时间后,过滤,发现滤液呈无色,说明硫酸铜已经完全反应,锌可能过量,也可能恰好与硫酸铜完全反应,故滤渣中一定含有Cu、Ag;溶液中离子数目增加的是Zn2+,铜离子、银离子数目逐渐减小,硫酸根离子和硝酸根离子数目不变。
(
1
)
