浙教版科学中考复习专题训练:盐的性质【word,含答案】
文档属性
| 名称 | 浙教版科学中考复习专题训练:盐的性质【word,含答案】 |  | |
| 格式 | docx | ||
| 文件大小 | 174.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-14 11:05:03 | ||
图片预览



文档简介
盐的性质
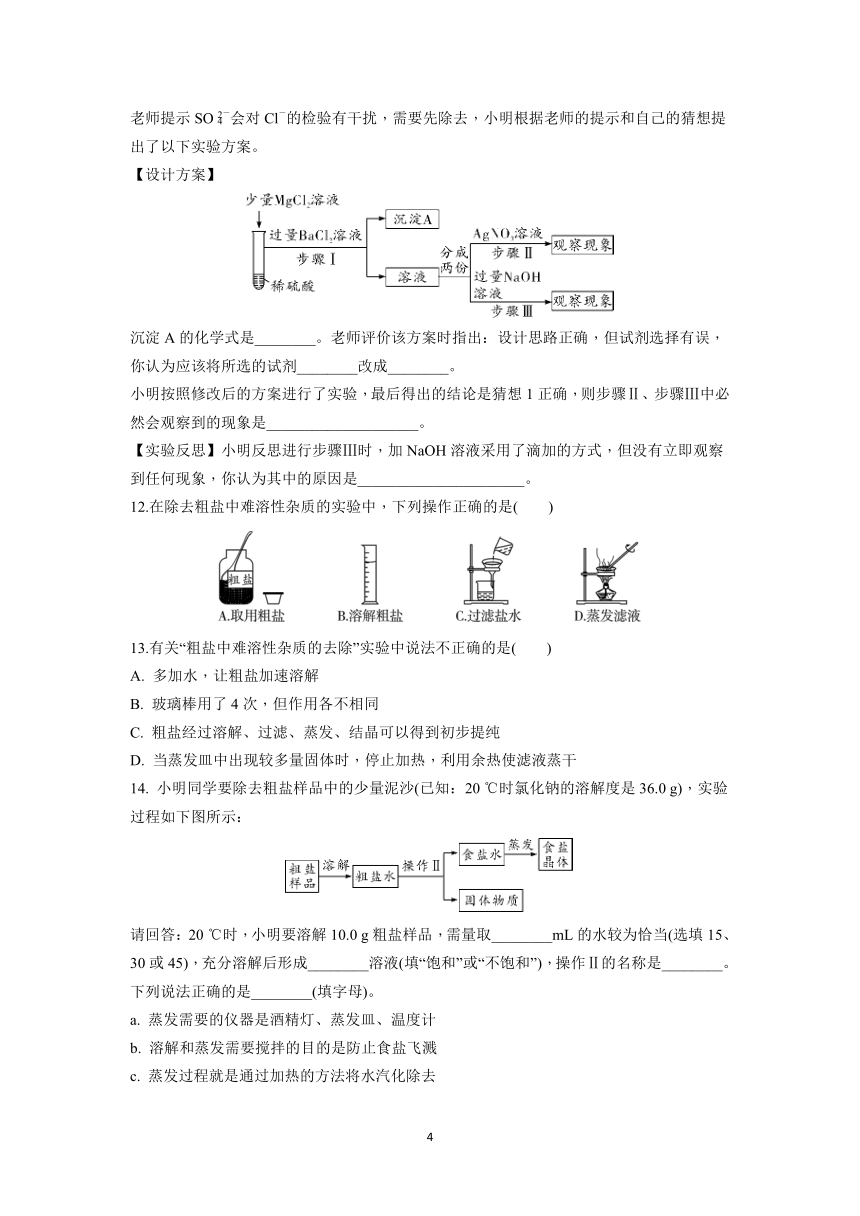
1. 下列我国著名科学家中,主要贡献为发明了联合制碱法的是( )
A. 袁隆平 B. 侯德榜 C. 张青莲 D. 屠呦呦
2. 下列有关盐的用途的说法错误的是( )
A. 氯化钠是重要的调味品
B. 可用亚硝酸钠代替食盐腌渍食品
C. 小苏打可用于焙制糕点
D. 碳酸钙可用作补钙剂
3. 硝石是主要含KNO3的天然矿物,历史上《本草经集注》中对硝石有记载:“强烧之,紫青烟起……云是真硝石也”。下列有关KNO3的叙述不正确的是( )
A. 是一种化合物
B. 可用作复合肥料
C. 可能发生分解反应
D. 其溶解度一定大于NaCl的溶解度
4.小深同学用思维导图梳理了Na2CO3的相关知识,其中描述错误的是( )
5. 课外实验具有趣味性、实践性等特点。鸡蛋壳成分的探究过程如下,其中正确的是( )
实验①证明蛋壳成分是CaCO3
B. 实验②可证明蛋壳中含钙元素
C. 实验③得到的固体能与水反应
D. 实验中每步操作都是规范的
6.学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成(其它物质省略),如图所示。请回答:
(1)若盐是硫酸钾,则①中发生反应的化学方程式为________________________。
(2)若盐是氯化亚铁,则在已显示的变化中可以通过置换反应来实现的有______(填序号)。
(3)若盐是硝酸铜,由⑦来实现的化学方程式为:__________________________。
(4)图中⑤处应补充的文字是________________________(写一种,不能与图中已有信息重复)。
7.将下列各组物质放入足量的水中、充分搅拌后,得到无色溶液的是( )
A. 硝酸钾和氯化铁
B. 氢氧化钾和盐酸
C. 硫酸铜和氢氧化钠
D. 硫酸钠和氯化钡
8. 一包白色粉末可能含有KNO3、CuCl2、KCl、BaCl2中的一种或几种。为验证其成分,做如下实验:
(1)取样加入适量水完全溶解,溶液呈无色。
(2)将(1)所得溶液均分两份,向其中1份滴加硫酸钠溶液,无沉淀产生。
(3)向另一份滴加硝酸银溶液,有白色沉淀产生。
据此分析:①原白色粉末的组成是____________或________________。
②产生沉淀的化学方程式为____________________________________。
9.酸、碱、盐的溶解性表是学习化学的重要工具之一。下表是部分酸、碱、盐在水中的溶解性(20 ℃),请回答下列问题。
阳离子 阴离子 OH- NO CO Cl-
K+ 溶 溶 溶 溶
Ba2+ 溶 溶 不 溶
Cu2+ 不 溶 不 溶
(1)上述阴、阳离子形成不溶性碱的化学式为________,形成复合肥料的化学式为________。
(2)KOH溶液和Ba(NO3)2溶液________(填“能”或“不能”)反应,理由是____________________。
(3)下列各组离子在水溶液中能大量共存的是________。
A. OH- H+ Ba2+ NO B. OH- Ba2+ K+ Cl-
C. CO K+ Ba2+ Cl- D. CO Cu2+ NO K+
10.在宏观、微观、符号之间建立联系,是化学学科的主要学习内容和方法。
图1图2
图3
回答下列问题:
(1)根据图1,HCl在水中会解离出H+和Cl-,表示为HCl=== H++Cl-,则NaOH在水中解离可表示为________________________。
(2)根据图2,氢氧化钠溶液与盐酸反应的实质可表示为:H++OH-=== H2O。图3是氯化钡溶液与硫酸钠溶液反应的微观示意图,该反应的实质可表示为______________。
(3)氢氧化钠溶液与硫酸铜溶液反应的实质可表示为______________________________。
11. 学习复分解反应发生条件时,小红同学做了下表中的四个实验。
试管编号 ① ② ③ ④
试管内试剂 NaOH溶液 MgCl2溶液 Na2CO3溶液 Ba(NO3)2溶液
加入稀硫酸后的现象 无明显现象 无明显现象 产生气泡 白色沉淀生成
(1)根据以上实验,可以判断试管③④中发生了复分解反应。试管③中反应的化学方程式为___________________________。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是________。
(3)为了验证试管②中是否发生复分解反应,小明同学进行了如下探究。
【提出猜想】猜想1:试管②中没有发生复分解反应,溶液中有MgCl2,即Mg2+和Cl-同时存在溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示SO会对Cl-的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了以下实验方案。
【设计方案】
沉淀A的化学式是________。老师评价该方案时指出:设计思路正确,但试剂选择有误,你认为应该将所选的试剂________改成________。
小明按照修改后的方案进行了实验,最后得出的结论是猜想1正确,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是____________________。
【实验反思】小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是______________________。
12.在除去粗盐中难溶性杂质的实验中,下列操作正确的是( )
13.有关“粗盐中难溶性杂质的去除”实验中说法不正确的是( )
A. 多加水,让粗盐加速溶解
B. 玻璃棒用了4次,但作用各不相同
C. 粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯
D. 当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
14. 小明同学要除去粗盐样品中的少量泥沙(已知:20 ℃时氯化钠的溶解度是36.0 g),实验过程如下图所示:
请回答:20 ℃时,小明要溶解10.0 g粗盐样品,需量取________mL的水较为恰当(选填15、30或45),充分溶解后形成________溶液(填“饱和”或“不饱和”),操作Ⅱ的名称是________。下列说法正确的是________(填字母)。
a. 蒸发需要的仪器是酒精灯、蒸发皿、温度计
b. 溶解和蒸发需要搅拌的目的是防止食盐飞溅
c. 蒸发过程就是通过加热的方法将水汽化除去
15. 去除难溶性杂质后的食盐样品中还含有可溶性杂质:CaCl2、MgCl2和Na2SO4。为除去可溶性杂质,将食盐样品溶于水,依次加入稍过量的三种溶液:BaCl2溶液、NaOH溶液、Na2CO3溶液。充分反应后过滤,得滤渣X,向滤液中加入过量的稀盐酸,搅拌、煮沸,得氯化钠溶液。下列说法正确的是( )
A. 滤渣X中有三种成分
B. “向滤液中加入过量的稀盐酸”目的只是为了除去过量的NaOH
C. 除杂过程中有Na2CO3参加的化学反应为复分解反应
D. 将氯化钠溶液用如图装置加热蒸发,至水分完全蒸干时停止加热
16. 实验室对含有MgCl2的粗盐进行提纯,步骤如图:
(1)步骤①中, 称量5.0 g粗盐需补充的主要仪器是________。
(2)步骤②中,玻璃棒的作用是____________。
(3)步骤③中,滴加过量NaOH溶液除去MgCl2,反应的化学方程式是_____________。
(4)步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是________(填字母)。
A. 稀盐酸 B. 稀硫酸 C. 稀硝酸
(5)步骤⑥的操作名称是________,当________________时,停止加热。
17. 粗盐中含有泥沙等不溶性杂质,还含有氯化钙、氯化镁、硫酸钠等可溶性杂质。提纯粗盐的工艺流程如下:
请根据上述题中有关信息,回答下列问题:
(1)滤液2中溶质的成分是____________________(填化学式)。
(2)步骤③中加入的试剂A的化学式是____________,发生反应的化学方程式为___________。
(3)步骤④中加入过量Na2CO3溶液的目的是________________________。
(4)若步骤⑤中加入的盐酸不慎过量,对氯化钠的纯度_________影响(填“有”或 “无”),理由是___________________________。
18. 小滨给校园里枝叶稀疏、叶色发黄的植物施用尿素[CO(NH2)2],尿素是一种( )
A. 氮肥 B. 复合肥 C. 磷肥 D. 钾肥
19. 学校花圃所种的花卉缺乏氮元素和钾元素。如果只施用一种化肥,则应施用( )
A. 硝酸钾 B. 碳酸钾 C. 尿素 D. 碳酸氢铵
20. 磷肥可以促进作物生长,增强作物的抗寒、抗旱能力。下列化肥属于磷肥的是( )
A. K2SO4 B. NH4Cl C. KNO3 D. Ca3(PO4)2
21. 同学们夏季郊游时,发现稻田里的水稻叶子发黄并倒下了一片,都认为应该向稻田中施用的复合肥是( )
A. NH4NO3 B. KNO3 C. Ca3(PO4)2 D. KCl
22.今年夏粮又获丰收,再显中国饭碗自信,其中化肥功不可没。下列说法错误的是( )
A. 铵态氮肥不能与碱性物质混用
B. 磷酸二氢铵(NH4H2PO4)属于复合肥
C. 含氮量为31.5%的硝酸铵(NH4NO3)化肥样品为纯净物
D. 化肥虽好但不能滥用,过度施肥会造成土壤退化和水体污染
23.小华的爷爷去年购买的化肥,由于外包装上的字迹模糊,无法辨认,只记得该化肥成分是KNO3、NH4HCO3和(NH4)2SO4中的一种。小华为帮助爷爷鉴别化肥,设计了如下方案:
(1)取该化肥少量于研钵中,加入少量熟石灰粉末混合研磨,闻到氨味,推断该化肥成分一定不是________。
(2)为进一步鉴别该化肥的成分,小华设计了以下实验:
实验步骤 实验现象 实验结论
取少量化肥于试管中,加水溶解后,再滴加稀盐酸 无气泡产生 该化肥成分是________(填写物质名称)
(3)小华为了确认化肥成分中的阴离子,设计了如下三种实验方案:①先加入氯化钡溶液,再加入稀盐酸。②先加入硫酸酸化,再加入氯化钡溶液。③先加入盐酸酸化,再加氯化钡溶液。你认为上述三种方案合理的是______,简述不合理方案的理由________________________(任写一种)。
(4)请你写出使用铵态氮肥的一点注意事项________________________。
(5)实验室需要配制质量分数为2%的(NH4)2SO4溶液,配制该溶液的过程中,所需要的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需要________(填写仪器名称)。
参考答案
1. B 【解析】袁隆平是杂交水稻之父,A不正确;侯德榜发明了联合制碱法,B正确;张青莲主持测定多种元素的相对原子质量,C不正确;屠呦呦因发现青蒿素治疗疟疾的新疗法而获得诺贝尔奖,D不正确。
2. B 【解析】亚硝酸钠有毒,不能代替食盐腌渍食品,B错误。
3. D 【解析】硝酸钾是由三种元素组成的纯净物,属于化合物,A正确;硝酸钾中同时含有植物所需的营养元素中的钾元素和氮元素,属于复合肥,B正确;硝石强烧能产生紫青烟,说明该反应可能是分解反应,C正确;比较硝酸钾和氯化钠的溶解度时要指明温度,否则不能比较,D不正确。
4. A
5. C 【解析】与酸反应产生气泡的物质不止有碳酸钙,A错误;加入酚酞溶液不变色,不能证明蛋壳中含钙元素,B错误;蛋壳灼烧会生成氧化钙,氧化钙能与水发生反应,C正确;实验中使用胶头滴管的操作错误,胶头滴管滴加液体时应垂直悬空于烧杯口的正上方,D错误。
6. (1)2KOH+H2SO4=== K2SO4+2H2O (2)④⑥
(3)Ba(NO3)2+CuSO4=== Cu(NO3)2+BaSO4↓[或2AgNO3+CuCl2=== Cu(NO3)2+2AgCl↓]
(4)金属氧化物+酸(合理即可)
【解析】(1)若盐是硫酸钾,则酸和碱的反应为KOH和H2SO4的中和反应。(2)若盐是氯化亚铁,则可以通过置换反应来实现的分别为金属和酸(铁和盐酸)、金属和盐(铁和氯化铜)。(3)若盐为硝酸铜,根据复分解反应发生的条件可知,盐和盐的反应为硝酸钡和硫酸铜或硝酸银和氯化铜的反应,据此写出化学反应方程式。(4)根据不同类别的物质生成盐的反应可知,金属氧化物+酸或非金属氧化物+碱的反应也可生成盐,如稀盐酸除铁锈生成氯化铁和水、二氧化碳和氢氧化钠反应生成碳酸钠和水。
7. B 【解析】氯化铁溶液呈黄色,氢氧化钾和盐酸反应生成氯化钾和水,溶液无色;硫酸铜和氢氧化钠反应生成氢氧化铜蓝色沉淀;硫酸钠和氯化钡反应生成硫酸钡白色沉淀;故选B。
8. (3)①KCl KCl和KNO3 ②KCl+AgNO3=== AgCl↓+KNO3
【解析】(1)取样加入适量水溶解,溶液呈无色,说明白色粉末中没有氯化铜。(2)向(1)所得溶液中加入硫酸钠溶液,无沉淀产生,说明白色粉末中没有氯化钡。(3)向(1)所得溶液中滴加硝酸银溶液,有白色沉淀产生,说明白色粉末中一定含有氯化钾,可能含有硝酸钾。因此①白色粉末的组成是氯化钾或氯化钾和硝酸钾的混合物; ②氯化钾和硝酸银反应生成氯化银沉淀和硝酸钾,反应的化学方程式为KCl+AgNO3=== AgCl↓+KNO3。
9. (1)Cu(OH)2 KNO3 (2)不能 KOH和Ba(NO3)2互相交换成分,不能生成水、气体或沉淀,不满足复分解反应发生的条件 (3)B
【解析】(1)解离时生成的阴离子全部是氢氧根离子的化合物属于碱,表中阴、阳离子能形成的不溶性碱是氢氧化铜,化学式为Cu(OH)2;含氮、磷、钾中的两种或三种营养元素的化肥称为复合肥,表中阴、阳离子能形成的复合肥是硝酸钾,化学式为KNO3。(2)KOH和Ba(NO3)2互相交换成分,在溶液中不能生成水、气体或沉淀,不满足复分解反应发生的条件,因此不能发生反应。(3)若物质在水中解离出的离子能重新结合生成水或气体或沉淀时,物质就不能共存。H+与OH-结合生成水,不能共存,A错误;OH-、Ba2+、K+、Cl-两两结合不会发生反应,可以共存,B正确;Ba2+与CO结合生成白色沉淀,不能共存,C错误;Cu2+与CO结合形成不溶性的CuCO3,不能共存,D错误。
10. (1)NaOH=== Na++OH- (2)Ba2++SO=== BaSO4↓
(3)2OH-+Cu2+=== Cu(OH)2↓
【解析】(1)氢氧化钠是一种碱,在水溶液中解离出的阴离子全部是氢氧根离子,阳离子是钠离子,因此氢氧化钠在水中的解离可表示为NaOH=== Na++OH-。(2)氯化钡溶液与硫酸钠溶液反应的实质是钡离子与硫酸根离子结合生成硫酸钡沉淀,可表示为Ba2++SO=== BaSO4↓。(3)氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,反应的实质是氢氧根离子与铜离子结合生成氢氧化铜沉淀,可表示为Cu2++2OH-=== Cu(OH)2↓。
11. (1)H2SO4+Na2CO3=== Na2SO4+H2O+CO2↑
(2)无色酚酞溶液(合理即可) (3)【设计方案】BaSO4 BaCl2 Ba(NO3)2 均有白色沉淀生成 【实验反思】氢氧化钠溶液先与溶液中的酸反应
【解析】(1)试管③中碳酸钠与稀硫酸反应生成硫酸钠、水和二氧化碳,据此写出反应的化学方程式。(2)根据中和反应实验,要在反应中看到明显的现象,加入的试剂可以为无色酚酞溶液。(3)【设计方案】氯化钡和稀硫酸发生反应生成硫酸钡沉淀和氯化氢,所以沉淀A的化学式为BaSO4。选择试剂为氯化钡时,引入了Cl-,对验证氯化镁造成干扰,同时考虑不影响溶液中的Mg2+的检验,故应该将所选试剂BaCl2溶液改成Ba(NO3)2溶液。修改方案之后,步骤Ⅱ中发生的反应是:2AgNO3+MgCl2=== 2AgCl↓+Mg(NO3)2 ,步骤Ⅲ中发生的反应是:2NaOH+MgCl2=== Mg(OH)2↓+2NaCl,所以必然会观察到的现象是均有白色沉淀生成。【实验反思】因为步骤Ⅰ反应后的溶液中有酸,所以加入氢氧化钠溶液会先与溶液中的酸反应,故不会立即观察到现象。
12. D 【解析】取用粗盐时瓶塞要倒放,A错误;溶解粗盐不能在量筒中进行,B错误;过滤时要用玻璃棒引流,C错误;蒸发滤液时要用玻璃棒搅拌,防止因局部受热导致液滴飞溅,D正确。
13. A
14. 30 不饱和 过滤 c
【解析】20 ℃时,氯化钠的溶解度为36.0 g,即100 g水中最多溶解36.0 g氯化钠,那么溶解10.0 g粗盐,至少需要水的质量约为27.8 g,则需量取30 mL的水较为恰当。充分溶解后形成的溶液是不饱和溶液,操作Ⅱ后得到食盐水以及固体物质,可知该操作为过滤。蒸发需要的仪器是酒精灯、蒸发皿、玻璃棒,a错误;溶解需要搅拌的目的是加速溶解,蒸发需要搅拌的目的是防止因局部温度过高造成液滴飞溅,b错误;蒸发过程就是通过加热的方法将水汽化除去,c正确。
15. C 【解析】由题中信息分析去除可溶性杂质的过程为:
则滤渣X中含有硫酸钡、氢氧化镁、碳酸钡和碳酸钙四种成分,A错误;向滤液中加入过量盐酸的目的是除去过量的氢氧化钠和碳酸钠溶液,B错误;除杂过程中碳酸钠与氯化钙、氯化钡、稀盐酸的反应均为复分解反应,C正确;蒸发氯化钠溶液时需用玻璃棒不断搅拌,在蒸发皿中出现较多量固体时停止加热,用余热将剩余液体蒸干,D错误。
16. (1)托盘天平(或电子天平) (2)搅拌,加速溶解 (3)2NaOH+MgCl2=== 2NaCl+Mg(OH)2↓ (4)A (5)蒸发 蒸发皿中出现较多固体
【解析】(1)步骤①中,称量5.0 g粗盐需要用到的称量仪器是托盘天平或电子天平。(2)步骤②为溶解粗盐,其中玻璃棒的作用是搅拌,加速溶解。(3)步骤③中,滴加过量氢氧化钠溶液除去氯化镁,氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式为2NaOH+MgCl2=== 2NaCl+Mg(OH)2↓。(4)步骤⑤中,为中和过量的氢氧化钠,氢氧化钠属于碱,能与稀盐酸反应生成氯化钠和水,与稀硫酸反应生成硫酸钠和水,与稀硝酸反应生成硝酸钠和水,为得到纯净的氯化钠且不引入新杂质,则应滴加的试剂a为稀盐酸,故选A。(5)步骤⑥的操作是从溶液中析出晶体的过程,其操作名称是蒸发,当蒸发皿中出现较多固体时,应停止加热,利用余热蒸干液体。
17. (1)CaCl2、Na2SO4、NaCl、NaOH (2)BaCl2 BaCl2+Na2SO4=== BaSO4↓+2NaCl (3)除去氯化钙和过量的氯化钡 (4)无 氯化氢具有挥发性
18. A
19. A 【解析】硝酸钾中既含氮元素又含钾元素,A正确;碳酸钾中只含所缺少的钾元素,B错误;尿素、碳酸氢铵中只含所缺少的氮元素,C、D错误。
20. D 21. B
22. C 【解析】铵态氮肥与碱性物质混用会生成氨气,降低肥效,A正确;磷酸二氢铵中含有植物生长所需氮元素和磷元素,属于复合肥,B正确;硝酸铵中氮元素质量分数为35%,含氮量为31.5%的硝酸铵化肥样品为混合物,C错误;大量使用化肥会造成水体污染、土壤退化,所以要合理使用,D正确。
23. (1)KNO3 (2)硫酸铵 (3)①③ 加入硫酸酸化时引入SO,无法确定原化肥中是否含SO (4)不能与碱性物质混用 (5)量筒
【解析】(1)铵盐与碱反应放出氨气;将化肥与熟石灰一起研磨时能闻到氨味,说明该化肥属于铵盐,含有NH,即该化肥一定不是KNO3。(2)取少量化肥滴加盐酸后无气泡产生,说明该化肥是硫酸铵。(3)向样品中加入氯化钡溶液,有沉淀生成说明化肥中含SO;无沉淀生成时,再加稀盐酸,产生气泡说明化肥含HCO,不产生气泡说明化肥含NO,方案①合理;向样品中加入稀硫酸,产生气泡说明化肥含HCO;若不产生气泡则再向其中滴加氯化钡溶液,由于加入的稀硫酸中含SO,因此一定会产生白色沉淀,但化肥中含有NO还是SO无法确定;方案②不合理;先向样品中加入稀盐酸,产生气泡说明化肥含HCO;若不产生气泡则再向其中滴加氯化钡溶液,此时若产生白色沉淀,说明化肥中含SO;若不产生沉淀,则说明化肥中含NO,方案③合理。(4)铵态氮肥与碱性物质发生反应能放出氨气,降低肥效,因此使用铵态氮肥时不能与碱性物质混用。(5)在用硫酸铵固体配制2%硫酸铵溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和量筒等。
(
1
)
1. 下列我国著名科学家中,主要贡献为发明了联合制碱法的是( )
A. 袁隆平 B. 侯德榜 C. 张青莲 D. 屠呦呦
2. 下列有关盐的用途的说法错误的是( )
A. 氯化钠是重要的调味品
B. 可用亚硝酸钠代替食盐腌渍食品
C. 小苏打可用于焙制糕点
D. 碳酸钙可用作补钙剂
3. 硝石是主要含KNO3的天然矿物,历史上《本草经集注》中对硝石有记载:“强烧之,紫青烟起……云是真硝石也”。下列有关KNO3的叙述不正确的是( )
A. 是一种化合物
B. 可用作复合肥料
C. 可能发生分解反应
D. 其溶解度一定大于NaCl的溶解度
4.小深同学用思维导图梳理了Na2CO3的相关知识,其中描述错误的是( )
5. 课外实验具有趣味性、实践性等特点。鸡蛋壳成分的探究过程如下,其中正确的是( )
实验①证明蛋壳成分是CaCO3
B. 实验②可证明蛋壳中含钙元素
C. 实验③得到的固体能与水反应
D. 实验中每步操作都是规范的
6.学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成(其它物质省略),如图所示。请回答:
(1)若盐是硫酸钾,则①中发生反应的化学方程式为________________________。
(2)若盐是氯化亚铁,则在已显示的变化中可以通过置换反应来实现的有______(填序号)。
(3)若盐是硝酸铜,由⑦来实现的化学方程式为:__________________________。
(4)图中⑤处应补充的文字是________________________(写一种,不能与图中已有信息重复)。
7.将下列各组物质放入足量的水中、充分搅拌后,得到无色溶液的是( )
A. 硝酸钾和氯化铁
B. 氢氧化钾和盐酸
C. 硫酸铜和氢氧化钠
D. 硫酸钠和氯化钡
8. 一包白色粉末可能含有KNO3、CuCl2、KCl、BaCl2中的一种或几种。为验证其成分,做如下实验:
(1)取样加入适量水完全溶解,溶液呈无色。
(2)将(1)所得溶液均分两份,向其中1份滴加硫酸钠溶液,无沉淀产生。
(3)向另一份滴加硝酸银溶液,有白色沉淀产生。
据此分析:①原白色粉末的组成是____________或________________。
②产生沉淀的化学方程式为____________________________________。
9.酸、碱、盐的溶解性表是学习化学的重要工具之一。下表是部分酸、碱、盐在水中的溶解性(20 ℃),请回答下列问题。
阳离子 阴离子 OH- NO CO Cl-
K+ 溶 溶 溶 溶
Ba2+ 溶 溶 不 溶
Cu2+ 不 溶 不 溶
(1)上述阴、阳离子形成不溶性碱的化学式为________,形成复合肥料的化学式为________。
(2)KOH溶液和Ba(NO3)2溶液________(填“能”或“不能”)反应,理由是____________________。
(3)下列各组离子在水溶液中能大量共存的是________。
A. OH- H+ Ba2+ NO B. OH- Ba2+ K+ Cl-
C. CO K+ Ba2+ Cl- D. CO Cu2+ NO K+
10.在宏观、微观、符号之间建立联系,是化学学科的主要学习内容和方法。
图1图2
图3
回答下列问题:
(1)根据图1,HCl在水中会解离出H+和Cl-,表示为HCl=== H++Cl-,则NaOH在水中解离可表示为________________________。
(2)根据图2,氢氧化钠溶液与盐酸反应的实质可表示为:H++OH-=== H2O。图3是氯化钡溶液与硫酸钠溶液反应的微观示意图,该反应的实质可表示为______________。
(3)氢氧化钠溶液与硫酸铜溶液反应的实质可表示为______________________________。
11. 学习复分解反应发生条件时,小红同学做了下表中的四个实验。
试管编号 ① ② ③ ④
试管内试剂 NaOH溶液 MgCl2溶液 Na2CO3溶液 Ba(NO3)2溶液
加入稀硫酸后的现象 无明显现象 无明显现象 产生气泡 白色沉淀生成
(1)根据以上实验,可以判断试管③④中发生了复分解反应。试管③中反应的化学方程式为___________________________。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是________。
(3)为了验证试管②中是否发生复分解反应,小明同学进行了如下探究。
【提出猜想】猜想1:试管②中没有发生复分解反应,溶液中有MgCl2,即Mg2+和Cl-同时存在溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示SO会对Cl-的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了以下实验方案。
【设计方案】
沉淀A的化学式是________。老师评价该方案时指出:设计思路正确,但试剂选择有误,你认为应该将所选的试剂________改成________。
小明按照修改后的方案进行了实验,最后得出的结论是猜想1正确,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是____________________。
【实验反思】小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是______________________。
12.在除去粗盐中难溶性杂质的实验中,下列操作正确的是( )
13.有关“粗盐中难溶性杂质的去除”实验中说法不正确的是( )
A. 多加水,让粗盐加速溶解
B. 玻璃棒用了4次,但作用各不相同
C. 粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯
D. 当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
14. 小明同学要除去粗盐样品中的少量泥沙(已知:20 ℃时氯化钠的溶解度是36.0 g),实验过程如下图所示:
请回答:20 ℃时,小明要溶解10.0 g粗盐样品,需量取________mL的水较为恰当(选填15、30或45),充分溶解后形成________溶液(填“饱和”或“不饱和”),操作Ⅱ的名称是________。下列说法正确的是________(填字母)。
a. 蒸发需要的仪器是酒精灯、蒸发皿、温度计
b. 溶解和蒸发需要搅拌的目的是防止食盐飞溅
c. 蒸发过程就是通过加热的方法将水汽化除去
15. 去除难溶性杂质后的食盐样品中还含有可溶性杂质:CaCl2、MgCl2和Na2SO4。为除去可溶性杂质,将食盐样品溶于水,依次加入稍过量的三种溶液:BaCl2溶液、NaOH溶液、Na2CO3溶液。充分反应后过滤,得滤渣X,向滤液中加入过量的稀盐酸,搅拌、煮沸,得氯化钠溶液。下列说法正确的是( )
A. 滤渣X中有三种成分
B. “向滤液中加入过量的稀盐酸”目的只是为了除去过量的NaOH
C. 除杂过程中有Na2CO3参加的化学反应为复分解反应
D. 将氯化钠溶液用如图装置加热蒸发,至水分完全蒸干时停止加热
16. 实验室对含有MgCl2的粗盐进行提纯,步骤如图:
(1)步骤①中, 称量5.0 g粗盐需补充的主要仪器是________。
(2)步骤②中,玻璃棒的作用是____________。
(3)步骤③中,滴加过量NaOH溶液除去MgCl2,反应的化学方程式是_____________。
(4)步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是________(填字母)。
A. 稀盐酸 B. 稀硫酸 C. 稀硝酸
(5)步骤⑥的操作名称是________,当________________时,停止加热。
17. 粗盐中含有泥沙等不溶性杂质,还含有氯化钙、氯化镁、硫酸钠等可溶性杂质。提纯粗盐的工艺流程如下:
请根据上述题中有关信息,回答下列问题:
(1)滤液2中溶质的成分是____________________(填化学式)。
(2)步骤③中加入的试剂A的化学式是____________,发生反应的化学方程式为___________。
(3)步骤④中加入过量Na2CO3溶液的目的是________________________。
(4)若步骤⑤中加入的盐酸不慎过量,对氯化钠的纯度_________影响(填“有”或 “无”),理由是___________________________。
18. 小滨给校园里枝叶稀疏、叶色发黄的植物施用尿素[CO(NH2)2],尿素是一种( )
A. 氮肥 B. 复合肥 C. 磷肥 D. 钾肥
19. 学校花圃所种的花卉缺乏氮元素和钾元素。如果只施用一种化肥,则应施用( )
A. 硝酸钾 B. 碳酸钾 C. 尿素 D. 碳酸氢铵
20. 磷肥可以促进作物生长,增强作物的抗寒、抗旱能力。下列化肥属于磷肥的是( )
A. K2SO4 B. NH4Cl C. KNO3 D. Ca3(PO4)2
21. 同学们夏季郊游时,发现稻田里的水稻叶子发黄并倒下了一片,都认为应该向稻田中施用的复合肥是( )
A. NH4NO3 B. KNO3 C. Ca3(PO4)2 D. KCl
22.今年夏粮又获丰收,再显中国饭碗自信,其中化肥功不可没。下列说法错误的是( )
A. 铵态氮肥不能与碱性物质混用
B. 磷酸二氢铵(NH4H2PO4)属于复合肥
C. 含氮量为31.5%的硝酸铵(NH4NO3)化肥样品为纯净物
D. 化肥虽好但不能滥用,过度施肥会造成土壤退化和水体污染
23.小华的爷爷去年购买的化肥,由于外包装上的字迹模糊,无法辨认,只记得该化肥成分是KNO3、NH4HCO3和(NH4)2SO4中的一种。小华为帮助爷爷鉴别化肥,设计了如下方案:
(1)取该化肥少量于研钵中,加入少量熟石灰粉末混合研磨,闻到氨味,推断该化肥成分一定不是________。
(2)为进一步鉴别该化肥的成分,小华设计了以下实验:
实验步骤 实验现象 实验结论
取少量化肥于试管中,加水溶解后,再滴加稀盐酸 无气泡产生 该化肥成分是________(填写物质名称)
(3)小华为了确认化肥成分中的阴离子,设计了如下三种实验方案:①先加入氯化钡溶液,再加入稀盐酸。②先加入硫酸酸化,再加入氯化钡溶液。③先加入盐酸酸化,再加氯化钡溶液。你认为上述三种方案合理的是______,简述不合理方案的理由________________________(任写一种)。
(4)请你写出使用铵态氮肥的一点注意事项________________________。
(5)实验室需要配制质量分数为2%的(NH4)2SO4溶液,配制该溶液的过程中,所需要的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需要________(填写仪器名称)。
参考答案
1. B 【解析】袁隆平是杂交水稻之父,A不正确;侯德榜发明了联合制碱法,B正确;张青莲主持测定多种元素的相对原子质量,C不正确;屠呦呦因发现青蒿素治疗疟疾的新疗法而获得诺贝尔奖,D不正确。
2. B 【解析】亚硝酸钠有毒,不能代替食盐腌渍食品,B错误。
3. D 【解析】硝酸钾是由三种元素组成的纯净物,属于化合物,A正确;硝酸钾中同时含有植物所需的营养元素中的钾元素和氮元素,属于复合肥,B正确;硝石强烧能产生紫青烟,说明该反应可能是分解反应,C正确;比较硝酸钾和氯化钠的溶解度时要指明温度,否则不能比较,D不正确。
4. A
5. C 【解析】与酸反应产生气泡的物质不止有碳酸钙,A错误;加入酚酞溶液不变色,不能证明蛋壳中含钙元素,B错误;蛋壳灼烧会生成氧化钙,氧化钙能与水发生反应,C正确;实验中使用胶头滴管的操作错误,胶头滴管滴加液体时应垂直悬空于烧杯口的正上方,D错误。
6. (1)2KOH+H2SO4=== K2SO4+2H2O (2)④⑥
(3)Ba(NO3)2+CuSO4=== Cu(NO3)2+BaSO4↓[或2AgNO3+CuCl2=== Cu(NO3)2+2AgCl↓]
(4)金属氧化物+酸(合理即可)
【解析】(1)若盐是硫酸钾,则酸和碱的反应为KOH和H2SO4的中和反应。(2)若盐是氯化亚铁,则可以通过置换反应来实现的分别为金属和酸(铁和盐酸)、金属和盐(铁和氯化铜)。(3)若盐为硝酸铜,根据复分解反应发生的条件可知,盐和盐的反应为硝酸钡和硫酸铜或硝酸银和氯化铜的反应,据此写出化学反应方程式。(4)根据不同类别的物质生成盐的反应可知,金属氧化物+酸或非金属氧化物+碱的反应也可生成盐,如稀盐酸除铁锈生成氯化铁和水、二氧化碳和氢氧化钠反应生成碳酸钠和水。
7. B 【解析】氯化铁溶液呈黄色,氢氧化钾和盐酸反应生成氯化钾和水,溶液无色;硫酸铜和氢氧化钠反应生成氢氧化铜蓝色沉淀;硫酸钠和氯化钡反应生成硫酸钡白色沉淀;故选B。
8. (3)①KCl KCl和KNO3 ②KCl+AgNO3=== AgCl↓+KNO3
【解析】(1)取样加入适量水溶解,溶液呈无色,说明白色粉末中没有氯化铜。(2)向(1)所得溶液中加入硫酸钠溶液,无沉淀产生,说明白色粉末中没有氯化钡。(3)向(1)所得溶液中滴加硝酸银溶液,有白色沉淀产生,说明白色粉末中一定含有氯化钾,可能含有硝酸钾。因此①白色粉末的组成是氯化钾或氯化钾和硝酸钾的混合物; ②氯化钾和硝酸银反应生成氯化银沉淀和硝酸钾,反应的化学方程式为KCl+AgNO3=== AgCl↓+KNO3。
9. (1)Cu(OH)2 KNO3 (2)不能 KOH和Ba(NO3)2互相交换成分,不能生成水、气体或沉淀,不满足复分解反应发生的条件 (3)B
【解析】(1)解离时生成的阴离子全部是氢氧根离子的化合物属于碱,表中阴、阳离子能形成的不溶性碱是氢氧化铜,化学式为Cu(OH)2;含氮、磷、钾中的两种或三种营养元素的化肥称为复合肥,表中阴、阳离子能形成的复合肥是硝酸钾,化学式为KNO3。(2)KOH和Ba(NO3)2互相交换成分,在溶液中不能生成水、气体或沉淀,不满足复分解反应发生的条件,因此不能发生反应。(3)若物质在水中解离出的离子能重新结合生成水或气体或沉淀时,物质就不能共存。H+与OH-结合生成水,不能共存,A错误;OH-、Ba2+、K+、Cl-两两结合不会发生反应,可以共存,B正确;Ba2+与CO结合生成白色沉淀,不能共存,C错误;Cu2+与CO结合形成不溶性的CuCO3,不能共存,D错误。
10. (1)NaOH=== Na++OH- (2)Ba2++SO=== BaSO4↓
(3)2OH-+Cu2+=== Cu(OH)2↓
【解析】(1)氢氧化钠是一种碱,在水溶液中解离出的阴离子全部是氢氧根离子,阳离子是钠离子,因此氢氧化钠在水中的解离可表示为NaOH=== Na++OH-。(2)氯化钡溶液与硫酸钠溶液反应的实质是钡离子与硫酸根离子结合生成硫酸钡沉淀,可表示为Ba2++SO=== BaSO4↓。(3)氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,反应的实质是氢氧根离子与铜离子结合生成氢氧化铜沉淀,可表示为Cu2++2OH-=== Cu(OH)2↓。
11. (1)H2SO4+Na2CO3=== Na2SO4+H2O+CO2↑
(2)无色酚酞溶液(合理即可) (3)【设计方案】BaSO4 BaCl2 Ba(NO3)2 均有白色沉淀生成 【实验反思】氢氧化钠溶液先与溶液中的酸反应
【解析】(1)试管③中碳酸钠与稀硫酸反应生成硫酸钠、水和二氧化碳,据此写出反应的化学方程式。(2)根据中和反应实验,要在反应中看到明显的现象,加入的试剂可以为无色酚酞溶液。(3)【设计方案】氯化钡和稀硫酸发生反应生成硫酸钡沉淀和氯化氢,所以沉淀A的化学式为BaSO4。选择试剂为氯化钡时,引入了Cl-,对验证氯化镁造成干扰,同时考虑不影响溶液中的Mg2+的检验,故应该将所选试剂BaCl2溶液改成Ba(NO3)2溶液。修改方案之后,步骤Ⅱ中发生的反应是:2AgNO3+MgCl2=== 2AgCl↓+Mg(NO3)2 ,步骤Ⅲ中发生的反应是:2NaOH+MgCl2=== Mg(OH)2↓+2NaCl,所以必然会观察到的现象是均有白色沉淀生成。【实验反思】因为步骤Ⅰ反应后的溶液中有酸,所以加入氢氧化钠溶液会先与溶液中的酸反应,故不会立即观察到现象。
12. D 【解析】取用粗盐时瓶塞要倒放,A错误;溶解粗盐不能在量筒中进行,B错误;过滤时要用玻璃棒引流,C错误;蒸发滤液时要用玻璃棒搅拌,防止因局部受热导致液滴飞溅,D正确。
13. A
14. 30 不饱和 过滤 c
【解析】20 ℃时,氯化钠的溶解度为36.0 g,即100 g水中最多溶解36.0 g氯化钠,那么溶解10.0 g粗盐,至少需要水的质量约为27.8 g,则需量取30 mL的水较为恰当。充分溶解后形成的溶液是不饱和溶液,操作Ⅱ后得到食盐水以及固体物质,可知该操作为过滤。蒸发需要的仪器是酒精灯、蒸发皿、玻璃棒,a错误;溶解需要搅拌的目的是加速溶解,蒸发需要搅拌的目的是防止因局部温度过高造成液滴飞溅,b错误;蒸发过程就是通过加热的方法将水汽化除去,c正确。
15. C 【解析】由题中信息分析去除可溶性杂质的过程为:
则滤渣X中含有硫酸钡、氢氧化镁、碳酸钡和碳酸钙四种成分,A错误;向滤液中加入过量盐酸的目的是除去过量的氢氧化钠和碳酸钠溶液,B错误;除杂过程中碳酸钠与氯化钙、氯化钡、稀盐酸的反应均为复分解反应,C正确;蒸发氯化钠溶液时需用玻璃棒不断搅拌,在蒸发皿中出现较多量固体时停止加热,用余热将剩余液体蒸干,D错误。
16. (1)托盘天平(或电子天平) (2)搅拌,加速溶解 (3)2NaOH+MgCl2=== 2NaCl+Mg(OH)2↓ (4)A (5)蒸发 蒸发皿中出现较多固体
【解析】(1)步骤①中,称量5.0 g粗盐需要用到的称量仪器是托盘天平或电子天平。(2)步骤②为溶解粗盐,其中玻璃棒的作用是搅拌,加速溶解。(3)步骤③中,滴加过量氢氧化钠溶液除去氯化镁,氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式为2NaOH+MgCl2=== 2NaCl+Mg(OH)2↓。(4)步骤⑤中,为中和过量的氢氧化钠,氢氧化钠属于碱,能与稀盐酸反应生成氯化钠和水,与稀硫酸反应生成硫酸钠和水,与稀硝酸反应生成硝酸钠和水,为得到纯净的氯化钠且不引入新杂质,则应滴加的试剂a为稀盐酸,故选A。(5)步骤⑥的操作是从溶液中析出晶体的过程,其操作名称是蒸发,当蒸发皿中出现较多固体时,应停止加热,利用余热蒸干液体。
17. (1)CaCl2、Na2SO4、NaCl、NaOH (2)BaCl2 BaCl2+Na2SO4=== BaSO4↓+2NaCl (3)除去氯化钙和过量的氯化钡 (4)无 氯化氢具有挥发性
18. A
19. A 【解析】硝酸钾中既含氮元素又含钾元素,A正确;碳酸钾中只含所缺少的钾元素,B错误;尿素、碳酸氢铵中只含所缺少的氮元素,C、D错误。
20. D 21. B
22. C 【解析】铵态氮肥与碱性物质混用会生成氨气,降低肥效,A正确;磷酸二氢铵中含有植物生长所需氮元素和磷元素,属于复合肥,B正确;硝酸铵中氮元素质量分数为35%,含氮量为31.5%的硝酸铵化肥样品为混合物,C错误;大量使用化肥会造成水体污染、土壤退化,所以要合理使用,D正确。
23. (1)KNO3 (2)硫酸铵 (3)①③ 加入硫酸酸化时引入SO,无法确定原化肥中是否含SO (4)不能与碱性物质混用 (5)量筒
【解析】(1)铵盐与碱反应放出氨气;将化肥与熟石灰一起研磨时能闻到氨味,说明该化肥属于铵盐,含有NH,即该化肥一定不是KNO3。(2)取少量化肥滴加盐酸后无气泡产生,说明该化肥是硫酸铵。(3)向样品中加入氯化钡溶液,有沉淀生成说明化肥中含SO;无沉淀生成时,再加稀盐酸,产生气泡说明化肥含HCO,不产生气泡说明化肥含NO,方案①合理;向样品中加入稀硫酸,产生气泡说明化肥含HCO;若不产生气泡则再向其中滴加氯化钡溶液,由于加入的稀硫酸中含SO,因此一定会产生白色沉淀,但化肥中含有NO还是SO无法确定;方案②不合理;先向样品中加入稀盐酸,产生气泡说明化肥含HCO;若不产生气泡则再向其中滴加氯化钡溶液,此时若产生白色沉淀,说明化肥中含SO;若不产生沉淀,则说明化肥中含NO,方案③合理。(4)铵态氮肥与碱性物质发生反应能放出氨气,降低肥效,因此使用铵态氮肥时不能与碱性物质混用。(5)在用硫酸铵固体配制2%硫酸铵溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和量筒等。
(
1
)
