河北省石家庄市辛集市2022-2023学年高二上学期期末教学质量监测化学试题(含答案)
文档属性
| 名称 | 河北省石家庄市辛集市2022-2023学年高二上学期期末教学质量监测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-14 14:07:08 | ||
图片预览


文档简介
辛集市2022-2023学年高二上学期期末教学质量监测
化学试卷
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Al—27 S—32 Cl—35.5 Ca-40 Zn—65 Fe—56
第Ⅰ卷(共46分)
一、选择题(本题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.化学与科技、生活密切相关。下列说法错误的是( )
A.医学上的钡餐透视,常用做内服造影剂
B.工业上电解精炼铜时,要用粗铜作阳极
C.空间站的“太阳翼”及光伏发电系统能将太阳能转化为电能
D.配制溶液时,先将晶体溶于较浓的盐酸中,再加水稀释成所需浓度
2.下列有关化学用语表示正确的是( )
A.的电子式:
B.的最外层电子排布式:
C.基态碳原子的最外层电子轨道表示式:
D.空间填充模型可以表示分子,也可以表示分子
3.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟()等9种元素相对原子质量的新值,被采用为国际新标准。铟是第五周期ⅢA族元素。下列说法正确的是( )
A.ln与K处于同一周期 B.的中子数与电子数的差值为66
C.碱性: D.原子半径:In>Al
4.室温时,在由水电离出的的无色溶液中,一定能大量共存的离子组是( )
A.、、、 B.、、、
C.、、、 D.、、、
5.对可逆反应,下列叙述正确的是( )
A.达到化学平衡时,
B.若单位时间内生成x mol NO的同时,消耗x mol ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:
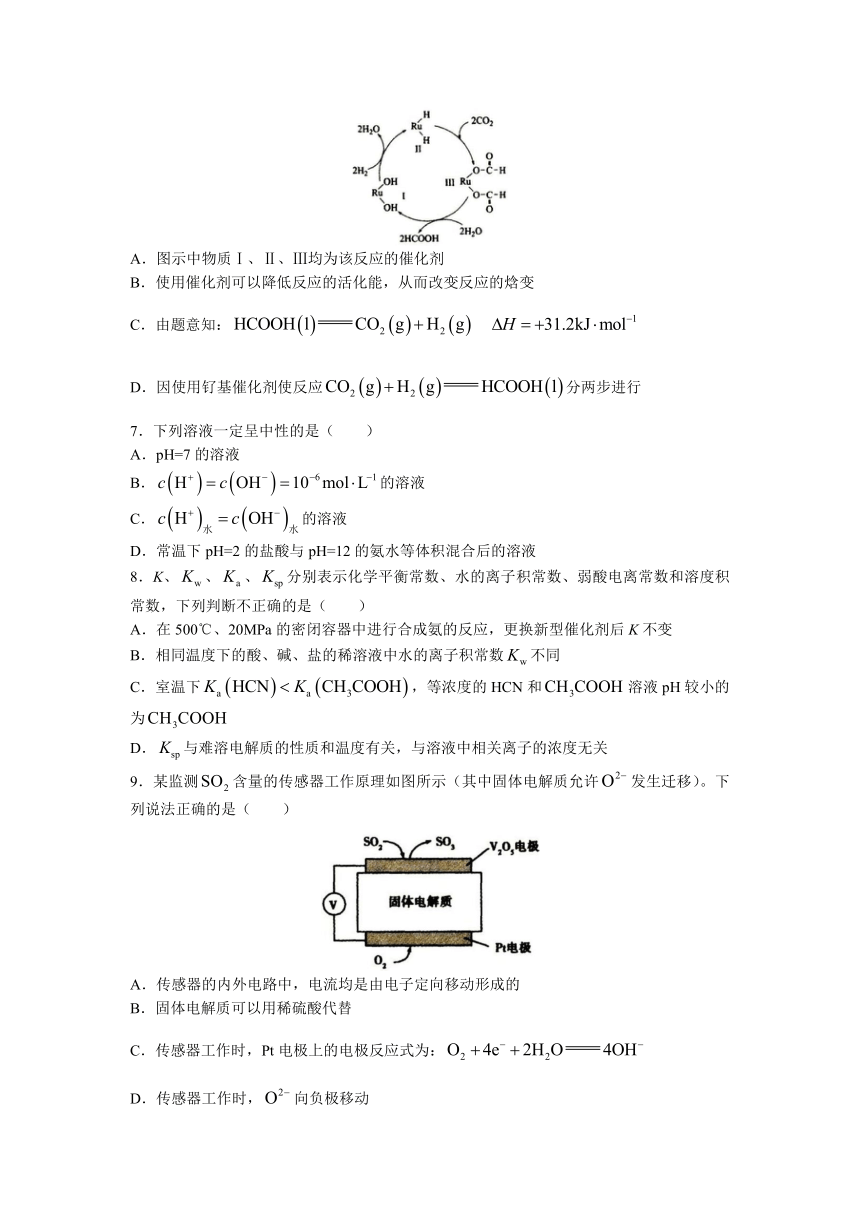
6.下图是用钌(Ru)基催化剂催化和的反应的示意图,当反应生成46g液态HCOOH时放出31.2kJ的热量。下列说法正确的是( )
A.图示中物质Ⅰ、Ⅱ、Ⅲ均为该反应的催化剂
B.使用催化剂可以降低反应的活化能,从而改变反应的焓变
C.由题意知:
D.因使用钌基催化剂使反应分两步进行
7.下列溶液一定呈中性的是( )
A.pH=7的溶液
B.的溶液
C.的溶液
D.常温下pH=2的盐酸与pH=12的氨水等体积混合后的溶液
8.K、、、分别表示化学平衡常数、水的离子积常数、弱酸电离常数和溶度积常数,下列判断不正确的是( )
A.在500℃、20MPa的密闭容器中进行合成氨的反应,更换新型催化剂后K不变
B.相同温度下的酸、碱、盐的稀溶液中水的离子积常数不同
C.室温下,等浓度的HCN和溶液pH较小的为
D.与难溶电解质的性质和温度有关,与溶液中相关离子的浓度无关
9.某监测含量的传感器工作原理如图所示(其中固体电解质允许发生迁移)。下列说法正确的是( )
A.传感器的内外电路中,电流均是由电子定向移动形成的
B.固体电解质可以用稀硫酸代替
C.传感器工作时,Pt电极上的电极反应式为:
D.传感器工作时,向负极移动
10.下列有关实验的内容正确的是( )
A.可用碱式滴定管量取12.85mL的溶液
B.实验室蒸馏石油可用如图甲所示实验装置
C.取用金属钠或钾时,没用完的钠或钾要放回原瓶
D.配制500mL 0.4mol/L NaCl溶液,必要的仪器如图乙所示
二、不定项选择题(本题共4小题,每小题4分,共16分。每小题有一至两个选项符合题意,全部选对得4分,选对但不全得2分,有选错的得0分。)
11.下列推论不正确的是( )
A.为放热反应,则的能量一定高于的能量
B.C(s,石墨)=C(s,金刚石) ,则石墨比金刚石稳定
C.葡萄糖的燃烧热是2800,则
D.101kPa时, ,则碳的燃烧热为110.5KJ/mol
12.下列离子方程式书写正确的是( )
A.氯水呈酸性:
B.NaCN溶液呈碱性:
C.NaHS溶液水解:
D.能用溶液除铁锈的原因:
13.已知。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是( )
A.可用MnS除去溶液中混有的少量
B.a点有ZnS沉淀生成
C.CuS和MnS共存的悬浊液中,
D.向CuS悬浊液中加入少量水,平衡向溶解的方向移动,增大
14.现有4种元素的基态原子的电子排布式如下:①;②;③;④。则下列比较中,正确的是( )
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
第Ⅱ卷(非选择题 共54分)
三、非选择题:(本题共4小题,共54分。)
15.(14分)化学反应原理在科研和生产中有广泛应用。
(1)在微生物作用的条件下,经过两步反应被氧化成。两步反应的能量变化示意图如下:
①第一步反应是______反应(填“放热”或“吸热”)。
②1mol 全部氧化成的热化学方程式是______。
(2)为研究不同条件对反应(Ⅱ) 的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol ,10min时反应(Ⅱ)达到平衡。测得10min内,则平衡后______mol,NO的转化率______。其它条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率______(填“>”“<”或“=”)。
(3)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(、)下温度变化的曲线(如图)。
①比较、的大小关系:______。
②随温度升高,该反应平衡常数变化的趋势是______。
16.(14分)
Ⅰ.某研究小组进行的沉淀溶解平衡的实验探究。
【查阅资料】25℃时,,
【制备试剂】向2支均盛有1mL 0.1mol/L溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量的沉淀。
(1)分别向两支试管中加入不同试剂,请填写下表中的实验现象、反应离子方程式。
试管编号 加入试剂 实验现象 反应离子方程式
Ⅰ 2滴0.1mol/L溶液 ①______ ②______
Ⅱ 4mL 2mol/L溶液 白色沉淀溶解,得无色溶液
(2)同学们猜想产生试管Ⅱ中现象的主要原因有以下两种。
猜想1:结合电离出的,使的沉淀溶解平衡正向移动。
猜想2:______
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入V mL醋酸铵溶液(pH=7),另一支试管中加入V ml 和氨水混合液(pH=8),两支试管中氢氧化镁均溶解。该实验证明(2)中______(填“猜想1”或“猜想2”)正确。
Ⅱ.工业上常用惰性电极电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示。测得同温同压下,气体甲、乙的体积比约为1∶2。
(4)b电极反应式是______,离子交换膜d为______(填“阳”或“阴”)离子交换膜.产物丙为______溶液(填“名称”)
Ⅲ.某些弱酸在25℃时的电离常数如下:
弱电解质 HSCN HCN HClO
(5)下列反应可以发生的是______(填标号)。
A.
B.
C.
D.
17.(13分)工业制胆矾时,将粗制CuO粉末(含杂质FeO、)慢慢加入适量的稀中完全溶解,除去杂质离子后,再经过一系列操作可得纯净的胆矾晶体。已知:pH≥9.6时,以的形式完全沉淀;pH≥6.4时,以的形式完全沉淀;pH接近4时,以的形式完全沉淀。回答下列问题:
(1)为除去溶液中的,可先加入______,(从下面四个选项选择)将氧化为,反应的离子方程式为______,然后加入适量的______,(从下面四个选项选择)调整溶液的pH使转化为沉淀。
A.CuO B. C. D.
(2)甲同学怀疑调整至溶液pH=4是否能达到除去而不损失的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下的溶度积,的溶度积,通常残留在溶液中的离子浓度小于时就认为沉淀完全,设溶液中的浓度为3,则开始沉淀时溶液的pH为______,完全沉淀时溶液的pH为______,通过计算确定上述方案______(填“可行”或“不可行”)。
(3)pH=6,溶液中由水电离出的是______
18.(13分)下表是元素周期表的一部分,表中所列字母分别代表一种元素。试回答下列问题:
a
b c d e f
g h i j k l M
n o p
(1)基态o原子的价层电子的轨道表示式为;基态的价层电子排布式为______。
(2)基态j原子的核外电子填充时最高能级符号为______。
(3)将以上周期表中g、h、i、j四种元素的电负性由大到小排序为______(用元素符号表示),第一电离能由大到小排序为______(用元素符号表示)。
(4)g的单质在空气中燃烧时发出黄色火焰,请用原子结构的知识解释火焰呈黄色的原因:______。
(5)表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是(填元素符号)。
化学试卷参考答案
第Ⅰ卷
一、选择题(共30分;每小题只有一个选项符合题意)
1 2 3 4 5 6 7 8 9 10
A B D C A C B B D C
二、不定项选择题(本题共4小题,每小题4分,共16分。每小题有一至两个选项符合题意,全部选对得4分,选对但不全得2分,有选错的得0分)
11 12 13 14
AD D BD A
第Ⅱ卷 非选择题(共54分)
15.(共14分,每空2分)
(1)放热
②NH(aq)+2O2(g)=NO(aq)+H2O(l)+2H+(aq) ΔH= - 346 kJ·mol-1
(2)0.025 75% >
(3)p116.(共14分,除标注外每空2分)
(1)①白色沉淀转化为红褐色沉淀
②
(2)铵根离子水解使溶液显酸性,消耗氢氧化镁电离出的氢氧根离子,促进氧氧化镁沉淀溶解平衡正向移动
(3)猜想1
(4)① ②阳(1分) ③硫酸(1分)
(5)AB(答案不全给1分,有错误答案给0分)
17.(共13分,除标注外每空2分)
(1)D 2Fe2++H2O2+2H+=2Fe3++2H2O AC(答案不全给1分,有错误答案给0分)
(2)4 3 可行(1分)
(3)1×10-6mol·L-1
18. (共13分,除标注外每空2分)
(1);3d5
(2)3p(1分)
(3);
(4)电子从能量较高的原子轨道跃迁到能量较低的原子轨道时,以光(子)的形式释放能量。
(5)Al
化学试卷
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Al—27 S—32 Cl—35.5 Ca-40 Zn—65 Fe—56
第Ⅰ卷(共46分)
一、选择题(本题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.化学与科技、生活密切相关。下列说法错误的是( )
A.医学上的钡餐透视,常用做内服造影剂
B.工业上电解精炼铜时,要用粗铜作阳极
C.空间站的“太阳翼”及光伏发电系统能将太阳能转化为电能
D.配制溶液时,先将晶体溶于较浓的盐酸中,再加水稀释成所需浓度
2.下列有关化学用语表示正确的是( )
A.的电子式:
B.的最外层电子排布式:
C.基态碳原子的最外层电子轨道表示式:
D.空间填充模型可以表示分子,也可以表示分子
3.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟()等9种元素相对原子质量的新值,被采用为国际新标准。铟是第五周期ⅢA族元素。下列说法正确的是( )
A.ln与K处于同一周期 B.的中子数与电子数的差值为66
C.碱性: D.原子半径:In>Al
4.室温时,在由水电离出的的无色溶液中,一定能大量共存的离子组是( )
A.、、、 B.、、、
C.、、、 D.、、、
5.对可逆反应,下列叙述正确的是( )
A.达到化学平衡时,
B.若单位时间内生成x mol NO的同时,消耗x mol ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:
6.下图是用钌(Ru)基催化剂催化和的反应的示意图,当反应生成46g液态HCOOH时放出31.2kJ的热量。下列说法正确的是( )
A.图示中物质Ⅰ、Ⅱ、Ⅲ均为该反应的催化剂
B.使用催化剂可以降低反应的活化能,从而改变反应的焓变
C.由题意知:
D.因使用钌基催化剂使反应分两步进行
7.下列溶液一定呈中性的是( )
A.pH=7的溶液
B.的溶液
C.的溶液
D.常温下pH=2的盐酸与pH=12的氨水等体积混合后的溶液
8.K、、、分别表示化学平衡常数、水的离子积常数、弱酸电离常数和溶度积常数,下列判断不正确的是( )
A.在500℃、20MPa的密闭容器中进行合成氨的反应,更换新型催化剂后K不变
B.相同温度下的酸、碱、盐的稀溶液中水的离子积常数不同
C.室温下,等浓度的HCN和溶液pH较小的为
D.与难溶电解质的性质和温度有关,与溶液中相关离子的浓度无关
9.某监测含量的传感器工作原理如图所示(其中固体电解质允许发生迁移)。下列说法正确的是( )
A.传感器的内外电路中,电流均是由电子定向移动形成的
B.固体电解质可以用稀硫酸代替
C.传感器工作时,Pt电极上的电极反应式为:
D.传感器工作时,向负极移动
10.下列有关实验的内容正确的是( )
A.可用碱式滴定管量取12.85mL的溶液
B.实验室蒸馏石油可用如图甲所示实验装置
C.取用金属钠或钾时,没用完的钠或钾要放回原瓶
D.配制500mL 0.4mol/L NaCl溶液,必要的仪器如图乙所示
二、不定项选择题(本题共4小题,每小题4分,共16分。每小题有一至两个选项符合题意,全部选对得4分,选对但不全得2分,有选错的得0分。)
11.下列推论不正确的是( )
A.为放热反应,则的能量一定高于的能量
B.C(s,石墨)=C(s,金刚石) ,则石墨比金刚石稳定
C.葡萄糖的燃烧热是2800,则
D.101kPa时, ,则碳的燃烧热为110.5KJ/mol
12.下列离子方程式书写正确的是( )
A.氯水呈酸性:
B.NaCN溶液呈碱性:
C.NaHS溶液水解:
D.能用溶液除铁锈的原因:
13.已知。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是( )
A.可用MnS除去溶液中混有的少量
B.a点有ZnS沉淀生成
C.CuS和MnS共存的悬浊液中,
D.向CuS悬浊液中加入少量水,平衡向溶解的方向移动,增大
14.现有4种元素的基态原子的电子排布式如下:①;②;③;④。则下列比较中,正确的是( )
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
第Ⅱ卷(非选择题 共54分)
三、非选择题:(本题共4小题,共54分。)
15.(14分)化学反应原理在科研和生产中有广泛应用。
(1)在微生物作用的条件下,经过两步反应被氧化成。两步反应的能量变化示意图如下:
①第一步反应是______反应(填“放热”或“吸热”)。
②1mol 全部氧化成的热化学方程式是______。
(2)为研究不同条件对反应(Ⅱ) 的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol ,10min时反应(Ⅱ)达到平衡。测得10min内,则平衡后______mol,NO的转化率______。其它条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率______(填“>”“<”或“=”)。
(3)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(、)下温度变化的曲线(如图)。
①比较、的大小关系:______。
②随温度升高,该反应平衡常数变化的趋势是______。
16.(14分)
Ⅰ.某研究小组进行的沉淀溶解平衡的实验探究。
【查阅资料】25℃时,,
【制备试剂】向2支均盛有1mL 0.1mol/L溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量的沉淀。
(1)分别向两支试管中加入不同试剂,请填写下表中的实验现象、反应离子方程式。
试管编号 加入试剂 实验现象 反应离子方程式
Ⅰ 2滴0.1mol/L溶液 ①______ ②______
Ⅱ 4mL 2mol/L溶液 白色沉淀溶解,得无色溶液
(2)同学们猜想产生试管Ⅱ中现象的主要原因有以下两种。
猜想1:结合电离出的,使的沉淀溶解平衡正向移动。
猜想2:______
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入V mL醋酸铵溶液(pH=7),另一支试管中加入V ml 和氨水混合液(pH=8),两支试管中氢氧化镁均溶解。该实验证明(2)中______(填“猜想1”或“猜想2”)正确。
Ⅱ.工业上常用惰性电极电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示。测得同温同压下,气体甲、乙的体积比约为1∶2。
(4)b电极反应式是______,离子交换膜d为______(填“阳”或“阴”)离子交换膜.产物丙为______溶液(填“名称”)
Ⅲ.某些弱酸在25℃时的电离常数如下:
弱电解质 HSCN HCN HClO
(5)下列反应可以发生的是______(填标号)。
A.
B.
C.
D.
17.(13分)工业制胆矾时,将粗制CuO粉末(含杂质FeO、)慢慢加入适量的稀中完全溶解,除去杂质离子后,再经过一系列操作可得纯净的胆矾晶体。已知:pH≥9.6时,以的形式完全沉淀;pH≥6.4时,以的形式完全沉淀;pH接近4时,以的形式完全沉淀。回答下列问题:
(1)为除去溶液中的,可先加入______,(从下面四个选项选择)将氧化为,反应的离子方程式为______,然后加入适量的______,(从下面四个选项选择)调整溶液的pH使转化为沉淀。
A.CuO B. C. D.
(2)甲同学怀疑调整至溶液pH=4是否能达到除去而不损失的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下的溶度积,的溶度积,通常残留在溶液中的离子浓度小于时就认为沉淀完全,设溶液中的浓度为3,则开始沉淀时溶液的pH为______,完全沉淀时溶液的pH为______,通过计算确定上述方案______(填“可行”或“不可行”)。
(3)pH=6,溶液中由水电离出的是______
18.(13分)下表是元素周期表的一部分,表中所列字母分别代表一种元素。试回答下列问题:
a
b c d e f
g h i j k l M
n o p
(1)基态o原子的价层电子的轨道表示式为;基态的价层电子排布式为______。
(2)基态j原子的核外电子填充时最高能级符号为______。
(3)将以上周期表中g、h、i、j四种元素的电负性由大到小排序为______(用元素符号表示),第一电离能由大到小排序为______(用元素符号表示)。
(4)g的单质在空气中燃烧时发出黄色火焰,请用原子结构的知识解释火焰呈黄色的原因:______。
(5)表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是(填元素符号)。
化学试卷参考答案
第Ⅰ卷
一、选择题(共30分;每小题只有一个选项符合题意)
1 2 3 4 5 6 7 8 9 10
A B D C A C B B D C
二、不定项选择题(本题共4小题,每小题4分,共16分。每小题有一至两个选项符合题意,全部选对得4分,选对但不全得2分,有选错的得0分)
11 12 13 14
AD D BD A
第Ⅱ卷 非选择题(共54分)
15.(共14分,每空2分)
(1)放热
②NH(aq)+2O2(g)=NO(aq)+H2O(l)+2H+(aq) ΔH= - 346 kJ·mol-1
(2)0.025 75% >
(3)p1
(1)①白色沉淀转化为红褐色沉淀
②
(2)铵根离子水解使溶液显酸性,消耗氢氧化镁电离出的氢氧根离子,促进氧氧化镁沉淀溶解平衡正向移动
(3)猜想1
(4)① ②阳(1分) ③硫酸(1分)
(5)AB(答案不全给1分,有错误答案给0分)
17.(共13分,除标注外每空2分)
(1)D 2Fe2++H2O2+2H+=2Fe3++2H2O AC(答案不全给1分,有错误答案给0分)
(2)4 3 可行(1分)
(3)1×10-6mol·L-1
18. (共13分,除标注外每空2分)
(1);3d5
(2)3p(1分)
(3);
(4)电子从能量较高的原子轨道跃迁到能量较低的原子轨道时,以光(子)的形式释放能量。
(5)Al
同课章节目录
