第二章 第三节 物质的量 第一课时 课件(共16张PPT) 2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第二章 第三节 物质的量 第一课时 课件(共16张PPT) 2022-2023学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-14 00:00:00 | ||
图片预览






文档简介
(共16张PPT)
第二章 第三节
物质的量
(第一课时)
当个体小,数量较大时,人们习惯以集体为单位统计个体数量。
生活中的计量
堆量
一辆汽车
一袋大米
一盒曲别针
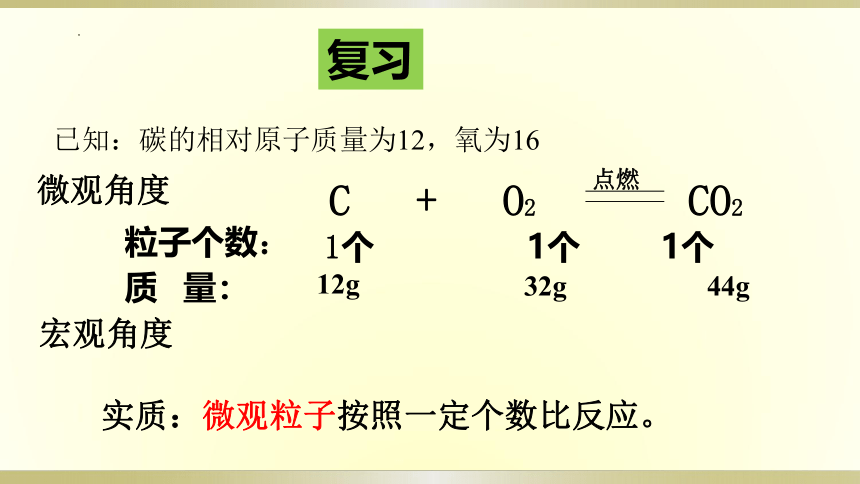
复习
粒子个数:
1个 1个 1个
C + O2 CO2
点燃
质 量:
12g
32g
44g
宏观角度
微观角度
实质:微观粒子按照一定个数比反应。
已知:碳的相对原子质量为12,氧为16
宏观:物质之间是按照一定的质量关系进行的,物质是可称量的。
微观:粒子按一定的数目关系进行,微观粒子难以称量。
思考:能否将可称量的物质与难称量的粒子联系起来呢?
单位
所含数目
1双筷子
双
2
1打毛巾
打
12
1摩尔微粒
摩尔
12g12C中所含有的碳原子个数
(约为6.02×1023个)
标准
阿伏加德罗常数
NA
物质的量
定义:表示含有一定数目粒子的集合体。
符号:n
单位:摩尔,简称摩(符号:mol)
规定:1mol粒子集合体所含的粒子数约为6.02×1023个
一个惊人的数字!
将6.02×1023 个面值为一毛的硬币排起来,可往返地球和太阳间400亿次之多
物质的量、阿伏伽德罗常数、粒子数(N)
之间存在的关系
n=
N
NA
摩尔
mol
物质的量
amount of substance
国际单位制的7个基本单位
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流 安培 A
热力学温度 开尔文 K
发光强度 坎德拉 cd
(1) 1 mol CO2中有 mol O ,
2
2NA
约含有 个O。
2×6.02×1023
练习1:
1. 204×1024
(2) 含3.01×1023个水分子的水的物质的量
是 。
0.5mol
n=
N
NA
物质的量=
微粒数
阿伏加德罗常数
摩尔质量 M
定义:单位物质的量的物质所具有的质量。
摩尔质量的单位?
g/mol
g·mol-1
摩尔质量数值上与该粒子的相对原子质量或相对分子质量相等
(1)2molFe的质量是_________,
1.5molSO2的质量是_________。
(2)49克H2SO4的物质的量是___________。
112g
96g
0.5mol
练习2:
Fe-56 S-32 O-16 H-1
物质的量=
质量
摩尔质量
n=
m
M
练习3
算一算360mL纯净水中有多少个水分子?
(写计算过程)
N,n,m之间的相互转化
N
n
m
÷NA
×
NA×
M÷
联系微观粒子和宏观物质的桥梁
M
归纳总结:
练习4:
(1)2mol水所有的定量意义。
(2)氢气燃烧反应方程式所有的定量意义。
(3)9.03×1023个氨分子是 mol氨分子,含 mol氮原子,含有 mol氢原子,含 mol质子,含有 个电子。
第二章 第三节
物质的量
(第一课时)
当个体小,数量较大时,人们习惯以集体为单位统计个体数量。
生活中的计量
堆量
一辆汽车
一袋大米
一盒曲别针
复习
粒子个数:
1个 1个 1个
C + O2 CO2
点燃
质 量:
12g
32g
44g
宏观角度
微观角度
实质:微观粒子按照一定个数比反应。
已知:碳的相对原子质量为12,氧为16
宏观:物质之间是按照一定的质量关系进行的,物质是可称量的。
微观:粒子按一定的数目关系进行,微观粒子难以称量。
思考:能否将可称量的物质与难称量的粒子联系起来呢?
单位
所含数目
1双筷子
双
2
1打毛巾
打
12
1摩尔微粒
摩尔
12g12C中所含有的碳原子个数
(约为6.02×1023个)
标准
阿伏加德罗常数
NA
物质的量
定义:表示含有一定数目粒子的集合体。
符号:n
单位:摩尔,简称摩(符号:mol)
规定:1mol粒子集合体所含的粒子数约为6.02×1023个
一个惊人的数字!
将6.02×1023 个面值为一毛的硬币排起来,可往返地球和太阳间400亿次之多
物质的量、阿伏伽德罗常数、粒子数(N)
之间存在的关系
n=
N
NA
摩尔
mol
物质的量
amount of substance
国际单位制的7个基本单位
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流 安培 A
热力学温度 开尔文 K
发光强度 坎德拉 cd
(1) 1 mol CO2中有 mol O ,
2
2NA
约含有 个O。
2×6.02×1023
练习1:
1. 204×1024
(2) 含3.01×1023个水分子的水的物质的量
是 。
0.5mol
n=
N
NA
物质的量=
微粒数
阿伏加德罗常数
摩尔质量 M
定义:单位物质的量的物质所具有的质量。
摩尔质量的单位?
g/mol
g·mol-1
摩尔质量数值上与该粒子的相对原子质量或相对分子质量相等
(1)2molFe的质量是_________,
1.5molSO2的质量是_________。
(2)49克H2SO4的物质的量是___________。
112g
96g
0.5mol
练习2:
Fe-56 S-32 O-16 H-1
物质的量=
质量
摩尔质量
n=
m
M
练习3
算一算360mL纯净水中有多少个水分子?
(写计算过程)
N,n,m之间的相互转化
N
n
m
÷NA
×
NA×
M÷
联系微观粒子和宏观物质的桥梁
M
归纳总结:
练习4:
(1)2mol水所有的定量意义。
(2)氢气燃烧反应方程式所有的定量意义。
(3)9.03×1023个氨分子是 mol氨分子,含 mol氮原子,含有 mol氢原子,含 mol质子,含有 个电子。
