化学人教版(2019)必修第一册4.3.2共价键 课件(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.2共价键 课件(共28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 568.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-14 16:46:30 | ||
图片预览



文档简介
(共28张PPT)
共价键
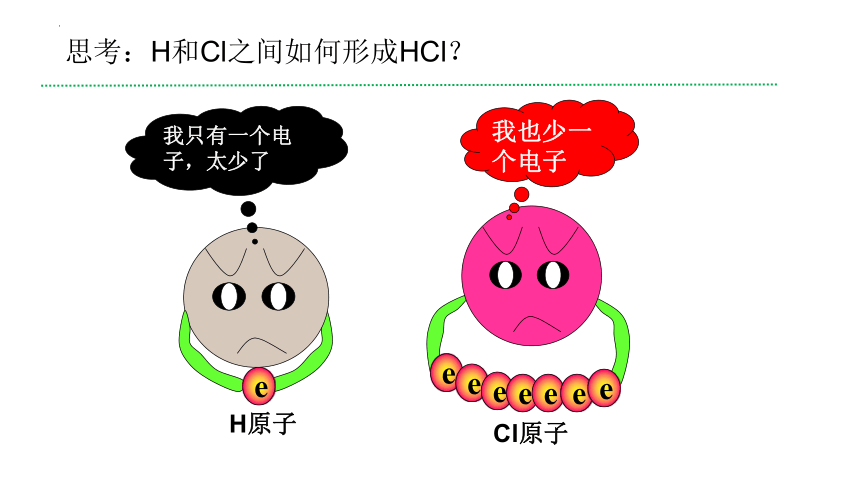
我只有一个电子,太少了
我也少一个电子
e
H原子
Cl原子
e
e
e
e
e
e
e
思考:H和Cl之间如何形成HCl?
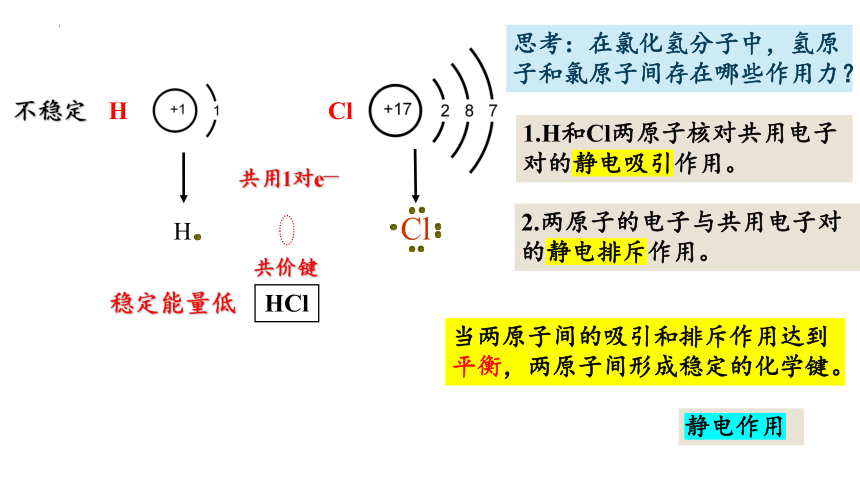
H
Cl
不稳定
共用1对e—
HCl
稳定能量低
共价键
H
Cl
思考:在氯化氢分子中,氢原子和氯原子间存在哪些作用力?
当两原子间的吸引和排斥作用达到平衡,两原子间形成稳定的化学键。
静电作用
1.H和Cl两原子核对共用电子对的静电吸引作用。
2.两原子的电子与共用电子对的静电排斥作用。
原子间通过共用电子对所形成的相互作用
一、共价键
1.定义:
微粒
本质
静电作用:引力+斥力
3.成键元素:
同种或不同种的非金属元素
特例:共价键:AlCl3
4.成键条件:
成键前原子未达到饱和
缺几成几
H/F/Cl/Br/I O/S/Se/Te N/P/As C/Si
1
2
3
4
2.成键结果:
原子趋于稳定,分子总能量降低
如:NH4+ / O22-- / C22-- / OH-- / SO42--/ NO3-- / CO32-- / HCO3-- / CH3COO--等
5.存在:
①非金属单质(除稀有气体)
如:N2 / H2 / O2 / O3等
②原子团
③部分化合物
如:CO2 / H2O2 / H2SO4 / NH3·H2O / KOH /NH4Cl 等
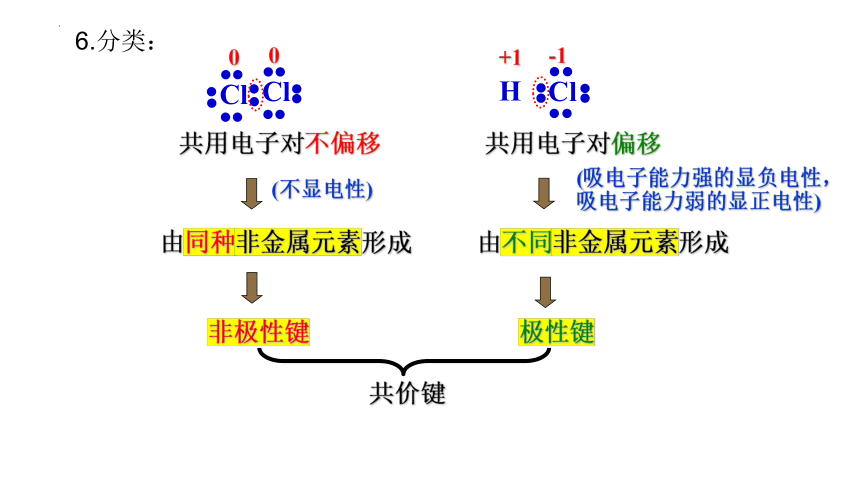
共用电子对不偏移
共用电子对偏移
由不同非金属元素形成
由同种非金属元素形成
非极性键
极性键
共价键
Cl
Cl
H
Cl
(不显电性)
(吸电子能力强的显负电性,
吸电子能力弱的显正电性)
0
0
+1
-1
6.分类:
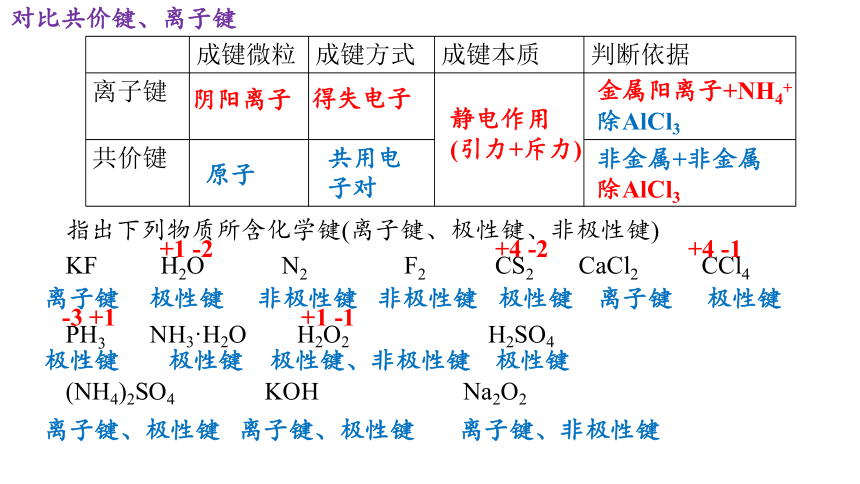
指出下列物质所含化学键(离子键、极性键、非极性键)
KF H2O N2 F2 CS2 CaCl2 CCl4
PH3 NH3·H2O H2O2 H2SO4
(NH4)2SO4 KOH Na2O2
非极性键
极性键
极性键
离子键
极性键
离子键、极性键
离子键、非极性键
极性键、非极性键
离子键
非极性键
极性键
极性键
极性键
离子键、极性键
成键微粒 成键方式 成键本质 判断依据
离子键
共价键
阴阳离子
原子
得失电子
共用电子对
静电作用
(引力+斥力)
金属阳离子+NH4+除AlCl3
非金属+非金属
除AlCl3
对比共价键、离子键
+1 -2
+4 -2
+4 -1
-3 +1
+1 -1
DT1.下列物质中只含有共价键的是( )
A.NaCl HCl H2O NaOH
B.Cl2 Na2S HCl SO2
C.HBr CO2 H2O CS2
D.Na2O2 H2O2 H2O O3
离子键
极性键
极性键
离子键、极性键
非极性键
离子键
极性键
极性键
极性键
极性键
极性键
极性键
离子键
非极性键
极性键
非极性键
极性键
非极性键
C
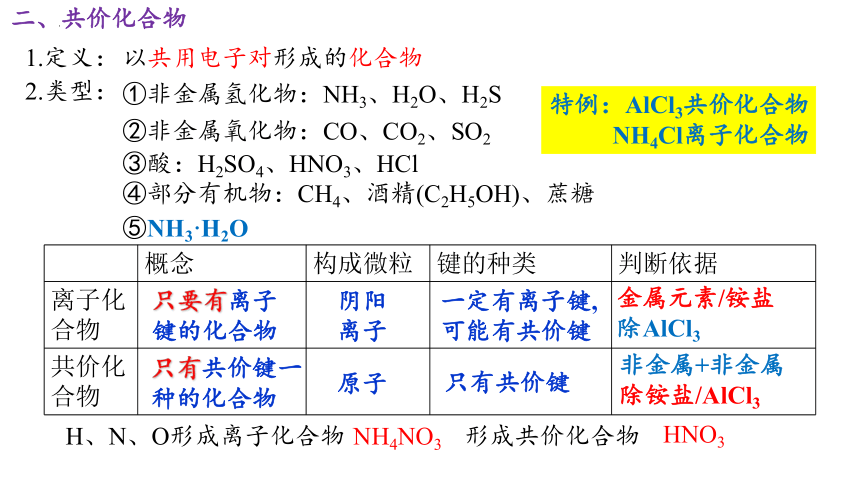
二、共价化合物
1.定义:
以共用电子对形成的化合物
2.类型:
①非金属氢化物:NH3、H2O、H2S
②非金属氧化物:CO、CO2、SO2
③酸:H2SO4、HNO3、HCl
④部分有机物:CH4、酒精(C2H5OH)、蔗糖
特例:AlCl3共价化合物 NH4Cl离子化合物
概念 构成微粒 键的种类 判断依据
离子化合物
共价化合物
只要有离子键的化合物
阴阳
离子
一定有离子键,可能有共价键
只有共价键一种的化合物
原子
只有共价键
金属元素/铵盐
除AlCl3
非金属+非金属
除铵盐/AlCl3
H、N、O形成离子化合物 形成共价化合物
NH4NO3
HNO3
⑤NH3·H2O
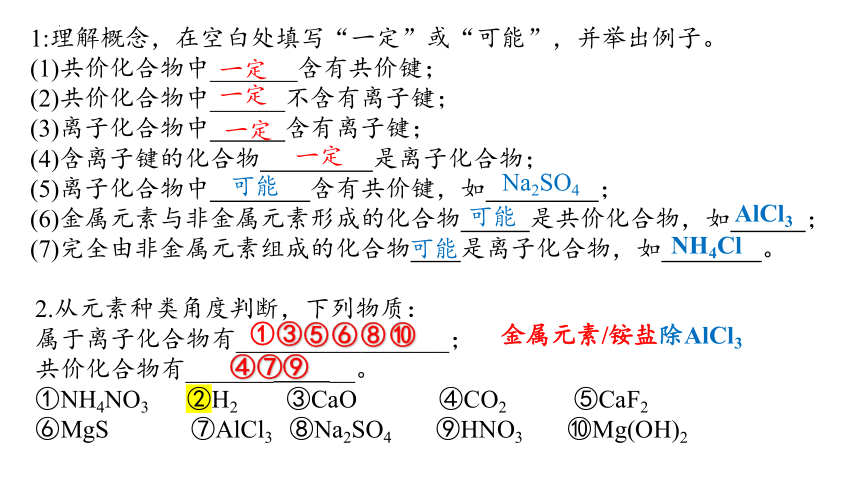
1:理解概念,在空白处填写“一定”或“可能”,并举出例子。
(1)共价化合物中_______含有共价键;
(2)共价化合物中______不含有离子键;
(3)离子化合物中 含有离子键;
(4)含离子键的化合物 是离子化合物;
(5)离子化合物中 含有共价键,如 ;
(6)金属元素与非金属元素形成的化合物 是共价化合物,如 ;
(7)完全由非金属元素组成的化合物 是离子化合物,如 。
一定
一定
一定
一定
可能
Na2SO4
可能
AlCl3
可能
NH4Cl
2.从元素种类角度判断,下列物质:
属于离子化合物有_________________;
共价化合物有_______ __。
①NH4NO3 ②H2 ③CaO ④CO2 ⑤CaF2
⑥MgS ⑦AlCl3 ⑧Na2SO4 ⑨HNO3 ⑩Mg(OH)2
⑩
③
⑤
⑥
⑧
④
⑦
⑨
①
金属元素/铵盐除AlCl3
3.性质:
①熔点较低,大部分熔点比离子化合物低,部分熔点高(SiO2/SiC/金刚石、Si)
②共价化合物本身不导电,熔融状态均不导电,溶于水后部分导电(酸);
鉴别:熔融状态导电是离子化合物,熔融状态不导电是共价化合物
导电 离子化合物 共价化合物
本身
水溶液
熔融
电解质
不导电
不导电
导电
导电
不导电
部分导电(酸)
全是
部分是(酸)
Q:证明HCl是共价化合物:
液态HCl不导电
熔点:Al2O3(离子)>AlCl3(共价)
分子/原子构成
KHSO4(熔融)=
KHSO4(aq)=
K++HSO4--
K++H++SO42--
离子键 共价键
水
熔融(加热)
破坏
破坏
破坏部分(酸)
2.将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有( )
A.2种 B.3种 C.4种 D.5种
C
1.下列各情况破坏什么作用力(“离子键”/“极性键”/“非极性键”):
(1)NaCl溶于水时破坏__________;
(2)HCl溶于水时破坏__________;
(3)Na2O熔化时被破坏的是________;
(4)Na2O2溶于水破坏的是 。
离子键
极性键
离子键
离子键、极性键
金属键
①碘的升华 ②加热熔化氢氧化钠 ③食盐溶解于水 ④氯化氢溶解于水 ⑤氧气溶解于水 ⑥过氧化钠溶解于水 ⑦NH4HCO3受热分解
其中没有发生化学键断裂的是________;
只发生离子键断裂的是________;
只发生共价键断裂的是________;
既发生了离子键断裂,又发生共价键断裂的是________。
①
②
③
④
⑥
⑤
⑦
1.含有共价键的化合物不一定是共价化合物
2.共价化合物中只含有共价键
3.离子化合物中一定只含有离子键
4.离子化合物中可能是含有共价键
5.非金属元素组成的化合物一定是共价化合物
6.两种非金属元素形成AB型化合物,一定为共价化合物
7.非极性键只存在于双原子单质分子中
8.离子化合物一定是电解质,共价化合物一定是非电解质
9.共价化合物一定不导电,离子化合物一定能导电
离子键
共价键
离子化合物
共价化合物
电解质
非电解质
一定
只含
熔融状态能导电
熔融状态不导电
一定
共价键:溶于水/反应时被破坏
离子键:溶于水/熔融/反应时被破坏
可能
三、共价分子的电子式、结构式
3.H2O2 HClO N2H4 HCN COCl2 C2H2
1.H2 Cl2 O2 N2
2.H2O NH3 NF3 CH4 CCl4 CO2
H2S
PH3
SiH4
SiCl4
CS2
COS
4.MgBr2 NaOH Na2O2 NH4I
SiF4
一判(离子/共价)、
二析(中心原子,缺几成几)、
三写
结构式:用一根短线表示一对共用电子对的式子,而其他不共用的电子省略。
I2
IBr
18电子,做火箭燃料
18电子,
做火箭助燃剂
中心原子(缺电子多的)放中间,缺几成几
PF3
NCl3
三、共价分子的电子式、结构式
3.H2O2 HClO N2H4 HCN
1.H2 Cl2 O2 N2
2.H2O NH3 CH4 CCl4 CO2 COCl2
H2S
PH3
NF3
SiH4
SiCl4
CS2
COS
4.MgBr2 NaOH Na2O2 NH4I
SiF4
一判(离子/共价)、
二析(中心原子,缺几成几)、
三写
结构式:用一根短线表示一对共用电子对的式子,而其他不共用的电子省略。
I2
IBr
18电子,
做火箭助燃剂
18电子,
做火箭燃料
中心原子(缺电子多的)放中间,缺几成几
分子具有一定的空间
直线形
V形
正四面体
(不定项选择)固体A的化学式为NH5,它的所有原子的最外电子层结构都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A.1 mol NH5中含有5NA个N—H键
B.NH5中既有共价键又有离子键
C.NH5的电子式为
D.NH5与水反应的离子方程式为NH4++H-+H2O===NH3·H2O+H2↑,属于非氧化还原反应
A
D
E.氨气: F.四氯化碳:
G.氮气: H.二氧化碳:
3.下列分子的电子式书写正确的是( )
:
D
G
H + O + H → H O H
×
×
×
×
HCl
H2O
F2
+
→
+
→
Cl
H
H
Cl
F
F
F
F
四、共价分子的形成过程
左原子,箭头连,右分子
五、8电子稳定结构:
(1)经验规律法
①分子中的H不满足8电子稳定结构
②一般来说,ABn型分子中,
原子最外层电子数+|化合价|=8
如CO2分子中,
+4--2
C、O均满足8电子稳定结构
(2)试写结构法
原子最外层电子数+所成共价键数目=8
下列分子中各原子最外层均达到8电子稳定结构的是( )A.BeCl2 PCl5 SF6 B.CS2 SiO2 CF2Cl2
C.BrF3 SCl2 BF3 D.XeF2 PCl3 CH4
B
六、利用化学键推断元素:
(2019卷1)其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半,正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
Na
Cl
Si
P
+1
+4
--3
--1
W、X、Y、Z
缺3个电子
缺几成几
中性
XH3PO4中强酸
满足
C
(2020卷2)短周期主族元素W、X、Y、Z的原子序数依次增大,且总和为24。错误的是( )
A.该化合物中,W、X、Y之间均为共价键
B.Z单质能与水反应
C.Y的最高价氧化物水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
W、X、Y、Z
Na
H
N
B
缺5个电子
BF3中B未满足8电子稳定结构
D
短周期主族元素W、X、Y、Z、M原子序数依次增大;已知M原子核外电子总数是Y原子核外电子总数的两倍,此物质中X满足8电子稳定结构,错误的是( )
A.X和Y可能组成多种化合物
B.W和Z位于周期表中同一主族
C.元素的非金属性强弱顺序为Z>Y>X
D.Y、M的简单气态氢化物的沸点:Y>M
N
H
F
O
S
M不满足8电子稳定结构
N2O NO N2O3 NO2 N2O4 N2O5
B
沸点:H2O>H2S
六、利用化学键推断元素:
(2019卷1)其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半
Na
Cl
Si
P
+1
+4
--3
--1
W、X、Y、Z
(2020卷2)短周期主族元素W、X、Y、Z的原子序数依次增大,且总和为24
W、X、Y、Z
Na
H
N
B
缺3个电子
缺5个电子
缺几成几
短周期主族元素W、X、Y、M、Z原子序数依次增大;已知M原子核外电子总数是Y原子核外电子总数的两倍,此物质中X满足8电子稳定结构
N
H
S
O
Cl
S不满足8电子稳定结构
S4N4
+2
P4S3
--2
七、分析共价化合物化合价:电子对的偏移决定
--2
共价化合物
极性键N-S
非极性键N-N
共价化合物
极性键P-S
非极性键S-S
+3
+1
+1
+1
+1.5
S、N均满足8电子稳定结构
S、P均满足8电子稳定结构
八、化学反应的本质
旧键断裂(吸热),新键形成(放热)
1.下列过程属于化学变化的是( )
A.KCl晶体熔化 B.石墨转化为金刚石 C.干冰升华 D.五氧化二磷吸水 E.HCl溶于水 F.12C转化为14C
范德华力
离子键
共价键
B
核变化
D
同时满足
2.(1)电解水,断裂的键为 ,形成的键为 。
(2)P4+10Cl2=4PCl5,断裂的键为 ,形成的键为 。
H--O
H--H
P--P
P--Cl
6P--P
10Cl--Cl
20P--Cl
O=O
Cl--Cl
4.在下列变化过程中,属于“破坏极性键和非极性键→形成极性键和非极性键”过程的是( )
A.冰→水→水蒸气→H2和O2
B.2Na+Cl2==2NaCl
C.2H2+O2==2H2O
D.2H2O2==2H2O+O2↑
D
3.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl=NH3↑+HCl↑
B.NH3+CO2+H2O===NH4HCO3
C.2NaOH+Cl2===NaCl+NaClO+H2O
D.2Na2O2+2CO2===2Na2CO3+O2
D
要破坏的先有
共价键
我只有一个电子,太少了
我也少一个电子
e
H原子
Cl原子
e
e
e
e
e
e
e
思考:H和Cl之间如何形成HCl?
H
Cl
不稳定
共用1对e—
HCl
稳定能量低
共价键
H
Cl
思考:在氯化氢分子中,氢原子和氯原子间存在哪些作用力?
当两原子间的吸引和排斥作用达到平衡,两原子间形成稳定的化学键。
静电作用
1.H和Cl两原子核对共用电子对的静电吸引作用。
2.两原子的电子与共用电子对的静电排斥作用。
原子间通过共用电子对所形成的相互作用
一、共价键
1.定义:
微粒
本质
静电作用:引力+斥力
3.成键元素:
同种或不同种的非金属元素
特例:共价键:AlCl3
4.成键条件:
成键前原子未达到饱和
缺几成几
H/F/Cl/Br/I O/S/Se/Te N/P/As C/Si
1
2
3
4
2.成键结果:
原子趋于稳定,分子总能量降低
如:NH4+ / O22-- / C22-- / OH-- / SO42--/ NO3-- / CO32-- / HCO3-- / CH3COO--等
5.存在:
①非金属单质(除稀有气体)
如:N2 / H2 / O2 / O3等
②原子团
③部分化合物
如:CO2 / H2O2 / H2SO4 / NH3·H2O / KOH /NH4Cl 等
共用电子对不偏移
共用电子对偏移
由不同非金属元素形成
由同种非金属元素形成
非极性键
极性键
共价键
Cl
Cl
H
Cl
(不显电性)
(吸电子能力强的显负电性,
吸电子能力弱的显正电性)
0
0
+1
-1
6.分类:
指出下列物质所含化学键(离子键、极性键、非极性键)
KF H2O N2 F2 CS2 CaCl2 CCl4
PH3 NH3·H2O H2O2 H2SO4
(NH4)2SO4 KOH Na2O2
非极性键
极性键
极性键
离子键
极性键
离子键、极性键
离子键、非极性键
极性键、非极性键
离子键
非极性键
极性键
极性键
极性键
离子键、极性键
成键微粒 成键方式 成键本质 判断依据
离子键
共价键
阴阳离子
原子
得失电子
共用电子对
静电作用
(引力+斥力)
金属阳离子+NH4+除AlCl3
非金属+非金属
除AlCl3
对比共价键、离子键
+1 -2
+4 -2
+4 -1
-3 +1
+1 -1
DT1.下列物质中只含有共价键的是( )
A.NaCl HCl H2O NaOH
B.Cl2 Na2S HCl SO2
C.HBr CO2 H2O CS2
D.Na2O2 H2O2 H2O O3
离子键
极性键
极性键
离子键、极性键
非极性键
离子键
极性键
极性键
极性键
极性键
极性键
极性键
离子键
非极性键
极性键
非极性键
极性键
非极性键
C
二、共价化合物
1.定义:
以共用电子对形成的化合物
2.类型:
①非金属氢化物:NH3、H2O、H2S
②非金属氧化物:CO、CO2、SO2
③酸:H2SO4、HNO3、HCl
④部分有机物:CH4、酒精(C2H5OH)、蔗糖
特例:AlCl3共价化合物 NH4Cl离子化合物
概念 构成微粒 键的种类 判断依据
离子化合物
共价化合物
只要有离子键的化合物
阴阳
离子
一定有离子键,可能有共价键
只有共价键一种的化合物
原子
只有共价键
金属元素/铵盐
除AlCl3
非金属+非金属
除铵盐/AlCl3
H、N、O形成离子化合物 形成共价化合物
NH4NO3
HNO3
⑤NH3·H2O
1:理解概念,在空白处填写“一定”或“可能”,并举出例子。
(1)共价化合物中_______含有共价键;
(2)共价化合物中______不含有离子键;
(3)离子化合物中 含有离子键;
(4)含离子键的化合物 是离子化合物;
(5)离子化合物中 含有共价键,如 ;
(6)金属元素与非金属元素形成的化合物 是共价化合物,如 ;
(7)完全由非金属元素组成的化合物 是离子化合物,如 。
一定
一定
一定
一定
可能
Na2SO4
可能
AlCl3
可能
NH4Cl
2.从元素种类角度判断,下列物质:
属于离子化合物有_________________;
共价化合物有_______ __。
①NH4NO3 ②H2 ③CaO ④CO2 ⑤CaF2
⑥MgS ⑦AlCl3 ⑧Na2SO4 ⑨HNO3 ⑩Mg(OH)2
⑩
③
⑤
⑥
⑧
④
⑦
⑨
①
金属元素/铵盐除AlCl3
3.性质:
①熔点较低,大部分熔点比离子化合物低,部分熔点高(SiO2/SiC/金刚石、Si)
②共价化合物本身不导电,熔融状态均不导电,溶于水后部分导电(酸);
鉴别:熔融状态导电是离子化合物,熔融状态不导电是共价化合物
导电 离子化合物 共价化合物
本身
水溶液
熔融
电解质
不导电
不导电
导电
导电
不导电
部分导电(酸)
全是
部分是(酸)
Q:证明HCl是共价化合物:
液态HCl不导电
熔点:Al2O3(离子)>AlCl3(共价)
分子/原子构成
KHSO4(熔融)=
KHSO4(aq)=
K++HSO4--
K++H++SO42--
离子键 共价键
水
熔融(加热)
破坏
破坏
破坏部分(酸)
2.将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有( )
A.2种 B.3种 C.4种 D.5种
C
1.下列各情况破坏什么作用力(“离子键”/“极性键”/“非极性键”):
(1)NaCl溶于水时破坏__________;
(2)HCl溶于水时破坏__________;
(3)Na2O熔化时被破坏的是________;
(4)Na2O2溶于水破坏的是 。
离子键
极性键
离子键
离子键、极性键
金属键
①碘的升华 ②加热熔化氢氧化钠 ③食盐溶解于水 ④氯化氢溶解于水 ⑤氧气溶解于水 ⑥过氧化钠溶解于水 ⑦NH4HCO3受热分解
其中没有发生化学键断裂的是________;
只发生离子键断裂的是________;
只发生共价键断裂的是________;
既发生了离子键断裂,又发生共价键断裂的是________。
①
②
③
④
⑥
⑤
⑦
1.含有共价键的化合物不一定是共价化合物
2.共价化合物中只含有共价键
3.离子化合物中一定只含有离子键
4.离子化合物中可能是含有共价键
5.非金属元素组成的化合物一定是共价化合物
6.两种非金属元素形成AB型化合物,一定为共价化合物
7.非极性键只存在于双原子单质分子中
8.离子化合物一定是电解质,共价化合物一定是非电解质
9.共价化合物一定不导电,离子化合物一定能导电
离子键
共价键
离子化合物
共价化合物
电解质
非电解质
一定
只含
熔融状态能导电
熔融状态不导电
一定
共价键:溶于水/反应时被破坏
离子键:溶于水/熔融/反应时被破坏
可能
三、共价分子的电子式、结构式
3.H2O2 HClO N2H4 HCN COCl2 C2H2
1.H2 Cl2 O2 N2
2.H2O NH3 NF3 CH4 CCl4 CO2
H2S
PH3
SiH4
SiCl4
CS2
COS
4.MgBr2 NaOH Na2O2 NH4I
SiF4
一判(离子/共价)、
二析(中心原子,缺几成几)、
三写
结构式:用一根短线表示一对共用电子对的式子,而其他不共用的电子省略。
I2
IBr
18电子,做火箭燃料
18电子,
做火箭助燃剂
中心原子(缺电子多的)放中间,缺几成几
PF3
NCl3
三、共价分子的电子式、结构式
3.H2O2 HClO N2H4 HCN
1.H2 Cl2 O2 N2
2.H2O NH3 CH4 CCl4 CO2 COCl2
H2S
PH3
NF3
SiH4
SiCl4
CS2
COS
4.MgBr2 NaOH Na2O2 NH4I
SiF4
一判(离子/共价)、
二析(中心原子,缺几成几)、
三写
结构式:用一根短线表示一对共用电子对的式子,而其他不共用的电子省略。
I2
IBr
18电子,
做火箭助燃剂
18电子,
做火箭燃料
中心原子(缺电子多的)放中间,缺几成几
分子具有一定的空间
直线形
V形
正四面体
(不定项选择)固体A的化学式为NH5,它的所有原子的最外电子层结构都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A.1 mol NH5中含有5NA个N—H键
B.NH5中既有共价键又有离子键
C.NH5的电子式为
D.NH5与水反应的离子方程式为NH4++H-+H2O===NH3·H2O+H2↑,属于非氧化还原反应
A
D
E.氨气: F.四氯化碳:
G.氮气: H.二氧化碳:
3.下列分子的电子式书写正确的是( )
:
D
G
H + O + H → H O H
×
×
×
×
HCl
H2O
F2
+
→
+
→
Cl
H
H
Cl
F
F
F
F
四、共价分子的形成过程
左原子,箭头连,右分子
五、8电子稳定结构:
(1)经验规律法
①分子中的H不满足8电子稳定结构
②一般来说,ABn型分子中,
原子最外层电子数+|化合价|=8
如CO2分子中,
+4--2
C、O均满足8电子稳定结构
(2)试写结构法
原子最外层电子数+所成共价键数目=8
下列分子中各原子最外层均达到8电子稳定结构的是( )A.BeCl2 PCl5 SF6 B.CS2 SiO2 CF2Cl2
C.BrF3 SCl2 BF3 D.XeF2 PCl3 CH4
B
六、利用化学键推断元素:
(2019卷1)其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半,正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
Na
Cl
Si
P
+1
+4
--3
--1
W、X、Y、Z
缺3个电子
缺几成几
中性
X
满足
C
(2020卷2)短周期主族元素W、X、Y、Z的原子序数依次增大,且总和为24。错误的是( )
A.该化合物中,W、X、Y之间均为共价键
B.Z单质能与水反应
C.Y的最高价氧化物水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
W、X、Y、Z
Na
H
N
B
缺5个电子
BF3中B未满足8电子稳定结构
D
短周期主族元素W、X、Y、Z、M原子序数依次增大;已知M原子核外电子总数是Y原子核外电子总数的两倍,此物质中X满足8电子稳定结构,错误的是( )
A.X和Y可能组成多种化合物
B.W和Z位于周期表中同一主族
C.元素的非金属性强弱顺序为Z>Y>X
D.Y、M的简单气态氢化物的沸点:Y>M
N
H
F
O
S
M不满足8电子稳定结构
N2O NO N2O3 NO2 N2O4 N2O5
B
沸点:H2O>H2S
六、利用化学键推断元素:
(2019卷1)其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半
Na
Cl
Si
P
+1
+4
--3
--1
W、X、Y、Z
(2020卷2)短周期主族元素W、X、Y、Z的原子序数依次增大,且总和为24
W、X、Y、Z
Na
H
N
B
缺3个电子
缺5个电子
缺几成几
短周期主族元素W、X、Y、M、Z原子序数依次增大;已知M原子核外电子总数是Y原子核外电子总数的两倍,此物质中X满足8电子稳定结构
N
H
S
O
Cl
S不满足8电子稳定结构
S4N4
+2
P4S3
--2
七、分析共价化合物化合价:电子对的偏移决定
--2
共价化合物
极性键N-S
非极性键N-N
共价化合物
极性键P-S
非极性键S-S
+3
+1
+1
+1
+1.5
S、N均满足8电子稳定结构
S、P均满足8电子稳定结构
八、化学反应的本质
旧键断裂(吸热),新键形成(放热)
1.下列过程属于化学变化的是( )
A.KCl晶体熔化 B.石墨转化为金刚石 C.干冰升华 D.五氧化二磷吸水 E.HCl溶于水 F.12C转化为14C
范德华力
离子键
共价键
B
核变化
D
同时满足
2.(1)电解水,断裂的键为 ,形成的键为 。
(2)P4+10Cl2=4PCl5,断裂的键为 ,形成的键为 。
H--O
H--H
P--P
P--Cl
6P--P
10Cl--Cl
20P--Cl
O=O
Cl--Cl
4.在下列变化过程中,属于“破坏极性键和非极性键→形成极性键和非极性键”过程的是( )
A.冰→水→水蒸气→H2和O2
B.2Na+Cl2==2NaCl
C.2H2+O2==2H2O
D.2H2O2==2H2O+O2↑
D
3.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl=NH3↑+HCl↑
B.NH3+CO2+H2O===NH4HCO3
C.2NaOH+Cl2===NaCl+NaClO+H2O
D.2Na2O2+2CO2===2Na2CO3+O2
D
要破坏的先有
