第五章 化工生产中的重要非金属元素 单元复习课件
文档属性
| 名称 | 第五章 化工生产中的重要非金属元素 单元复习课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 40.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-15 16:04:52 | ||
图片预览





文档简介
(共16张PPT)
吴 彦
化工生产中的重要非金属元素
第五章 化工生产中的重要非金属元素
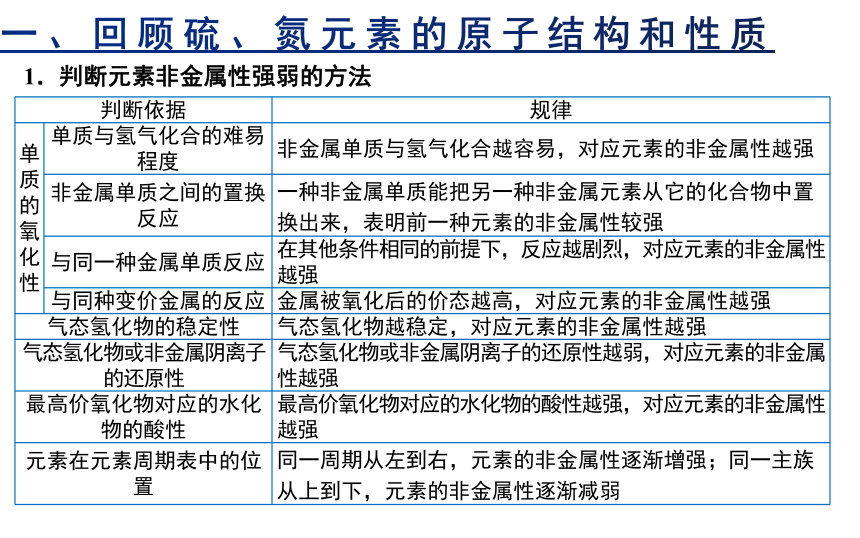
硫元素、氮元素与氧元素、氯元素非金属性相比有什么不同?
判断依据 规律
单质的氧化性 单质与氢气化合的难易程度 非金属单质与氢气化合越容易,对应元素的非金属性越强
非金属单质之间的置换反应 一种非金属单质能把另一种非金属元素从它的化合物中置换出来,表明前一种元素的非金属性较强
与同一种金属单质反应 在其他条件相同的前提下,反应越剧烈,对应元素的非金属性越强
与同种变价金属的反应 金属被氧化后的价态越高,对应元素的非金属性越强
气态氢化物的稳定性 气态氢化物越稳定,对应元素的非金属性越强
气态氢化物或非金属阴离子的还原性 气态氢化物或非金属阴离子的还原性越弱,对应元素的非金属性越强
最高价氧化物对应的水化物的酸性 最高价氧化物对应的水化物的酸性越强,对应元素的非金属性越强
元素在元素周期表中的位置 同一周期从左到右,元素的非金属性逐渐增强;同一主族从上到下,元素的非金属性逐渐减弱
1.判断元素非金属性强弱的方法
一、回顾硫、氮元素的原子结构和性质
判断依据 规律
单质的 还原性 单质与水或酸反应置换出氢气的难易程度 单质与水或酸(非氧化性酸)反应越容易置换出氢气 (即反应越剧烈),对应元素的金属性越强
金属单质之间的置换反应 一种金属能把另一种金属从它的化合物中置换出来,表明前一种金属元素的金属性较强
与同一种非金属单质反应 在其他条件相同的前提下,反应越剧烈,对应元素的金属性越强
金属阳离子的氧化性 金属阳离子(该金属只有一种阳离子)的氧化性越弱,对应的金属元素的金属性越强
最高价氧化物对应的水化物的碱性 最高价氧化物对应的水化物的碱性越强,对应元素的金属性越强
元素在元素周期表中的位置 同一周期从左到右,元素的金属性逐渐减弱;同一主族从上到下,元素的金属性逐渐增强
2.判断元素金属性强弱的方法
一、回顾硫、氮元素的原子结构和性质
二、复习化工生产中重要的物质转化关系
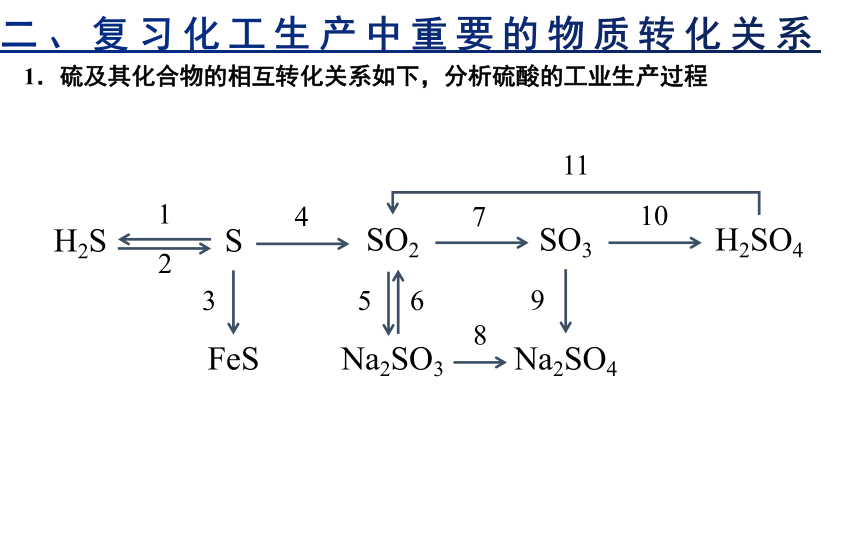
1.硫及其化合物的相互转化关系如下,分析硫酸的工业生产过程
H2S
S
FeS
SO2
SO3
H2SO4
Na2SO4
Na2SO3
1
4
7
10
11
3
5
6
8
9
2
二、复习化工生产中重要的物质转化关系
2.对煤燃烧后的废气进行常温脱硫处理的基本流程示意图如下,写出在废气脱硫并形成副产物的过程中所发生的主要反应的化学方程式
石膏
煤燃烧后的废气:
O2、CO2、N2、SO2
主要化学反应:
SO2→CaSO3
CaSO3→CaSO4
CaCO3+H2O
(浆状物)
脱硫后的气体:O2、CO2、N2
空气
二、复习化工生产中重要的物质转化关系
3.展示氮及其化合物的相互转化关系如图,分析硝酸的工业生产过程
N2
NH3
NO
NO2
HNO3
NH4NO3
O2
O2
H2O
NH3
1
4
7
3
5
6
8
2
二、复习化工生产中重要的物质转化关系
4.硅及其化合物的相互转化关系
SiF4
Si
SiO2
Na2SiO3
CaSiO3
1
4
3
5
6
2
三、分类梳理重要实验
回顾本章重要的物质性质探究实验、物质制备实验、物质检验实验和粗盐的分离提纯实验。用化学方程式或离子方程式表示下列实验事实∶
(1)二氧化硫溶于水:
(2)蘸有浓氨水和浓盐酸的玻璃棒靠近时空气中产生白烟:
(3)氨的水溶液显碱性:
(4)加热时浓硫酸能溶解铜:
(5)浓硝酸与铜生成红棕色气体:
(6)稀硝酸与铜生成无色气体:
(7)实验室制取氨气:
三、分类梳理重要实验
如何检验Cl-、SO42-、CO32-?
如何检验Na2SO4溶液中是否含有Cl-?
如何检验Na2SO3溶液是否变质?
(1)取少量待测液于试管中,滴加硝酸酸化的硝酸银溶液,若出现白色沉淀,则证明含有Cl-。
(2)取少量待测液于试管中,滴加盐酸酸化,无明显现象,再向溶液中滴加 BaCl2溶液,若出现白色沉淀,则证明含有SO42-。
(3)取少量待测液于试管中,滴加BaCl2溶液,产生白色沉淀,过滤,向沉淀中滴加盐酸,若产生使澄清石灰水变浑浊的无色无味气体,证明含有CO32-。
?
四、无机非金属材料
C
四、无机非金属材料
C
四、无机非金属材料
D
CO2、HCl
①②③
CO2
避免空气中的O2、CO2、水蒸气对实验产生干扰
作安全瓶,防止倒吸
澄清石灰水
PdCl2溶液
无尾气吸收装置
向Na2SiO3溶液中通入CO2气体,溶液变浑浊
今日作业
1.梳理本章思维导图。
2.完成本节课方程式的书写。
吴 彦
化工生产中的重要非金属元素
第五章 化工生产中的重要非金属元素
硫元素、氮元素与氧元素、氯元素非金属性相比有什么不同?
判断依据 规律
单质的氧化性 单质与氢气化合的难易程度 非金属单质与氢气化合越容易,对应元素的非金属性越强
非金属单质之间的置换反应 一种非金属单质能把另一种非金属元素从它的化合物中置换出来,表明前一种元素的非金属性较强
与同一种金属单质反应 在其他条件相同的前提下,反应越剧烈,对应元素的非金属性越强
与同种变价金属的反应 金属被氧化后的价态越高,对应元素的非金属性越强
气态氢化物的稳定性 气态氢化物越稳定,对应元素的非金属性越强
气态氢化物或非金属阴离子的还原性 气态氢化物或非金属阴离子的还原性越弱,对应元素的非金属性越强
最高价氧化物对应的水化物的酸性 最高价氧化物对应的水化物的酸性越强,对应元素的非金属性越强
元素在元素周期表中的位置 同一周期从左到右,元素的非金属性逐渐增强;同一主族从上到下,元素的非金属性逐渐减弱
1.判断元素非金属性强弱的方法
一、回顾硫、氮元素的原子结构和性质
判断依据 规律
单质的 还原性 单质与水或酸反应置换出氢气的难易程度 单质与水或酸(非氧化性酸)反应越容易置换出氢气 (即反应越剧烈),对应元素的金属性越强
金属单质之间的置换反应 一种金属能把另一种金属从它的化合物中置换出来,表明前一种金属元素的金属性较强
与同一种非金属单质反应 在其他条件相同的前提下,反应越剧烈,对应元素的金属性越强
金属阳离子的氧化性 金属阳离子(该金属只有一种阳离子)的氧化性越弱,对应的金属元素的金属性越强
最高价氧化物对应的水化物的碱性 最高价氧化物对应的水化物的碱性越强,对应元素的金属性越强
元素在元素周期表中的位置 同一周期从左到右,元素的金属性逐渐减弱;同一主族从上到下,元素的金属性逐渐增强
2.判断元素金属性强弱的方法
一、回顾硫、氮元素的原子结构和性质
二、复习化工生产中重要的物质转化关系
1.硫及其化合物的相互转化关系如下,分析硫酸的工业生产过程
H2S
S
FeS
SO2
SO3
H2SO4
Na2SO4
Na2SO3
1
4
7
10
11
3
5
6
8
9
2
二、复习化工生产中重要的物质转化关系
2.对煤燃烧后的废气进行常温脱硫处理的基本流程示意图如下,写出在废气脱硫并形成副产物的过程中所发生的主要反应的化学方程式
石膏
煤燃烧后的废气:
O2、CO2、N2、SO2
主要化学反应:
SO2→CaSO3
CaSO3→CaSO4
CaCO3+H2O
(浆状物)
脱硫后的气体:O2、CO2、N2
空气
二、复习化工生产中重要的物质转化关系
3.展示氮及其化合物的相互转化关系如图,分析硝酸的工业生产过程
N2
NH3
NO
NO2
HNO3
NH4NO3
O2
O2
H2O
NH3
1
4
7
3
5
6
8
2
二、复习化工生产中重要的物质转化关系
4.硅及其化合物的相互转化关系
SiF4
Si
SiO2
Na2SiO3
CaSiO3
1
4
3
5
6
2
三、分类梳理重要实验
回顾本章重要的物质性质探究实验、物质制备实验、物质检验实验和粗盐的分离提纯实验。用化学方程式或离子方程式表示下列实验事实∶
(1)二氧化硫溶于水:
(2)蘸有浓氨水和浓盐酸的玻璃棒靠近时空气中产生白烟:
(3)氨的水溶液显碱性:
(4)加热时浓硫酸能溶解铜:
(5)浓硝酸与铜生成红棕色气体:
(6)稀硝酸与铜生成无色气体:
(7)实验室制取氨气:
三、分类梳理重要实验
如何检验Cl-、SO42-、CO32-?
如何检验Na2SO4溶液中是否含有Cl-?
如何检验Na2SO3溶液是否变质?
(1)取少量待测液于试管中,滴加硝酸酸化的硝酸银溶液,若出现白色沉淀,则证明含有Cl-。
(2)取少量待测液于试管中,滴加盐酸酸化,无明显现象,再向溶液中滴加 BaCl2溶液,若出现白色沉淀,则证明含有SO42-。
(3)取少量待测液于试管中,滴加BaCl2溶液,产生白色沉淀,过滤,向沉淀中滴加盐酸,若产生使澄清石灰水变浑浊的无色无味气体,证明含有CO32-。
?
四、无机非金属材料
C
四、无机非金属材料
C
四、无机非金属材料
D
CO2、HCl
①②③
CO2
避免空气中的O2、CO2、水蒸气对实验产生干扰
作安全瓶,防止倒吸
澄清石灰水
PdCl2溶液
无尾气吸收装置
向Na2SiO3溶液中通入CO2气体,溶液变浑浊
今日作业
1.梳理本章思维导图。
2.完成本节课方程式的书写。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
