5.2.2氨的转化与生成 课件
文档属性
| 名称 | 5.2.2氨的转化与生成 课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 146.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-15 16:06:07 | ||
图片预览






文档简介
(共19张PPT)
吴 彦
氮的循环
——氨的转化与生成
第五章 化工生产中的重要非金属元素
第2节 氮及其化合物(2)
弗里茨·哈伯
卡尔·博施
格哈德·埃特尔
三位德国化学家哈伯、博施、埃特尔分别于1918年、1931年、2007年在氮肥领域研究获诺贝尔奖。
课题引入
一、氨气的物理性质
如果你是氮肥厂家的技术员,你是否会选择接用氨气做肥料?为什么?
化学氮肥主要包括铵态氮肥(主要成分为 NH4+)、硝态氮肥(主要成分为 NO3-) 和 有 机 态 氮 肥 —— 尿素[CO(NH2)2]。
无色、有刺激性气味的气体;
密度比空气小,为0.771 g·L-1;
氨易液化,液氨汽化时要吸收大量的热,因此氨可用作制冷剂。
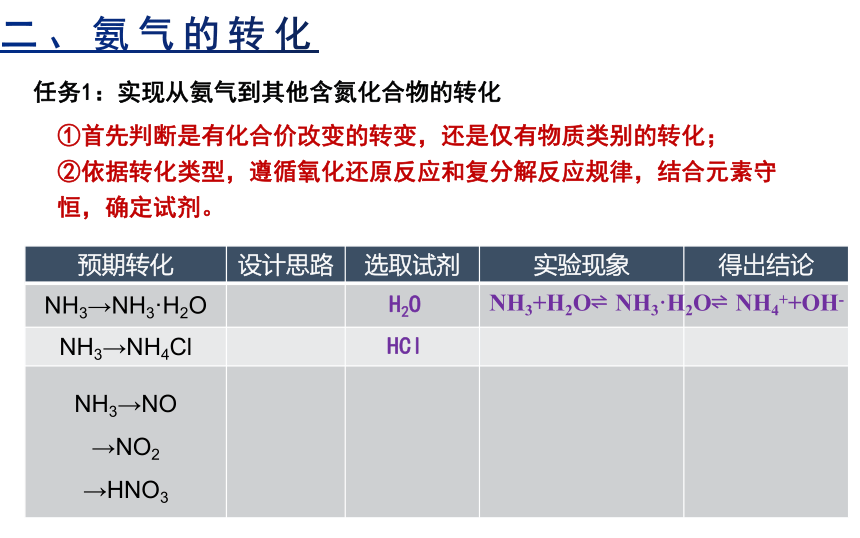
二、氨气的转化
任务1:实现从氨气到其他含氮化合物的转化
①首先判断是有化合价改变的转变,还是仅有物质类别的转化;
②依据转化类型,遵循氧化还原反应和复分解反应规律,结合元素守恒,确定试剂。
预期转化 设计思路 选取试剂 实验现象 得出结论
NH3→NH3·H2O
NH3→NH4Cl
NH3→NO →NO2 →HNO3
H2O
一、氨气的物理性质
如果你是氮肥厂家的技术员,你是否会选择接用氨气做肥料?为什么?
化学氮肥主要包括铵态氮肥(主要成分为 NH4+)、硝态氮肥(主要成分为 NO3-) 和 有 机 态 氮 肥 —— 尿素[CO(NH2)2]。
无色、有刺激性气味的气体;
密度比空气小,为0.771 g·L-1;
氨易液化,液氨汽化时要吸收大量的热,因此氨可用作制冷剂。
极易溶于水且能快速溶解,常温、常压下1体积水能溶解约 700 体积氨气;
任务1:实现从氨气到其他含氮化合物的转化
①首先判断是有化合价改变的转变,还是仅有物质类别的转化;
②依据转化类型,遵循氧化还原反应和复分解反应规律,结合元素守恒,确定试剂。
预期转化 设计思路 选取试剂 实验现象 得出结论
NH3→NH3·H2O
NH3→NH4Cl
NH3→NO →NO2 →HNO3
H2O
NH3+H2O NH3·H2O NH4++OH-
HCl
二、氨气的转化
任务1:实现从氨气到其他含氮化合物的转化
①首先判断是有化合价改变的转变,还是仅有物质类别的转化;
②依据转化类型,遵循氧化还原反应和复分解反应规律,结合元素守恒,确定试剂。
预期转化 设计思路 选取试剂 实验现象 得出结论
NH3→NH3·H2O
NH3→NH4Cl
NH3→NO →NO2 →HNO3
H2O
NH3+H2O NH3·H2O NH4++OH-
HCl
NH3+HCl=NH4Cl
4NH3+5O2=4NO+6H2O
催化剂
2NO + O2=2NO2
3NO2+H2O=2HNO3+NO
二、氨气的转化
三、氨气的生成
任务2:实现从氮气和其他含氮化合物到氨气的转化
预期转化 设计思路 选取试剂 实验现象 得出结论
N2→NH3
其他含氮化合物→NH3
N2 + 3H2 2NH3
高温、高压
催化剂
任务2:实现从氮气和其他含氮化合物到氨气的转化
三、氨气的生成
任务2:实现从氮气和其他含氮化合物到氨气的转化
NH4Cl=NH3↑+HCl↑
NH4HCO3 =NH3↑+H2O+CO2↑
2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑
三、氨气的生成
对于铵态氮肥的储存你有何想法?
低温保存,不宜与碱性的肥料混合使用
三、氨气的生成
图 5-13 为实验室制取氨的简易装置示意图。请仔细观察实验装置,思考如何检验试管中已收集满氨,如何吸收处理实验中多余的氨。
任务2:实现从氮气和其他含氮化合物到氨气的转化
碱为什么不用NaOH?铵盐为什么不用碳酸铵?
能否用加热氯化铵固体的方法制取氨?
导管口为什么要插入试管底部?
NaOH易吸水结块,而且对玻璃仪器的腐蚀性较强;碳酸铵分解会产生 CO2,使收集到的氨不纯。
氯化铵加热分解为氨和氯化氢,但是遇冷后二者会立即结合成氯化铵,收集不到氨。
氨的密度比空气的小,相当于向下排空气法将空气排出,收集氨。
三、氨气的生成
图 5-13 为实验室制取氨的简易装置示意图。请仔细观察实验装置,思考如何检验试管中已收集满氨,如何吸收处理实验中多余的氨。
任务2:实现从氮气和其他含氮化合物到氨气的转化
试管口塞有用水或稀硫酸浸湿的棉花团的作用是什么?
能否直接将导管插入水中?
氨可用哪些干燥剂干燥
塞棉花团的作用是抑制氨逸出,防止污染空气。
不能。因为会发生倒吸。
只能用碱性干燥剂,如生石灰;不能用酸性干燥剂,如 P2O5、浓硫酸等;也不能用CaCl2,因为CaCl2会与NH3结合成CaCl2·8NH3。
三、氨气的生成
方法 化学方程式 气体发生装置
加热浓氨水
浓氨水+固体NaOH
浓氨水+固体CaO
NH3·H2O=NH3↑+H2O
NH3·H2O=NH3↑+H2O
NaOH溶于水放热促使NH3·H2O分解,OH-浓度增大有利于NH3的逸出。
NH3·H2O+CaO=NH3↑+Ca(OH)2
CaO与水反应,使溶剂减少;反应放热,促使NH3·H2O分解,NH3逸出。
①
③
③
浓氨水制备氨气的方法
任务2:实现从氮气和其他含氮化合物到氨气的转化
在实验室中,常利用铵盐与强碱反应产生氨这一性质来检验铵根离子的存在和制取氨。
NH4++OH-=NH3↑+H2O
【实验5-7】
向盛有少量NH4Cl溶液、NH4NO3溶液和(NH4)2SO4溶液的三支试管中分别加入NaOH溶液并加热(注意通风),用镊子夹住一片湿润的红色石蕊试纸放在试管口。观察现象,分析现象产生的原因,写出反应的离子方程式。
不湿润可行吗?
三、氨气的生成
课堂小结
从物质类别和氮元素化合价的角度总结氨气的性质。
NH4++OH-=NH3↑+H2O
今日作业
1.梳理课堂笔记。
2.【练透】氮 第二课时p.155-157。
吴 彦
氮的循环
——氨的转化与生成
第五章 化工生产中的重要非金属元素
第2节 氮及其化合物(2)
弗里茨·哈伯
卡尔·博施
格哈德·埃特尔
三位德国化学家哈伯、博施、埃特尔分别于1918年、1931年、2007年在氮肥领域研究获诺贝尔奖。
课题引入
一、氨气的物理性质
如果你是氮肥厂家的技术员,你是否会选择接用氨气做肥料?为什么?
化学氮肥主要包括铵态氮肥(主要成分为 NH4+)、硝态氮肥(主要成分为 NO3-) 和 有 机 态 氮 肥 —— 尿素[CO(NH2)2]。
无色、有刺激性气味的气体;
密度比空气小,为0.771 g·L-1;
氨易液化,液氨汽化时要吸收大量的热,因此氨可用作制冷剂。
二、氨气的转化
任务1:实现从氨气到其他含氮化合物的转化
①首先判断是有化合价改变的转变,还是仅有物质类别的转化;
②依据转化类型,遵循氧化还原反应和复分解反应规律,结合元素守恒,确定试剂。
预期转化 设计思路 选取试剂 实验现象 得出结论
NH3→NH3·H2O
NH3→NH4Cl
NH3→NO →NO2 →HNO3
H2O
一、氨气的物理性质
如果你是氮肥厂家的技术员,你是否会选择接用氨气做肥料?为什么?
化学氮肥主要包括铵态氮肥(主要成分为 NH4+)、硝态氮肥(主要成分为 NO3-) 和 有 机 态 氮 肥 —— 尿素[CO(NH2)2]。
无色、有刺激性气味的气体;
密度比空气小,为0.771 g·L-1;
氨易液化,液氨汽化时要吸收大量的热,因此氨可用作制冷剂。
极易溶于水且能快速溶解,常温、常压下1体积水能溶解约 700 体积氨气;
任务1:实现从氨气到其他含氮化合物的转化
①首先判断是有化合价改变的转变,还是仅有物质类别的转化;
②依据转化类型,遵循氧化还原反应和复分解反应规律,结合元素守恒,确定试剂。
预期转化 设计思路 选取试剂 实验现象 得出结论
NH3→NH3·H2O
NH3→NH4Cl
NH3→NO →NO2 →HNO3
H2O
NH3+H2O NH3·H2O NH4++OH-
HCl
二、氨气的转化
任务1:实现从氨气到其他含氮化合物的转化
①首先判断是有化合价改变的转变,还是仅有物质类别的转化;
②依据转化类型,遵循氧化还原反应和复分解反应规律,结合元素守恒,确定试剂。
预期转化 设计思路 选取试剂 实验现象 得出结论
NH3→NH3·H2O
NH3→NH4Cl
NH3→NO →NO2 →HNO3
H2O
NH3+H2O NH3·H2O NH4++OH-
HCl
NH3+HCl=NH4Cl
4NH3+5O2=4NO+6H2O
催化剂
2NO + O2=2NO2
3NO2+H2O=2HNO3+NO
二、氨气的转化
三、氨气的生成
任务2:实现从氮气和其他含氮化合物到氨气的转化
预期转化 设计思路 选取试剂 实验现象 得出结论
N2→NH3
其他含氮化合物→NH3
N2 + 3H2 2NH3
高温、高压
催化剂
任务2:实现从氮气和其他含氮化合物到氨气的转化
三、氨气的生成
任务2:实现从氮气和其他含氮化合物到氨气的转化
NH4Cl=NH3↑+HCl↑
NH4HCO3 =NH3↑+H2O+CO2↑
2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑
三、氨气的生成
对于铵态氮肥的储存你有何想法?
低温保存,不宜与碱性的肥料混合使用
三、氨气的生成
图 5-13 为实验室制取氨的简易装置示意图。请仔细观察实验装置,思考如何检验试管中已收集满氨,如何吸收处理实验中多余的氨。
任务2:实现从氮气和其他含氮化合物到氨气的转化
碱为什么不用NaOH?铵盐为什么不用碳酸铵?
能否用加热氯化铵固体的方法制取氨?
导管口为什么要插入试管底部?
NaOH易吸水结块,而且对玻璃仪器的腐蚀性较强;碳酸铵分解会产生 CO2,使收集到的氨不纯。
氯化铵加热分解为氨和氯化氢,但是遇冷后二者会立即结合成氯化铵,收集不到氨。
氨的密度比空气的小,相当于向下排空气法将空气排出,收集氨。
三、氨气的生成
图 5-13 为实验室制取氨的简易装置示意图。请仔细观察实验装置,思考如何检验试管中已收集满氨,如何吸收处理实验中多余的氨。
任务2:实现从氮气和其他含氮化合物到氨气的转化
试管口塞有用水或稀硫酸浸湿的棉花团的作用是什么?
能否直接将导管插入水中?
氨可用哪些干燥剂干燥
塞棉花团的作用是抑制氨逸出,防止污染空气。
不能。因为会发生倒吸。
只能用碱性干燥剂,如生石灰;不能用酸性干燥剂,如 P2O5、浓硫酸等;也不能用CaCl2,因为CaCl2会与NH3结合成CaCl2·8NH3。
三、氨气的生成
方法 化学方程式 气体发生装置
加热浓氨水
浓氨水+固体NaOH
浓氨水+固体CaO
NH3·H2O=NH3↑+H2O
NH3·H2O=NH3↑+H2O
NaOH溶于水放热促使NH3·H2O分解,OH-浓度增大有利于NH3的逸出。
NH3·H2O+CaO=NH3↑+Ca(OH)2
CaO与水反应,使溶剂减少;反应放热,促使NH3·H2O分解,NH3逸出。
①
③
③
浓氨水制备氨气的方法
任务2:实现从氮气和其他含氮化合物到氨气的转化
在实验室中,常利用铵盐与强碱反应产生氨这一性质来检验铵根离子的存在和制取氨。
NH4++OH-=NH3↑+H2O
【实验5-7】
向盛有少量NH4Cl溶液、NH4NO3溶液和(NH4)2SO4溶液的三支试管中分别加入NaOH溶液并加热(注意通风),用镊子夹住一片湿润的红色石蕊试纸放在试管口。观察现象,分析现象产生的原因,写出反应的离子方程式。
不湿润可行吗?
三、氨气的生成
课堂小结
从物质类别和氮元素化合价的角度总结氨气的性质。
NH4++OH-=NH3↑+H2O
今日作业
1.梳理课堂笔记。
2.【练透】氮 第二课时p.155-157。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
