化学人教版(2019)必修第二册6.2.2化学反应的速率与限度(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.2.2化学反应的速率与限度(共22张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 671.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-15 16:08:19 | ||
图片预览








文档简介
(共22张PPT)
第六章 化学反应与能量
第二节 化学反应的速率与限度
一个化学反应在实际进行时(如化学实验、化工生产等),反应物是否会按化学方程式中的计量关系完全转变成产物呢?
科学史话:炼铁高炉尾气之谜
高温
高炉炼铁的主要反应:Fe2O3+3CO == 2Fe+3CO2
其CO发生的反应是:C+O2=CO2、C+CO2=2CO
生产中所需焦炭的实际用量,远高于按照化学方程式计算所需的量,而且从高炉炉顶出来的气体中总是含有没有利用的CO气体。
研究化学反应的新视角:化学反应的限度
高
炉
19世纪下半叶,法国科学家勒夏特列才将谜底揭开:C+CO2 2CO是一个可逆反应。
后来的研究证明,在高炉中Fe2O3和CO反应也不能全部转化为 Fe 和 CO2。
科学研究表明,很多化学反应都具有可逆性,即正向反应和逆向反应在同时进行。只是可逆的程度有所不同且差异很大。
科学史话:炼铁高炉尾气之谜
研究化学反应的新视角:化学反应的限度
一、可逆反应
1、定义:
2、特点:
在同一条件下,既能向正方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应。
(1)普遍性:
(2)同条件:
(3)同时性:
(4)共存性:
大多数的化学反应都是可逆反应
正、逆反应是在同一条件下进行的
正、逆反应同时进行
反应物和生成物共存
二、化学反应的限度
一、可逆反应
3、常见的可逆反应
NH3 + H2O NH3·H2O
2SO2 + O2 2SO3
N2 + 3H2 2NH3
Cl2 + H2O HClO + HCl
Cr2O72 (橙色) + H2O 2CrO42 (黄色) + 2H+
二、化学反应的限度
练、某学习小组为了证明2Fe3++2I 2Fe2++I2 为可逆反应,设计了如下的方案:
取2 ml 0.5 mol/L KI溶液,滴加2 ml 0.1 mol/L的FeCl3溶液,再继续加入2 ml CCl4,充分振荡、静置、分层,再取上清液,滴加KSCN溶液。
(1)该方案中能证明该反应为可逆反应的现象是:
_________________________________________
_________________________________________。
下层溶液呈紫红色,且上清夜中加KSCN后溶液呈血红色。
二、化学反应的限度
(2)有同学认为该方案不够严密,即使该反应不是可逆反应也可能出现上述现象,原因是:__________________________
______________________________。
振荡过程中,溶液中Fe2+可被空气中的氧气氧化成Fe3+
练、某学习小组为了证明2Fe3++2I 2Fe2++I2 为可逆反应,设计了如下的方案:
二、化学反应的限度
二、化学反应的限度
(1)化学平衡状态的建立
以CO(g)+H2O(g) CO2(g)+H2(g)为例:在一定温度下,将0.1mol CO(g)0.1molH2O(g)通入1L密闭容器中。
开始时
c(生成物)=0,v逆=0
c(反应物)最大,v正最大
进行中
c(生成物)逐渐增大,v逆逐渐增大
c(反应物)逐渐减小,v正逐渐减小
平衡时
v正=v逆≠0
c(反应物)、 c(生成物)均不变
二、化学反应的限度
v
0
t
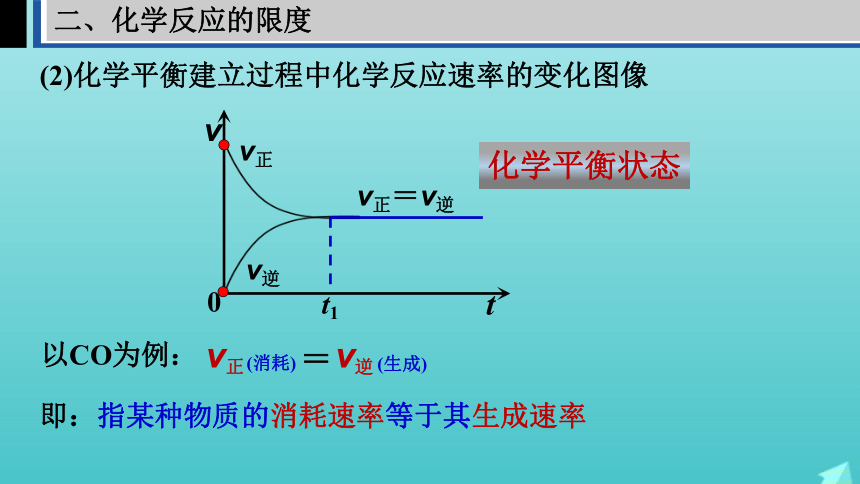
(2)化学平衡建立过程中化学反应速率的变化图像
v正
v逆
t1
v正=v逆
以CO为例:
v正
v逆
(消耗)
(生成)
=
即:指某种物质的消耗速率等于其生成速率
化学平衡状态
二、化学反应的限度
(3)化学平衡状态的概念:
一定条件下的可逆反应中,当反应进行到一定程度时,正反应速率与逆反应速率相等,反应物浓度和生成物浓度都不再改变,达到一种表面静止的状态。称为化学平衡状态,简称化学平衡。
前提(适用范围):
内在本质:
外在标志:
可逆反应
v正=v逆≠0
各组分的浓度保持不变
说明:化学平衡状态是可逆反应在一定条件下所能达到的或完成的最大程度,即该反应的限度。
二、化学反应的限度
建立化学平衡的反应是可逆反应
同一物质正反应速率和逆反应速率相等(即v正=v逆)
达到平衡状态时,反应并没有停止(即v正=v逆≠0)
平衡体系中各组分的含量(c、体积分数等)保存一定
任一化学平衡状态均是暂时的、相对的、有条件的。条件改变时,如果正、逆反应速率不再相等,化学平衡将发生改变(平衡发生移动)。
(4)化学平衡状态的特征
逆:
等:
动:
定:
变:
二、化学反应的限度
思考:如何判断可逆反应是否已达到平衡状态?
分析:从化学平衡的概念入手
化学平衡的标志
(1)正反应速率与逆反应速率相等
(2)反应物浓度和生成物浓度都不再改变
等
定
化学平衡强调的两个方面:
二、化学反应的限度
三、化学平衡的判断
(1)动态标志: v正=v逆≠0
①同种物质:
②不同物质:
必须标明是“异向”的反应速率关系
同一物质的生成速率等于消耗速率
(2)静态标志:各种“量”不变
①各物质的质量、物质的量或浓度保持不变
如:aA(g)+bB(g) cC(g)+dD(g),
当v正(A) : v逆(B)= 时,反应达到平衡状态
a : b
二、化学反应的限度
②各物质的百分含量(物质的量分数、质量分数、体积分数)不变。
(2)静态标志:各种“量”不变
①各物质的质量、物质的量或浓度保持不变
③温度、压强、颜色保持不变
判断可逆反应是否达到化学平衡状态的方法
—— 异向相等、变量不变
二、化学反应的限度
(3)综合分析
举例 mA(g)+nB(g) pC(g)+qD(g) 状态
混物体系中合各组分的含量 各物质的质量或 各物质的质量分数一定
各气体的体积或体积分数一定
总物质的量、总压强一定
平衡
平衡
不一定平衡
m + n ≠ p + q (非等体反应) 平衡
m + n=p + q (等体反应) 不平衡
三、化学平衡的判断——异向相等、变量不变
二、化学反应的限度
举例 mA(g)+nB(g) pC(g)+qD(g) 状态
正逆反应 速率关系 在单位时间内消耗了m molA,同时生成m molA,即v正=v逆
在单位时间内消耗了 n molB, 同时生成 p molC
vA : vB : vC : vD = m : n : p : q, v正不一定等于v逆
在单位时间内生成了 n molB, 同时消耗了 q molD
(续表)
平衡
不一定平衡
不一定平衡
不一定平衡
二、化学反应的限度
举例 mA(g)+nB(g) pC(g)+qD(g) 状态
温度 体系温度一定(假设体系与环境无能量交换)
密度 密度一定
颜色 含有有色物质的体系 颜色不再变化
(续表)
平衡
不一定平衡
平衡
不一定平衡
平衡
二、化学反应的限度
练、下列的说法中可以证明反应: H2(g) +I2(g) 2HI(g)
已达平衡状态的是________
(1)单位时间内生成n molH2的同时生成n mol HI;
(2)一个H H键断裂的同时,有两个H I键断裂;
(3)质量分数:w(HI) = w(I2);
(4) c(HI) : c(H2) : c(I2) = 2 : 1 : 1;
(5)温度和体积一定时,容器内压强不再变化;
(6)条件一定,混合气体的平均相对分子质量不再变化;
(7)温度和压强一定时,混合气体的颜色不再发生变化;
(8)温度和压强一定时,混合气体的密度不再变化。
(2)、(7)
二、化学反应的限度
练、在一定温度下密闭容器中进行的反应2SO2+O2 2SO3
下列说法中能说明已经达到化学平衡的是( )
①2v(O2)生成=v(SO2)消耗
②SO2、O2、SO3的浓度之比为 2∶1∶2
③单位时间内消耗 1 mol O2 ,同时生成 2 mol SO3
④混合气体的压强不变。
A. ①④ B. ②③ C. ①②③④ D. ①③④
A
练、判断:对于可逆反应
NH2COONH4(s) 2NH3(g)+CO2(g),当NH3的体积分数保持不变时,该反应达到化学平衡状态。
二、化学反应的限度
1、控制反应条件的意义
(1)促进有利的化学反应
(2)抑制有害的化学反应
提高反应速率
提高原料的利用率
降低反应速率
控制副反应的发生
减少甚至消除有害物质的产生
三、化学反应条件的控制
2、控制反应条件的基本措施
通过改变影响化学反应速率的外界因素(温度、浓度、压强等),可以调控反应速率、改变可逆反应的限度,进而提高反应转化率。
3、化工生产控制反应条件的原则
如:N2(g)+H2(g) 2NH3(g)
原则:考虑控制反应条件的成本和实际可行性
选择:400~500oC、 10~30MPa
三、化学反应条件的控制
4、案例分析:“提高煤的燃烧效率”
(1)煤的状态:
(4)热量的利用:
(2)空气用量:
(3)炉膛温度的材料:
煤研得越细,与空气中氧气的接触面积越大,燃烧越充分,反应速率越大。
适量的空气有利于煤的燃烧,过多的空气会带走大量的热量;少量的空气会使煤燃烧不充分
采用隔热的耐高温材料
废气中的热量可用于供暖和发电等
三、化学反应条件的控制
第六章 化学反应与能量
第二节 化学反应的速率与限度
一个化学反应在实际进行时(如化学实验、化工生产等),反应物是否会按化学方程式中的计量关系完全转变成产物呢?
科学史话:炼铁高炉尾气之谜
高温
高炉炼铁的主要反应:Fe2O3+3CO == 2Fe+3CO2
其CO发生的反应是:C+O2=CO2、C+CO2=2CO
生产中所需焦炭的实际用量,远高于按照化学方程式计算所需的量,而且从高炉炉顶出来的气体中总是含有没有利用的CO气体。
研究化学反应的新视角:化学反应的限度
高
炉
19世纪下半叶,法国科学家勒夏特列才将谜底揭开:C+CO2 2CO是一个可逆反应。
后来的研究证明,在高炉中Fe2O3和CO反应也不能全部转化为 Fe 和 CO2。
科学研究表明,很多化学反应都具有可逆性,即正向反应和逆向反应在同时进行。只是可逆的程度有所不同且差异很大。
科学史话:炼铁高炉尾气之谜
研究化学反应的新视角:化学反应的限度
一、可逆反应
1、定义:
2、特点:
在同一条件下,既能向正方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应。
(1)普遍性:
(2)同条件:
(3)同时性:
(4)共存性:
大多数的化学反应都是可逆反应
正、逆反应是在同一条件下进行的
正、逆反应同时进行
反应物和生成物共存
二、化学反应的限度
一、可逆反应
3、常见的可逆反应
NH3 + H2O NH3·H2O
2SO2 + O2 2SO3
N2 + 3H2 2NH3
Cl2 + H2O HClO + HCl
Cr2O72 (橙色) + H2O 2CrO42 (黄色) + 2H+
二、化学反应的限度
练、某学习小组为了证明2Fe3++2I 2Fe2++I2 为可逆反应,设计了如下的方案:
取2 ml 0.5 mol/L KI溶液,滴加2 ml 0.1 mol/L的FeCl3溶液,再继续加入2 ml CCl4,充分振荡、静置、分层,再取上清液,滴加KSCN溶液。
(1)该方案中能证明该反应为可逆反应的现象是:
_________________________________________
_________________________________________。
下层溶液呈紫红色,且上清夜中加KSCN后溶液呈血红色。
二、化学反应的限度
(2)有同学认为该方案不够严密,即使该反应不是可逆反应也可能出现上述现象,原因是:__________________________
______________________________。
振荡过程中,溶液中Fe2+可被空气中的氧气氧化成Fe3+
练、某学习小组为了证明2Fe3++2I 2Fe2++I2 为可逆反应,设计了如下的方案:
二、化学反应的限度
二、化学反应的限度
(1)化学平衡状态的建立
以CO(g)+H2O(g) CO2(g)+H2(g)为例:在一定温度下,将0.1mol CO(g)0.1molH2O(g)通入1L密闭容器中。
开始时
c(生成物)=0,v逆=0
c(反应物)最大,v正最大
进行中
c(生成物)逐渐增大,v逆逐渐增大
c(反应物)逐渐减小,v正逐渐减小
平衡时
v正=v逆≠0
c(反应物)、 c(生成物)均不变
二、化学反应的限度
v
0
t
(2)化学平衡建立过程中化学反应速率的变化图像
v正
v逆
t1
v正=v逆
以CO为例:
v正
v逆
(消耗)
(生成)
=
即:指某种物质的消耗速率等于其生成速率
化学平衡状态
二、化学反应的限度
(3)化学平衡状态的概念:
一定条件下的可逆反应中,当反应进行到一定程度时,正反应速率与逆反应速率相等,反应物浓度和生成物浓度都不再改变,达到一种表面静止的状态。称为化学平衡状态,简称化学平衡。
前提(适用范围):
内在本质:
外在标志:
可逆反应
v正=v逆≠0
各组分的浓度保持不变
说明:化学平衡状态是可逆反应在一定条件下所能达到的或完成的最大程度,即该反应的限度。
二、化学反应的限度
建立化学平衡的反应是可逆反应
同一物质正反应速率和逆反应速率相等(即v正=v逆)
达到平衡状态时,反应并没有停止(即v正=v逆≠0)
平衡体系中各组分的含量(c、体积分数等)保存一定
任一化学平衡状态均是暂时的、相对的、有条件的。条件改变时,如果正、逆反应速率不再相等,化学平衡将发生改变(平衡发生移动)。
(4)化学平衡状态的特征
逆:
等:
动:
定:
变:
二、化学反应的限度
思考:如何判断可逆反应是否已达到平衡状态?
分析:从化学平衡的概念入手
化学平衡的标志
(1)正反应速率与逆反应速率相等
(2)反应物浓度和生成物浓度都不再改变
等
定
化学平衡强调的两个方面:
二、化学反应的限度
三、化学平衡的判断
(1)动态标志: v正=v逆≠0
①同种物质:
②不同物质:
必须标明是“异向”的反应速率关系
同一物质的生成速率等于消耗速率
(2)静态标志:各种“量”不变
①各物质的质量、物质的量或浓度保持不变
如:aA(g)+bB(g) cC(g)+dD(g),
当v正(A) : v逆(B)= 时,反应达到平衡状态
a : b
二、化学反应的限度
②各物质的百分含量(物质的量分数、质量分数、体积分数)不变。
(2)静态标志:各种“量”不变
①各物质的质量、物质的量或浓度保持不变
③温度、压强、颜色保持不变
判断可逆反应是否达到化学平衡状态的方法
—— 异向相等、变量不变
二、化学反应的限度
(3)综合分析
举例 mA(g)+nB(g) pC(g)+qD(g) 状态
混物体系中合各组分的含量 各物质的质量或 各物质的质量分数一定
各气体的体积或体积分数一定
总物质的量、总压强一定
平衡
平衡
不一定平衡
m + n ≠ p + q (非等体反应) 平衡
m + n=p + q (等体反应) 不平衡
三、化学平衡的判断——异向相等、变量不变
二、化学反应的限度
举例 mA(g)+nB(g) pC(g)+qD(g) 状态
正逆反应 速率关系 在单位时间内消耗了m molA,同时生成m molA,即v正=v逆
在单位时间内消耗了 n molB, 同时生成 p molC
vA : vB : vC : vD = m : n : p : q, v正不一定等于v逆
在单位时间内生成了 n molB, 同时消耗了 q molD
(续表)
平衡
不一定平衡
不一定平衡
不一定平衡
二、化学反应的限度
举例 mA(g)+nB(g) pC(g)+qD(g) 状态
温度 体系温度一定(假设体系与环境无能量交换)
密度 密度一定
颜色 含有有色物质的体系 颜色不再变化
(续表)
平衡
不一定平衡
平衡
不一定平衡
平衡
二、化学反应的限度
练、下列的说法中可以证明反应: H2(g) +I2(g) 2HI(g)
已达平衡状态的是________
(1)单位时间内生成n molH2的同时生成n mol HI;
(2)一个H H键断裂的同时,有两个H I键断裂;
(3)质量分数:w(HI) = w(I2);
(4) c(HI) : c(H2) : c(I2) = 2 : 1 : 1;
(5)温度和体积一定时,容器内压强不再变化;
(6)条件一定,混合气体的平均相对分子质量不再变化;
(7)温度和压强一定时,混合气体的颜色不再发生变化;
(8)温度和压强一定时,混合气体的密度不再变化。
(2)、(7)
二、化学反应的限度
练、在一定温度下密闭容器中进行的反应2SO2+O2 2SO3
下列说法中能说明已经达到化学平衡的是( )
①2v(O2)生成=v(SO2)消耗
②SO2、O2、SO3的浓度之比为 2∶1∶2
③单位时间内消耗 1 mol O2 ,同时生成 2 mol SO3
④混合气体的压强不变。
A. ①④ B. ②③ C. ①②③④ D. ①③④
A
练、判断:对于可逆反应
NH2COONH4(s) 2NH3(g)+CO2(g),当NH3的体积分数保持不变时,该反应达到化学平衡状态。
二、化学反应的限度
1、控制反应条件的意义
(1)促进有利的化学反应
(2)抑制有害的化学反应
提高反应速率
提高原料的利用率
降低反应速率
控制副反应的发生
减少甚至消除有害物质的产生
三、化学反应条件的控制
2、控制反应条件的基本措施
通过改变影响化学反应速率的外界因素(温度、浓度、压强等),可以调控反应速率、改变可逆反应的限度,进而提高反应转化率。
3、化工生产控制反应条件的原则
如:N2(g)+H2(g) 2NH3(g)
原则:考虑控制反应条件的成本和实际可行性
选择:400~500oC、 10~30MPa
三、化学反应条件的控制
4、案例分析:“提高煤的燃烧效率”
(1)煤的状态:
(4)热量的利用:
(2)空气用量:
(3)炉膛温度的材料:
煤研得越细,与空气中氧气的接触面积越大,燃烧越充分,反应速率越大。
适量的空气有利于煤的燃烧,过多的空气会带走大量的热量;少量的空气会使煤燃烧不充分
采用隔热的耐高温材料
废气中的热量可用于供暖和发电等
三、化学反应条件的控制
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
