2022-2023学年鲁科版高中化学必修1 3.1.2 铁 铁氧化物 铁氢氧化物 课件(共22张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版高中化学必修1 3.1.2 铁 铁氧化物 铁氢氧化物 课件(共22张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-15 20:49:15 | ||
图片预览








文档简介
(共22张PPT)
铁
之
五
家
环
元素五环——铁五环
铁单质、铁氧化物、铁氢氧化物
美图赏析
china上的点缀
——绿色釉
千年华夏智慧
——敦煌壁画
世界最伟大的建筑之一
——故宫一角
我国四大发明之一
——司南(指南针)
根据生产、生活中的应用实例或通过实验探究,逐步建立宏观辨识与微观探析的化学核心素养。
核心素养
目标
能通过实验探究交流研讨,掌握铁单质、铁的氧化物、铁的氢氧化物的性质,能利用物质的性质和反应,设计Fe(OH)2的制备方案,提升科学探究与创新能力。
能从物质类别和价态两个视角研究物质,认识含铁物质在生产和生活中的应用,建立含铁物质性质和应用间的关系,增强科学态度与社会责任。
要学什么
自主探究
初中化学我们已经对铁元素有所了解,尤其是熟知铁单质的一些物化性质,根据初中所学以及对课本P89-91的自学内容,尝试回答以下问题并写在导学案相应位置上:
1、我们这节课的对象是铁单质、铁氧化物、铁氢氧化物,能否分类举例并写出它们的化学式,同时标注铁元素对应的化合价?
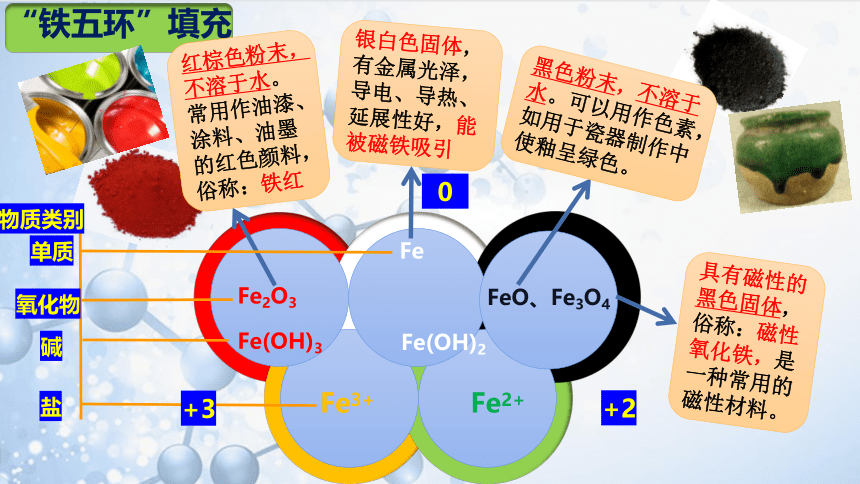
2、根据预习及提供的试剂观察其外观,将化学式填在“铁五环”对应颜色中;并在“铁五环”方框中标注上对应铁元素的价态。
3、能否回顾与铁单质有关的物化性质,相关化学反应写出其化学方程式?
银白色固体,有金属光泽,导电、导热、延展性好,能被磁铁吸引
Fe3+
Fe2O3
Fe(OH)3
Fe2+
Fe
Fe(OH)2
FeO、Fe3O4
“铁五环”填充
黑色粉末,不溶于水。可以用作色素,如用于瓷器制作中使釉呈绿色。
具有磁性的黑色固体,俗称:磁性氧化铁,是一种常用的磁性材料。
红棕色粉末,不溶于水。常用作油漆、涂料、油墨的红色颜料,俗称:铁红
物质类别
单质
氧化物
碱
盐
02
+2
+3
铁的化学性质
非金属单质
非氧化性酸
盐溶液
铁
水?
与盐酸:
②与氯气:
点燃
2Fe + 3Cl2 2FeCl3
Fe + 2H+ Fe2++ H2↑
①与硫酸铜溶液:
Fe + 2Fe3+ 3Fe2+
②与三氯化铁溶液
3Fe + 2O2 Fe3O4
点燃
①与氧气:
Fe + Cu2+ Fe2++ Cu
冷水或热水不反应
铁单质
实验装置 实验现象 实验结论
肥皂液中有气泡产生,用火柴点燃气泡,____ ________ 铁和水蒸气反应生成H2,化学方程式:___________
______________
铁和水蒸气的反应(课本P89)
爆鸣声
3Fe+4H2O(g)
听到
知识支持:肥皂液在该实验中可以起到“收集”氢气的作用。
铁单质
小结
铁
Fe
非金属单质
盐酸、稀硫酸
盐溶液
水
2Fe + 3Cl2 2FeCl3
点燃
3Fe + 2O2 Fe3O4
点燃
Fe + 2H+ Fe2++ H2↑
Fe + Cu2+ Fe2++ Cu
Fe + 2Fe3+ 3Fe2+
3Fe + 4H2O(g) Fe3O4 + 4H2
高温
铁单质
快速完成导学案【课堂检测】1、2T
探究
思考
铁氧化物、铁氢氧化物都有哪些化学性质呢?能否通过实验验证一下呢?
01.预测物质的性质
从物质类别和氧化还原角度
02.设计实验
说明选择的试剂及选择的理由
03.推测现象
推测可能出现的实验现象
FeO粉末
Fe2O3粉末
Fe3O4粉末
FeSO4粉末
Fe2(SO4)3粉末
稀硫酸溶液
稀氢氧化钠溶液
实验1:探究铁氧化物的性质
实验2:探究铁氢氧化物的制备方法
实验3:探究铁氢氧化物的性质
实验探究
先独立思考问题,后组内交流,小组代表分享观点
实验探究
预测 角度 实验 目的 代表 物质 选取 试剂 预测 现象 实验 现象 离子方程式及结论
物质 类别 铁氧化物的性质 Fe2O3 稀硫酸溶液 Fe2O3粉末 固体溶解,形成黄色溶液
物质类别氧化还原 铁氢氧化物的制备 Fe(OH)2 Fe(OH)3
物质类别 氧化还原 铁氢氧化物的性质 Fe(OH)2 Fe(OH)3
实验探究
预测 角度 实验 目的 代表 物质 选取 试剂 预测 现象 实验 现象 实验结论
物质 类别 铁氧化物的性质 Fe2O3 稀硫酸溶液 Fe2O3粉末 固体溶解,形成黄色溶液
物质类别氧化还原 铁氢氧化物的制备 Fe(OH)2 Fe(OH)3 Fe2(SO4)3 FeSO4 NaOH溶液 产生白色/红褐色沉淀
物质类别 氧化还原 铁氢氧化物的性质 Fe(OH)2 Fe(OH)3 稀硫酸溶液 Fe(OH)2 Fe(OH)3 固体溶解,形成浅绿/黄色溶液
实验操作
1.安全提示: 药品不要沾到皮肤上
2.分工合作: 老师演示实验,同学观察并记录现象
3.试剂用量: 取新配制的FeSO4、Fe2(SO4)3溶液1ml
(约20滴)左右,NaOH溶液、H2SO4溶液3-5滴。
4.规范操作:滴加溶液时胶头滴管位置如图所示。
5.特别注意: 边加试剂边振荡
FeSO4
H2SO4溶液
NaOH溶液
实验探究
Fe2(SO4)3
H2SO4溶液
NaOH溶液
实验操作
实验现象
固体溶解产成黄色溶液
先产生红褐色沉淀,后沉淀溶解,产成黄色溶液
先产生白色沉淀,迅速变成灰绿色,最后变成红褐色;加酸后沉淀溶解,产成黄色溶液
Fe2O3可溶于酸
氢氧化铁可溶于酸
?
实验结论
实验探究
Fe2O3
H2SO4溶液
FeSO4
H2SO4溶液
NaOH溶液
Fe2(SO4)3
H2SO4溶液
NaOH溶液
迷津点拨
先产生白色沉淀,迅速变为灰绿色,最终变为红褐色
进一步验证Fe(Ⅱ)具有较强还原性
4Fe(OH)2+O2+2H2O=4Fe(OH)3
实验探究
讨论
思考
1.制备氢氧化亚铁应注意什么问题呢?
2.具体措施是什么呢?
3.能否根据提供的试剂和仪器来制备呢?
①新制备的亚铁盐溶液(现用现配)
②将溶解亚铁盐的蒸馏水煮沸,除去溶解在水中的氧气。
③将胶头滴管伸入亚铁盐溶液的液面下
④可在亚铁盐溶液液面上加上隔绝氧气的物质,如苯、植物油
知识支持
制备氢氧化亚铁应注意:(防止被氧化)
实验操作
1.安全提示: 药品不要沾到皮肤上
2.分工合作: 老师演示实验,同学观察并记录现象
3.试剂用量: 溶液3-5ml;固体1-2g
4.规范操作:制备新制FeSO4时应打开瓶塞,溶解结束后
立即将瓶塞盖上
5.特别注意: 将注射器针头深入液面以下
实验探究
无氧水、
硫酸亚铁粉末、
盛放在注射器中煮沸的NaOH溶液
——NaOH溶液
名称 氧化亚铁 氧化铁 四氧化三铁
化学式
俗称
颜色、状态
水溶性
铁的化合价
用途
+2
黑色粉末
红棕色粉末
黑色晶体
铁红
磁性氧化铁
都不溶于水
+3
+2 、+3
磁铁
冶炼铁的原料
涂料、红色油漆、
FeO
Fe2O3
Fe3O4
与盐酸反应
Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O
FeO + 2H+ = Fe2+ + H2O
Fe2O3 + 6H+= 2Fe3+ + 3H2O
知识整合
与还原剂反应
Fe3O4 +4CO = 3Fe + 4CO2
FeO + H2 = Fe+ H2O
2Al + Fe2O3 = 2Fe + Al2O3
高温
高温
高温
化学式 Fe(OH)2 Fe(OH)3
色态 白色固体
溶解性 难溶
稳定性
与O2反应
与硫酸反应
制备
不稳定,易被空气氧化
4Fe(OH)2+2H2O+O2=4Fe(OH)3
红褐色固体
难溶
Fe(OH)2+2H+ = Fe2+ +2H2O
Fe(OH)3 + 3H+ = Fe3+ +3H2O
Fe2++2OH-=Fe(OH)2↓
Fe3++3OH- = Fe(OH)3↓
2Fe(OH)3=Fe2O3+3H2O
▲
知识整合
非氧化性酸
热稳定性差(难溶性碱)
Fe3+
Fe2O3
Fe(OH)3
Fe2+
Fe
Fe(OH)2
FeO、Fe3O4
“铁五环”小结
物质类别
单质
氧化物
碱
盐
02
+2
+3
均体现0价铁单质的还原性
可被还原剂H2、CO、Al等还原
非氧化性酸
非金属单质、酸、盐溶液、水
只有还原性
只有氧化性
既有还原性
又有氧化性
可被O2等氧化剂氧化
含有相同价态铁元素的物质之间的转化,利用复分解反应实现。
含有不同价态铁元素的物质之间的转化,利用氧化还原反应实现。
这种思想将贯穿整个元素化合物的学习!
谢
谢
配
合
铁
之
五
家
环
元素五环——铁五环
铁单质、铁氧化物、铁氢氧化物
美图赏析
china上的点缀
——绿色釉
千年华夏智慧
——敦煌壁画
世界最伟大的建筑之一
——故宫一角
我国四大发明之一
——司南(指南针)
根据生产、生活中的应用实例或通过实验探究,逐步建立宏观辨识与微观探析的化学核心素养。
核心素养
目标
能通过实验探究交流研讨,掌握铁单质、铁的氧化物、铁的氢氧化物的性质,能利用物质的性质和反应,设计Fe(OH)2的制备方案,提升科学探究与创新能力。
能从物质类别和价态两个视角研究物质,认识含铁物质在生产和生活中的应用,建立含铁物质性质和应用间的关系,增强科学态度与社会责任。
要学什么
自主探究
初中化学我们已经对铁元素有所了解,尤其是熟知铁单质的一些物化性质,根据初中所学以及对课本P89-91的自学内容,尝试回答以下问题并写在导学案相应位置上:
1、我们这节课的对象是铁单质、铁氧化物、铁氢氧化物,能否分类举例并写出它们的化学式,同时标注铁元素对应的化合价?
2、根据预习及提供的试剂观察其外观,将化学式填在“铁五环”对应颜色中;并在“铁五环”方框中标注上对应铁元素的价态。
3、能否回顾与铁单质有关的物化性质,相关化学反应写出其化学方程式?
银白色固体,有金属光泽,导电、导热、延展性好,能被磁铁吸引
Fe3+
Fe2O3
Fe(OH)3
Fe2+
Fe
Fe(OH)2
FeO、Fe3O4
“铁五环”填充
黑色粉末,不溶于水。可以用作色素,如用于瓷器制作中使釉呈绿色。
具有磁性的黑色固体,俗称:磁性氧化铁,是一种常用的磁性材料。
红棕色粉末,不溶于水。常用作油漆、涂料、油墨的红色颜料,俗称:铁红
物质类别
单质
氧化物
碱
盐
02
+2
+3
铁的化学性质
非金属单质
非氧化性酸
盐溶液
铁
水?
与盐酸:
②与氯气:
点燃
2Fe + 3Cl2 2FeCl3
Fe + 2H+ Fe2++ H2↑
①与硫酸铜溶液:
Fe + 2Fe3+ 3Fe2+
②与三氯化铁溶液
3Fe + 2O2 Fe3O4
点燃
①与氧气:
Fe + Cu2+ Fe2++ Cu
冷水或热水不反应
铁单质
实验装置 实验现象 实验结论
肥皂液中有气泡产生,用火柴点燃气泡,____ ________ 铁和水蒸气反应生成H2,化学方程式:___________
______________
铁和水蒸气的反应(课本P89)
爆鸣声
3Fe+4H2O(g)
听到
知识支持:肥皂液在该实验中可以起到“收集”氢气的作用。
铁单质
小结
铁
Fe
非金属单质
盐酸、稀硫酸
盐溶液
水
2Fe + 3Cl2 2FeCl3
点燃
3Fe + 2O2 Fe3O4
点燃
Fe + 2H+ Fe2++ H2↑
Fe + Cu2+ Fe2++ Cu
Fe + 2Fe3+ 3Fe2+
3Fe + 4H2O(g) Fe3O4 + 4H2
高温
铁单质
快速完成导学案【课堂检测】1、2T
探究
思考
铁氧化物、铁氢氧化物都有哪些化学性质呢?能否通过实验验证一下呢?
01.预测物质的性质
从物质类别和氧化还原角度
02.设计实验
说明选择的试剂及选择的理由
03.推测现象
推测可能出现的实验现象
FeO粉末
Fe2O3粉末
Fe3O4粉末
FeSO4粉末
Fe2(SO4)3粉末
稀硫酸溶液
稀氢氧化钠溶液
实验1:探究铁氧化物的性质
实验2:探究铁氢氧化物的制备方法
实验3:探究铁氢氧化物的性质
实验探究
先独立思考问题,后组内交流,小组代表分享观点
实验探究
预测 角度 实验 目的 代表 物质 选取 试剂 预测 现象 实验 现象 离子方程式及结论
物质 类别 铁氧化物的性质 Fe2O3 稀硫酸溶液 Fe2O3粉末 固体溶解,形成黄色溶液
物质类别氧化还原 铁氢氧化物的制备 Fe(OH)2 Fe(OH)3
物质类别 氧化还原 铁氢氧化物的性质 Fe(OH)2 Fe(OH)3
实验探究
预测 角度 实验 目的 代表 物质 选取 试剂 预测 现象 实验 现象 实验结论
物质 类别 铁氧化物的性质 Fe2O3 稀硫酸溶液 Fe2O3粉末 固体溶解,形成黄色溶液
物质类别氧化还原 铁氢氧化物的制备 Fe(OH)2 Fe(OH)3 Fe2(SO4)3 FeSO4 NaOH溶液 产生白色/红褐色沉淀
物质类别 氧化还原 铁氢氧化物的性质 Fe(OH)2 Fe(OH)3 稀硫酸溶液 Fe(OH)2 Fe(OH)3 固体溶解,形成浅绿/黄色溶液
实验操作
1.安全提示: 药品不要沾到皮肤上
2.分工合作: 老师演示实验,同学观察并记录现象
3.试剂用量: 取新配制的FeSO4、Fe2(SO4)3溶液1ml
(约20滴)左右,NaOH溶液、H2SO4溶液3-5滴。
4.规范操作:滴加溶液时胶头滴管位置如图所示。
5.特别注意: 边加试剂边振荡
FeSO4
H2SO4溶液
NaOH溶液
实验探究
Fe2(SO4)3
H2SO4溶液
NaOH溶液
实验操作
实验现象
固体溶解产成黄色溶液
先产生红褐色沉淀,后沉淀溶解,产成黄色溶液
先产生白色沉淀,迅速变成灰绿色,最后变成红褐色;加酸后沉淀溶解,产成黄色溶液
Fe2O3可溶于酸
氢氧化铁可溶于酸
?
实验结论
实验探究
Fe2O3
H2SO4溶液
FeSO4
H2SO4溶液
NaOH溶液
Fe2(SO4)3
H2SO4溶液
NaOH溶液
迷津点拨
先产生白色沉淀,迅速变为灰绿色,最终变为红褐色
进一步验证Fe(Ⅱ)具有较强还原性
4Fe(OH)2+O2+2H2O=4Fe(OH)3
实验探究
讨论
思考
1.制备氢氧化亚铁应注意什么问题呢?
2.具体措施是什么呢?
3.能否根据提供的试剂和仪器来制备呢?
①新制备的亚铁盐溶液(现用现配)
②将溶解亚铁盐的蒸馏水煮沸,除去溶解在水中的氧气。
③将胶头滴管伸入亚铁盐溶液的液面下
④可在亚铁盐溶液液面上加上隔绝氧气的物质,如苯、植物油
知识支持
制备氢氧化亚铁应注意:(防止被氧化)
实验操作
1.安全提示: 药品不要沾到皮肤上
2.分工合作: 老师演示实验,同学观察并记录现象
3.试剂用量: 溶液3-5ml;固体1-2g
4.规范操作:制备新制FeSO4时应打开瓶塞,溶解结束后
立即将瓶塞盖上
5.特别注意: 将注射器针头深入液面以下
实验探究
无氧水、
硫酸亚铁粉末、
盛放在注射器中煮沸的NaOH溶液
——NaOH溶液
名称 氧化亚铁 氧化铁 四氧化三铁
化学式
俗称
颜色、状态
水溶性
铁的化合价
用途
+2
黑色粉末
红棕色粉末
黑色晶体
铁红
磁性氧化铁
都不溶于水
+3
+2 、+3
磁铁
冶炼铁的原料
涂料、红色油漆、
FeO
Fe2O3
Fe3O4
与盐酸反应
Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O
FeO + 2H+ = Fe2+ + H2O
Fe2O3 + 6H+= 2Fe3+ + 3H2O
知识整合
与还原剂反应
Fe3O4 +4CO = 3Fe + 4CO2
FeO + H2 = Fe+ H2O
2Al + Fe2O3 = 2Fe + Al2O3
高温
高温
高温
化学式 Fe(OH)2 Fe(OH)3
色态 白色固体
溶解性 难溶
稳定性
与O2反应
与硫酸反应
制备
不稳定,易被空气氧化
4Fe(OH)2+2H2O+O2=4Fe(OH)3
红褐色固体
难溶
Fe(OH)2+2H+ = Fe2+ +2H2O
Fe(OH)3 + 3H+ = Fe3+ +3H2O
Fe2++2OH-=Fe(OH)2↓
Fe3++3OH- = Fe(OH)3↓
2Fe(OH)3=Fe2O3+3H2O
▲
知识整合
非氧化性酸
热稳定性差(难溶性碱)
Fe3+
Fe2O3
Fe(OH)3
Fe2+
Fe
Fe(OH)2
FeO、Fe3O4
“铁五环”小结
物质类别
单质
氧化物
碱
盐
02
+2
+3
均体现0价铁单质的还原性
可被还原剂H2、CO、Al等还原
非氧化性酸
非金属单质、酸、盐溶液、水
只有还原性
只有氧化性
既有还原性
又有氧化性
可被O2等氧化剂氧化
含有相同价态铁元素的物质之间的转化,利用复分解反应实现。
含有不同价态铁元素的物质之间的转化,利用氧化还原反应实现。
这种思想将贯穿整个元素化合物的学习!
谢
谢
配
合
