化学人教版(2019)必修第二册5.3无机非金属材料(共36张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.3无机非金属材料(共36张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 36.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-16 08:19:01 | ||
图片预览







文档简介
(共36张PPT)
第五章第三节
无机非金属材料
学习任务1:学习硅酸盐产品的类别、原料、组成、应用
1、阅读教材19页内容,学习交流以下两点:
(1)传统无机非金属材料指什么?包括哪些类别的物质?
(2)学习“资料卡片”,学习硅酸盐的结构,思考、讨论:硅酸盐材料有什么特点?是由什么结构特点决定的?
一、硅酸盐材料
陶瓷
玻璃
水泥
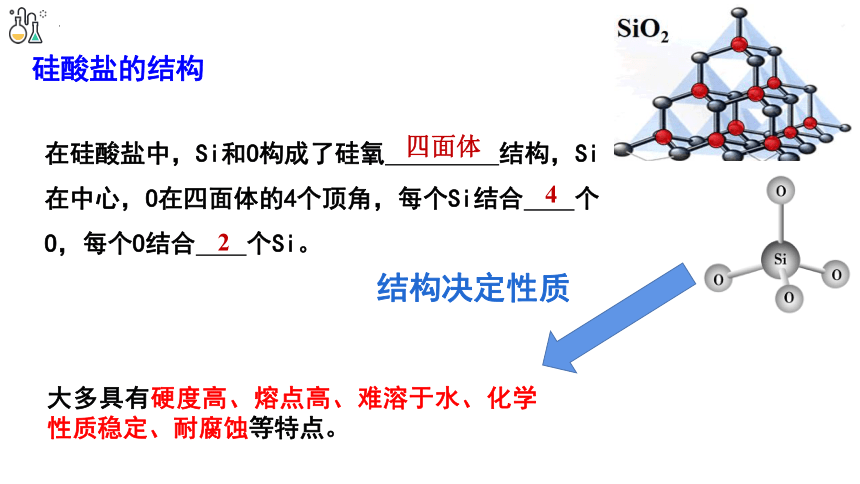
硅酸盐的结构
在硅酸盐中,Si和O构成了硅氧 结构,Si在中心,O在四面体的4个顶角,每个Si结合 个O,每个O结合 个Si。
2
大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点。
四面体
4
结构决定性质
学习任务1:学习硅酸盐产品的类别、原料、组成、应用
2、阅读教材20—21页中陶瓷、玻璃和水泥的相关内容,讨论、对比它们各自的原料、主要成分及用途。
产品 原料 制取设备 主要成分 用途
陶瓷 _______ _______ 含水的铝硅酸盐
玻璃 _______ _______ _______
水泥 _______ _______ 硅酸三钙(3CaO·SiO2)、硅酸二钙(2CaO·SiO2)、铝酸三钙(3CaO·Al2O3)
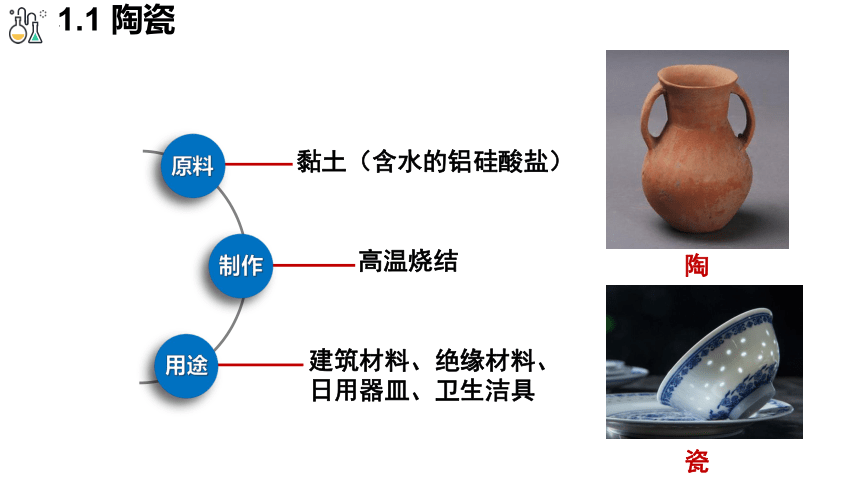
1.1 陶瓷
黏土(含水的铝硅酸盐)
原料
制作
用途
高温烧结
建筑材料、绝缘材料、日用器皿、卫生洁具
陶
瓷
1
2
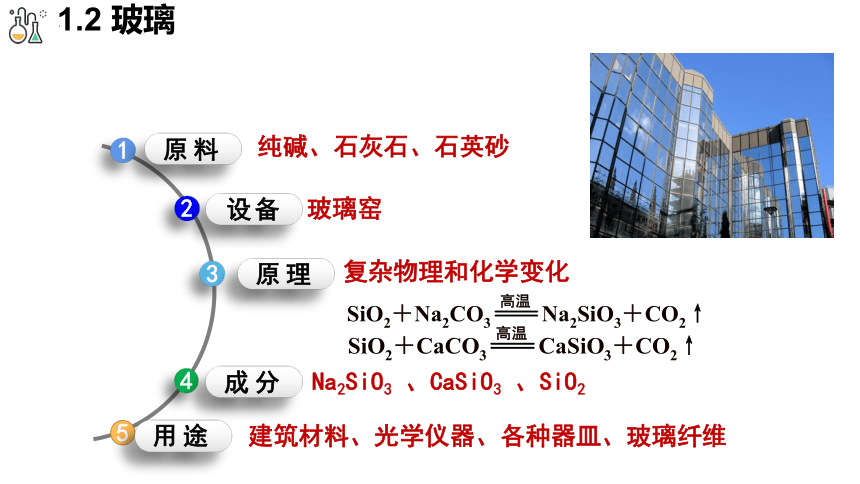
原料
设备
纯碱、石灰石、石英砂
玻璃窑
3
原理
复杂物理和化学变化
4
成分
Na2SiO3 、CaSiO3 、SiO2
1.2 玻璃
5
用途
建筑材料、光学仪器、各种器皿、玻璃纤维
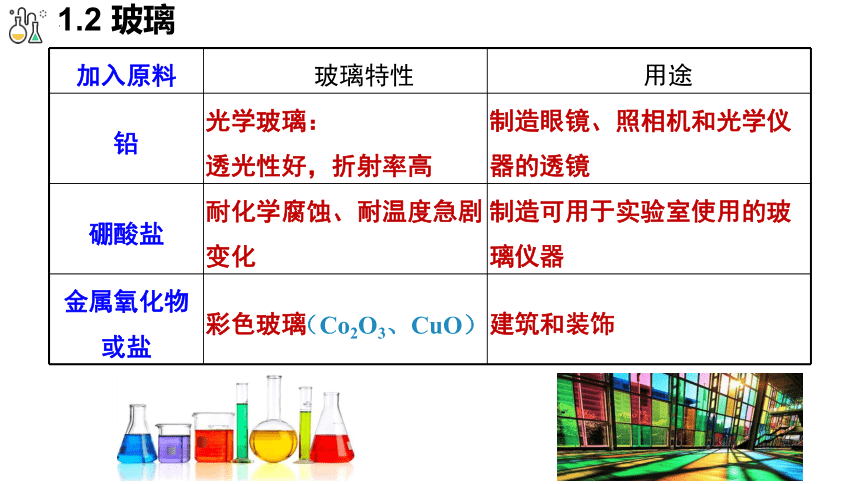
加入原料 玻璃特性 用途
铅 光学玻璃: 透光性好,折射率高 制造眼镜、照相机和光学仪器的透镜
硼酸盐 耐化学腐蚀、耐温度急剧变化 制造可用于实验室使用的玻璃仪器
金属氧化物或盐 彩色玻璃 建筑和装饰
(Co2O3、CuO)
1.2 玻璃
1.3 水泥
1
2
3
原料
原理
设备
黏土、石灰石
复杂的物理、化学变化
水泥回转窑
4
6
石膏
混凝土
条件
5
高温煅烧
调节水泥硬化速率
水泥、沙子、碎石和水
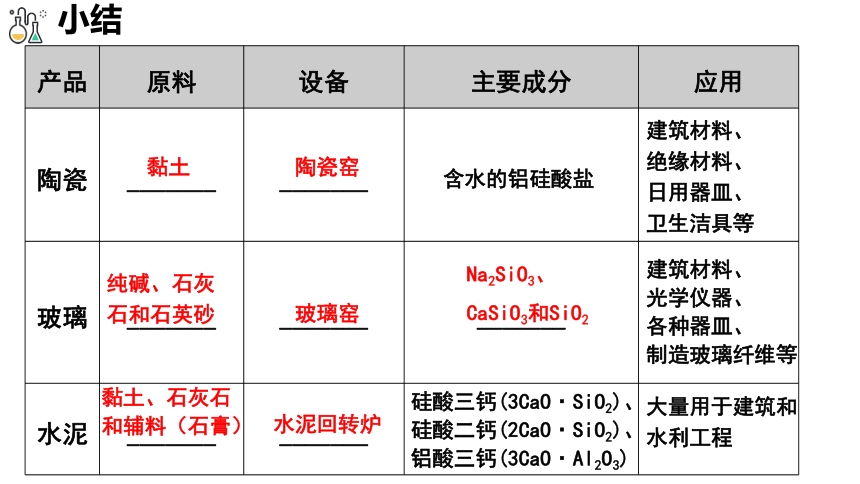
产品 原料 设备 主要成分 应用
陶瓷 _______ _______ 含水的铝硅酸盐
玻璃 _______ _______ _______
水泥 _______ _______ 硅酸三钙(3CaO·SiO2)、硅酸二钙(2CaO·SiO2)、铝酸三钙(3CaO·Al2O3)
黏土
建筑材料、
绝缘材料、
日用器皿、
卫生洁具等
纯碱、石灰石和石英砂
Na2SiO3、
CaSiO3和SiO2
建筑材料、
光学仪器、
各种器皿、
制造玻璃纤维等
黏土、石灰石和辅料(石膏)
大量用于建筑和
水利工程
小结
陶瓷窑
玻璃窑
水泥回转炉
(1)硅酸盐是由硅、氧和金属组成的混合物( )
(2)硅酸盐结构较为复杂,大多不溶于水,化学性质很稳定( )
(3)水泥与玻璃的共同原料是石灰石,水泥与陶瓷的共同原料是黏土( )
(4)陶瓷、玻璃、水泥的生产都需要在高温下进行( )
(5)玻璃和水泥生产中都发生复杂的物理和化学变化( )
【判断正误】
×
√
√
√
√
二、新型无机非金属材料
高纯度的含硅元素:
单晶硅、二氧化硅等,具有特殊的光学和电学性能。
含碳、氮等其他元素:
在航天、能源和医疗等领域广泛应用。
学习任务2:学习新型无机非金属材料
1、阅读教材21—22页中硅和二氧化硅的相关内容。讨论以下问题:
(1)描述硅在周期表中的位置,讨论硅的导电性和硅为什么是应用最广泛的半导体材料。
(2)硅在自然界中以什么形式存在?如何制备粗硅?为什么除去晶体硅中的杂质制成高纯硅?
(3)学习资料卡片“高纯硅的制备”,结合反应原理,想一想反应生成的氢气和氯化氢是否可以循环利用。
(4)高纯硅有哪些用途?
(5)二氧化硅有什么用途?
2.1 硅和二氧化硅
(1)硅元素的结构与存在
翻看元素周期表,找出硅元素的位置,画出其原子结构示意图,并与碳原子比较。
第三周期、第IVA族,处于金属和非金属的分界线位置
硅单质的导电性介于导体和绝缘体之间,是应用最为广泛的半导体材料。
C
Si
学习任务2:学习新型无机非金属材料
1、阅读教材21—22页中硅和二氧化硅的相关内容。讨论以下问题:
(1)描述硅在周期表中的位置,讨论硅的导电性和硅为什么是应用最广泛的半导体材料。
(2)硅在自然界中以什么形式存在?如何制备粗硅?为什么除去晶体硅中的杂质制成高纯硅?
(3)学习资料卡片“高纯硅的制备”,结合反应原理,想一想反应生成的氢气和氯化氢是否可以循环利用。
(4)高纯硅有哪些用途?
(5)二氧化硅有什么用途?
硅元素含量在地壳中居 。
硅是亲氧元素,在自然界中没有游离态,主要以 和 的形式存在。
硅酸盐矿石
水晶
玛瑙
2.1 硅和二氧化硅
(1)硅元素的结构与存在
第二位
硅酸盐
氧化物
硅单质的物理性质:
①灰黑色,有金属光泽的固体
②硅的结构类似于金刚石,
熔、沸点高,硬度大
(2)单质硅的工业制备
2.1 硅和二氧化硅
石英砂
粗硅
SiHCl3
1800-2000℃
焦炭
300℃HCl
高纯硅
1100℃
H2
涉及的主要化学反应:
①SiO2+2C Si(粗)+2CO↑
②Si+3HCl SiHCl3+H2
③SiHCl3+H2 Si(纯)+3HCl
98%
三氯硅烷
思考:工业上利用焦炭与SiO2在高温下反应制备粗硅,由此能否说明碳的还原性大于硅?
提示:氧化性、还原性的强弱,必须是在通常的情况下发生的反应,上述反应是在高温条件下发生的,故不能比较还原性的强弱。
①
②
③
学习任务2:学习新型无机非金属材料
1、阅读教材21—22页中硅和二氧化硅的相关内容。讨论以下问题:
(1)描述硅在周期表中的位置,讨论硅的导电性和硅为什么是应用最广泛的半导体材料。
(2)硅在自然界中以什么形式存在?如何制备粗硅?为什么除去晶体硅中的杂质制成高纯硅?
(3)学习资料卡片“高纯硅的制备”,结合反应原理,想一想反应生成的氢气和氯化氢是否可以循环利用。
(4)高纯硅有哪些用途?
(5)二氧化硅有什么用途?
(3)单质硅的用途
集成电路的芯片
晶体管
Si导电性介于导体和半导体之间,是良好的半导体材料,是 技术和 技术的关键材料。
硅太阳能电池
CPU
2.1 硅和二氧化硅
信息
新能源
(4)二氧化硅
(1)存在形式
硅藻土
石英、水晶、玛瑙、沙子
结晶形:
无定形:
统称硅石
(2)空间构型:硅氧四面体(空间网状)
熔沸点高、硬度大、不溶于水
(3)物理性质:
(5)用途:
(4)化学性质:稳定、不活泼
生产 、石英坩埚、玻璃仪器等
2.1 硅和二氧化硅
光导纤维
学习任务2:学习新型无机非金属材料
2、阅读教材23页的相关内容。讨论以下问题:
(1)为什么碳化硅陶瓷的硬度很大?碳化硅有哪些用途?
(2)阅读“科学.技术.社会”,还有哪些新型陶瓷?分别有哪些成分、性能和用途?
2.2 新型陶瓷
和 通过共价键连接
结构:
性能
砂纸和砂轮的磨料
SiC
碳化硅
(金刚砂)
高温抗氧化性能
硬度大
耐高温结构材料
耐高温半导体材料
新型陶瓷在组成上不再限于传统的硅酸盐体系,在 等方面有很多新的特性和功能。
光学、热学、电学、磁学
碳原子
硅原子
类别 成分 性能 应用
高温 结构陶瓷
压电陶瓷
透明陶瓷
超导陶瓷
SiC Si3N4
某些金属氧化物
耐高温、抗氧化、耐腐蚀
火箭发动机、高温电极材料
钛酸盐、锆酸盐
实现机械能与电能的相互转化
滤波器、扬声器、点火器
氧化铝、氧化钇
氮化铝、氟化钙
优异的光学性能、耐高温,绝缘性好
高压钠灯、激光器、高温探测窗
某临界温度下电阻为零,超导性
电力、交通、医疗
2.2 新型陶瓷
资料卡片
YBa2Cu3O7-δ,Bi2Sr2Ca2Cu3O10,Tl2Ba2Ca2Cu3O10
学习活动2:学习新型无机非金属材料
3、阅读教材23—24页中纳米材料的相关内容,讨论以下内容:
(1)什么是富勒烯?富勒烯的代表物是什么?
(2)碳纳米管结构特点是什么?有哪些用途?
(3)石墨烯的结构特点是什么?具有什么性质?有哪些用途?
2.3 碳纳米材料
碳纳米材料
富勒烯
碳纳米管
由 构成的一系列笼形分子的总称,开启了碳纳米材料研究和应用的新时代
由 卷成的管状物
有相当高的 和优良的 ,可用于生产复合材料、电池和传感器等。
石墨烯
厚度的单层石墨
电阻率 ,热导率 ,具有很高的强度;应用于光电器件、超级电容器、电池和复合材料等方面。
(代表物 )
碳原子
C60
石墨片层
只有一个碳原子直径
强度
电学性能
低
高
1.氢氟酸是HF的水溶液,可与SiO2发生反应生成SiF4气体和H2O。请写出该反应的化学方程式。想一想,为什么可以用氢氟酸溶蚀玻璃生产磨砂玻璃?
SiO2+4HF=SiF4↑+2H2O
拓展学习
2.SiO2可与强碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物是否正确
不正确。因为二氧化硅跟氢氟酸反应产物不是盐和水,所以不属于两性氧化物,但是属于酸性氧化物。
思考与交流:
氢氟酸是唯一 一种能和SiO2反应的酸
实验室不用玻璃瓶盛装氢氟酸,应该用 盛装
塑料瓶
SiO2+2NaOH = Na2SiO3+H2O
SiO2+CaO = CaSiO3
高温
3.实验室盛NaOH溶液的试剂瓶为什么用橡胶塞不用玻璃塞?
Na2SiO3的水溶液俗称水玻璃,具有黏结力强、耐高温等特性,可以用作黏合剂和防火剂。
NaOH溶液能与玻璃中的SiO2反应生成 Na2SiO3,硅酸钠水溶液有粘性,使瓶塞部分粘结而无法打开。因此盛装NaOH溶液的试剂瓶不能用玻璃塞而要用橡胶塞。
注意:不能用磨口玻璃塞盛碱性溶液,
如NaOH、KOH、Na2CO3、Na2SiO3溶液等
SiO2 + 2NaOH = Na2SiO3 +H2O
拓展学习
1.二氧化硅是酸性氧化物,但是SiO2不能与水直接化合成H2SiO3,那如何制备H2SiO3呢?
SiO2不溶于水,所以硅酸是通过可溶性硅酸盐与酸反应制得的,如:
2.如何以SiO2为主要原料制取硅酸 写出反应的化学方程式。
SiO2+2NaOH=Na2SiO3+H2O
Na2SiO3+2HCl=H2SiO3↓+2NaCl
拓展提升
酸性:碳酸>硅酸
CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3
Na2SiO3+2HCl=H2SiO3↓+2NaCl
首先制备出可溶性硅酸盐
硅酸脱水后可制得硅胶,可作为干燥剂及催化剂载体。
探究:如何设计实验证明H2CO3的酸性大于H2SiO3
盐酸
CaCO3
Na2SiO3溶液
【思考】1、这个装置能否证明非金属性:C>Si ?
那能否证明非金属性:Cl>C>Si ?
饱和NaHCO3溶液
2、写出试管中的离子方程式:
SiO32-+CO2 (少量)+H2O=H2SiO3 ↓+CO32-
能
不能
分类—酸性氧化物
价态—最高价(氧化性)
特性—与氢氟酸反应
SiO2
SiO2+2C===Si+2CO↑
高温
SiO2+4HF=SiF4↑+2H2O
二氧化硅的化学性质
SiO2+2NaOH==Na2SiO3+H2O
SiO2+CaO===CaSiO3
高温
SiO2+Na2CO3 === Na2SiO3+CO2
高温
用途:光导纤维、石英坩埚、水晶饰品、玛瑙饰品
归纳总结
1、 盛放下列试剂的试剂瓶能用磨口玻璃塞的是( )
A. 氢氧化钠溶液 B. 盐酸
C. 硅酸钠溶液 D. 氢氟酸
B
当堂检测
2、要除去SiO2中混有的少量CaO杂质,最适宜的试剂是( )
A.纯碱溶液 B.盐酸
C.硫酸 D.苛性钠溶液
3、下列物质的变化,不能通过一步化学反应完成的是( )
A.CO2→H2CO3 B.SiO2→Na2SiO3
C.Na2O→Na2CO3 D.SiO2→H2SiO3
B
D
1.硅在无机非金属材料中一直扮演着重要角色,被誉为无机非金属材料的主角。下列物品的制造用到硅单质的是( )
A.玻璃制品 B.石英钟表
C.计算机芯片 D.光导纤维
√
课堂达标
2.下列有关水泥的说法不正确的是( )
A.制造水泥的主要原料是石灰石、纯碱和黏土
B.普通水泥的主要成分是钙的硅酸盐和铝酸盐
C.石膏可以调节水泥硬化速率
D.混凝土由水泥、沙子和碎石等与水混合而得
√
课堂达标
√
4.我国科学家合成的3 nm长的管状碳纳米管,长度居世界之首。这种碳纤维具有强度高、刚度(抵抗变形的能力)高、密度小(只有钢的1/4)、熔点高、化学稳定性好的特点,因此被称为“超级纤维”。下列对碳纤维的说法中不正确的是( )
A.它是制造飞机的理想材料 B.它的主要组成元素是碳元素
C.它的结构与石墨相似 D.碳纤维复合材料耐高温
解析:石墨的内部结构是层状的,碳纳米管是管状的。
√
课堂达标
课堂达标
5.开发新材料是现代科技发展的方向之一。下列有关材料的说法正确的是( )
A.石墨烯是新型无机非金属材料
B.纳米材料属于胶体
C.硅酸盐材料只含有非金属元素
D.二氧化硅常用作人造卫星的太阳能电池
√
6.下列材料与其主要成分对应关系错误的是( )
A.漂白粉的有效成分为Ca(ClO)2
B.计算机芯片的主要成分为硅
C.水泥的主要成分为硅酸盐
D.水玻璃的主要成分是二氧化硅
√
7.当航天飞机返回地球大气层时,由于与空气的剧烈摩擦,飞机尖端的温度可达1 000 ℃以上,为了防止高温将其烧毁,科学家给航天飞机的相应部位安装了可靠的保护层。制作保护层的材料是( )
A.塑料 B.玻璃
C.新型陶瓷 D.镁铝合金
解析:制作保护层的材料应该硬度很大,且具有优异的高温抗氧化性
能,只有C项符合要求。
√
课堂达标
第五章第三节
无机非金属材料
学习任务1:学习硅酸盐产品的类别、原料、组成、应用
1、阅读教材19页内容,学习交流以下两点:
(1)传统无机非金属材料指什么?包括哪些类别的物质?
(2)学习“资料卡片”,学习硅酸盐的结构,思考、讨论:硅酸盐材料有什么特点?是由什么结构特点决定的?
一、硅酸盐材料
陶瓷
玻璃
水泥
硅酸盐的结构
在硅酸盐中,Si和O构成了硅氧 结构,Si在中心,O在四面体的4个顶角,每个Si结合 个O,每个O结合 个Si。
2
大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点。
四面体
4
结构决定性质
学习任务1:学习硅酸盐产品的类别、原料、组成、应用
2、阅读教材20—21页中陶瓷、玻璃和水泥的相关内容,讨论、对比它们各自的原料、主要成分及用途。
产品 原料 制取设备 主要成分 用途
陶瓷 _______ _______ 含水的铝硅酸盐
玻璃 _______ _______ _______
水泥 _______ _______ 硅酸三钙(3CaO·SiO2)、硅酸二钙(2CaO·SiO2)、铝酸三钙(3CaO·Al2O3)
1.1 陶瓷
黏土(含水的铝硅酸盐)
原料
制作
用途
高温烧结
建筑材料、绝缘材料、日用器皿、卫生洁具
陶
瓷
1
2
原料
设备
纯碱、石灰石、石英砂
玻璃窑
3
原理
复杂物理和化学变化
4
成分
Na2SiO3 、CaSiO3 、SiO2
1.2 玻璃
5
用途
建筑材料、光学仪器、各种器皿、玻璃纤维
加入原料 玻璃特性 用途
铅 光学玻璃: 透光性好,折射率高 制造眼镜、照相机和光学仪器的透镜
硼酸盐 耐化学腐蚀、耐温度急剧变化 制造可用于实验室使用的玻璃仪器
金属氧化物或盐 彩色玻璃 建筑和装饰
(Co2O3、CuO)
1.2 玻璃
1.3 水泥
1
2
3
原料
原理
设备
黏土、石灰石
复杂的物理、化学变化
水泥回转窑
4
6
石膏
混凝土
条件
5
高温煅烧
调节水泥硬化速率
水泥、沙子、碎石和水
产品 原料 设备 主要成分 应用
陶瓷 _______ _______ 含水的铝硅酸盐
玻璃 _______ _______ _______
水泥 _______ _______ 硅酸三钙(3CaO·SiO2)、硅酸二钙(2CaO·SiO2)、铝酸三钙(3CaO·Al2O3)
黏土
建筑材料、
绝缘材料、
日用器皿、
卫生洁具等
纯碱、石灰石和石英砂
Na2SiO3、
CaSiO3和SiO2
建筑材料、
光学仪器、
各种器皿、
制造玻璃纤维等
黏土、石灰石和辅料(石膏)
大量用于建筑和
水利工程
小结
陶瓷窑
玻璃窑
水泥回转炉
(1)硅酸盐是由硅、氧和金属组成的混合物( )
(2)硅酸盐结构较为复杂,大多不溶于水,化学性质很稳定( )
(3)水泥与玻璃的共同原料是石灰石,水泥与陶瓷的共同原料是黏土( )
(4)陶瓷、玻璃、水泥的生产都需要在高温下进行( )
(5)玻璃和水泥生产中都发生复杂的物理和化学变化( )
【判断正误】
×
√
√
√
√
二、新型无机非金属材料
高纯度的含硅元素:
单晶硅、二氧化硅等,具有特殊的光学和电学性能。
含碳、氮等其他元素:
在航天、能源和医疗等领域广泛应用。
学习任务2:学习新型无机非金属材料
1、阅读教材21—22页中硅和二氧化硅的相关内容。讨论以下问题:
(1)描述硅在周期表中的位置,讨论硅的导电性和硅为什么是应用最广泛的半导体材料。
(2)硅在自然界中以什么形式存在?如何制备粗硅?为什么除去晶体硅中的杂质制成高纯硅?
(3)学习资料卡片“高纯硅的制备”,结合反应原理,想一想反应生成的氢气和氯化氢是否可以循环利用。
(4)高纯硅有哪些用途?
(5)二氧化硅有什么用途?
2.1 硅和二氧化硅
(1)硅元素的结构与存在
翻看元素周期表,找出硅元素的位置,画出其原子结构示意图,并与碳原子比较。
第三周期、第IVA族,处于金属和非金属的分界线位置
硅单质的导电性介于导体和绝缘体之间,是应用最为广泛的半导体材料。
C
Si
学习任务2:学习新型无机非金属材料
1、阅读教材21—22页中硅和二氧化硅的相关内容。讨论以下问题:
(1)描述硅在周期表中的位置,讨论硅的导电性和硅为什么是应用最广泛的半导体材料。
(2)硅在自然界中以什么形式存在?如何制备粗硅?为什么除去晶体硅中的杂质制成高纯硅?
(3)学习资料卡片“高纯硅的制备”,结合反应原理,想一想反应生成的氢气和氯化氢是否可以循环利用。
(4)高纯硅有哪些用途?
(5)二氧化硅有什么用途?
硅元素含量在地壳中居 。
硅是亲氧元素,在自然界中没有游离态,主要以 和 的形式存在。
硅酸盐矿石
水晶
玛瑙
2.1 硅和二氧化硅
(1)硅元素的结构与存在
第二位
硅酸盐
氧化物
硅单质的物理性质:
①灰黑色,有金属光泽的固体
②硅的结构类似于金刚石,
熔、沸点高,硬度大
(2)单质硅的工业制备
2.1 硅和二氧化硅
石英砂
粗硅
SiHCl3
1800-2000℃
焦炭
300℃HCl
高纯硅
1100℃
H2
涉及的主要化学反应:
①SiO2+2C Si(粗)+2CO↑
②Si+3HCl SiHCl3+H2
③SiHCl3+H2 Si(纯)+3HCl
98%
三氯硅烷
思考:工业上利用焦炭与SiO2在高温下反应制备粗硅,由此能否说明碳的还原性大于硅?
提示:氧化性、还原性的强弱,必须是在通常的情况下发生的反应,上述反应是在高温条件下发生的,故不能比较还原性的强弱。
①
②
③
学习任务2:学习新型无机非金属材料
1、阅读教材21—22页中硅和二氧化硅的相关内容。讨论以下问题:
(1)描述硅在周期表中的位置,讨论硅的导电性和硅为什么是应用最广泛的半导体材料。
(2)硅在自然界中以什么形式存在?如何制备粗硅?为什么除去晶体硅中的杂质制成高纯硅?
(3)学习资料卡片“高纯硅的制备”,结合反应原理,想一想反应生成的氢气和氯化氢是否可以循环利用。
(4)高纯硅有哪些用途?
(5)二氧化硅有什么用途?
(3)单质硅的用途
集成电路的芯片
晶体管
Si导电性介于导体和半导体之间,是良好的半导体材料,是 技术和 技术的关键材料。
硅太阳能电池
CPU
2.1 硅和二氧化硅
信息
新能源
(4)二氧化硅
(1)存在形式
硅藻土
石英、水晶、玛瑙、沙子
结晶形:
无定形:
统称硅石
(2)空间构型:硅氧四面体(空间网状)
熔沸点高、硬度大、不溶于水
(3)物理性质:
(5)用途:
(4)化学性质:稳定、不活泼
生产 、石英坩埚、玻璃仪器等
2.1 硅和二氧化硅
光导纤维
学习任务2:学习新型无机非金属材料
2、阅读教材23页的相关内容。讨论以下问题:
(1)为什么碳化硅陶瓷的硬度很大?碳化硅有哪些用途?
(2)阅读“科学.技术.社会”,还有哪些新型陶瓷?分别有哪些成分、性能和用途?
2.2 新型陶瓷
和 通过共价键连接
结构:
性能
砂纸和砂轮的磨料
SiC
碳化硅
(金刚砂)
高温抗氧化性能
硬度大
耐高温结构材料
耐高温半导体材料
新型陶瓷在组成上不再限于传统的硅酸盐体系,在 等方面有很多新的特性和功能。
光学、热学、电学、磁学
碳原子
硅原子
类别 成分 性能 应用
高温 结构陶瓷
压电陶瓷
透明陶瓷
超导陶瓷
SiC Si3N4
某些金属氧化物
耐高温、抗氧化、耐腐蚀
火箭发动机、高温电极材料
钛酸盐、锆酸盐
实现机械能与电能的相互转化
滤波器、扬声器、点火器
氧化铝、氧化钇
氮化铝、氟化钙
优异的光学性能、耐高温,绝缘性好
高压钠灯、激光器、高温探测窗
某临界温度下电阻为零,超导性
电力、交通、医疗
2.2 新型陶瓷
资料卡片
YBa2Cu3O7-δ,Bi2Sr2Ca2Cu3O10,Tl2Ba2Ca2Cu3O10
学习活动2:学习新型无机非金属材料
3、阅读教材23—24页中纳米材料的相关内容,讨论以下内容:
(1)什么是富勒烯?富勒烯的代表物是什么?
(2)碳纳米管结构特点是什么?有哪些用途?
(3)石墨烯的结构特点是什么?具有什么性质?有哪些用途?
2.3 碳纳米材料
碳纳米材料
富勒烯
碳纳米管
由 构成的一系列笼形分子的总称,开启了碳纳米材料研究和应用的新时代
由 卷成的管状物
有相当高的 和优良的 ,可用于生产复合材料、电池和传感器等。
石墨烯
厚度的单层石墨
电阻率 ,热导率 ,具有很高的强度;应用于光电器件、超级电容器、电池和复合材料等方面。
(代表物 )
碳原子
C60
石墨片层
只有一个碳原子直径
强度
电学性能
低
高
1.氢氟酸是HF的水溶液,可与SiO2发生反应生成SiF4气体和H2O。请写出该反应的化学方程式。想一想,为什么可以用氢氟酸溶蚀玻璃生产磨砂玻璃?
SiO2+4HF=SiF4↑+2H2O
拓展学习
2.SiO2可与强碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物是否正确
不正确。因为二氧化硅跟氢氟酸反应产物不是盐和水,所以不属于两性氧化物,但是属于酸性氧化物。
思考与交流:
氢氟酸是唯一 一种能和SiO2反应的酸
实验室不用玻璃瓶盛装氢氟酸,应该用 盛装
塑料瓶
SiO2+2NaOH = Na2SiO3+H2O
SiO2+CaO = CaSiO3
高温
3.实验室盛NaOH溶液的试剂瓶为什么用橡胶塞不用玻璃塞?
Na2SiO3的水溶液俗称水玻璃,具有黏结力强、耐高温等特性,可以用作黏合剂和防火剂。
NaOH溶液能与玻璃中的SiO2反应生成 Na2SiO3,硅酸钠水溶液有粘性,使瓶塞部分粘结而无法打开。因此盛装NaOH溶液的试剂瓶不能用玻璃塞而要用橡胶塞。
注意:不能用磨口玻璃塞盛碱性溶液,
如NaOH、KOH、Na2CO3、Na2SiO3溶液等
SiO2 + 2NaOH = Na2SiO3 +H2O
拓展学习
1.二氧化硅是酸性氧化物,但是SiO2不能与水直接化合成H2SiO3,那如何制备H2SiO3呢?
SiO2不溶于水,所以硅酸是通过可溶性硅酸盐与酸反应制得的,如:
2.如何以SiO2为主要原料制取硅酸 写出反应的化学方程式。
SiO2+2NaOH=Na2SiO3+H2O
Na2SiO3+2HCl=H2SiO3↓+2NaCl
拓展提升
酸性:碳酸>硅酸
CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3
Na2SiO3+2HCl=H2SiO3↓+2NaCl
首先制备出可溶性硅酸盐
硅酸脱水后可制得硅胶,可作为干燥剂及催化剂载体。
探究:如何设计实验证明H2CO3的酸性大于H2SiO3
盐酸
CaCO3
Na2SiO3溶液
【思考】1、这个装置能否证明非金属性:C>Si ?
那能否证明非金属性:Cl>C>Si ?
饱和NaHCO3溶液
2、写出试管中的离子方程式:
SiO32-+CO2 (少量)+H2O=H2SiO3 ↓+CO32-
能
不能
分类—酸性氧化物
价态—最高价(氧化性)
特性—与氢氟酸反应
SiO2
SiO2+2C===Si+2CO↑
高温
SiO2+4HF=SiF4↑+2H2O
二氧化硅的化学性质
SiO2+2NaOH==Na2SiO3+H2O
SiO2+CaO===CaSiO3
高温
SiO2+Na2CO3 === Na2SiO3+CO2
高温
用途:光导纤维、石英坩埚、水晶饰品、玛瑙饰品
归纳总结
1、 盛放下列试剂的试剂瓶能用磨口玻璃塞的是( )
A. 氢氧化钠溶液 B. 盐酸
C. 硅酸钠溶液 D. 氢氟酸
B
当堂检测
2、要除去SiO2中混有的少量CaO杂质,最适宜的试剂是( )
A.纯碱溶液 B.盐酸
C.硫酸 D.苛性钠溶液
3、下列物质的变化,不能通过一步化学反应完成的是( )
A.CO2→H2CO3 B.SiO2→Na2SiO3
C.Na2O→Na2CO3 D.SiO2→H2SiO3
B
D
1.硅在无机非金属材料中一直扮演着重要角色,被誉为无机非金属材料的主角。下列物品的制造用到硅单质的是( )
A.玻璃制品 B.石英钟表
C.计算机芯片 D.光导纤维
√
课堂达标
2.下列有关水泥的说法不正确的是( )
A.制造水泥的主要原料是石灰石、纯碱和黏土
B.普通水泥的主要成分是钙的硅酸盐和铝酸盐
C.石膏可以调节水泥硬化速率
D.混凝土由水泥、沙子和碎石等与水混合而得
√
课堂达标
√
4.我国科学家合成的3 nm长的管状碳纳米管,长度居世界之首。这种碳纤维具有强度高、刚度(抵抗变形的能力)高、密度小(只有钢的1/4)、熔点高、化学稳定性好的特点,因此被称为“超级纤维”。下列对碳纤维的说法中不正确的是( )
A.它是制造飞机的理想材料 B.它的主要组成元素是碳元素
C.它的结构与石墨相似 D.碳纤维复合材料耐高温
解析:石墨的内部结构是层状的,碳纳米管是管状的。
√
课堂达标
课堂达标
5.开发新材料是现代科技发展的方向之一。下列有关材料的说法正确的是( )
A.石墨烯是新型无机非金属材料
B.纳米材料属于胶体
C.硅酸盐材料只含有非金属元素
D.二氧化硅常用作人造卫星的太阳能电池
√
6.下列材料与其主要成分对应关系错误的是( )
A.漂白粉的有效成分为Ca(ClO)2
B.计算机芯片的主要成分为硅
C.水泥的主要成分为硅酸盐
D.水玻璃的主要成分是二氧化硅
√
7.当航天飞机返回地球大气层时,由于与空气的剧烈摩擦,飞机尖端的温度可达1 000 ℃以上,为了防止高温将其烧毁,科学家给航天飞机的相应部位安装了可靠的保护层。制作保护层的材料是( )
A.塑料 B.玻璃
C.新型陶瓷 D.镁铝合金
解析:制作保护层的材料应该硬度很大,且具有优异的高温抗氧化性
能,只有C项符合要求。
√
课堂达标
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
