江西省吉安市遂川县中2022-2023学年高二上学期期末考试化学试题(含解析)
文档属性
| 名称 | 江西省吉安市遂川县中2022-2023学年高二上学期期末考试化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-16 10:41:50 | ||
图片预览


文档简介
遂川县中2022-2023学年高二上学期期末考试
化学试卷
一.单选题(每小题3分,共30分)
1.下列有关化学用语表示正确的是
A.中子数为10的氟原子:10F
B.钠基态原子的核外电子排布式:1s22s22p63s2
C.Mg2+的结构示意图:
D.2p3p4p能级轨道数目依次增多
2.下列说法正确的是
A.同一原子中,2p、3p、4p能级的轨道数依次增多
B.电子排布式(22Ti)1s22s22p63s23p10违反了能量最低原则
C.表示的原子能量处于最低状态
D.正三价阳离子的电子排布式为1s22s22p63s23p63d5的元素在周期表中位于Ⅷ族
3.下列表示正确的是
A.NH4Cl的电子式 B.N2H4的结构式:
C.CCl4的比例模型: D.N原子的结构示意图:
4.下列说法中不正确的是( )
A.分子有一个键,两个键
B.两个原子间形成的键比键重叠程度大,键形成的共价键强
C.两个原子间形成共价键时,最多有一个键
D.气体单质中,一定有键,可能有键
5.下列描述中正确的是
A.NO3-的空间构型为三角锥形
B.SiF4和SO32-的中心原子均为sp3杂化
C.在所有的元素中,氟的第一电离能最大
D.C2H5OH分子中共含有8个极性键,1个π键
6.下列分子中,属于含极性键的非极性分子的是
A.SO2 B.H2
C.BBr3 D.COCl2
7.下列说法正确的是
A.σ键和π键比例为7:1
B.SO3空间结构为三角锥形
C.配合物铁氰化钾K3[Fe(CN)6]中几种元素电离能由大到小的顺序是N>C>K>Fe
D.CO2分子中C和O原子之间的σ键是由C原子的sp杂化轨道与O原子的2p轨道重叠形成
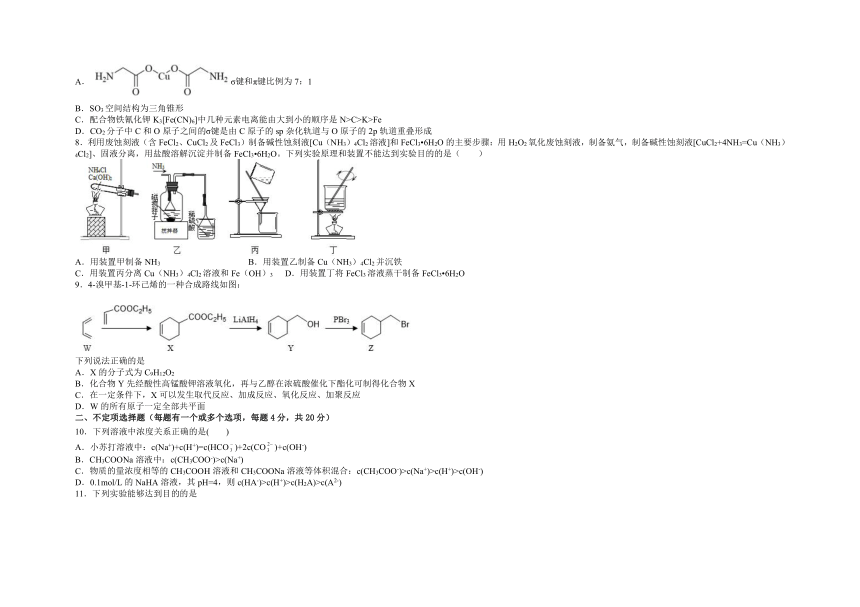
8.利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl3 6H2O的主要步骤:用H2O2氧化废蚀刻液,制备氨气,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl3 6H2O。下列实验原理和装置不能达到实验目的的是( )
A.用装置甲制备NH3 B.用装置乙制备Cu(NH3)4Cl2并沉铁
C.用装置丙分离Cu(NH3)4Cl2溶液和Fe(OH)3 D.用装置丁将FeCl3溶液蒸干制备FeCl3 6H2O
9.4 溴甲基 1 环己烯的一种合成路线如图:
下列说法正确的是
A.X的分子式为C9H12O2
B.化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化可制得化合物X
C.在一定条件下,X可以发生取代反应、加成反应、氧化反应、加聚反应
D.W的所有原子一定全部共平面
二、不定项选择题(每题有一个或多个选项,每题4分,共20分)
10.下列溶液中浓度关系正确的是()
A.小苏打溶液中:c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-)
B.CH3COONa溶液中:c(CH3COO-)>c(Na+)
C.物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.0.1mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
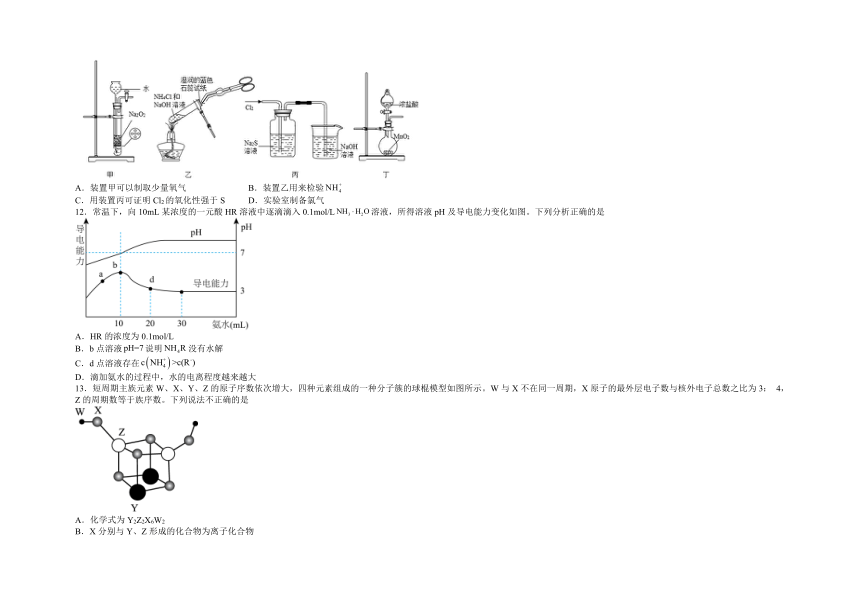
11.下列实验能够达到目的的是
A.装置甲可以制取少量氧气 B.装置乙用来检验
C.用装置丙可证明Cl2的氧化性强于S D.实验室制备氯气
12.常温下,向10mL某浓度的一元酸HR溶液中逐滴滴入0.1mol/L溶液,所得溶液pH及导电能力变化如图。下列分析正确的是
A.HR的浓度为0.1mol/L
B.b点溶液说明没有水解
C.d点溶液存在
D.滴加氨水的过程中,水的电离程度越来越大
13.短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素组成的一种分子簇的球棍模型如图所示。W与X不在同一周期,X原子的最外层电子数与核外电子总数之比为3: 4,Z的周期数等于族序数。下列说法不正确的是
A.化学式为Y2Z2X6W2
B.X分别与Y、Z形成的化合物为离子化合物
C.简单离子的半径: X> Y> Z
D.Y、Z的简单离子均可抑制水的电离
14.根据下列实验操作和现象所得到的结论不正确的是
选项 实验操作和现象 结论
A 向2mL0.1mol·L 1的FeCl3溶液中加入4mL0.1mol·L 1的KI溶液,充分反应后,分别取少量溶液于两支试管中,向其中一支试管中滴加几滴淀粉溶液,溶液变蓝,另一支试管中滴加几滴KSCN溶液,溶液变红 KI与FeCl3的反应是可逆反应
B 室温下,向0.1mol·L 1HCl溶液中加入少量镁粉,产生大量气泡,测得溶液温度上升 镁与盐酸反应放热
C 向盛有2mL0.1mol·L-1的硝酸银溶液的试管中滴加2滴0.1mol·L-1的氯化钠溶液,生成白色沉淀,再滴加2滴 0.1mol·L-1的碘化钾溶液,有黄色沉淀生成 Ksp(AgI)D 用pH试纸测得:CH3COONa溶液的pH约为9,NaHCO3溶液的pH约为10 CH3COOH电离出H+的能力比H2CO3强
A.A B.B C.C D.D
15.酒石酸(H2B)及其与OH-形成的微粒的浓度分数随溶液pH变化曲线如图(已知: 20℃时,Ksp(KHB)=3.8× 10-4, S(K2B)=100 g/L)。向25 mL 0.1 mol/L酒石酸溶液中,逐滴加入0.2mol/LKOH溶液,下列相关说法不正确的是
A.酒石酸的Ka2的数量级为10-3
B.pH=3, c(H2B)> c(HB- )>c(B2- )
C.pH越高,越有利于用酒石酸检验K+
D.V(KOH)=12.5 mL时,c(H2B)+c(HB- )+c(B2- )≈0.0195mol/L
三、填空题(共50分)
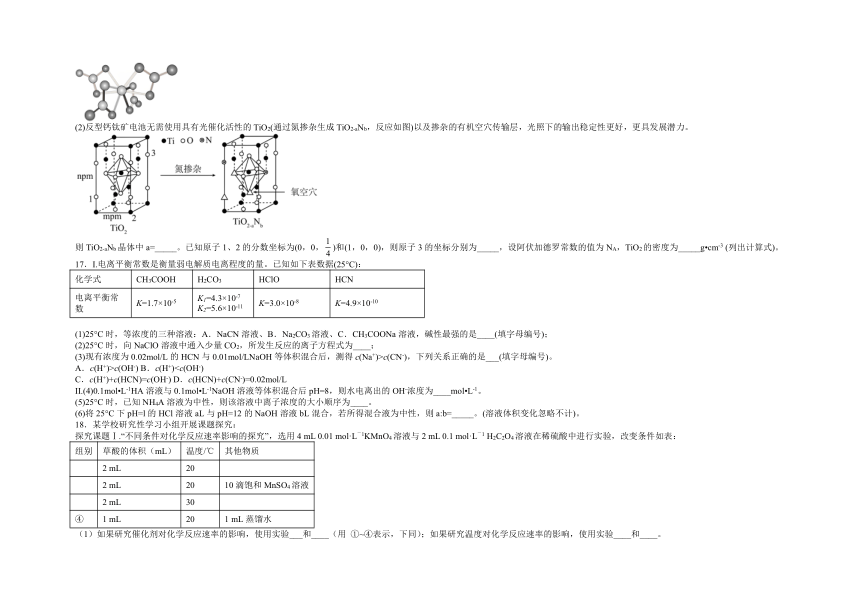
16.2022年2月我国科学家在《科学》杂志发表反型钙钛矿太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟新方向。
(1)Ti(H2O)中∠H-O-H_____(填“大于”、“小于”或“等于”)单个水分子中∠H-O-H;Ti(NO3)4的球棍结构如图,Ti的配位数是_____。
(2)反型钙钛矿电池无需使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
则TiO2-aNb晶体中a=_____。已知原子1、2的分数坐标为(0,0,)和(1,0,0),则原子3的坐标分别为_____,设阿伏加德罗常数的值为NA,TiO2的密度为_____g cm-3 (列出计算式)。
17.I.电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25°C):
化学式 CH3COOH H2CO3 HClO HCN
电离平衡常数 K=1.7×10-5 K1=4.3×10-7 K2=5.6×10-11 K=3.0×10-8 K=4.9×10-10
(1)25°C时,等浓度的三种溶液:A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液,碱性最强的是____(填字母编号);
(2)25°C时,向NaClO溶液中通入少量CO2,所发生反应的离子方程式为____;
(3)现有浓度为0.02mol/L的HCN与0.01mol/LNaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是___(填字母编号)。
A.c(H+)>c(OH-) B.c(H+)C.c(H+)+c(HCN)=c(OH-) D.c(HCN)+c(CN-)=0.02mol/L
II.(4)0.1mol L-1HA溶液与0.1mol L-1NaOH溶液等体积混合后pH=8,则水电离出的OH-浓度为____mol L-1。
(5)25°C时,已知NH4A溶液为中性,则该溶液中离子浓度的大小顺序为____。
(6)将25°C下pH=l的HCl溶液aL与pH=12的NaOH溶液bL混合,若所得混合液为中性,则a:b=_____。(溶液体积变化忽略不计)。
18.某学校研究性学习小组开展课题探究:
探究课题Ⅰ.“不同条件对化学反应速率影响的探究”,选用4 mL 0.01 mol·L-1KMnO4溶液与2 mL 0.1 mol·L-1 H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
组别 草酸的体积(mL) 温度/℃ 其他物质
2 mL 20
2 mL 20 10滴饱和MnSO4溶液
2 mL 30
④ 1 mL 20 1 mL蒸馏水
(1)如果研究催化剂对化学反应速率的影响,使用实验___和____(用 ①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验____和____。
(2)对比实验①和④,可以研究_____对化 学反应速率的影响,实验④中加入1 mL蒸馏水的目的是_____________________。
探究课题Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂?_______________(填“是”或“否”),请说明理由___________。
(2)滴定时用________(填a或b)滴定管盛装KMnO4标准溶液。
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为________________。
19.(1)在一定温度下,向体积固定的密闭容器中加入足量的和,起始压强为时,发生下列反应生成水煤气:
Ⅰ.
Ⅱ.
①下列说法正确的是_______;
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时,的转化率为,CO的物质的量为。此时,整个体系_______(填“吸收”或“放出”)热量_______kJ,反应Ⅰ的平衡常数_______(以分压表示,分压=总压×物质的量分数)。
(2)一种脱除和利用水煤气中方法的示意图如下:
①某温度下,吸收塔中溶液吸收一定量的后,,则该溶液的_______(该温度下的);
②再生塔中产生的离子方程式为_______;
③利用电化学原理,将电催化还原为,阴极反应式为_______。
1.C
【详解】A.氟的质子数为9,中子数为10的氟原子的质量数为19,该元素符号可以表示为:19F,故A错误;
B.钠是11号元素,核外电子排布式:1s22s22p63s1,故B错误;
C.镁离子是镁原子失去最外层的2个电子得到的,结构示意图为:,故C正确;
D.2p3p4p能级轨道数目相同,故D错误;
故选C。
2.D
【详解】A.2p、3p、4p能级都含有3个原子轨道,故A错误;
B.3p能级最多排6个电子,所以电子排布式(22Ti)1s22s22p63s23p10违反洪特规则和保利不相容原理,故B错误;
C.违反了洪特规则,故C错误;
D.某+3价离子的电子排布式为1s22s22p63s23p63d5,其原子核外电子数为23+3=26,为Fe元素,原子核外排布式为1s22s22p63s23p63d64s2,处于周期表中第4周期第Ⅷ族,故D正确;
故选D。
【点睛】本题考查原子核外电子的排布规律。根据构造原理确定核外电子排布式是否正确。①能量最低原理:原子核外电子先占有能量较低的轨道,然后依次进入能量较高的轨道;②泡利不相容原理:每个原子轨道上最多只能容纳 2个自旋状态相反的电子;③洪特规则:在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同。
3.B
【详解】A.NH4Cl是由铵根离子与氯离子构成,属于离子化合物,其电子式为:,A错误;
B.N2H4分子中各原子达到稳定结构,其电子式为:,B正确;
C.因原子半径:Cl>C,所以CCl4的比例模型为,C错误;
D.N原子核外电子数等于核内质子数,所以其结构示意图为:,D错误;
故选B。
4.D
【详解】A. N2分子中两个氮原子之间形成氮氮三键,有一个σ键,2个π键,故A正确,但不符合题意;
B.σ键是轴对称而π键是镜面对称,σ键是头碰头重叠,π键是肩并肩重叠,σ键比π键重叠程度大,形成的共价键强,故B正确,但不符合题意;
C. 根据杂化轨道理论,两个原子之间形成共价键时,最多有一个σ键,其余为π键,故C正确,但不符合题意;
D. 气体单质中,不一定形成σ键,如稀有气体分子为单原子分子,没有σ键,故D错误,符合题意。
故选:D。
5.B
【详解】A.硝酸根离子的空间构型为平面三角形,A项错误;B.SiF4中硅原子含有4个σ键且不含孤电子对,所以硅原子采用sp3杂化,SO32-中价层电子对个数=3+1/2(6+2 3×2)=4,所以硫原子为sp3杂化,B项正确;C.第一电离能最大的是零族元素的He,C项错误;D.乙醇分子中只有单键,没有双键和三键,所以没有π键,D项错误。答案选B。
6.C
【详解】A.SO2是角形结构,是含极性键的极性分子,A不符合题意;
B.H2属于含非极性键的非极性分子,B不符合题意;
C.BBr3是平面正三角形,是含极性键非极性分子,C符合题意;
D.COCl2是含极性键的极性分子,D不符合题意;
故选C。
7.D
【详解】A.双键中有1个σ键、1个π键,N-H单键、N-C单键、O-C单键、C-H单键,Cu-O单键均为σ键,所以σ键和π键比例为9:1,A错误;
B.SO3中心S原子的价层电子对数为=3,不含孤电子对,空间构型为平面三角形,B错误;
C.Fe的金属性比K弱,电离能大于K,C错误;
D.CO2分子中C原子采取sp杂化,C原子的sp杂化轨道与O原子的2p轨道重叠形成一个σ键,D正确;
综上所述答案为D。
8.D
【详解】A.实验室制备氨气,可用氢氧化钙、氯化铵在加热条件下进行,故A正确;
B.氨气易溶于水,注意防止倒吸,氨气与溶液反应生成Cu(NH3)4Cl2和氢氧化铁,故B正确;
C.分离固体和液体,可用过滤的方法,故C正确;
D.应在蒸发皿中蒸发,且避免氯化铁水解,更不能直接蒸干,故D错误;
故答案为D。
【点睛】考查物质制备实验设计、物质分离的实验基本操作,明确实验原理是解题关键,用H2O2氧化废蚀刻液,使亚铁离子生成铁离子,用甲装置制备氨气,生成的氨气通入乙装置,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2],用丙装置过滤分离,用盐酸溶解氢氧化铁沉淀,将溶液在蒸发皿中进行蒸发,且应通入氯化氢,防止铁离子水解,以达到制备FeCl3 6H2O的目的,注意把握物质性质的理解、物质分离提纯的方法。
9.C
【详解】A.由X的结构式可知,X的分子式为C9H14O2,故A错误;
B.化合物Y中含有碳碳双键和醇羟基,均能被酸性高锰酸钾溶液氧化,被酸性高锰酸钾溶液氧化时碳碳双键断裂,环状结构不复存在,所以化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化不能制得化合物X,故B错误;
C.X中含有碳碳双键,可以发生加成反应、氧化反应、加聚反应,含有酯基,可以发生水解(取代)反应,故C正确;
D.W为1,3-丁二烯,因位于2号碳原子和3号碳原子之间的碳碳单键可以旋转,所以W的所有原子可能全部共平面,故D错误;
答案选C。
10.AC
【详解】A.小苏打溶液中满足电荷守恒:c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-),A正确;
B.CH3COONa溶液中醋酸根水解:c(CH3COO-)<c(Na+),B错误;
C.物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合,溶液显酸性,醋酸的电离常数大于醋酸根离子的水解程度:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),C正确;
D.0.1mol/L的NaHA溶液,其pH=4,说明HA-的电离常数大于其水解程度,则c(HA-)>c(H+)>c(A2-)>c(H2A),D错误;
答案选AC。
11.C
【详解】A.该装置要求固体药品为块状,不溶于水,Na2O2是粉末状药剂,无法实现固液分离要求,不符题意;
B.检验NH3等碱性气体应使用湿润的红色石蕊试纸,检验试剂错误,不符题意;
C.Cl2通入洗气瓶,瓶中溶液出现浑浊,发生反应,Cl2做氧化剂,S是氧化产物,氧化剂氧化性大于氧化产物氧化性,描述正确,符合题意;
D.二氧化锰与浓盐酸反应制氯气反应必须加热才能进行,仪器选择错误,不符题意;
综上,本题选C。
12.AC
【详解】A.向10mL某浓度的一元酸HR溶液中逐滴滴入0.1mol/L溶液,加入10mL时恰好反应,发生反应为HR+=NH4R+H2O,HR的浓度为0.1mol/L,故A正确;
B.根据图像可知,b点溶液pH=7,此时HR与一水合氨的物质的量相等,二者恰好反应生成NH4R,HR、均为弱电解质,发生相互促进的水解,故B错误;
C.根据图像可知,d点时溶液的pH>7,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-),故C正确;
D.a点酸过量,抑制水的电离;b点酸碱恰好中和,生成弱酸弱碱盐,根据都弱都水解的规律可知,此时水电离程度最大;d点氨水过量,一水合氨抑制水的电离,故D错误;
故答案为AC。
13.D
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,X原子的最外层电子数与核外电子总数之比为3:4,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故X为O元素;Z的周期数等于族序数,其原子序数大于氧,只能处于第三周期,故Z为Al;W、X(氧)位于不同周期,且W的原子半径小于氧的半径,可推知W为H元素;根据图示可知,四种元素组成的分子簇化学式为H2Al2O6Y2,结合化合价代数和为0可知,Y的化合价为+2,其原子半径大于Al,则Y为Mg元素,据此分析解答。
【详解】A. 由图可知,该分子的化学式为Y2Z2X6W2,故A正确;
B. O分别与Mg、Al形成的化合物为MgO、Al2O3,均为离子化合物,故B正确;
C. O2-、Mg2+、Al3+的核外电子排布相同,核电荷数越大,离子半径越小,则简单离子的半径:O2->Mg2+>Al3+,故C正确;
D. Mg2+、Al3+均为可水解的弱离子,均可促进水的电离,故D错误;
故选D。
14.CD
【详解】A.根据滴入淀粉溶液后溶液变蓝,可以知道反应后的溶液中有碘单质,根据滴入KSCN溶液后溶液变红,可知在碘离子过量时,反应后溶液仍然含有铁离子,所以KI与FeCl3的反应是可逆反应,故A正确;
B.镁与盐酸反应后溶液温度上升,可以说明该反应为放热反应,故B正确;
C.实验中硝酸银溶液过量,加入的碘化钾直接和过量的硝酸银溶液反应生成AgI,没发生沉淀的转化,故无法得到结论Ksp(AgI)D.由于溶液体积未知,所以无法比较醋酸和碳酸的酸性强弱,故D错误;
故答案选CD。
15.AC
【分析】随着pH的增大H2B浓度越来越小,HB-的浓度是先增大后减小,B2-的浓度是逐渐增大,则图中没条线代表的微粒分别为如图所示: ,以此解题。
【详解】A.由图可知,当B2-的浓度分数为0.48时, 溶液的pH为4.37, 则H2B的电离常数Ka2= 1 ×10-4.37,则Ka2的数量级为10-5, A错误;
B.由图可知,溶液pH为3时,溶液中三种微粒浓度c(H2B)> c(HB-)>c(B2-),B正确;
C.由题干信息可知,HB-浓度越大,越有利于酒石酸氢钾的生成,由图可知,溶液pH在3.04~4.37范围内,溶液中HB-离子浓度较大,有利于钾离子转化为酒石酸氢钾沉淀,pH并不是越高越好,C错误;
D.当氢氧化钾溶液的体积为12.5mL时,酒石酸溶液与氢氧化钾溶液恰好反应生成酒石酸氢钾,由酒石酸氢钾的溶度积可知,溶液中HB-的浓度为。c(K+ )=0.0195mo/L,由物料守恒可知,溶液中c(K+ )=c(H2B)+c(HB- )+c(B2- )≈0.0195mol/L, D正确;
故选AC。
16.(1) 大于 8
(2) (1,1,)
【详解】(1)由Ti(H2O)可知,H2O中O原子的孤电子对进入Ti2+的空轨道,形成配位键,则孤电子对数减小,斥力减小, Ti(H2O)中∠H-O-H变大,所以Ti(H2O)中∠H-O-H大于单个水分子中∠H-O-H。观察Ti(NO3)4的球棍结构可知,每个配体NO中有两个O原子与Ti 形成配位键,NO是双齿配体,则Ti的配位数是,答案:大于;8;
(2)由TiO2-aNb晶胞结构可知,氮掺杂反应后,有3个氧空穴,O原子6个在棱上、6个在面上,1个在体内,O原子个数为,N原子1个在棱上、1个在面上,N原子个数为,Ti原子在晶胞的8个顶点、4个面心和1个在体内,Ti原子个数为,所以Ti、O、N原子个数比为4∶∶=1∶∶,则2-a=,a=。已知原子1、2的分数坐标为(0,0,)和(1,0,0),由TiO 的晶胞结构可知,原子3的坐标为(1,1,)。一个晶胞中含Ti:,含O:,则1mol晶胞质量,1个晶胞体积,1个晶胞质量,则TiO2密度 ,答案:;(1,1,);。
17. B ClO-+CO2+H2O=+HClO B 1×10-6 c()=c(A-)>c(H+)=c(OH-) 1:10
【详解】I:(1)25 ℃时,电离平衡常数CH3COOH>H2CO3>HCN>HCO,等浓度的A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH为:Na2CO3>NaCN>CH3COONa,等浓度的三种溶液的pH由大到小的顺序为B>A>C,碱性最强的为Na2CO3溶液,故答案为:B;
(2)25℃时,电离平衡常数H2CO3>HClO>HCO,向NaClO溶液中通入少量CO2,反应生成次氯酸和碳酸氢钠,离子方程式为:ClO-+CO2+H2O=+HClO;
(3)将0.02mol/L的HCN与0.01mol/L 的NaOH溶液等体积混合,溶液中的溶质是物质的量浓度都为0.005mol L-1的NaCN、HCN,测得c(Na+)>c(CN-),根据电荷守恒可知:c(H+)<c(OH-),溶液呈碱性,NaCN的水解程度大于HCN的电离程度,所以HCN的浓度大于0.005mol L-1,CN-的浓度小于0.005mol L-1,
A.根据分析可知,溶液呈碱性,c(H+)<c(OH-),故A错误;
B.混合液呈碱性,则c(H+)<c(OH-),故B正确;
C.电荷守恒c(Na+)+c(H+)=c(OH-)+c(CN-),物料守恒2c(Na+)=c(CN-)+c(HCN),则c(HCN)+2c(H+)=2c(OH-)+c(CN-),故C错误;
D.根据物料守恒可知:c(HCN)+c(CN-)=0.01mol/L,故D错误;
故答案为:B;
II.(4)0.1mol L-1HA溶液与0.1mol L-1NaOH溶液等体积混合后pH=8,此时溶质为NaA,则水电离出的OH-浓度为mol L-1;
(5)25°C时,已知NH4A溶液为中性,则c(H+)=c(OH-),由电荷守恒得:c(H+)+c()=c(OH-)+c(A-),则c()=c(A-),水解程度是微弱的,则该溶液中离子浓度的大小顺序为c()=c(A-)>c(H+)=c(OH-);
(6)25℃pH=12的NaOH溶液中c(OH-)=0.01mol/L,pH=1的HCl溶液中c(H+)=0.1mol/L,若所得混合溶液呈中性,则n(OH-)=n(H+),即aL×0.1mol/L=bL×0.01mol/L,解得a∶b=1∶10。
18. ① ② ① ③ 草酸的浓度,或反应物的浓度 确保①和④组对比实验中c(KMnO4)不变,或确保溶液总体积不变 否 KMnO4溶液呈紫色,达滴定终点紫色褪去 b 75%
【详解】试题
分析:Ⅰ.(1)如果研究催化剂对化学反应速率的影响需有对照实验,因此选①和②;如果研究温度对化学反应速率的影响需要其他因素相同做对照实验,因此选① 和 ③;(2)①和④中浓度不同, 确保①和④组对比实验中c(KMnO4)不变,或确保溶液总体积不变。Ⅱ.(1)由于KMnO4本身是紫红色,无需再加指示剂;(2)KMnO4盛装在酸式滴定管中;(3)
5C2O42-+2MnO4-+16H+= 10CO2↑+2Mn2++8H2O
5 2
x 1500×10-3 ×0.200
x =7.5 ×10-3 a(Na2C2O4)=7.5 ×10-3×134/1.34=75%
考点: 不同条件对化学反应速率影响酸碱中和滴定相关知识。
19.(1) BD 吸收 31.2
(2) 10 2CO2↑++H2O 2CO2+12e-+12H+=C2H4+4H2O、AgCl+e-=Ag+Cl-
【详解】(1)①A.在恒温恒容条件下,平衡时向容器中充入情性气体不能改变反应混合物的浓度,因此反应Ⅰ的平衡不移动,A说法不正确;
B.在反应中有固体C转化为气体,气体的质量增加,而容器的体积不变,因此气体的密度在反应过程中不断增大,当混合气体的密度保持不变时,说明反应体系已达到平衡,B说法正确;
C.若C(s)和H2O(g)完全反应全部转化为CO2(g)和H2(g),由C(s)+ 2H2O(g) = CO2(g)+ 2H2(g)可知,H2的体积分数的极值为,由于可逆反应只有一定的限度,反应物不可能全部转化为生成物,因此,平衡时H2的体积分数不可能大于,C说法不正确;
D.将炭块粉碎可以增大其与H2O(g)的接触面积,因此可加快反应速率,D说法正确;
综上所述,相关说法正确的是BD。
②反应平衡时,H2O(g)的转化率为50%,则水的变化量为0.5mol,水的平衡量也是0.5mol,由于CO的物质的量为0.1mol,则根据O原子守恒可知CO2的物质的量为0.2mol,生成0.2mol CO2时消耗了0.2mol CO,故在反应Ⅰ实际生成了0.3molCO。根据相关反应的热化学方程式可知,生成0.3mol CO要吸收热量39.42kJ ,生成0.2mol CO2要放出热量8.22kJ此时,因此整个体系吸收热量39.42kJ-8.22kJ=31.2kJ;由H原子守恒可知,平衡时H2的物质的量为0.5mol,CO的物质的量为0.1mol,CO2的物质的量为0.2mol,水的物质的量为0.5mol,则平衡时气体的总物质的量为0.5mol+0.1mol+0.2mol+0.5mol=1.3mol,在同温同体积条件下,气体的总压之比等于气体的总物质的量之比,则平衡体系的总压为0.2MPa1.3=0.26MPa,反应I(C(s)+H2O(g)CO(g)+H2(g))的平衡常数Kp= 。
(2)①某温度下,吸收塔中K2CO3溶液吸收一定量的CO2后,c():c()=1:2,由可知,=,则该溶液的pH=10;
②再生塔中KHCO3受热分解生成K2CO3、H2O和CO2,该反应的离子方程式为2CO2↑++H2O;
③利用电化学原理,将CO2电催化还原为C2H4,阴极上发生还原反应,阳极上水放电生成氧气和H+,H+通过质子交换膜迁移到阴极区参与反应生成乙烯,铂电极和Ag/AgCl电极均为阴极,在电解过程中AgCl可以转化为Ag,则阴极的电极反应式为2CO2+12e-+12H+=C2H4+4H2O、AgCl+e-=Ag+Cl-。
化学试卷
一.单选题(每小题3分,共30分)
1.下列有关化学用语表示正确的是
A.中子数为10的氟原子:10F
B.钠基态原子的核外电子排布式:1s22s22p63s2
C.Mg2+的结构示意图:
D.2p3p4p能级轨道数目依次增多
2.下列说法正确的是
A.同一原子中,2p、3p、4p能级的轨道数依次增多
B.电子排布式(22Ti)1s22s22p63s23p10违反了能量最低原则
C.表示的原子能量处于最低状态
D.正三价阳离子的电子排布式为1s22s22p63s23p63d5的元素在周期表中位于Ⅷ族
3.下列表示正确的是
A.NH4Cl的电子式 B.N2H4的结构式:
C.CCl4的比例模型: D.N原子的结构示意图:
4.下列说法中不正确的是( )
A.分子有一个键,两个键
B.两个原子间形成的键比键重叠程度大,键形成的共价键强
C.两个原子间形成共价键时,最多有一个键
D.气体单质中,一定有键,可能有键
5.下列描述中正确的是
A.NO3-的空间构型为三角锥形
B.SiF4和SO32-的中心原子均为sp3杂化
C.在所有的元素中,氟的第一电离能最大
D.C2H5OH分子中共含有8个极性键,1个π键
6.下列分子中,属于含极性键的非极性分子的是
A.SO2 B.H2
C.BBr3 D.COCl2
7.下列说法正确的是
A.σ键和π键比例为7:1
B.SO3空间结构为三角锥形
C.配合物铁氰化钾K3[Fe(CN)6]中几种元素电离能由大到小的顺序是N>C>K>Fe
D.CO2分子中C和O原子之间的σ键是由C原子的sp杂化轨道与O原子的2p轨道重叠形成
8.利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl3 6H2O的主要步骤:用H2O2氧化废蚀刻液,制备氨气,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl3 6H2O。下列实验原理和装置不能达到实验目的的是( )
A.用装置甲制备NH3 B.用装置乙制备Cu(NH3)4Cl2并沉铁
C.用装置丙分离Cu(NH3)4Cl2溶液和Fe(OH)3 D.用装置丁将FeCl3溶液蒸干制备FeCl3 6H2O
9.4 溴甲基 1 环己烯的一种合成路线如图:
下列说法正确的是
A.X的分子式为C9H12O2
B.化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化可制得化合物X
C.在一定条件下,X可以发生取代反应、加成反应、氧化反应、加聚反应
D.W的所有原子一定全部共平面
二、不定项选择题(每题有一个或多个选项,每题4分,共20分)
10.下列溶液中浓度关系正确的是()
A.小苏打溶液中:c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-)
B.CH3COONa溶液中:c(CH3COO-)>c(Na+)
C.物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.0.1mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
11.下列实验能够达到目的的是
A.装置甲可以制取少量氧气 B.装置乙用来检验
C.用装置丙可证明Cl2的氧化性强于S D.实验室制备氯气
12.常温下,向10mL某浓度的一元酸HR溶液中逐滴滴入0.1mol/L溶液,所得溶液pH及导电能力变化如图。下列分析正确的是
A.HR的浓度为0.1mol/L
B.b点溶液说明没有水解
C.d点溶液存在
D.滴加氨水的过程中,水的电离程度越来越大
13.短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素组成的一种分子簇的球棍模型如图所示。W与X不在同一周期,X原子的最外层电子数与核外电子总数之比为3: 4,Z的周期数等于族序数。下列说法不正确的是
A.化学式为Y2Z2X6W2
B.X分别与Y、Z形成的化合物为离子化合物
C.简单离子的半径: X> Y> Z
D.Y、Z的简单离子均可抑制水的电离
14.根据下列实验操作和现象所得到的结论不正确的是
选项 实验操作和现象 结论
A 向2mL0.1mol·L 1的FeCl3溶液中加入4mL0.1mol·L 1的KI溶液,充分反应后,分别取少量溶液于两支试管中,向其中一支试管中滴加几滴淀粉溶液,溶液变蓝,另一支试管中滴加几滴KSCN溶液,溶液变红 KI与FeCl3的反应是可逆反应
B 室温下,向0.1mol·L 1HCl溶液中加入少量镁粉,产生大量气泡,测得溶液温度上升 镁与盐酸反应放热
C 向盛有2mL0.1mol·L-1的硝酸银溶液的试管中滴加2滴0.1mol·L-1的氯化钠溶液,生成白色沉淀,再滴加2滴 0.1mol·L-1的碘化钾溶液,有黄色沉淀生成 Ksp(AgI)
A.A B.B C.C D.D
15.酒石酸(H2B)及其与OH-形成的微粒的浓度分数随溶液pH变化曲线如图(已知: 20℃时,Ksp(KHB)=3.8× 10-4, S(K2B)=100 g/L)。向25 mL 0.1 mol/L酒石酸溶液中,逐滴加入0.2mol/LKOH溶液,下列相关说法不正确的是
A.酒石酸的Ka2的数量级为10-3
B.pH=3, c(H2B)> c(HB- )>c(B2- )
C.pH越高,越有利于用酒石酸检验K+
D.V(KOH)=12.5 mL时,c(H2B)+c(HB- )+c(B2- )≈0.0195mol/L
三、填空题(共50分)
16.2022年2月我国科学家在《科学》杂志发表反型钙钛矿太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟新方向。
(1)Ti(H2O)中∠H-O-H_____(填“大于”、“小于”或“等于”)单个水分子中∠H-O-H;Ti(NO3)4的球棍结构如图,Ti的配位数是_____。
(2)反型钙钛矿电池无需使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
则TiO2-aNb晶体中a=_____。已知原子1、2的分数坐标为(0,0,)和(1,0,0),则原子3的坐标分别为_____,设阿伏加德罗常数的值为NA,TiO2的密度为_____g cm-3 (列出计算式)。
17.I.电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25°C):
化学式 CH3COOH H2CO3 HClO HCN
电离平衡常数 K=1.7×10-5 K1=4.3×10-7 K2=5.6×10-11 K=3.0×10-8 K=4.9×10-10
(1)25°C时,等浓度的三种溶液:A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液,碱性最强的是____(填字母编号);
(2)25°C时,向NaClO溶液中通入少量CO2,所发生反应的离子方程式为____;
(3)现有浓度为0.02mol/L的HCN与0.01mol/LNaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是___(填字母编号)。
A.c(H+)>c(OH-) B.c(H+)
II.(4)0.1mol L-1HA溶液与0.1mol L-1NaOH溶液等体积混合后pH=8,则水电离出的OH-浓度为____mol L-1。
(5)25°C时,已知NH4A溶液为中性,则该溶液中离子浓度的大小顺序为____。
(6)将25°C下pH=l的HCl溶液aL与pH=12的NaOH溶液bL混合,若所得混合液为中性,则a:b=_____。(溶液体积变化忽略不计)。
18.某学校研究性学习小组开展课题探究:
探究课题Ⅰ.“不同条件对化学反应速率影响的探究”,选用4 mL 0.01 mol·L-1KMnO4溶液与2 mL 0.1 mol·L-1 H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
组别 草酸的体积(mL) 温度/℃ 其他物质
2 mL 20
2 mL 20 10滴饱和MnSO4溶液
2 mL 30
④ 1 mL 20 1 mL蒸馏水
(1)如果研究催化剂对化学反应速率的影响,使用实验___和____(用 ①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验____和____。
(2)对比实验①和④,可以研究_____对化 学反应速率的影响,实验④中加入1 mL蒸馏水的目的是_____________________。
探究课题Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂?_______________(填“是”或“否”),请说明理由___________。
(2)滴定时用________(填a或b)滴定管盛装KMnO4标准溶液。
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为________________。
19.(1)在一定温度下,向体积固定的密闭容器中加入足量的和,起始压强为时,发生下列反应生成水煤气:
Ⅰ.
Ⅱ.
①下列说法正确的是_______;
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时,的转化率为,CO的物质的量为。此时,整个体系_______(填“吸收”或“放出”)热量_______kJ,反应Ⅰ的平衡常数_______(以分压表示,分压=总压×物质的量分数)。
(2)一种脱除和利用水煤气中方法的示意图如下:
①某温度下,吸收塔中溶液吸收一定量的后,,则该溶液的_______(该温度下的);
②再生塔中产生的离子方程式为_______;
③利用电化学原理,将电催化还原为,阴极反应式为_______。
1.C
【详解】A.氟的质子数为9,中子数为10的氟原子的质量数为19,该元素符号可以表示为:19F,故A错误;
B.钠是11号元素,核外电子排布式:1s22s22p63s1,故B错误;
C.镁离子是镁原子失去最外层的2个电子得到的,结构示意图为:,故C正确;
D.2p3p4p能级轨道数目相同,故D错误;
故选C。
2.D
【详解】A.2p、3p、4p能级都含有3个原子轨道,故A错误;
B.3p能级最多排6个电子,所以电子排布式(22Ti)1s22s22p63s23p10违反洪特规则和保利不相容原理,故B错误;
C.违反了洪特规则,故C错误;
D.某+3价离子的电子排布式为1s22s22p63s23p63d5,其原子核外电子数为23+3=26,为Fe元素,原子核外排布式为1s22s22p63s23p63d64s2,处于周期表中第4周期第Ⅷ族,故D正确;
故选D。
【点睛】本题考查原子核外电子的排布规律。根据构造原理确定核外电子排布式是否正确。①能量最低原理:原子核外电子先占有能量较低的轨道,然后依次进入能量较高的轨道;②泡利不相容原理:每个原子轨道上最多只能容纳 2个自旋状态相反的电子;③洪特规则:在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同。
3.B
【详解】A.NH4Cl是由铵根离子与氯离子构成,属于离子化合物,其电子式为:,A错误;
B.N2H4分子中各原子达到稳定结构,其电子式为:,B正确;
C.因原子半径:Cl>C,所以CCl4的比例模型为,C错误;
D.N原子核外电子数等于核内质子数,所以其结构示意图为:,D错误;
故选B。
4.D
【详解】A. N2分子中两个氮原子之间形成氮氮三键,有一个σ键,2个π键,故A正确,但不符合题意;
B.σ键是轴对称而π键是镜面对称,σ键是头碰头重叠,π键是肩并肩重叠,σ键比π键重叠程度大,形成的共价键强,故B正确,但不符合题意;
C. 根据杂化轨道理论,两个原子之间形成共价键时,最多有一个σ键,其余为π键,故C正确,但不符合题意;
D. 气体单质中,不一定形成σ键,如稀有气体分子为单原子分子,没有σ键,故D错误,符合题意。
故选:D。
5.B
【详解】A.硝酸根离子的空间构型为平面三角形,A项错误;B.SiF4中硅原子含有4个σ键且不含孤电子对,所以硅原子采用sp3杂化,SO32-中价层电子对个数=3+1/2(6+2 3×2)=4,所以硫原子为sp3杂化,B项正确;C.第一电离能最大的是零族元素的He,C项错误;D.乙醇分子中只有单键,没有双键和三键,所以没有π键,D项错误。答案选B。
6.C
【详解】A.SO2是角形结构,是含极性键的极性分子,A不符合题意;
B.H2属于含非极性键的非极性分子,B不符合题意;
C.BBr3是平面正三角形,是含极性键非极性分子,C符合题意;
D.COCl2是含极性键的极性分子,D不符合题意;
故选C。
7.D
【详解】A.双键中有1个σ键、1个π键,N-H单键、N-C单键、O-C单键、C-H单键,Cu-O单键均为σ键,所以σ键和π键比例为9:1,A错误;
B.SO3中心S原子的价层电子对数为=3,不含孤电子对,空间构型为平面三角形,B错误;
C.Fe的金属性比K弱,电离能大于K,C错误;
D.CO2分子中C原子采取sp杂化,C原子的sp杂化轨道与O原子的2p轨道重叠形成一个σ键,D正确;
综上所述答案为D。
8.D
【详解】A.实验室制备氨气,可用氢氧化钙、氯化铵在加热条件下进行,故A正确;
B.氨气易溶于水,注意防止倒吸,氨气与溶液反应生成Cu(NH3)4Cl2和氢氧化铁,故B正确;
C.分离固体和液体,可用过滤的方法,故C正确;
D.应在蒸发皿中蒸发,且避免氯化铁水解,更不能直接蒸干,故D错误;
故答案为D。
【点睛】考查物质制备实验设计、物质分离的实验基本操作,明确实验原理是解题关键,用H2O2氧化废蚀刻液,使亚铁离子生成铁离子,用甲装置制备氨气,生成的氨气通入乙装置,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2],用丙装置过滤分离,用盐酸溶解氢氧化铁沉淀,将溶液在蒸发皿中进行蒸发,且应通入氯化氢,防止铁离子水解,以达到制备FeCl3 6H2O的目的,注意把握物质性质的理解、物质分离提纯的方法。
9.C
【详解】A.由X的结构式可知,X的分子式为C9H14O2,故A错误;
B.化合物Y中含有碳碳双键和醇羟基,均能被酸性高锰酸钾溶液氧化,被酸性高锰酸钾溶液氧化时碳碳双键断裂,环状结构不复存在,所以化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化不能制得化合物X,故B错误;
C.X中含有碳碳双键,可以发生加成反应、氧化反应、加聚反应,含有酯基,可以发生水解(取代)反应,故C正确;
D.W为1,3-丁二烯,因位于2号碳原子和3号碳原子之间的碳碳单键可以旋转,所以W的所有原子可能全部共平面,故D错误;
答案选C。
10.AC
【详解】A.小苏打溶液中满足电荷守恒:c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-),A正确;
B.CH3COONa溶液中醋酸根水解:c(CH3COO-)<c(Na+),B错误;
C.物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合,溶液显酸性,醋酸的电离常数大于醋酸根离子的水解程度:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),C正确;
D.0.1mol/L的NaHA溶液,其pH=4,说明HA-的电离常数大于其水解程度,则c(HA-)>c(H+)>c(A2-)>c(H2A),D错误;
答案选AC。
11.C
【详解】A.该装置要求固体药品为块状,不溶于水,Na2O2是粉末状药剂,无法实现固液分离要求,不符题意;
B.检验NH3等碱性气体应使用湿润的红色石蕊试纸,检验试剂错误,不符题意;
C.Cl2通入洗气瓶,瓶中溶液出现浑浊,发生反应,Cl2做氧化剂,S是氧化产物,氧化剂氧化性大于氧化产物氧化性,描述正确,符合题意;
D.二氧化锰与浓盐酸反应制氯气反应必须加热才能进行,仪器选择错误,不符题意;
综上,本题选C。
12.AC
【详解】A.向10mL某浓度的一元酸HR溶液中逐滴滴入0.1mol/L溶液,加入10mL时恰好反应,发生反应为HR+=NH4R+H2O,HR的浓度为0.1mol/L,故A正确;
B.根据图像可知,b点溶液pH=7,此时HR与一水合氨的物质的量相等,二者恰好反应生成NH4R,HR、均为弱电解质,发生相互促进的水解,故B错误;
C.根据图像可知,d点时溶液的pH>7,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-),故C正确;
D.a点酸过量,抑制水的电离;b点酸碱恰好中和,生成弱酸弱碱盐,根据都弱都水解的规律可知,此时水电离程度最大;d点氨水过量,一水合氨抑制水的电离,故D错误;
故答案为AC。
13.D
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,X原子的最外层电子数与核外电子总数之比为3:4,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故X为O元素;Z的周期数等于族序数,其原子序数大于氧,只能处于第三周期,故Z为Al;W、X(氧)位于不同周期,且W的原子半径小于氧的半径,可推知W为H元素;根据图示可知,四种元素组成的分子簇化学式为H2Al2O6Y2,结合化合价代数和为0可知,Y的化合价为+2,其原子半径大于Al,则Y为Mg元素,据此分析解答。
【详解】A. 由图可知,该分子的化学式为Y2Z2X6W2,故A正确;
B. O分别与Mg、Al形成的化合物为MgO、Al2O3,均为离子化合物,故B正确;
C. O2-、Mg2+、Al3+的核外电子排布相同,核电荷数越大,离子半径越小,则简单离子的半径:O2->Mg2+>Al3+,故C正确;
D. Mg2+、Al3+均为可水解的弱离子,均可促进水的电离,故D错误;
故选D。
14.CD
【详解】A.根据滴入淀粉溶液后溶液变蓝,可以知道反应后的溶液中有碘单质,根据滴入KSCN溶液后溶液变红,可知在碘离子过量时,反应后溶液仍然含有铁离子,所以KI与FeCl3的反应是可逆反应,故A正确;
B.镁与盐酸反应后溶液温度上升,可以说明该反应为放热反应,故B正确;
C.实验中硝酸银溶液过量,加入的碘化钾直接和过量的硝酸银溶液反应生成AgI,没发生沉淀的转化,故无法得到结论Ksp(AgI)
故答案选CD。
15.AC
【分析】随着pH的增大H2B浓度越来越小,HB-的浓度是先增大后减小,B2-的浓度是逐渐增大,则图中没条线代表的微粒分别为如图所示: ,以此解题。
【详解】A.由图可知,当B2-的浓度分数为0.48时, 溶液的pH为4.37, 则H2B的电离常数Ka2= 1 ×10-4.37,则Ka2的数量级为10-5, A错误;
B.由图可知,溶液pH为3时,溶液中三种微粒浓度c(H2B)> c(HB-)>c(B2-),B正确;
C.由题干信息可知,HB-浓度越大,越有利于酒石酸氢钾的生成,由图可知,溶液pH在3.04~4.37范围内,溶液中HB-离子浓度较大,有利于钾离子转化为酒石酸氢钾沉淀,pH并不是越高越好,C错误;
D.当氢氧化钾溶液的体积为12.5mL时,酒石酸溶液与氢氧化钾溶液恰好反应生成酒石酸氢钾,由酒石酸氢钾的溶度积可知,溶液中HB-的浓度为。c(K+ )=0.0195mo/L,由物料守恒可知,溶液中c(K+ )=c(H2B)+c(HB- )+c(B2- )≈0.0195mol/L, D正确;
故选AC。
16.(1) 大于 8
(2) (1,1,)
【详解】(1)由Ti(H2O)可知,H2O中O原子的孤电子对进入Ti2+的空轨道,形成配位键,则孤电子对数减小,斥力减小, Ti(H2O)中∠H-O-H变大,所以Ti(H2O)中∠H-O-H大于单个水分子中∠H-O-H。观察Ti(NO3)4的球棍结构可知,每个配体NO中有两个O原子与Ti 形成配位键,NO是双齿配体,则Ti的配位数是,答案:大于;8;
(2)由TiO2-aNb晶胞结构可知,氮掺杂反应后,有3个氧空穴,O原子6个在棱上、6个在面上,1个在体内,O原子个数为,N原子1个在棱上、1个在面上,N原子个数为,Ti原子在晶胞的8个顶点、4个面心和1个在体内,Ti原子个数为,所以Ti、O、N原子个数比为4∶∶=1∶∶,则2-a=,a=。已知原子1、2的分数坐标为(0,0,)和(1,0,0),由TiO 的晶胞结构可知,原子3的坐标为(1,1,)。一个晶胞中含Ti:,含O:,则1mol晶胞质量,1个晶胞体积,1个晶胞质量,则TiO2密度 ,答案:;(1,1,);。
17. B ClO-+CO2+H2O=+HClO B 1×10-6 c()=c(A-)>c(H+)=c(OH-) 1:10
【详解】I:(1)25 ℃时,电离平衡常数CH3COOH>H2CO3>HCN>HCO,等浓度的A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH为:Na2CO3>NaCN>CH3COONa,等浓度的三种溶液的pH由大到小的顺序为B>A>C,碱性最强的为Na2CO3溶液,故答案为:B;
(2)25℃时,电离平衡常数H2CO3>HClO>HCO,向NaClO溶液中通入少量CO2,反应生成次氯酸和碳酸氢钠,离子方程式为:ClO-+CO2+H2O=+HClO;
(3)将0.02mol/L的HCN与0.01mol/L 的NaOH溶液等体积混合,溶液中的溶质是物质的量浓度都为0.005mol L-1的NaCN、HCN,测得c(Na+)>c(CN-),根据电荷守恒可知:c(H+)<c(OH-),溶液呈碱性,NaCN的水解程度大于HCN的电离程度,所以HCN的浓度大于0.005mol L-1,CN-的浓度小于0.005mol L-1,
A.根据分析可知,溶液呈碱性,c(H+)<c(OH-),故A错误;
B.混合液呈碱性,则c(H+)<c(OH-),故B正确;
C.电荷守恒c(Na+)+c(H+)=c(OH-)+c(CN-),物料守恒2c(Na+)=c(CN-)+c(HCN),则c(HCN)+2c(H+)=2c(OH-)+c(CN-),故C错误;
D.根据物料守恒可知:c(HCN)+c(CN-)=0.01mol/L,故D错误;
故答案为:B;
II.(4)0.1mol L-1HA溶液与0.1mol L-1NaOH溶液等体积混合后pH=8,此时溶质为NaA,则水电离出的OH-浓度为mol L-1;
(5)25°C时,已知NH4A溶液为中性,则c(H+)=c(OH-),由电荷守恒得:c(H+)+c()=c(OH-)+c(A-),则c()=c(A-),水解程度是微弱的,则该溶液中离子浓度的大小顺序为c()=c(A-)>c(H+)=c(OH-);
(6)25℃pH=12的NaOH溶液中c(OH-)=0.01mol/L,pH=1的HCl溶液中c(H+)=0.1mol/L,若所得混合溶液呈中性,则n(OH-)=n(H+),即aL×0.1mol/L=bL×0.01mol/L,解得a∶b=1∶10。
18. ① ② ① ③ 草酸的浓度,或反应物的浓度 确保①和④组对比实验中c(KMnO4)不变,或确保溶液总体积不变 否 KMnO4溶液呈紫色,达滴定终点紫色褪去 b 75%
【详解】试题
分析:Ⅰ.(1)如果研究催化剂对化学反应速率的影响需有对照实验,因此选①和②;如果研究温度对化学反应速率的影响需要其他因素相同做对照实验,因此选① 和 ③;(2)①和④中浓度不同, 确保①和④组对比实验中c(KMnO4)不变,或确保溶液总体积不变。Ⅱ.(1)由于KMnO4本身是紫红色,无需再加指示剂;(2)KMnO4盛装在酸式滴定管中;(3)
5C2O42-+2MnO4-+16H+= 10CO2↑+2Mn2++8H2O
5 2
x 1500×10-3 ×0.200
x =7.5 ×10-3 a(Na2C2O4)=7.5 ×10-3×134/1.34=75%
考点: 不同条件对化学反应速率影响酸碱中和滴定相关知识。
19.(1) BD 吸收 31.2
(2) 10 2CO2↑++H2O 2CO2+12e-+12H+=C2H4+4H2O、AgCl+e-=Ag+Cl-
【详解】(1)①A.在恒温恒容条件下,平衡时向容器中充入情性气体不能改变反应混合物的浓度,因此反应Ⅰ的平衡不移动,A说法不正确;
B.在反应中有固体C转化为气体,气体的质量增加,而容器的体积不变,因此气体的密度在反应过程中不断增大,当混合气体的密度保持不变时,说明反应体系已达到平衡,B说法正确;
C.若C(s)和H2O(g)完全反应全部转化为CO2(g)和H2(g),由C(s)+ 2H2O(g) = CO2(g)+ 2H2(g)可知,H2的体积分数的极值为,由于可逆反应只有一定的限度,反应物不可能全部转化为生成物,因此,平衡时H2的体积分数不可能大于,C说法不正确;
D.将炭块粉碎可以增大其与H2O(g)的接触面积,因此可加快反应速率,D说法正确;
综上所述,相关说法正确的是BD。
②反应平衡时,H2O(g)的转化率为50%,则水的变化量为0.5mol,水的平衡量也是0.5mol,由于CO的物质的量为0.1mol,则根据O原子守恒可知CO2的物质的量为0.2mol,生成0.2mol CO2时消耗了0.2mol CO,故在反应Ⅰ实际生成了0.3molCO。根据相关反应的热化学方程式可知,生成0.3mol CO要吸收热量39.42kJ ,生成0.2mol CO2要放出热量8.22kJ此时,因此整个体系吸收热量39.42kJ-8.22kJ=31.2kJ;由H原子守恒可知,平衡时H2的物质的量为0.5mol,CO的物质的量为0.1mol,CO2的物质的量为0.2mol,水的物质的量为0.5mol,则平衡时气体的总物质的量为0.5mol+0.1mol+0.2mol+0.5mol=1.3mol,在同温同体积条件下,气体的总压之比等于气体的总物质的量之比,则平衡体系的总压为0.2MPa1.3=0.26MPa,反应I(C(s)+H2O(g)CO(g)+H2(g))的平衡常数Kp= 。
(2)①某温度下,吸收塔中K2CO3溶液吸收一定量的CO2后,c():c()=1:2,由可知,=,则该溶液的pH=10;
②再生塔中KHCO3受热分解生成K2CO3、H2O和CO2,该反应的离子方程式为2CO2↑++H2O;
③利用电化学原理,将CO2电催化还原为C2H4,阴极上发生还原反应,阳极上水放电生成氧气和H+,H+通过质子交换膜迁移到阴极区参与反应生成乙烯,铂电极和Ag/AgCl电极均为阴极,在电解过程中AgCl可以转化为Ag,则阴极的电极反应式为2CO2+12e-+12H+=C2H4+4H2O、AgCl+e-=Ag+Cl-。
同课章节目录
