2.3 溶液的浓度 同步练习(含答案) 2022-2023学年人教版(五四学制)九年级下册化学
文档属性
| 名称 | 2.3 溶液的浓度 同步练习(含答案) 2022-2023学年人教版(五四学制)九年级下册化学 |
|
|
| 格式 | zip | ||
| 文件大小 | 80.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-16 08:49:25 | ||
图片预览



文档简介
2.3 溶液的浓度 同步练习 2022-2023学年人教版(五四学制)九年级下册化学
一、单选题
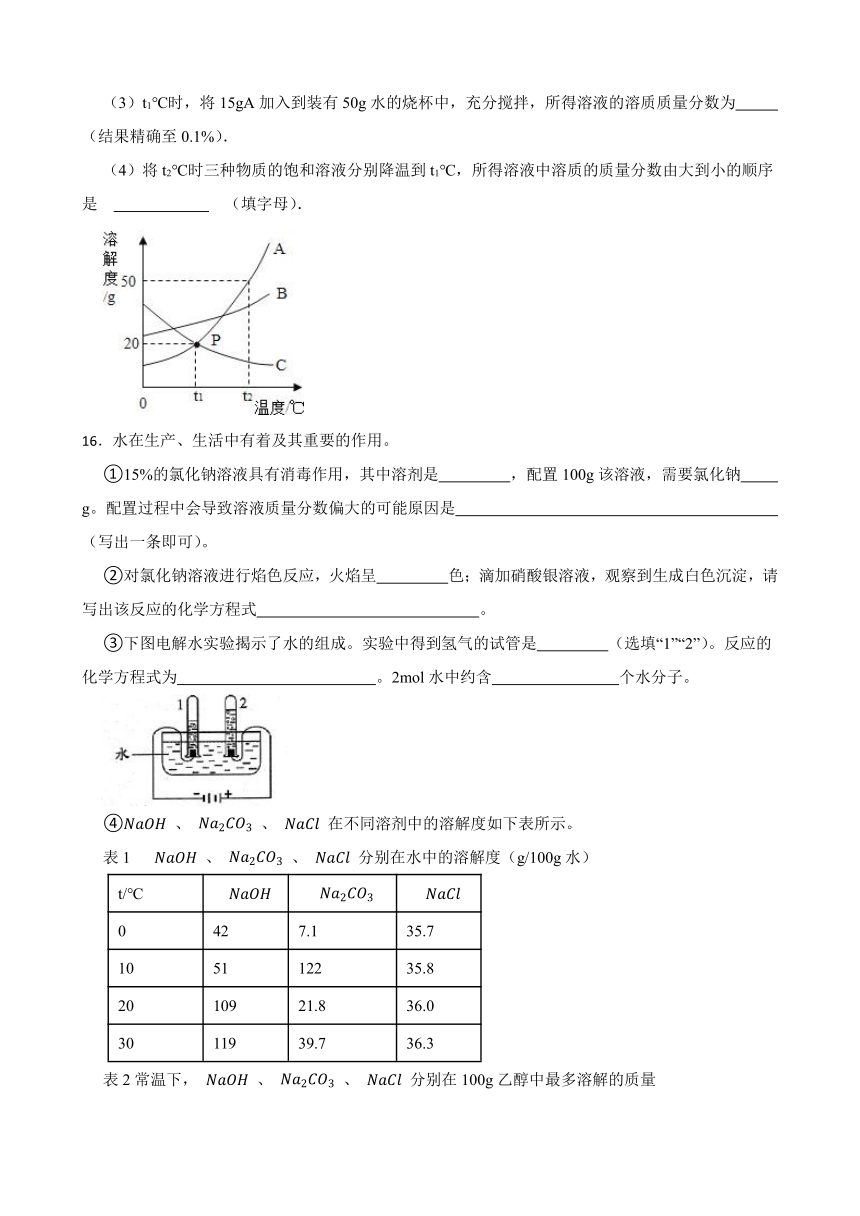
1.如下图为a、b、c三种固体物质(不含结晶水)的溶解度曲线。下列说法错误的是 ( )
A.t1℃时,a和c两种物质的饱和溶液溶质的质量分数相等
B.t2℃时,取三种物质各20 g分别放入100g水中充分溶解,只有c物质能形成饱和溶液
C.将等质量的三种物质的饱和溶液分别由t2℃降温到t1℃,a溶液中析出的晶体质量最大
D.t2℃时,将a、b、c三种物质的饱和溶液降温到t1℃,此时所得溶液溶质的质量分数是b>a=c
2.下列四个图像的变化趋势,能正确描述对应操作的是( )
A. 向一定量的氢氧化钠溶液中不断地滴加水
B. 向一定量久置于空气中的氢氧化钠固体中不断地滴加稀盐酸
C. 向等质量的锌、铁颗粒中分别滴加足量相同浓度的稀盐酸
D. 向t℃一定量饱和硝酸钾溶液中不断加入硝酸钾固体
3.用下列方法配制的溶液,其溶质质量分数为5%的是()
A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B.称取5.0g生石灰,放入95mL水中,充分搅拌
C.量取5.0mL浓盐酸,倒入95mL水中,充分搅拌
D.称取5.0g碳酸钙,放入95mL水中,充分搅拌
4.KCl与KNO3在不同温度的溶解度数据如表.则下列说法正确的是( )
温度/℃ 10 20 30 40 50
KCl 30g 33g 35g 38g 41g
KNO3 21g 31g 45g 65g 88g
A.KNO3比KCl的溶解度大
B.两物质的溶解度相等的温度在20~30℃之间
C.在20℃时,10g水中加入5gKCl可得到33.3%的KCl溶液
D.在50℃时,两物质各5g分别加入10g水中,充分溶解,均有固体剩余
5.下列说法中错误的是( )
A.在树木上涂刷含有硫粉的石灰浆,可以保护树木,防止害虫生卵
B.饱和溶液析出晶体后,溶液中溶质的质量分数可能不变
C.碱溶液能使酚酞溶液变红,那么能使酚酞溶液变红的溶液一定显碱性
D.中和反应能生成盐和水,则生成盐和水的反应一定是中和反应
6.甲、乙两种物质的溶解度曲线如图所示。下列叙述正确的是( )
A.依据溶解度曲线可判断,甲的溶解度比乙的大
B.将甲、乙的饱和溶液从t2℃降到t1℃,析出乙的质量大
C.将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法
D.t1℃时,甲和乙的饱和溶液各100g,其溶质的质量一定相等
7.现有20%的氯化钠溶液,根据“20%”这一数值,你可以知道该溶液( )
A.溶质质量为20g
B.溶液质量为100g
C.水的质量为80g
D.溶质:溶剂:溶液 (质量比)=1:4:5
8.甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度大于乙的溶解度
B.两种物质的溶解度都随温度升高而增大
C.将乙的饱和溶液从t1 ℃升温到t3 ℃的过程中不会析出晶体
D.t3 ℃时,甲、乙溶液的溶质质量分数相等
9.在一定温度下,在某一饱和溶液中,加入一些该溶质的晶体,则( )
A.晶体质量减少 B.溶质质量分数增大
C.溶剂的质量减小 D.溶质的溶解度不变
10.在温度不变的条件下,下列欲使10%的硝酸钾溶液的溶质质量分数变为20%的方法中,一定能实现的是( )
A.将20g10%的硝酸钾饱和溶液倒掉10g
B.将20g10%的硝酸钾不饱和溶液蒸发掉10g水
C.在20g10%的硝酸钾溶液中,加入10g40%的硝酸钾溶液
D.将20g10%的硝酸钾不饱和溶液中加入20g硝酸钾固体
11.将100g 98%的浓硫酸注入900g水中,所得稀硫酸中溶质的质量分数为( )
A.9.8% B.10.0% C.10.9% D.11.1%
12.在一定温度下,向盛有氯化钠饱和溶液的烧杯中加入氯化钠固体后,则( )
A.固体质量不变 B.固体质量减少
C.氯化钠溶解度增大 D.溶质质量分数增大
二、填空题
13.16克某二价金属R的氧化物与98克质量分数为20%的硫酸溶液恰好完全反应.则R的相对原子质量为 ;反应后溶液中溶质的质量分数为 .
14.蓄电池中所用电解液是质量分数约为28%的硫酸.若用1升98%的浓硫酸(密度为1.84克/厘米3)稀释成28%的硫酸,可得28%的硫酸溶液 克,需加水 毫升.
15.根据如图A、B、C三种固体的溶解度曲线回答;
(1)要使C的饱和溶液成为不饱和溶液,可采用 的方法.(填一种即可)
(2)要除去B中的少量A,可采用 的方法.
(3)t1℃时,将15gA加入到装有50g水的烧杯中,充分搅拌,所得溶液的溶质质量分数为 (结果精确至0.1%).
(4)将t2℃时三种物质的饱和溶液分别降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序是 (填字母).
16.水在生产、生活中有着及其重要的作用。
①15%的氯化钠溶液具有消毒作用,其中溶剂是 ,配置100g该溶液,需要氯化钠 g。配置过程中会导致溶液质量分数偏大的可能原因是 (写出一条即可)。
②对氯化钠溶液进行焰色反应,火焰呈 色;滴加硝酸银溶液,观察到生成白色沉淀,请写出该反应的化学方程式 。
③下图电解水实验揭示了水的组成。实验中得到氢气的试管是 (选填“1”“2”)。反应的化学方程式为 。2mol水中约含 个水分子。
④ 、 、 在不同溶剂中的溶解度如下表所示。
表1 、 、 分别在水中的溶解度(g/100g水)
t/℃
0 42 7.1 35.7
10 51 122 35.8
20 109 21.8 36.0
30 119 39.7 36.3
表2常温下, 、 、 分别在100g乙醇中最多溶解的质量
最多溶解的质量(g) 17.3 <0.01 0.1
根据表1和表2提供的数据回答下列问题
Ⅰ. 在水中的溶解度随温度升高而 (选填“增大”“减小”)。
Ⅱ.20℃时,饱和食盐水中溶质质量分数为 。
Ⅲ.常温下,将 通入饱和 的乙醇溶液中,反应的方程式为 ,可观察到的现象 。
17.A,B,C三种固体物质的溶解度曲线如图所示。
图1 图2
(1)当三物质溶解度大小为B>C>A时,温度t的范围是 。
(2)t2℃时,将A、B、C各25g分别放入100g水中,能形成饱和溶液的物质是 ,而没有形成饱和溶液的,可将溶液温度降到t1℃时,又能恰好形成饱和溶液的是 。
(3)t2℃时,将等质量的A、B、C三种物质加适量的水分别形成饱和溶液,三种饱和溶液中含水的质量由大到小的顺序为 (用A、B、C表示)。
18.在实验室配制溶质的质量分数为10%的氯化钠溶液100g,经计算,在 上称量 g氯化钠并倒入干燥洁净的烧杯里,然后用 量取 mL蒸馏水倒入装有氯化钠的烧杯里,并用 不断搅拌,使氯化钠完全溶解,即得所需的溶液.
三、综合题
19.25℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3,请结合图示回答下列问题:
(1)图1中甲、乙溶液的溶质质量分数大小关系为
(2)图2中一定为饱和溶液的是 (填“甲”或“乙”)
(3)图3中固体甲对应的溶解度曲线是 .
20.t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示.
(1)烧杯②种的上层清液是否达到饱和状态? (填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是 (写名称或化学式);
(3)将t1℃时50g硝酸钾的饱和溶液稀释成10%的溶液,需加水 g;
(4)关于图1中烧杯内的物质,下列说法正确的是 .
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
21.某造纸厂的废水中含一定量的碳酸钠和硫酸钠,为回收再利用,实验小组做如下实验:取废水100g,向其中加入一定质量分数的稀硫酸50g,恰好完全反应,所得溶液的质量是147.8g.求:
(1)生成二氧化碳的质量;
(2)若将所得溶液蒸干,得到7.8g固体.则原废水中硫酸钠的质量;
(3)稀硫酸的质量分数(精确到0.1%).
四、实验探究题
22.某校实验室有一瓶保管不当的试剂,其残缺的标签中只剩下“钠”和“10%”字样,已知它是初中化学常用的试剂,小强和小华同学对这瓶试剂很感兴趣,决定对其成分进行探究:
(1)【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 .
A.酸 B.碱 C.盐
(2)【查阅资料】Ⅰ、初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3.
Ⅱ、测定室温(20℃)时,四种物质的溶解度的数据如下:
物质 NaCl NaOH Na2CO3 NaHCO3
溶解度/g 36 109 215 9.6
【得出结论】小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是 .
(3)【作出猜想】①可能是NaOH溶液;②可能是 溶液;③可能是NaCl.
(4)【设计并实验】
①小强取样品少量,滴加无色酚酞试液,液体变红色他认为猜想①正确,他的判断是不合理的,原因是 .
②小华为了检验该溶液到底是什么又进行了如下实验:取样品于试管中,滴加氯化钙溶液,有白色沉淀生成.猜想②正确.反应的化学方程式 .
答案解析部分
1.【答案】D
2.【答案】B
3.【答案】A
4.【答案】B
5.【答案】D
6.【答案】D
7.【答案】D
8.【答案】C
9.【答案】D
10.【答案】C
11.【答案】A
12.【答案】A
13.【答案】64;28.1%
14.【答案】6440;4600
15.【答案】降低温度;蒸发结晶;16.7%;B>A>C
16.【答案】水;15;量筒量取水时,俯视读数,造成实际取得的水偏少,质量分数偏大;黄;;1;;;增大;26.5%;;产生白色沉淀
17.【答案】(1)0℃~t1℃
(2)C;A
(3)C>B>A
18.【答案】托盘天平;10;100mL量筒;90;玻璃棒
19.【答案】(1)甲=乙
(2)甲
(3)B
20.【答案】(1)是
(2)氯化钾
(3)50
(4)A、D
21.【答案】(1)解:根据化学反应可知,二氧化碳的质量等于质量的变化值,所以二氧化碳的质量=100g+50g﹣147.8g=2.2g
(2)解:设生成2.2g二氧化碳气体需要硫酸的质量是x,生成硫酸钠的质量为y,
Na2CO3+ H2SO4═ Na2SO4+H2O+ CO2↑
98 142 44
X y 2.2g
解得:x=4.9g y=7.1g;
所以原混合物中硫酸钠的质量为7.8﹣7.1=0.7g
(3)解:稀硫酸的质量分数是: =9.8%
22.【答案】(1)A
(2)NaHCO3
(3)Na2CO3
(4)Na2CO3溶液也显碱性;Na2CO3+CaCl2=CaCO3↓+2NaCl
一、单选题
1.如下图为a、b、c三种固体物质(不含结晶水)的溶解度曲线。下列说法错误的是 ( )
A.t1℃时,a和c两种物质的饱和溶液溶质的质量分数相等
B.t2℃时,取三种物质各20 g分别放入100g水中充分溶解,只有c物质能形成饱和溶液
C.将等质量的三种物质的饱和溶液分别由t2℃降温到t1℃,a溶液中析出的晶体质量最大
D.t2℃时,将a、b、c三种物质的饱和溶液降温到t1℃,此时所得溶液溶质的质量分数是b>a=c
2.下列四个图像的变化趋势,能正确描述对应操作的是( )
A. 向一定量的氢氧化钠溶液中不断地滴加水
B. 向一定量久置于空气中的氢氧化钠固体中不断地滴加稀盐酸
C. 向等质量的锌、铁颗粒中分别滴加足量相同浓度的稀盐酸
D. 向t℃一定量饱和硝酸钾溶液中不断加入硝酸钾固体
3.用下列方法配制的溶液,其溶质质量分数为5%的是()
A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B.称取5.0g生石灰,放入95mL水中,充分搅拌
C.量取5.0mL浓盐酸,倒入95mL水中,充分搅拌
D.称取5.0g碳酸钙,放入95mL水中,充分搅拌
4.KCl与KNO3在不同温度的溶解度数据如表.则下列说法正确的是( )
温度/℃ 10 20 30 40 50
KCl 30g 33g 35g 38g 41g
KNO3 21g 31g 45g 65g 88g
A.KNO3比KCl的溶解度大
B.两物质的溶解度相等的温度在20~30℃之间
C.在20℃时,10g水中加入5gKCl可得到33.3%的KCl溶液
D.在50℃时,两物质各5g分别加入10g水中,充分溶解,均有固体剩余
5.下列说法中错误的是( )
A.在树木上涂刷含有硫粉的石灰浆,可以保护树木,防止害虫生卵
B.饱和溶液析出晶体后,溶液中溶质的质量分数可能不变
C.碱溶液能使酚酞溶液变红,那么能使酚酞溶液变红的溶液一定显碱性
D.中和反应能生成盐和水,则生成盐和水的反应一定是中和反应
6.甲、乙两种物质的溶解度曲线如图所示。下列叙述正确的是( )
A.依据溶解度曲线可判断,甲的溶解度比乙的大
B.将甲、乙的饱和溶液从t2℃降到t1℃,析出乙的质量大
C.将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法
D.t1℃时,甲和乙的饱和溶液各100g,其溶质的质量一定相等
7.现有20%的氯化钠溶液,根据“20%”这一数值,你可以知道该溶液( )
A.溶质质量为20g
B.溶液质量为100g
C.水的质量为80g
D.溶质:溶剂:溶液 (质量比)=1:4:5
8.甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度大于乙的溶解度
B.两种物质的溶解度都随温度升高而增大
C.将乙的饱和溶液从t1 ℃升温到t3 ℃的过程中不会析出晶体
D.t3 ℃时,甲、乙溶液的溶质质量分数相等
9.在一定温度下,在某一饱和溶液中,加入一些该溶质的晶体,则( )
A.晶体质量减少 B.溶质质量分数增大
C.溶剂的质量减小 D.溶质的溶解度不变
10.在温度不变的条件下,下列欲使10%的硝酸钾溶液的溶质质量分数变为20%的方法中,一定能实现的是( )
A.将20g10%的硝酸钾饱和溶液倒掉10g
B.将20g10%的硝酸钾不饱和溶液蒸发掉10g水
C.在20g10%的硝酸钾溶液中,加入10g40%的硝酸钾溶液
D.将20g10%的硝酸钾不饱和溶液中加入20g硝酸钾固体
11.将100g 98%的浓硫酸注入900g水中,所得稀硫酸中溶质的质量分数为( )
A.9.8% B.10.0% C.10.9% D.11.1%
12.在一定温度下,向盛有氯化钠饱和溶液的烧杯中加入氯化钠固体后,则( )
A.固体质量不变 B.固体质量减少
C.氯化钠溶解度增大 D.溶质质量分数增大
二、填空题
13.16克某二价金属R的氧化物与98克质量分数为20%的硫酸溶液恰好完全反应.则R的相对原子质量为 ;反应后溶液中溶质的质量分数为 .
14.蓄电池中所用电解液是质量分数约为28%的硫酸.若用1升98%的浓硫酸(密度为1.84克/厘米3)稀释成28%的硫酸,可得28%的硫酸溶液 克,需加水 毫升.
15.根据如图A、B、C三种固体的溶解度曲线回答;
(1)要使C的饱和溶液成为不饱和溶液,可采用 的方法.(填一种即可)
(2)要除去B中的少量A,可采用 的方法.
(3)t1℃时,将15gA加入到装有50g水的烧杯中,充分搅拌,所得溶液的溶质质量分数为 (结果精确至0.1%).
(4)将t2℃时三种物质的饱和溶液分别降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序是 (填字母).
16.水在生产、生活中有着及其重要的作用。
①15%的氯化钠溶液具有消毒作用,其中溶剂是 ,配置100g该溶液,需要氯化钠 g。配置过程中会导致溶液质量分数偏大的可能原因是 (写出一条即可)。
②对氯化钠溶液进行焰色反应,火焰呈 色;滴加硝酸银溶液,观察到生成白色沉淀,请写出该反应的化学方程式 。
③下图电解水实验揭示了水的组成。实验中得到氢气的试管是 (选填“1”“2”)。反应的化学方程式为 。2mol水中约含 个水分子。
④ 、 、 在不同溶剂中的溶解度如下表所示。
表1 、 、 分别在水中的溶解度(g/100g水)
t/℃
0 42 7.1 35.7
10 51 122 35.8
20 109 21.8 36.0
30 119 39.7 36.3
表2常温下, 、 、 分别在100g乙醇中最多溶解的质量
最多溶解的质量(g) 17.3 <0.01 0.1
根据表1和表2提供的数据回答下列问题
Ⅰ. 在水中的溶解度随温度升高而 (选填“增大”“减小”)。
Ⅱ.20℃时,饱和食盐水中溶质质量分数为 。
Ⅲ.常温下,将 通入饱和 的乙醇溶液中,反应的方程式为 ,可观察到的现象 。
17.A,B,C三种固体物质的溶解度曲线如图所示。
图1 图2
(1)当三物质溶解度大小为B>C>A时,温度t的范围是 。
(2)t2℃时,将A、B、C各25g分别放入100g水中,能形成饱和溶液的物质是 ,而没有形成饱和溶液的,可将溶液温度降到t1℃时,又能恰好形成饱和溶液的是 。
(3)t2℃时,将等质量的A、B、C三种物质加适量的水分别形成饱和溶液,三种饱和溶液中含水的质量由大到小的顺序为 (用A、B、C表示)。
18.在实验室配制溶质的质量分数为10%的氯化钠溶液100g,经计算,在 上称量 g氯化钠并倒入干燥洁净的烧杯里,然后用 量取 mL蒸馏水倒入装有氯化钠的烧杯里,并用 不断搅拌,使氯化钠完全溶解,即得所需的溶液.
三、综合题
19.25℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3,请结合图示回答下列问题:
(1)图1中甲、乙溶液的溶质质量分数大小关系为
(2)图2中一定为饱和溶液的是 (填“甲”或“乙”)
(3)图3中固体甲对应的溶解度曲线是 .
20.t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示.
(1)烧杯②种的上层清液是否达到饱和状态? (填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是 (写名称或化学式);
(3)将t1℃时50g硝酸钾的饱和溶液稀释成10%的溶液,需加水 g;
(4)关于图1中烧杯内的物质,下列说法正确的是 .
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
21.某造纸厂的废水中含一定量的碳酸钠和硫酸钠,为回收再利用,实验小组做如下实验:取废水100g,向其中加入一定质量分数的稀硫酸50g,恰好完全反应,所得溶液的质量是147.8g.求:
(1)生成二氧化碳的质量;
(2)若将所得溶液蒸干,得到7.8g固体.则原废水中硫酸钠的质量;
(3)稀硫酸的质量分数(精确到0.1%).
四、实验探究题
22.某校实验室有一瓶保管不当的试剂,其残缺的标签中只剩下“钠”和“10%”字样,已知它是初中化学常用的试剂,小强和小华同学对这瓶试剂很感兴趣,决定对其成分进行探究:
(1)【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 .
A.酸 B.碱 C.盐
(2)【查阅资料】Ⅰ、初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3.
Ⅱ、测定室温(20℃)时,四种物质的溶解度的数据如下:
物质 NaCl NaOH Na2CO3 NaHCO3
溶解度/g 36 109 215 9.6
【得出结论】小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是 .
(3)【作出猜想】①可能是NaOH溶液;②可能是 溶液;③可能是NaCl.
(4)【设计并实验】
①小强取样品少量,滴加无色酚酞试液,液体变红色他认为猜想①正确,他的判断是不合理的,原因是 .
②小华为了检验该溶液到底是什么又进行了如下实验:取样品于试管中,滴加氯化钙溶液,有白色沉淀生成.猜想②正确.反应的化学方程式 .
答案解析部分
1.【答案】D
2.【答案】B
3.【答案】A
4.【答案】B
5.【答案】D
6.【答案】D
7.【答案】D
8.【答案】C
9.【答案】D
10.【答案】C
11.【答案】A
12.【答案】A
13.【答案】64;28.1%
14.【答案】6440;4600
15.【答案】降低温度;蒸发结晶;16.7%;B>A>C
16.【答案】水;15;量筒量取水时,俯视读数,造成实际取得的水偏少,质量分数偏大;黄;;1;;;增大;26.5%;;产生白色沉淀
17.【答案】(1)0℃~t1℃
(2)C;A
(3)C>B>A
18.【答案】托盘天平;10;100mL量筒;90;玻璃棒
19.【答案】(1)甲=乙
(2)甲
(3)B
20.【答案】(1)是
(2)氯化钾
(3)50
(4)A、D
21.【答案】(1)解:根据化学反应可知,二氧化碳的质量等于质量的变化值,所以二氧化碳的质量=100g+50g﹣147.8g=2.2g
(2)解:设生成2.2g二氧化碳气体需要硫酸的质量是x,生成硫酸钠的质量为y,
Na2CO3+ H2SO4═ Na2SO4+H2O+ CO2↑
98 142 44
X y 2.2g
解得:x=4.9g y=7.1g;
所以原混合物中硫酸钠的质量为7.8﹣7.1=0.7g
(3)解:稀硫酸的质量分数是: =9.8%
22.【答案】(1)A
(2)NaHCO3
(3)Na2CO3
(4)Na2CO3溶液也显碱性;Na2CO3+CaCl2=CaCO3↓+2NaCl
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
