10.1 常见的酸和碱 同步练习(含答案) 2022-2023学年人教版九年级下册化学
文档属性
| 名称 | 10.1 常见的酸和碱 同步练习(含答案) 2022-2023学年人教版九年级下册化学 |  | |
| 格式 | zip | ||
| 文件大小 | 231.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-16 10:26:25 | ||
图片预览




文档简介
10.1 常见的酸和碱 同步练习 2022-2023学年人教版九年级下册化学
一、单选题
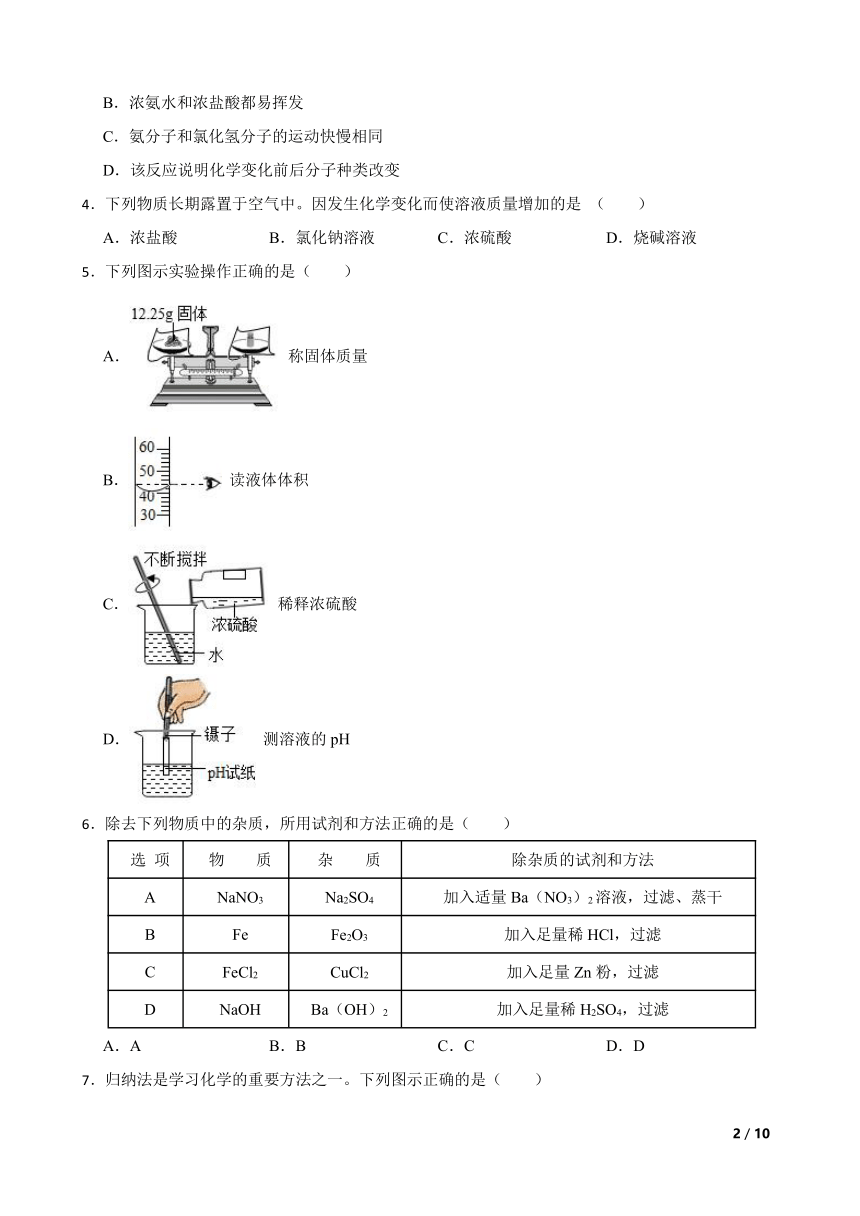
1.下列实验现象的描述,正确的是( )
A.向少量氧化铁粉末中加入足量稀盐酸,红色粉末逐渐消失,溶液变为浅绿色
B.在氯化铜溶液中加入银片,析出红色固体
C.打开装有浓盐酸试剂瓶的瓶塞,在瓶口上方观察到白烟
D.硝酸铵固体溶于水,溶液温度会降低
2.下列图像能正确表示其对应关系的是( )
A. 高温煅烧一定质量的石灰石,剩余固体质量随时间的变化
B. 某物质的着火点为t℃,则图中P点时,该物质燃烧得最旺
C. 20℃时,向一定量接近饱和的KNO3溶液中加入KNO3固体
D. 向一定量Ba(OH)2溶液中逐滴加入稀盐酸至过量,溶液pH的变化
3.取一滤纸条,等间距滴入10滴紫色石蕊溶液,装入玻璃管中,然后从玻璃管的两端同时放入分别蘸有浓氨水和浓盐酸的棉球,并迅速封闭两端管口,很快可观察到管内有白烟产生,待白烟消失后还可观察到如图所示的现象。下列说法错误的是( )
A.该反应有固体生成
B.浓氨水和浓盐酸都易挥发
C.氨分子和氯化氢分子的运动快慢相同
D.该反应说明化学变化前后分子种类改变
4.下列物质长期露置于空气中。因发生化学变化而使溶液质量增加的是 ( )
A.浓盐酸 B.氯化钠溶液 C.浓硫酸 D.烧碱溶液
5.下列图示实验操作正确的是( )
A. 称固体质量
B. 读液体体积
C. 稀释浓硫酸
D. 测溶液的pH
6.除去下列物质中的杂质,所用试剂和方法正确的是( )
选 项 物 质 杂 质 除杂质的试剂和方法
A NaNO3 Na2SO4 加入适量Ba(NO3)2溶液,过滤、蒸干
B Fe Fe2O3 加入足量稀HCl,过滤
C FeCl2 CuCl2 加入足量Zn粉,过滤
D NaOH Ba(OH)2 加入足量稀H2SO4,过滤
A.A B.B C.C D.D
7.归纳法是学习化学的重要方法之一。下列图示正确的是( )
A.有机合成材料
B.地壳中各元素含量
C.铁合金含碳量
D.碱的化学性质
8.下列实验方案能达到实验目的的是( )
序号 实验目的 实验方案
A 检验某集气瓶中的气体是否是二氧化碳 将燃着的木条伸入集气瓶中
B 验证稀盐酸与NaOH溶液是否恰好完全反应 向反应后的溶液中滴加AgNO3溶液
C 除去N2中少量的H2 将气体依次通入灼热CuO和浓硫酸
D 稀释浓硫酸 将水沿着烧杯内壁慢慢注入浓硫酸中,并不断搅拌
A.A B.B C.C D.D
9.化学是一门以实验为基础的学科。以下实验操作正确的是( )
A.过滤黄河水
B.稀释浓硫酸
C.验满二氧化碳
D.称量固体药品
10.向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,向滤液中插入锌片,有气泡产生。则以下判断错误的是( )
A.不溶物中一定含有铁 B.滤液中一定含有硫酸
C.不溶物中一定含有铜 D.滤液中一定含有硫酸亚铁
11.下列四个图象,分别对应四种操作过程,其中正确的是( )
A.向一定溶质质量分数的盐酸中加入大量水
B.向硝酸铜和盐酸的混合溶液中加入过量氢氧化钡溶液
C.向两份同体积和相同质量分数的盐酸中分别加入足量的锌粉和镁粉
D.某温度下,向接近饱和的氯化钠溶液中加入氯化钠晶体
12.生活处处有化学,安全时刻记心中。下列做法不合理的是( )
A.吃松花蛋时,为消除蛋中所含碱性物质的涩味,可加入少量食醋
B.炒菜时,油锅不慎着火迅速用锅盖盖灭
C.启用闲置的地窖前先进行灯火实验
D.夜间发现家中天然气泄漏,立即开灯查明泄漏原因
二、填空题
13.Ca(OH)2是建筑工业中常用的原材料,它 (填“是”或“不是”)氧化物,它的摩尔质量为 ,其中钙、氢、氧元素的原子个数比为 .Ca(OH)2与其它物质间相互反应的关系如图:(图中“——”表示相连的两种物质能发生化学反应)
① 若X是与其它三种不同类别的化合物,则X可以是 .
② 根据图中所示的物质间关系,写出其中两个反应的化学方程式:
Ⅰ. ;
Ⅱ. .
14.如图所示是化学试剂瓶上的标签,取10mL该硫酸可配制成9.8%的稀硫酸质量为 g,配制9.8%的稀硫酸的操作是 ;完全中和稀硫酸需要氢氧化钠的质量为mg,若用mg氢氧化钾与上述稀硫酸充分反应,所得溶液的pH 7(填“大于”、“小于”或“等于”)
15.新型冠状病毒肆虑,许多“明星物质”出现在公众视野。回答问题:
(1)口罩有很好的阻隔作用,起过滤作用的主要是内层过滤布,其材质主要是聚丙烯,原材料是丙烯(分子结构模型如图所示),每个丙烯分子中有 个原子。
(2)84消毒液主要成分为次氯酸钠(化学式为NaClO,NaClO中氯元素的化合价为 。测得某84消毒液的pH值为12,该84消毒液显 (填字母序号)。
A.酸性 B.中性 C.碱性 D.无法确定
(3)甘肃中药材在疫情防控中发挥了重要的作用。生石灰常用来保存中药材,用化学方程式表示其原理 。
16.将浓盐酸、氢氧化钠、石灰水三种物质的溶液长期存放在空气中,溶液质量因发生化学变化而减小的物质是 ,反应的化学方程式为 ,因发生化学变化溶液质量增大的物质是 .
17.消除安全隐患,严防事故发生。锅炉发生爆炸,可能是由于锅炉内水垢过厚或缺水造成的。为了防止锅炉因炉内水垢过厚而引起爆炸,常采用下列措施。
(1)锅炉使用软水。常用 来检验软水和硬水;
(2)定期清洗锅炉。水垢主要成分是碳酸钙(CaCO3)和氢氧化镁[Mg(OH)2],在工业上常用盐酸清洗,请写出盐酸与水垢中一种成分发生反应的化学方程式: 。在生活中可用 (填一种调味品)除去水壶或盛水器具中的水垢。
18.用石灰浆抹的墙壁逐渐变得坚硬,用化学方程式解释其原因 .
三、综合题
19.阅读下列短文,回答同题,
关于什么是酸和碱,其理论的形成有如下发展历程。
观点1:17世纪前,人们对酸碱的认识模糊,只凭感觉器官的感受来判定。
观点2:17世起末,朴素的酸感理论,凡物质的水溶液能使石蕊试液变红的物质叫酸:使石蕊试液变蓝的物质叫碱。
观点3:19世纪末,酸碱电离理论:电离时所生成的阳离子全部是H+的化合物叫酸,电离时所生成的阴离子全是OH-的化合物叫碱。
观点4:20世纪初,酸碱质子理论,任何能给出质子的物质(分子、原于或离子)都是酸,任何能接受质子的物质(分子、原于或离子)都是碱,且酸碱有如下关系:酸→H++碱,两者彼此联系在一起叫做共轭酸碱对酸失去一个质子后形成的物质叫做该酸的共轭碱,碱结合一个质子后形成的物质叫做该碱的共轭酸。
(1)根据观点1的判断,人们常吃的柠檬中含有 (选填“酸”或“碱”)。
(2)往碳酸氢钠溶液中滴加紫色石蕊溶液,变蓝,根据观点2,得到的结论是 。
(3)硫酸氢钠溶液中含氢离子,钠离子和硫酸根离子,根据观点3,硫酸氢钠 (填“是”或“不是”)酸。
(4)已知稀盐酸的电离方程式为 ,根据观点4,盐酸的共轭碱是 ;请写出稀硫酸的电离方程式 。
20.用化学知识可以解释许多生活生产中的问题和现象。
(1)“腌笃鲜”是苏州的一道时令美食。下列制作“腌笃鲜”的食材中,能提供蛋白质的是 (填字母序号).
(2)很多便利店售自热小火锅,其发热的原理是利用了生石灰与水反应放热,写出发生反应的化学方程式 ,反应结束后得到的是 液。
(3)铝制门窗比较耐腐蚀,主要原因是 (用文字叙述)。小红还发现新买的家具带有异味,于是在室内放了几个活性炭包以达到除去异味的目的,这是利用了活性炭的 性。
21.请选择与下列叙述相对应物质的序号填空:
①N2②CaO ③Ca(OH)2④CH4⑤KNO3
(1)天然气的主要成分: ;
(2)空气中含量最高的气体: .
(3)一种常用的复合肥: ;
(4)可用于改良酸性土壤的碱: .
(5)常用的干燥剂: .
四、实验探究题
22.在学习盐酸的化学性质时,小红、芳芳两位同学分别作了碳酸钠溶液和稀盐酸反应的实验如图所示。
(1)(实验现象)小红在实验中观察到有气泡冒出,而芳芳所做的实验无现象。写出小红实验的化学反应方程式: 。
(2)(实验讨论)芳芳同学的试验为什么观察不到有气泡?
反应后溶液的溶质有哪些?
(查阅资料)①碳酸钠和稀盐酸反应生成物受到盐酸的质量影响,稀盐酸过量生成二氧化碳,若盐酸量不足则生成碳酸氢钠;②碳酸氢钠与氯化钙溶液混合不发生反应,而碳酸钠和氯化钙溶液反应生成沉淀,且碳酸钠和碳酸氢钠溶液都呈碱性,氯化钙溶液呈中性。
(猜想与假设)实验反应后溶液中溶质可能有:①NaHCO3、NaCl、Na2CO3; ②NaHCO3、NaCl; ③NaHCO3、NaCl、HCl。
芳芳同学认为猜想③肯定不成立,理由是 。
(3)(实验设计)确定芳芳同学实验是否生成碳酸氢钠,并证明反应后的产物。
实验步骤 实验现象 实验结论
A、取上述溶液少量于试管中,加入足量的 溶液。 产生白色沉淀 猜想①正确
B、取步骤A所得上层清液少量,滴加 溶液。
(4)(实验反思)若用少量的稀盐酸鉴定氢氧化钠是否变质,发现无气泡冒出,则证明氢氧化钠溶液没有变质。对此实验结论,你是否赞同?若不赞同,还需说明理由。 。
答案解析部分
1.【答案】D
2.【答案】C
3.【答案】C
4.【答案】D
5.【答案】C
6.【答案】A
7.【答案】C
8.【答案】C
9.【答案】A
10.【答案】A
11.【答案】C
12.【答案】D
13.【答案】不是;74g/mol(漏单位不给分);1:2:2;CO2(或二氧化碳);Ca(OH)2 +Na2CO3 = Ca CO3↓+ 2NaOH;Ca(OH)2 + 2HCl = CaCl2 + 2H2O
14.【答案】184;用量筒量取浓硫酸和水,把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌;小于
15.【答案】(1)9
(2)+1;C
(3)
16.【答案】石灰水;Ca(OH)2+CO2=CaCO3↓+H2O;氢氧化钠
17.【答案】(1)肥皂水
(2)CaCO3+2HCl═CaCl2+H2O+CO2↑或Mg(OH)2+2HCl═MgCl2+2H2O;食醋
18.【答案】Ca(OH)2+CO2=CaCO3↓+H2O
19.【答案】(1)酸
(2)碳酸氢钠是碱
(3)不是
(4)Cl-;H2SO4=2H++SO42-
20.【答案】(1)BCD
(2);悬浊
(3)铝在空气中会与氧气形成一层致密的氧化膜;吸附
21.【答案】(1)④
(2)①
(3)⑤
(4)③
(5)②
22.【答案】(1)Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)碳酸氢钠会与盐酸反应
(3)CaCl2;无色酚酞试液(或稀盐酸);无色酚酞试液变红色(或有气泡产生)
(4)不赞同,因为变质后的碳酸钠与少量的盐酸反应生成碳酸氢钠,也无气泡产生。(或若氢氧化钠部分变质,加入少量的盐酸先与氢氧化钠发生中和反应,也无气泡产生。)
1 / 1
一、单选题
1.下列实验现象的描述,正确的是( )
A.向少量氧化铁粉末中加入足量稀盐酸,红色粉末逐渐消失,溶液变为浅绿色
B.在氯化铜溶液中加入银片,析出红色固体
C.打开装有浓盐酸试剂瓶的瓶塞,在瓶口上方观察到白烟
D.硝酸铵固体溶于水,溶液温度会降低
2.下列图像能正确表示其对应关系的是( )
A. 高温煅烧一定质量的石灰石,剩余固体质量随时间的变化
B. 某物质的着火点为t℃,则图中P点时,该物质燃烧得最旺
C. 20℃时,向一定量接近饱和的KNO3溶液中加入KNO3固体
D. 向一定量Ba(OH)2溶液中逐滴加入稀盐酸至过量,溶液pH的变化
3.取一滤纸条,等间距滴入10滴紫色石蕊溶液,装入玻璃管中,然后从玻璃管的两端同时放入分别蘸有浓氨水和浓盐酸的棉球,并迅速封闭两端管口,很快可观察到管内有白烟产生,待白烟消失后还可观察到如图所示的现象。下列说法错误的是( )
A.该反应有固体生成
B.浓氨水和浓盐酸都易挥发
C.氨分子和氯化氢分子的运动快慢相同
D.该反应说明化学变化前后分子种类改变
4.下列物质长期露置于空气中。因发生化学变化而使溶液质量增加的是 ( )
A.浓盐酸 B.氯化钠溶液 C.浓硫酸 D.烧碱溶液
5.下列图示实验操作正确的是( )
A. 称固体质量
B. 读液体体积
C. 稀释浓硫酸
D. 测溶液的pH
6.除去下列物质中的杂质,所用试剂和方法正确的是( )
选 项 物 质 杂 质 除杂质的试剂和方法
A NaNO3 Na2SO4 加入适量Ba(NO3)2溶液,过滤、蒸干
B Fe Fe2O3 加入足量稀HCl,过滤
C FeCl2 CuCl2 加入足量Zn粉,过滤
D NaOH Ba(OH)2 加入足量稀H2SO4,过滤
A.A B.B C.C D.D
7.归纳法是学习化学的重要方法之一。下列图示正确的是( )
A.有机合成材料
B.地壳中各元素含量
C.铁合金含碳量
D.碱的化学性质
8.下列实验方案能达到实验目的的是( )
序号 实验目的 实验方案
A 检验某集气瓶中的气体是否是二氧化碳 将燃着的木条伸入集气瓶中
B 验证稀盐酸与NaOH溶液是否恰好完全反应 向反应后的溶液中滴加AgNO3溶液
C 除去N2中少量的H2 将气体依次通入灼热CuO和浓硫酸
D 稀释浓硫酸 将水沿着烧杯内壁慢慢注入浓硫酸中,并不断搅拌
A.A B.B C.C D.D
9.化学是一门以实验为基础的学科。以下实验操作正确的是( )
A.过滤黄河水
B.稀释浓硫酸
C.验满二氧化碳
D.称量固体药品
10.向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,向滤液中插入锌片,有气泡产生。则以下判断错误的是( )
A.不溶物中一定含有铁 B.滤液中一定含有硫酸
C.不溶物中一定含有铜 D.滤液中一定含有硫酸亚铁
11.下列四个图象,分别对应四种操作过程,其中正确的是( )
A.向一定溶质质量分数的盐酸中加入大量水
B.向硝酸铜和盐酸的混合溶液中加入过量氢氧化钡溶液
C.向两份同体积和相同质量分数的盐酸中分别加入足量的锌粉和镁粉
D.某温度下,向接近饱和的氯化钠溶液中加入氯化钠晶体
12.生活处处有化学,安全时刻记心中。下列做法不合理的是( )
A.吃松花蛋时,为消除蛋中所含碱性物质的涩味,可加入少量食醋
B.炒菜时,油锅不慎着火迅速用锅盖盖灭
C.启用闲置的地窖前先进行灯火实验
D.夜间发现家中天然气泄漏,立即开灯查明泄漏原因
二、填空题
13.Ca(OH)2是建筑工业中常用的原材料,它 (填“是”或“不是”)氧化物,它的摩尔质量为 ,其中钙、氢、氧元素的原子个数比为 .Ca(OH)2与其它物质间相互反应的关系如图:(图中“——”表示相连的两种物质能发生化学反应)
① 若X是与其它三种不同类别的化合物,则X可以是 .
② 根据图中所示的物质间关系,写出其中两个反应的化学方程式:
Ⅰ. ;
Ⅱ. .
14.如图所示是化学试剂瓶上的标签,取10mL该硫酸可配制成9.8%的稀硫酸质量为 g,配制9.8%的稀硫酸的操作是 ;完全中和稀硫酸需要氢氧化钠的质量为mg,若用mg氢氧化钾与上述稀硫酸充分反应,所得溶液的pH 7(填“大于”、“小于”或“等于”)
15.新型冠状病毒肆虑,许多“明星物质”出现在公众视野。回答问题:
(1)口罩有很好的阻隔作用,起过滤作用的主要是内层过滤布,其材质主要是聚丙烯,原材料是丙烯(分子结构模型如图所示),每个丙烯分子中有 个原子。
(2)84消毒液主要成分为次氯酸钠(化学式为NaClO,NaClO中氯元素的化合价为 。测得某84消毒液的pH值为12,该84消毒液显 (填字母序号)。
A.酸性 B.中性 C.碱性 D.无法确定
(3)甘肃中药材在疫情防控中发挥了重要的作用。生石灰常用来保存中药材,用化学方程式表示其原理 。
16.将浓盐酸、氢氧化钠、石灰水三种物质的溶液长期存放在空气中,溶液质量因发生化学变化而减小的物质是 ,反应的化学方程式为 ,因发生化学变化溶液质量增大的物质是 .
17.消除安全隐患,严防事故发生。锅炉发生爆炸,可能是由于锅炉内水垢过厚或缺水造成的。为了防止锅炉因炉内水垢过厚而引起爆炸,常采用下列措施。
(1)锅炉使用软水。常用 来检验软水和硬水;
(2)定期清洗锅炉。水垢主要成分是碳酸钙(CaCO3)和氢氧化镁[Mg(OH)2],在工业上常用盐酸清洗,请写出盐酸与水垢中一种成分发生反应的化学方程式: 。在生活中可用 (填一种调味品)除去水壶或盛水器具中的水垢。
18.用石灰浆抹的墙壁逐渐变得坚硬,用化学方程式解释其原因 .
三、综合题
19.阅读下列短文,回答同题,
关于什么是酸和碱,其理论的形成有如下发展历程。
观点1:17世纪前,人们对酸碱的认识模糊,只凭感觉器官的感受来判定。
观点2:17世起末,朴素的酸感理论,凡物质的水溶液能使石蕊试液变红的物质叫酸:使石蕊试液变蓝的物质叫碱。
观点3:19世纪末,酸碱电离理论:电离时所生成的阳离子全部是H+的化合物叫酸,电离时所生成的阴离子全是OH-的化合物叫碱。
观点4:20世纪初,酸碱质子理论,任何能给出质子的物质(分子、原于或离子)都是酸,任何能接受质子的物质(分子、原于或离子)都是碱,且酸碱有如下关系:酸→H++碱,两者彼此联系在一起叫做共轭酸碱对酸失去一个质子后形成的物质叫做该酸的共轭碱,碱结合一个质子后形成的物质叫做该碱的共轭酸。
(1)根据观点1的判断,人们常吃的柠檬中含有 (选填“酸”或“碱”)。
(2)往碳酸氢钠溶液中滴加紫色石蕊溶液,变蓝,根据观点2,得到的结论是 。
(3)硫酸氢钠溶液中含氢离子,钠离子和硫酸根离子,根据观点3,硫酸氢钠 (填“是”或“不是”)酸。
(4)已知稀盐酸的电离方程式为 ,根据观点4,盐酸的共轭碱是 ;请写出稀硫酸的电离方程式 。
20.用化学知识可以解释许多生活生产中的问题和现象。
(1)“腌笃鲜”是苏州的一道时令美食。下列制作“腌笃鲜”的食材中,能提供蛋白质的是 (填字母序号).
(2)很多便利店售自热小火锅,其发热的原理是利用了生石灰与水反应放热,写出发生反应的化学方程式 ,反应结束后得到的是 液。
(3)铝制门窗比较耐腐蚀,主要原因是 (用文字叙述)。小红还发现新买的家具带有异味,于是在室内放了几个活性炭包以达到除去异味的目的,这是利用了活性炭的 性。
21.请选择与下列叙述相对应物质的序号填空:
①N2②CaO ③Ca(OH)2④CH4⑤KNO3
(1)天然气的主要成分: ;
(2)空气中含量最高的气体: .
(3)一种常用的复合肥: ;
(4)可用于改良酸性土壤的碱: .
(5)常用的干燥剂: .
四、实验探究题
22.在学习盐酸的化学性质时,小红、芳芳两位同学分别作了碳酸钠溶液和稀盐酸反应的实验如图所示。
(1)(实验现象)小红在实验中观察到有气泡冒出,而芳芳所做的实验无现象。写出小红实验的化学反应方程式: 。
(2)(实验讨论)芳芳同学的试验为什么观察不到有气泡?
反应后溶液的溶质有哪些?
(查阅资料)①碳酸钠和稀盐酸反应生成物受到盐酸的质量影响,稀盐酸过量生成二氧化碳,若盐酸量不足则生成碳酸氢钠;②碳酸氢钠与氯化钙溶液混合不发生反应,而碳酸钠和氯化钙溶液反应生成沉淀,且碳酸钠和碳酸氢钠溶液都呈碱性,氯化钙溶液呈中性。
(猜想与假设)实验反应后溶液中溶质可能有:①NaHCO3、NaCl、Na2CO3; ②NaHCO3、NaCl; ③NaHCO3、NaCl、HCl。
芳芳同学认为猜想③肯定不成立,理由是 。
(3)(实验设计)确定芳芳同学实验是否生成碳酸氢钠,并证明反应后的产物。
实验步骤 实验现象 实验结论
A、取上述溶液少量于试管中,加入足量的 溶液。 产生白色沉淀 猜想①正确
B、取步骤A所得上层清液少量,滴加 溶液。
(4)(实验反思)若用少量的稀盐酸鉴定氢氧化钠是否变质,发现无气泡冒出,则证明氢氧化钠溶液没有变质。对此实验结论,你是否赞同?若不赞同,还需说明理由。 。
答案解析部分
1.【答案】D
2.【答案】C
3.【答案】C
4.【答案】D
5.【答案】C
6.【答案】A
7.【答案】C
8.【答案】C
9.【答案】A
10.【答案】A
11.【答案】C
12.【答案】D
13.【答案】不是;74g/mol(漏单位不给分);1:2:2;CO2(或二氧化碳);Ca(OH)2 +Na2CO3 = Ca CO3↓+ 2NaOH;Ca(OH)2 + 2HCl = CaCl2 + 2H2O
14.【答案】184;用量筒量取浓硫酸和水,把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌;小于
15.【答案】(1)9
(2)+1;C
(3)
16.【答案】石灰水;Ca(OH)2+CO2=CaCO3↓+H2O;氢氧化钠
17.【答案】(1)肥皂水
(2)CaCO3+2HCl═CaCl2+H2O+CO2↑或Mg(OH)2+2HCl═MgCl2+2H2O;食醋
18.【答案】Ca(OH)2+CO2=CaCO3↓+H2O
19.【答案】(1)酸
(2)碳酸氢钠是碱
(3)不是
(4)Cl-;H2SO4=2H++SO42-
20.【答案】(1)BCD
(2);悬浊
(3)铝在空气中会与氧气形成一层致密的氧化膜;吸附
21.【答案】(1)④
(2)①
(3)⑤
(4)③
(5)②
22.【答案】(1)Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)碳酸氢钠会与盐酸反应
(3)CaCl2;无色酚酞试液(或稀盐酸);无色酚酞试液变红色(或有气泡产生)
(4)不赞同,因为变质后的碳酸钠与少量的盐酸反应生成碳酸氢钠,也无气泡产生。(或若氢氧化钠部分变质,加入少量的盐酸先与氢氧化钠发生中和反应,也无气泡产生。)
1 / 1
同课章节目录
