人教版(2019)高中化学必修一 4.3.3 氢键 课件(31张PPT)
文档属性
| 名称 | 人教版(2019)高中化学必修一 4.3.3 氢键 课件(31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-16 15:21:11 | ||
图片预览






文档简介
(共31张PPT)
第四章 物质结构 元素周期律
第三节 化学键
第3课时 分子间作用力 氢键
1.在100℃、101 kPa时,将1 mol H2O(l)变成1 mol H2O(g)需吸收能量47.3 kJ。
H2O(l) H2O(g)
能量
1mol H2O
H + H
O
断裂2mol H-O键,需要436KJ能量
想一想:以上两种变化分别是物理变化,还是化学变化?
所消耗的能量差距为什么这么大呢?
2.将水分子分解为氢气和氧气需2000℃以上的高温,将1 mol H2O拆分为2 mol H和1 mol O需吸收能量436 kJ。
(思考)
物理变化
化学变化
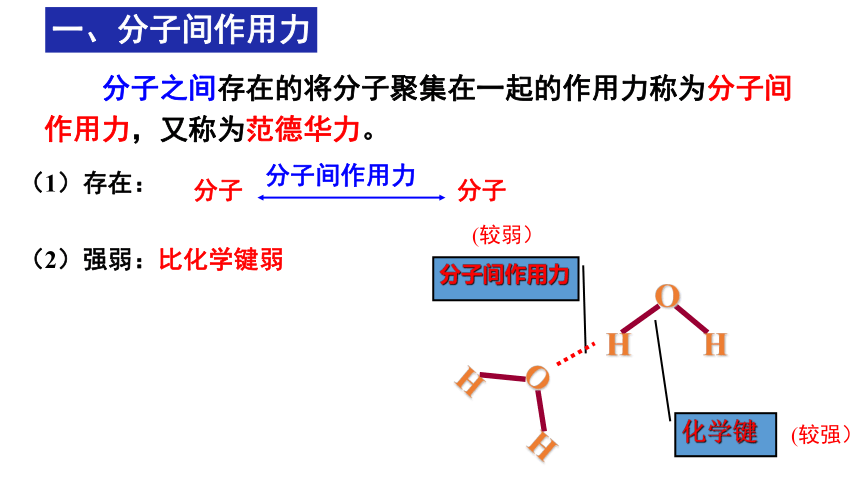
一、分子间作用力
分子之间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。
(1)存在:
分子 分子
分子间作用力
O
H
H
O
H
H
分子间作用力
化学键
(2)强弱:比化学键弱
(较弱)
(较强)
作用微粒 作用力强弱 大小范围
化学键
分子间作用力(范德华力)
原子或离子之间
分子之间
微弱作用
分子间作用力与化学键的比较
强烈作用
约125--836KJ/mol
约2--20KJ/mol
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么
1.为什么NaCl在熔化状态或水溶液中具有导电性,而液态氯化氢却不具有导电性
前者熔化或溶于水破坏了离子键,形成可自由移动的阴阳离子
后者原子间以共价键结合,分子间存在分子间作用力
物质变化时,没有克服化学键的是( )
A、 H2O电解 B 、I2升华
C、烧碱熔化 D、 NaCl溶于水
E、HCl溶于水 F、蔗糖溶于水
G、冰融化
离子键、共价键、分子间作用力都是微粒间的作用力。下列物质中,只存在一种作用力的是 ( )
A.干冰 B.NaCl C.NaOH
D.I2 E.H2SO4 F.Ar
B、F
B、F、G
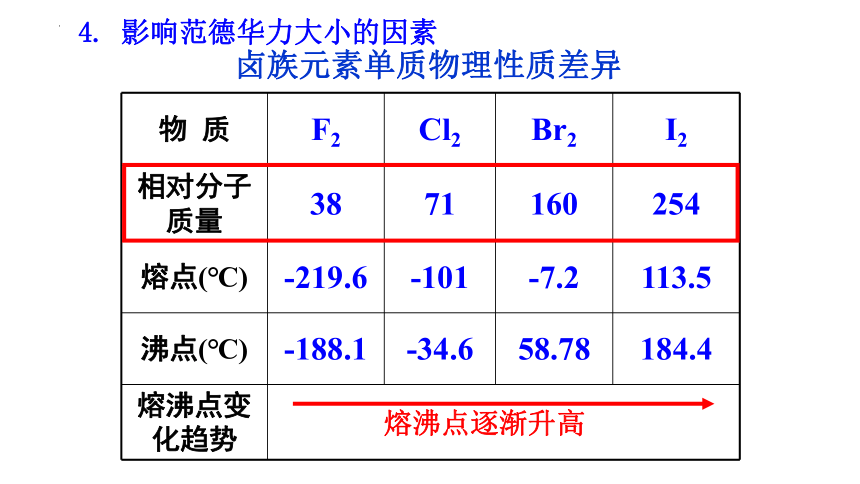
物 质 F2 Cl2 Br2 I2
相对分子质量 38 71 160 254
熔点(℃) -219.6 -101 -7.2 113.5
沸点(℃) -188.1 -34.6 58.78 184.4
熔沸点变化趋势 卤族元素单质物理性质差异
熔沸点逐渐升高
4. 影响范德华力大小的因素
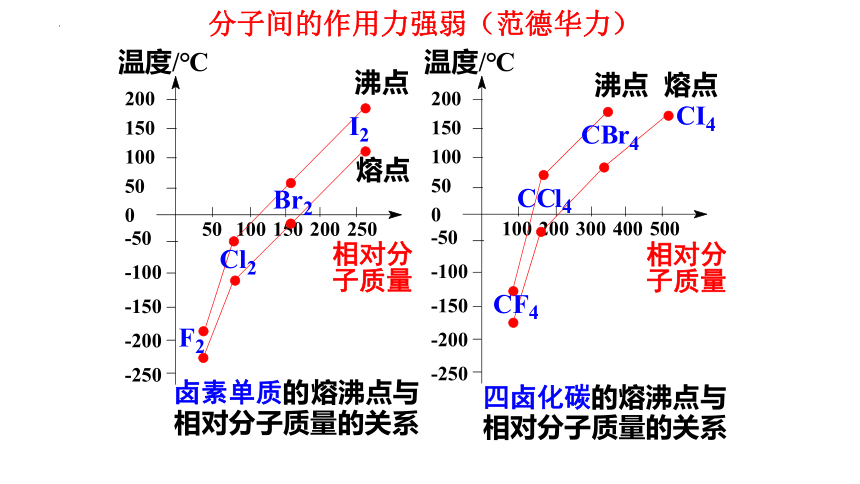
分子间的作用力强弱(范德华力)
结 论
组成和结构相似的物质
相对分子质量越大
分子间作用力越大
物质熔沸点越高
分子间的作用力强弱(范德华力)
比较下列物质的熔沸点的高低
CH4_ CF4 _ CCl4 _ CBr4 _ CI4
H2O_ H2S _ H2Se _ H2Te
HF_HCl_HBr _HI
<
<
<
<
<
<
<
<
<
<
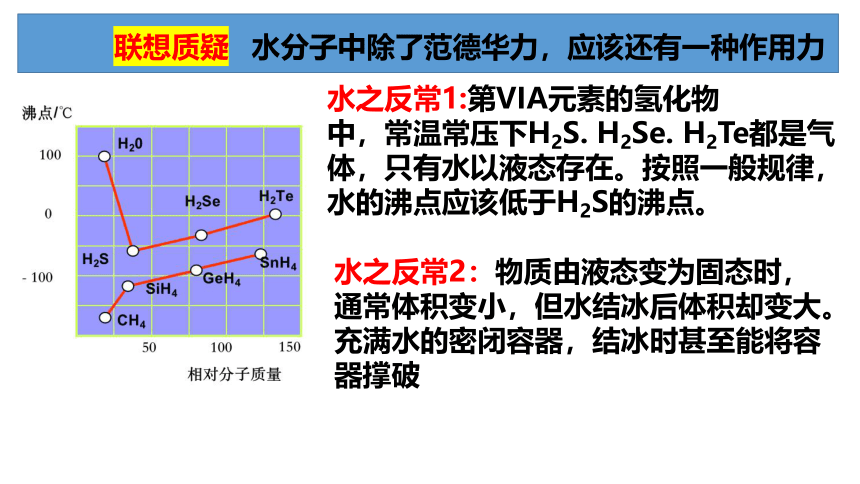
联系生活实际 你能发现什么矛盾吗
联想质疑
水之反常1:第VIA元素的氢化物
中,常温常压下H2S. H2Se. H2Te都是气体,只有水以液态存在。按照一般规律,水的沸点应该低于H2S的沸点。
水之反常2:物质由液态变为固态时,通常体积变小,但水结冰后体积却变大。充满水的密闭容器,结冰时甚至能将容器撑破
水分子中除了范德华力,应该还有一种作用力
问题探究1:
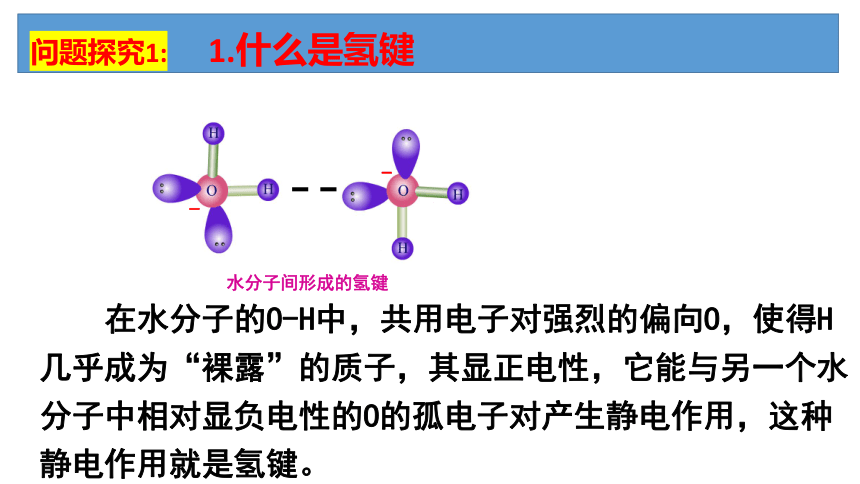
1.什么是氢键
水分子间形成的氢键
+
+
+
+
-
-
在水分子的O-H中,共用电子对强烈的偏向O,使得H几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中相对显负电性的O的孤电子对产生静电作用,这种静电作用就是氢键。
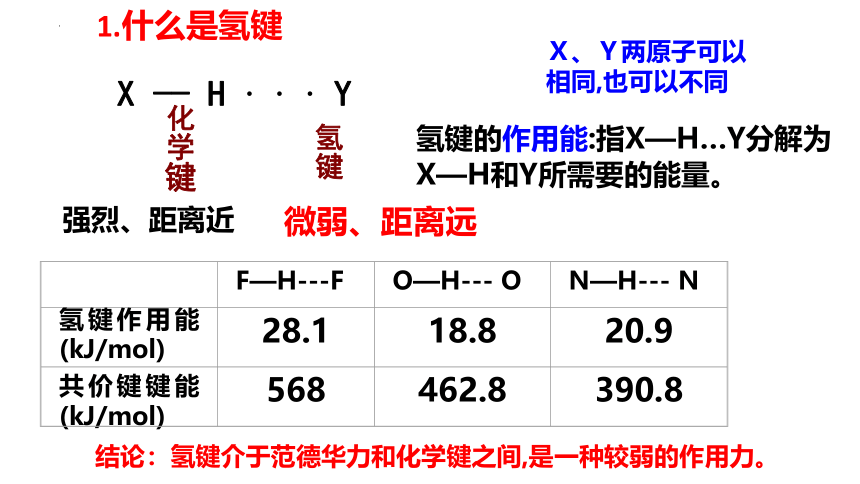
X —— H · · · Y
化学键
氢键
强烈、距离近
微弱、距离远
X、Y两原子可以相同,也可以不同
氢键的作用能:指X—H…Y分解为
X—H和Y所需要的能量。
1.什么是氢键
F—H---F
O—H--- O
N—H--- N
氢键作用能(kJ/mol)
28.1
18.8
20.9
共价键键能(kJ/mol)
568
462.8
390.8
结论:氢键介于范德华力和化学键之间,是一种较弱的作用力。
问题探究2:
2、氢键形成的条件
1、结合下列数据分析下列间题:
①为什么H2O分子间能形成氢键,而CH4分子间难形成氢键?
②为什么NH3分子间能形成氢键,而HCI分子间难形成氢键?
O原子的电负性强
N原子的半径小
氢键的本质: 强极性键(X-H)上的氢与电负性很大的、含孤电子对并带有部分负电荷的原子Y之间的静电作用力。
⑵ X—H…Y中的Y必须电负性强、原子半径小、具有孤对电子。X、Y可以相同,也可以不同。
⑴有X-H共价键,X原子电负性强,原子半径小,主要是F、O、N。
氢键的形成条件
3、氢键的特点:
有方向性,有饱和性
方向性(X-H…Y尽可能在同一条直线上)
饱和性(一个X-H只能和一个Y原子结合)
典例剖析
例1、下列物质中,分子间不能形成氢键的是( )
A、NH3 B、HF C、CH3CH2OH D、CH4
例2.固体乙醇晶体中不存在的作用力是( )
A.极性键 B.非极性键 C.离子键 D.氢键
例3. 共价键、离子键和范德华力是构成物质时粒子间的不同作用力。下列物质中,只含有上述一种作用力的是( )
A.干冰 B.氯化钠 C.氢氧化钠 D.碘
例4.下列说法正确的是( )
A.氢键不是化学键
B.甲烷可与水形成氢键
C.乙醇分子跟水分子之间只存在范德华力
D.溴化氢的沸点比氯化氢的高,是由于溴化氢分子间存在氢键
例5:写出下列物质中可能存在的氢键的表示式:①液氨 ②冰 ③氢氟酸
氢键的种类
氢键的种类
问题探究3:
邻羟基苯甲醛和对羟基苯甲醛是同分异构体。邻羟基苯甲醛的熔点为 2℃,沸点196.5 ℃ ,对羟基苯甲醛的熔点为 115℃,沸点246.6℃
请从邻羟基苯甲醛和
对羟基苯甲醛的结构
出发,分析二者形成
的氢键类型有何差别?
对熔沸点有何影响?
分子间氢键增强分子间作用力,使熔沸点升高。
分子内氢键削弱分子间作用力,使熔沸点降低。
4、氢键对物质性质的影响
●●●
思考讨论
1、NH3极易溶于水?NH3溶于水是形成N-H…O还是形成O-H…N
2、水和甲醇互溶原因?
形成氢键,也是溶液呈碱性原因。
水、甲醇互溶
氢键存在增大了溶解性。
(2)氢键对溶解度的影响
溶质分子与溶剂分子间形成氢键使溶质溶解度增大
(3)氢键对水的密度的影响
在水蒸气中,水以单个H2O 分子形式存在;
在液态水中,几个水分子通过氢键结合形成(H2O)n缔合分子;
讨论水的特殊性:
(1)水的熔沸点比较高?
(2)为什么结冰后体积膨胀浮在水面上?
在固态水(冰)中,水分子大范围地以氢键互相联结。形成相当疏松晶体,结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
(1)冰熔化或汽化时__________被破坏,分子____变化,属____变化;
(4)干冰升华时___________被破坏,属于_____变化
(5)食盐融化时_______被破坏,属于_____变化
(6) 金刚石融化时_______被破坏,属于_____变化
(3)碘化氢分解时_______被破坏,属于_____变化
(2)水分解时_______被破坏,分子_____变化,属于_____变化;
氢键和分子
间作用力
没有
物理
共价键
发生
化学
共价键
化学
分子间作用力
物理
离子键
物理
共价键
物理
分子直接构成的物质:
物理性质→
化学性质→
原子直接构成的物质:
物理性质→共价键
化学性质→共价键
离子化合物:
物理性质→离子键
化学性质→离子键
分子间作用力
共价键
分子间作用力、氢键与化学键的比较
存在 强弱 强弱因素 影响性质
共价键
离子键
范德华力
氢键 _____________
原子间
分子间
离子间
某些分子间
强烈
强烈
远小于化学键
略大于范德华力
微弱
原子半径
离子半径
带电荷数
相对分子质量
化学性质或物理性质
只物理
性质
1、下列说法正确的是 ( )
A.水很稳定是由于水分子间存在氢键
B.NaOH融化时离子键和共价键发生断裂
C.碳酸钙分解时发生了化学键的断裂和形成
D.冰融化时要吸热,所以共价键断裂
E.任何分子中都含有共价键
F.分子间作用力越大熔化或气化时所需的能量就越多,其化学性质也越稳定
C
2.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4 、 SnH4的熔点随相对分子质量的增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
B
3.下列过程中,共价键被破坏的是( )
A.碘升华
B.溴蒸气被木炭吸附
C.蔗糖溶于水
D.氯化氢气体溶于水
E.烧碱溶于水
D
4下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键
C
5.下列各组性质的比较不正确的是( )
A.酸性:HClO4>H2SO4>H3PO4>H2SiO3
B.稳定性:HF>H2O>H2S
C.碱性:KOH>NaOH>Mg(OH)2
D.熔、沸点:HI>HBr>HCl>HF
D
7.(2019福建三明第一中学开学考试)下列过程中化学键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水
④HCl气体溶于水 ⑤MgCl2溶解于水 ⑥NaCl熔化
A.全部 B.只有②③④⑤⑥
C.只有④⑤⑥ D.只有⑤⑥
C
D
第四章 物质结构 元素周期律
第三节 化学键
第3课时 分子间作用力 氢键
1.在100℃、101 kPa时,将1 mol H2O(l)变成1 mol H2O(g)需吸收能量47.3 kJ。
H2O(l) H2O(g)
能量
1mol H2O
H + H
O
断裂2mol H-O键,需要436KJ能量
想一想:以上两种变化分别是物理变化,还是化学变化?
所消耗的能量差距为什么这么大呢?
2.将水分子分解为氢气和氧气需2000℃以上的高温,将1 mol H2O拆分为2 mol H和1 mol O需吸收能量436 kJ。
(思考)
物理变化
化学变化
一、分子间作用力
分子之间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。
(1)存在:
分子 分子
分子间作用力
O
H
H
O
H
H
分子间作用力
化学键
(2)强弱:比化学键弱
(较弱)
(较强)
作用微粒 作用力强弱 大小范围
化学键
分子间作用力(范德华力)
原子或离子之间
分子之间
微弱作用
分子间作用力与化学键的比较
强烈作用
约125--836KJ/mol
约2--20KJ/mol
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么
1.为什么NaCl在熔化状态或水溶液中具有导电性,而液态氯化氢却不具有导电性
前者熔化或溶于水破坏了离子键,形成可自由移动的阴阳离子
后者原子间以共价键结合,分子间存在分子间作用力
物质变化时,没有克服化学键的是( )
A、 H2O电解 B 、I2升华
C、烧碱熔化 D、 NaCl溶于水
E、HCl溶于水 F、蔗糖溶于水
G、冰融化
离子键、共价键、分子间作用力都是微粒间的作用力。下列物质中,只存在一种作用力的是 ( )
A.干冰 B.NaCl C.NaOH
D.I2 E.H2SO4 F.Ar
B、F
B、F、G
物 质 F2 Cl2 Br2 I2
相对分子质量 38 71 160 254
熔点(℃) -219.6 -101 -7.2 113.5
沸点(℃) -188.1 -34.6 58.78 184.4
熔沸点变化趋势 卤族元素单质物理性质差异
熔沸点逐渐升高
4. 影响范德华力大小的因素
分子间的作用力强弱(范德华力)
结 论
组成和结构相似的物质
相对分子质量越大
分子间作用力越大
物质熔沸点越高
分子间的作用力强弱(范德华力)
比较下列物质的熔沸点的高低
CH4_ CF4 _ CCl4 _ CBr4 _ CI4
H2O_ H2S _ H2Se _ H2Te
HF_HCl_HBr _HI
<
<
<
<
<
<
<
<
<
<
联系生活实际 你能发现什么矛盾吗
联想质疑
水之反常1:第VIA元素的氢化物
中,常温常压下H2S. H2Se. H2Te都是气体,只有水以液态存在。按照一般规律,水的沸点应该低于H2S的沸点。
水之反常2:物质由液态变为固态时,通常体积变小,但水结冰后体积却变大。充满水的密闭容器,结冰时甚至能将容器撑破
水分子中除了范德华力,应该还有一种作用力
问题探究1:
1.什么是氢键
水分子间形成的氢键
+
+
+
+
-
-
在水分子的O-H中,共用电子对强烈的偏向O,使得H几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中相对显负电性的O的孤电子对产生静电作用,这种静电作用就是氢键。
X —— H · · · Y
化学键
氢键
强烈、距离近
微弱、距离远
X、Y两原子可以相同,也可以不同
氢键的作用能:指X—H…Y分解为
X—H和Y所需要的能量。
1.什么是氢键
F—H---F
O—H--- O
N—H--- N
氢键作用能(kJ/mol)
28.1
18.8
20.9
共价键键能(kJ/mol)
568
462.8
390.8
结论:氢键介于范德华力和化学键之间,是一种较弱的作用力。
问题探究2:
2、氢键形成的条件
1、结合下列数据分析下列间题:
①为什么H2O分子间能形成氢键,而CH4分子间难形成氢键?
②为什么NH3分子间能形成氢键,而HCI分子间难形成氢键?
O原子的电负性强
N原子的半径小
氢键的本质: 强极性键(X-H)上的氢与电负性很大的、含孤电子对并带有部分负电荷的原子Y之间的静电作用力。
⑵ X—H…Y中的Y必须电负性强、原子半径小、具有孤对电子。X、Y可以相同,也可以不同。
⑴有X-H共价键,X原子电负性强,原子半径小,主要是F、O、N。
氢键的形成条件
3、氢键的特点:
有方向性,有饱和性
方向性(X-H…Y尽可能在同一条直线上)
饱和性(一个X-H只能和一个Y原子结合)
典例剖析
例1、下列物质中,分子间不能形成氢键的是( )
A、NH3 B、HF C、CH3CH2OH D、CH4
例2.固体乙醇晶体中不存在的作用力是( )
A.极性键 B.非极性键 C.离子键 D.氢键
例3. 共价键、离子键和范德华力是构成物质时粒子间的不同作用力。下列物质中,只含有上述一种作用力的是( )
A.干冰 B.氯化钠 C.氢氧化钠 D.碘
例4.下列说法正确的是( )
A.氢键不是化学键
B.甲烷可与水形成氢键
C.乙醇分子跟水分子之间只存在范德华力
D.溴化氢的沸点比氯化氢的高,是由于溴化氢分子间存在氢键
例5:写出下列物质中可能存在的氢键的表示式:①液氨 ②冰 ③氢氟酸
氢键的种类
氢键的种类
问题探究3:
邻羟基苯甲醛和对羟基苯甲醛是同分异构体。邻羟基苯甲醛的熔点为 2℃,沸点196.5 ℃ ,对羟基苯甲醛的熔点为 115℃,沸点246.6℃
请从邻羟基苯甲醛和
对羟基苯甲醛的结构
出发,分析二者形成
的氢键类型有何差别?
对熔沸点有何影响?
分子间氢键增强分子间作用力,使熔沸点升高。
分子内氢键削弱分子间作用力,使熔沸点降低。
4、氢键对物质性质的影响
●●●
思考讨论
1、NH3极易溶于水?NH3溶于水是形成N-H…O还是形成O-H…N
2、水和甲醇互溶原因?
形成氢键,也是溶液呈碱性原因。
水、甲醇互溶
氢键存在增大了溶解性。
(2)氢键对溶解度的影响
溶质分子与溶剂分子间形成氢键使溶质溶解度增大
(3)氢键对水的密度的影响
在水蒸气中,水以单个H2O 分子形式存在;
在液态水中,几个水分子通过氢键结合形成(H2O)n缔合分子;
讨论水的特殊性:
(1)水的熔沸点比较高?
(2)为什么结冰后体积膨胀浮在水面上?
在固态水(冰)中,水分子大范围地以氢键互相联结。形成相当疏松晶体,结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
(1)冰熔化或汽化时__________被破坏,分子____变化,属____变化;
(4)干冰升华时___________被破坏,属于_____变化
(5)食盐融化时_______被破坏,属于_____变化
(6) 金刚石融化时_______被破坏,属于_____变化
(3)碘化氢分解时_______被破坏,属于_____变化
(2)水分解时_______被破坏,分子_____变化,属于_____变化;
氢键和分子
间作用力
没有
物理
共价键
发生
化学
共价键
化学
分子间作用力
物理
离子键
物理
共价键
物理
分子直接构成的物质:
物理性质→
化学性质→
原子直接构成的物质:
物理性质→共价键
化学性质→共价键
离子化合物:
物理性质→离子键
化学性质→离子键
分子间作用力
共价键
分子间作用力、氢键与化学键的比较
存在 强弱 强弱因素 影响性质
共价键
离子键
范德华力
氢键 _____________
原子间
分子间
离子间
某些分子间
强烈
强烈
远小于化学键
略大于范德华力
微弱
原子半径
离子半径
带电荷数
相对分子质量
化学性质或物理性质
只物理
性质
1、下列说法正确的是 ( )
A.水很稳定是由于水分子间存在氢键
B.NaOH融化时离子键和共价键发生断裂
C.碳酸钙分解时发生了化学键的断裂和形成
D.冰融化时要吸热,所以共价键断裂
E.任何分子中都含有共价键
F.分子间作用力越大熔化或气化时所需的能量就越多,其化学性质也越稳定
C
2.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4 、 SnH4的熔点随相对分子质量的增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
B
3.下列过程中,共价键被破坏的是( )
A.碘升华
B.溴蒸气被木炭吸附
C.蔗糖溶于水
D.氯化氢气体溶于水
E.烧碱溶于水
D
4下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键
C
5.下列各组性质的比较不正确的是( )
A.酸性:HClO4>H2SO4>H3PO4>H2SiO3
B.稳定性:HF>H2O>H2S
C.碱性:KOH>NaOH>Mg(OH)2
D.熔、沸点:HI>HBr>HCl>HF
D
7.(2019福建三明第一中学开学考试)下列过程中化学键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水
④HCl气体溶于水 ⑤MgCl2溶解于水 ⑥NaCl熔化
A.全部 B.只有②③④⑤⑥
C.只有④⑤⑥ D.只有⑤⑥
C
D
