人教版(2019)高中化学选修二 1.2.3 电负性 课件(29张PPT)
文档属性
| 名称 | 人教版(2019)高中化学选修二 1.2.3 电负性 课件(29张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-16 00:00:00 | ||
图片预览




文档简介
(共19张PPT)
第一章 原子结构与性质
第二节 原子结构与元素的性质
第3课时 电负性
【回顾2】化学键的定义?
【回顾1】写出HCl的电子式?
Cl
··
··
H
··
··
元素相互化合,相邻的原子之间产生的强烈的相互作用力,称为化学键
① 键合电子:原子中用于形成_________的电子。
② 电负性:用来描述不同元素的原子对___________吸引力的大小。电负性越大的原子,对键合电子的吸引力_______,元素的___________性越强。
键合电子
越大
③标准:以_____的电负性为4.0和_____的电负性为 作为相对标准,得出各元素的电负性(稀有气体未计)。
氟
锂
化学键
非金属
注意:电负性是相对值,没单位。
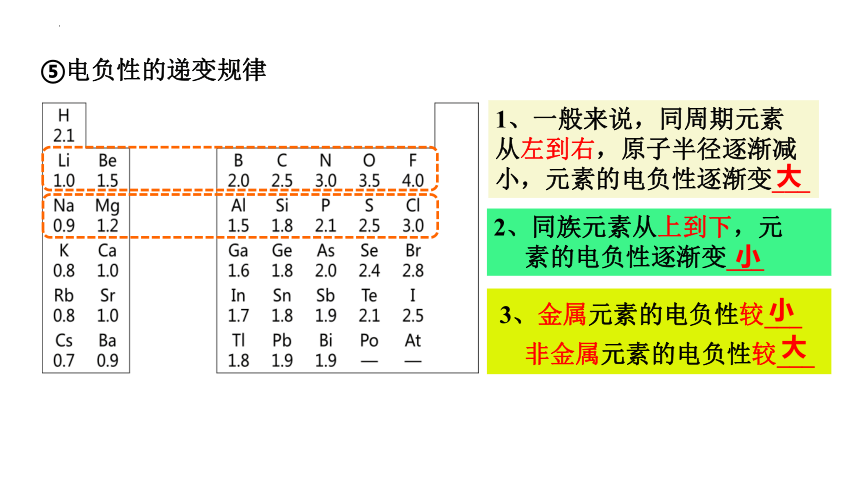
⑤电负性的递变规律
1、一般来说,同周期元素
从左到右,原子半径逐渐减小,元素的电负性逐渐变___
2、同族元素从上到下,元
素的电负性逐渐变___
3、金属元素的电负性较___
非金属元素的电负性较___
大
小
小
大
第二课时 元素周期律
电负性的应用
1、判断元素金属性和非金属性的强弱
电负性越大,元素的非金属性越强,电负性越小,元素的非金属性越弱。
金属元素的电负性一般小于1.8。
非金属元素的电负性一般大于1.8。
位于非金属三角区边界的“类金属”,电负性在1.8左右,既表现金属
性,又表现非金属性。
特例,如铅元素电负性为1.9,但其为金属.
电负性的应用
2、判断化学键的类型
电负性相差很大(相差>1.7)
离子键
电负性相差不大(相差<1.7)
共价键
电负性相差越大的共价键,共用电子对偏向电负性大
的原子趋势越大,键的极性越大。
也有特例(如HF)
特例(如NaH)
如极性:H—F H—Cl H—Br H—I
> > >
例:AlCl3中,Al:1.5 Cl :3.0
电负性的应用
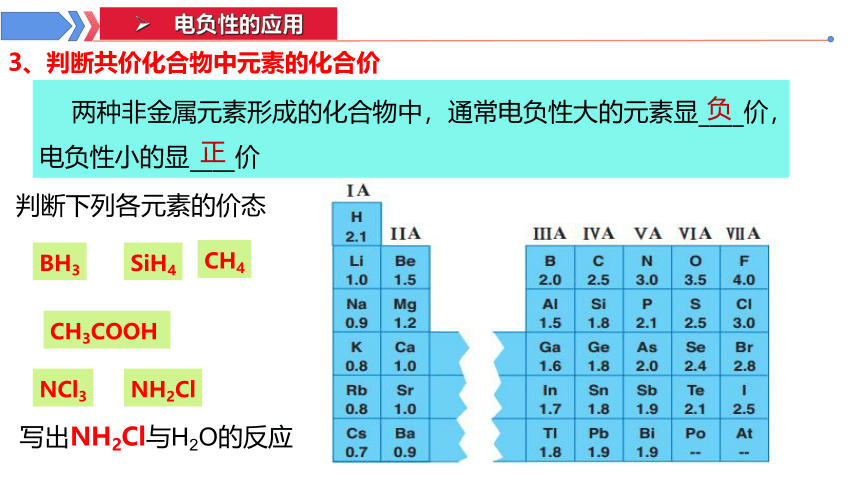
3、判断共价化合物中元素的化合价
两种非金属元素形成的化合物中,通常电负性大的元素显____价,电负性小的显____价
负
正
BH3
CH3COOH
SiH4
NCl3
NH2Cl
判断下列各元素的价态
写出NH2Cl与H2O的反应
CH4
电负性的应用
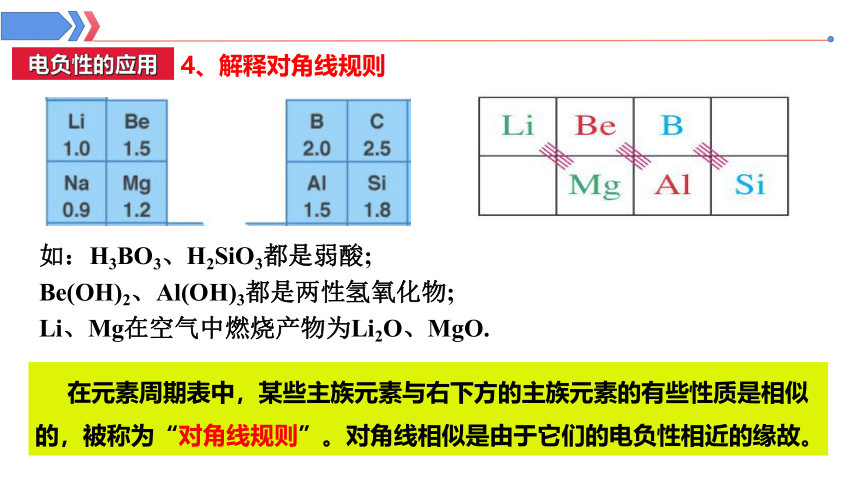
4、解释对角线规则
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,被称为“对角线规则”。对角线相似是由于它们的电负性相近的缘故。
如:H3BO3、H2SiO3都是弱酸;
Be(OH)2、Al(OH)3都是两性氢氧化物;
Li、Mg在空气中燃烧产物为Li2O、MgO.
小结:电负性、电离能与金属性和非金属性的关系
注:①____________为同周期中电离能最大
②第一电离能:ⅡA____ⅢA,ⅤA____ⅥA
稀有气体
>
>
阅读科学史话P26
逐级电离能出现突变 →
判断原子价层电子数/
推测其最高化合价
跨越不同能层失电子→
高考真题中的电负性问题
[2021全国乙卷]Cr的电负性比钾高,原子对键合电子的吸引力比钾大( )
[2021湖南卷] 中H、C、N的电负性由大到小的顺序为______。
[2021广东卷] 在Ⅱ( )中S元素的电负性最大( )
[2021山东卷] O、F、Cl电负性由大到小的顺序为___________。
CH2 S
CH S
CH2 OH
Hg
√
N>C>H
╳
F>O>Cl
【讨论】 (1)为什么副族元素又称为过渡元素 过渡元素价层电子数跟它们的族序数有什么关系 写出它们的价层电子排布通式。
副族元介于s区元素(主要是金属元素)种p区元素(主要是非金属元素)之间,处于由金属元素向非金属元素过渡的区域,因此副族元素又称为过渡元素。
【讨论】(2)s区、d区和p区分别有几个列 为什么s区(除氢元素)、
d区和ds区的元素都是金属元素
s区有2列,d区有8列,p区有6列。
s区元素的价层电子排布通式为ns1~2,
d区元素的价层电子排布通式为(n-1)d1~9ns1~2,
ds区元素的价层电子排布通式为(n-1)d10ns1~2 ,
它们的最外层电子数均不超过2,在化学反应中容易失去电子,
所以s区(除氢元素外)、d区和ds区的元素都是金属元素。
【讨论】(3)处于非金属与金属分界线附近的元素常被称为半金属或类金属,为什么
由于元素的金属性和非金属性之间并没有严格的界限,处于非金属与金属分界线上的元素既能表现出一定的非金属性,又能表现出一定的金属性,因此这些元素常被称为半金属或类金属。
【问题】(3)为什么表中非金属元素主要集中在右上角三角区内
同周期元素从左到右非金属性渐强,同主族从上到下非金属性渐弱,使右上角的元素主要呈现非金属性。
高考真题中的电离能问题
[2020江苏卷] C、N、O元素的第一电离能由大到小的顺序为___________。
N>O>C
[2019全国Ⅰ卷] 下列状态的镁中,电离最外层一个电子所需能量最大的是_____(填标号)。
[Ne]
↑
[Ne]
↑
↑
[Ne]
↑
↑
[Ne]
↑
A
[2018全国Ⅰ卷]已知:2Li(晶体) 2Li(g) 2Li+(g),
则Li原子的第一电离能为 ______ kJ·mol 1。
318kJ·mol 1
1040kJ·mol 1
520
3s
3s
3s
3p
3p
A B C D
第一章 原子结构与性质
第二节 原子结构与元素的性质
第3课时 电负性
【回顾2】化学键的定义?
【回顾1】写出HCl的电子式?
Cl
··
··
H
··
··
元素相互化合,相邻的原子之间产生的强烈的相互作用力,称为化学键
① 键合电子:原子中用于形成_________的电子。
② 电负性:用来描述不同元素的原子对___________吸引力的大小。电负性越大的原子,对键合电子的吸引力_______,元素的___________性越强。
键合电子
越大
③标准:以_____的电负性为4.0和_____的电负性为 作为相对标准,得出各元素的电负性(稀有气体未计)。
氟
锂
化学键
非金属
注意:电负性是相对值,没单位。
⑤电负性的递变规律
1、一般来说,同周期元素
从左到右,原子半径逐渐减小,元素的电负性逐渐变___
2、同族元素从上到下,元
素的电负性逐渐变___
3、金属元素的电负性较___
非金属元素的电负性较___
大
小
小
大
第二课时 元素周期律
电负性的应用
1、判断元素金属性和非金属性的强弱
电负性越大,元素的非金属性越强,电负性越小,元素的非金属性越弱。
金属元素的电负性一般小于1.8。
非金属元素的电负性一般大于1.8。
位于非金属三角区边界的“类金属”,电负性在1.8左右,既表现金属
性,又表现非金属性。
特例,如铅元素电负性为1.9,但其为金属.
电负性的应用
2、判断化学键的类型
电负性相差很大(相差>1.7)
离子键
电负性相差不大(相差<1.7)
共价键
电负性相差越大的共价键,共用电子对偏向电负性大
的原子趋势越大,键的极性越大。
也有特例(如HF)
特例(如NaH)
如极性:H—F H—Cl H—Br H—I
> > >
例:AlCl3中,Al:1.5 Cl :3.0
电负性的应用
3、判断共价化合物中元素的化合价
两种非金属元素形成的化合物中,通常电负性大的元素显____价,电负性小的显____价
负
正
BH3
CH3COOH
SiH4
NCl3
NH2Cl
判断下列各元素的价态
写出NH2Cl与H2O的反应
CH4
电负性的应用
4、解释对角线规则
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,被称为“对角线规则”。对角线相似是由于它们的电负性相近的缘故。
如:H3BO3、H2SiO3都是弱酸;
Be(OH)2、Al(OH)3都是两性氢氧化物;
Li、Mg在空气中燃烧产物为Li2O、MgO.
小结:电负性、电离能与金属性和非金属性的关系
注:①____________为同周期中电离能最大
②第一电离能:ⅡA____ⅢA,ⅤA____ⅥA
稀有气体
>
>
阅读科学史话P26
逐级电离能出现突变 →
判断原子价层电子数/
推测其最高化合价
跨越不同能层失电子→
高考真题中的电负性问题
[2021全国乙卷]Cr的电负性比钾高,原子对键合电子的吸引力比钾大( )
[2021湖南卷] 中H、C、N的电负性由大到小的顺序为______。
[2021广东卷] 在Ⅱ( )中S元素的电负性最大( )
[2021山东卷] O、F、Cl电负性由大到小的顺序为___________。
CH2 S
CH S
CH2 OH
Hg
√
N>C>H
╳
F>O>Cl
【讨论】 (1)为什么副族元素又称为过渡元素 过渡元素价层电子数跟它们的族序数有什么关系 写出它们的价层电子排布通式。
副族元介于s区元素(主要是金属元素)种p区元素(主要是非金属元素)之间,处于由金属元素向非金属元素过渡的区域,因此副族元素又称为过渡元素。
【讨论】(2)s区、d区和p区分别有几个列 为什么s区(除氢元素)、
d区和ds区的元素都是金属元素
s区有2列,d区有8列,p区有6列。
s区元素的价层电子排布通式为ns1~2,
d区元素的价层电子排布通式为(n-1)d1~9ns1~2,
ds区元素的价层电子排布通式为(n-1)d10ns1~2 ,
它们的最外层电子数均不超过2,在化学反应中容易失去电子,
所以s区(除氢元素外)、d区和ds区的元素都是金属元素。
【讨论】(3)处于非金属与金属分界线附近的元素常被称为半金属或类金属,为什么
由于元素的金属性和非金属性之间并没有严格的界限,处于非金属与金属分界线上的元素既能表现出一定的非金属性,又能表现出一定的金属性,因此这些元素常被称为半金属或类金属。
【问题】(3)为什么表中非金属元素主要集中在右上角三角区内
同周期元素从左到右非金属性渐强,同主族从上到下非金属性渐弱,使右上角的元素主要呈现非金属性。
高考真题中的电离能问题
[2020江苏卷] C、N、O元素的第一电离能由大到小的顺序为___________。
N>O>C
[2019全国Ⅰ卷] 下列状态的镁中,电离最外层一个电子所需能量最大的是_____(填标号)。
[Ne]
↑
[Ne]
↑
↑
[Ne]
↑
↑
[Ne]
↑
A
[2018全国Ⅰ卷]已知:2Li(晶体) 2Li(g) 2Li+(g),
则Li原子的第一电离能为 ______ kJ·mol 1。
318kJ·mol 1
1040kJ·mol 1
520
3s
3s
3s
3p
3p
A B C D
