人教版(2019)高中化学选修二 2.3 杂化轨道模型 课件(16张PPT)
文档属性
| 名称 | 人教版(2019)高中化学选修二 2.3 杂化轨道模型 课件(16张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-16 15:24:50 | ||
图片预览




文档简介
(共16张PPT)
思考讨论
2、成键电子中,碳原子提供的是哪个轨道上的电子?
1、根据价层电子互斥理论,预测CH4的VSEPR模型及分子构型
3、碳原子的2s、2p轨道电子云形状不同,形成共价键的能量也不同,与氢原子的1s电子云重叠,不可能得到四个键长相同的C-H键,那么如何用价键理论解释CH4的结构呢?
为什么碳原子与氢原子结合形成CH4,而不是CH2 ?
第二章
第2节 分子的空间结构
第3课时 杂化轨道理论
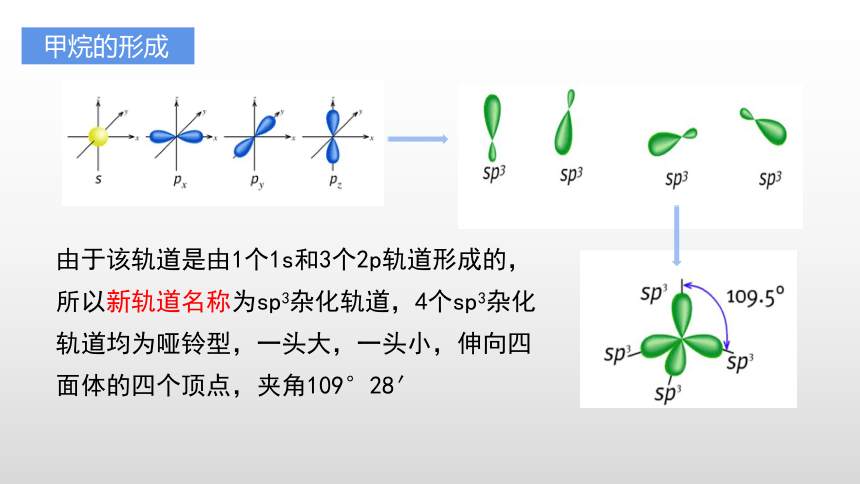
甲烷的形成
第一步:由于碳原子的价层电子2s、2p轨道能量接近,2s上的一个电子跃迁到2p轨道上
sp3
第二步:把这四个能量接近的轨道糅合在一起并重新分配,形成数目不变(4个)的、方向不同的、能量相同的轨道——该过程称为杂化
碳原子的2s、2p轨道电子云形状不同,形成共价键的能量也不同,与氢原子的1s电子云重叠,不可能得到四个键长相同的C-H键
甲烷的形成
由于该轨道是由1个1s和3个2p轨道形成的,所以新轨道名称为sp3杂化轨道,4个sp3杂化轨道均为哑铃型,一头大,一头小,伸向四面体的四个顶点,夹角109°28′
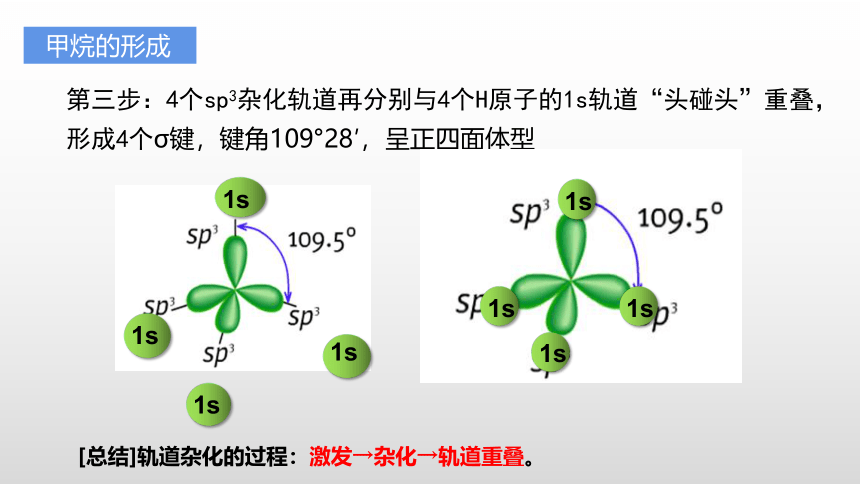
甲烷的形成
第三步:4个sp3杂化轨道再分别与4个H原子的1s轨道“头碰头”重叠,形成4个σ键,键角109°28′,呈正四面体型
1s
1s
1s
1s
1s
1s
1s
1s
[总结]轨道杂化的过程:激发→杂化→轨道重叠。
杂化和杂化轨道(中心原子)
在外界条件影响下,中心原子能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
1、杂化
2、杂化轨道
轨道杂化后形成的一组新的原子轨道,叫做杂化轨道;形状哑铃型(s和p杂化),一头大、一头小
3、杂化的条件:
(1)只有在形成化学键时才能杂化
(2)只有能量相近的轨道间才能杂化
4、杂化的特点
(1)杂化轨道数=参加杂化的原子轨道数
(3)为使杂化轨道间的斥力最小,杂化轨道尽可能远离
(4)杂化轨道只用于形成σ键和容纳孤电子对
(2)各杂化轨道能量相同,但比原来的原子轨道能量低,更易成键
5、常见杂化类型
sp、sp2、sp3
sp3
杂化类型和立体结构
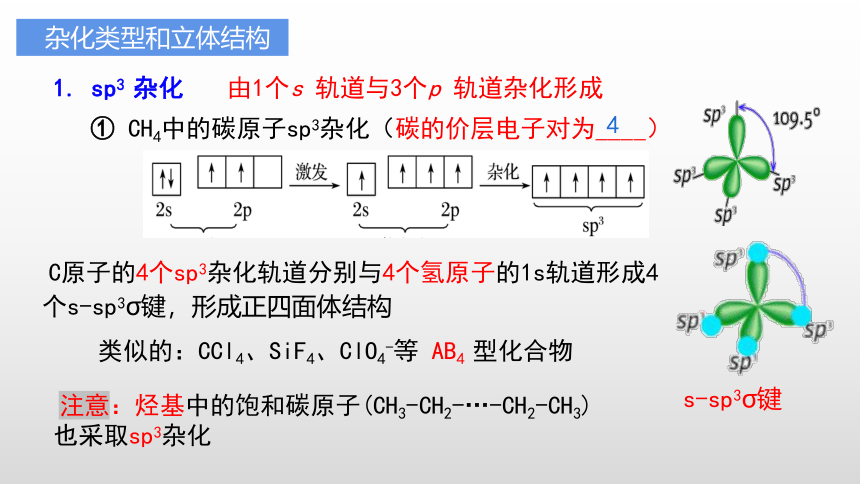
1. sp3 杂化
由1个s 轨道与3个p 轨道杂化形成
① CH4中的碳原子sp3杂化(碳的价层电子对为____)
C原子的4个sp3杂化轨道分别与4个氢原子的1s轨道形成4个s-sp3σ键,形成正四面体结构
s-sp3σ键
类似的:CCl4、SiF4、ClO4-等 AB4 型化合物
注意:烃基中的饱和碳原子(CH3-CH2-…-CH2-CH3)也采取sp3杂化
4
战
杂化类型和立体结构
1. sp3 杂化
② NH3中的N原子______杂化(N的价层电子对为_____)
N原子的4个sp3杂化轨道分别与3个氢原子的1s轨道形成
3个s-sp3σ键,剩余1个sp3杂化轨道含一对孤电子对
NH3为三角锥形,类似的还有NF3、PH3等
4
sp3
※杂化轨道只用于形成σ键和容纳孤电子对
杂化类型和立体结构
1. sp3 杂化
③ H20中的O原子______杂化(O的价层电子对为______)
O原子的4个sp3杂化轨道分别与2个氢原子的1s轨道形成2个s-sp3σ键,剩余2个sp3杂化轨道含2对孤电子对,
H2O的空间结构为V形,类似的还有H2S等
4
sp3
2. sp2 杂化
① BF3中的B原子______杂化(B的价层电子对为______)
B原子的3个sp2杂化轨道分别与3个F原子的2p轨道形成3个p-sp2σ键,
BF3的空间结构为平面三角形,类似的还有SO3、NO3-等
由1个s 轨道与2个p 轨道杂化形成
3
sp2
2. sp2 杂化
② CH2=CH2中的C原子的价电子对________,即C为________杂化
3
sp2
2. sp2 杂化
① CH2=CH2中的C原子sp2杂化
C原子的2个sp2杂化轨道分别与2个H原子的1S轨道形成2个s-sp2σ键,另一个sp2杂化轨道与另一个C原子的sp2杂化轨道头碰头形成1个σ键。两个C剩余未参与杂化的2p轨道肩并肩形成π键
2.有机物中形成双键的碳原子( C=C )均为_______杂化
sp2
注意:1.烃基中的饱和碳原子(CH3-CH2-…-CH2-CH3)也采取sp3杂化
※杂化轨道只用于形成σ键和容纳孤电子对
战
3. sp 杂化
BeCl2中Be的价层电子对为_____,Be杂化方式为_______
1个s轨道与1个p轨道进行的杂化, 形成2个sp杂化轨道。
激发
sp
sp杂化
Be原子的2个sp杂化轨道分别与Cl原子的3p轨道形成σ键
Cl
Cl
sp
px
px
2
sp
战
CH≡CH分子中碳原子的杂化
3. sp 杂化
两个碳原子的1个sp杂化轨道相互重叠形成sp-sp σ键,
另外1个杂化轨道与氢原子1s轨道重叠形成两个s-sp σ键,
未参与杂化的2个2P轨道相互重叠形成__________。
2个π键
※杂化轨道只用于形成σ键和容纳孤电子对
杂化和杂化轨道(中心原子)
在外界条件影响下,中心原子能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
1、杂化
2、杂化轨道
轨道杂化后形成的一组新的原子轨道,叫做杂化轨道;形状哑铃型(s和p杂化),一头大、一头小
3、杂化的条件:
(1)只有在形成化学键时才能杂化
(2)只有能量相近的轨道间才能杂化
4、杂化的特点
(1)杂化轨道数=参加杂化的原子轨道数
(3)为使杂化轨道间的斥力最小,杂化轨道尽可能远离
(4)杂化轨道只用于形成σ键和容纳孤电子对
(2)各杂化轨道能量相同,但比原来的原子轨道能量低,更易成键
5、常见杂化类型
sp、sp2、sp3
sp3
思考讨论
确定BF3和H3O+的中心原子的杂化轨道类型,并与同学讨论
第一步 计算中心原子孤电子对数:
第二步 计算价层电子对数:
第四步 确定杂化轨道类型:
第三步 确定杂化轨道数:
BF3
H3O+
3+0=3
3+1=4
sp2
sp3
3
4
杂化轨道数=价层电子对数
思考讨论
2、成键电子中,碳原子提供的是哪个轨道上的电子?
1、根据价层电子互斥理论,预测CH4的VSEPR模型及分子构型
3、碳原子的2s、2p轨道电子云形状不同,形成共价键的能量也不同,与氢原子的1s电子云重叠,不可能得到四个键长相同的C-H键,那么如何用价键理论解释CH4的结构呢?
为什么碳原子与氢原子结合形成CH4,而不是CH2 ?
第二章
第2节 分子的空间结构
第3课时 杂化轨道理论
甲烷的形成
第一步:由于碳原子的价层电子2s、2p轨道能量接近,2s上的一个电子跃迁到2p轨道上
sp3
第二步:把这四个能量接近的轨道糅合在一起并重新分配,形成数目不变(4个)的、方向不同的、能量相同的轨道——该过程称为杂化
碳原子的2s、2p轨道电子云形状不同,形成共价键的能量也不同,与氢原子的1s电子云重叠,不可能得到四个键长相同的C-H键
甲烷的形成
由于该轨道是由1个1s和3个2p轨道形成的,所以新轨道名称为sp3杂化轨道,4个sp3杂化轨道均为哑铃型,一头大,一头小,伸向四面体的四个顶点,夹角109°28′
甲烷的形成
第三步:4个sp3杂化轨道再分别与4个H原子的1s轨道“头碰头”重叠,形成4个σ键,键角109°28′,呈正四面体型
1s
1s
1s
1s
1s
1s
1s
1s
[总结]轨道杂化的过程:激发→杂化→轨道重叠。
杂化和杂化轨道(中心原子)
在外界条件影响下,中心原子能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
1、杂化
2、杂化轨道
轨道杂化后形成的一组新的原子轨道,叫做杂化轨道;形状哑铃型(s和p杂化),一头大、一头小
3、杂化的条件:
(1)只有在形成化学键时才能杂化
(2)只有能量相近的轨道间才能杂化
4、杂化的特点
(1)杂化轨道数=参加杂化的原子轨道数
(3)为使杂化轨道间的斥力最小,杂化轨道尽可能远离
(4)杂化轨道只用于形成σ键和容纳孤电子对
(2)各杂化轨道能量相同,但比原来的原子轨道能量低,更易成键
5、常见杂化类型
sp、sp2、sp3
sp3
杂化类型和立体结构
1. sp3 杂化
由1个s 轨道与3个p 轨道杂化形成
① CH4中的碳原子sp3杂化(碳的价层电子对为____)
C原子的4个sp3杂化轨道分别与4个氢原子的1s轨道形成4个s-sp3σ键,形成正四面体结构
s-sp3σ键
类似的:CCl4、SiF4、ClO4-等 AB4 型化合物
注意:烃基中的饱和碳原子(CH3-CH2-…-CH2-CH3)也采取sp3杂化
4
战
杂化类型和立体结构
1. sp3 杂化
② NH3中的N原子______杂化(N的价层电子对为_____)
N原子的4个sp3杂化轨道分别与3个氢原子的1s轨道形成
3个s-sp3σ键,剩余1个sp3杂化轨道含一对孤电子对
NH3为三角锥形,类似的还有NF3、PH3等
4
sp3
※杂化轨道只用于形成σ键和容纳孤电子对
杂化类型和立体结构
1. sp3 杂化
③ H20中的O原子______杂化(O的价层电子对为______)
O原子的4个sp3杂化轨道分别与2个氢原子的1s轨道形成2个s-sp3σ键,剩余2个sp3杂化轨道含2对孤电子对,
H2O的空间结构为V形,类似的还有H2S等
4
sp3
2. sp2 杂化
① BF3中的B原子______杂化(B的价层电子对为______)
B原子的3个sp2杂化轨道分别与3个F原子的2p轨道形成3个p-sp2σ键,
BF3的空间结构为平面三角形,类似的还有SO3、NO3-等
由1个s 轨道与2个p 轨道杂化形成
3
sp2
2. sp2 杂化
② CH2=CH2中的C原子的价电子对________,即C为________杂化
3
sp2
2. sp2 杂化
① CH2=CH2中的C原子sp2杂化
C原子的2个sp2杂化轨道分别与2个H原子的1S轨道形成2个s-sp2σ键,另一个sp2杂化轨道与另一个C原子的sp2杂化轨道头碰头形成1个σ键。两个C剩余未参与杂化的2p轨道肩并肩形成π键
2.有机物中形成双键的碳原子( C=C )均为_______杂化
sp2
注意:1.烃基中的饱和碳原子(CH3-CH2-…-CH2-CH3)也采取sp3杂化
※杂化轨道只用于形成σ键和容纳孤电子对
战
3. sp 杂化
BeCl2中Be的价层电子对为_____,Be杂化方式为_______
1个s轨道与1个p轨道进行的杂化, 形成2个sp杂化轨道。
激发
sp
sp杂化
Be原子的2个sp杂化轨道分别与Cl原子的3p轨道形成σ键
Cl
Cl
sp
px
px
2
sp
战
CH≡CH分子中碳原子的杂化
3. sp 杂化
两个碳原子的1个sp杂化轨道相互重叠形成sp-sp σ键,
另外1个杂化轨道与氢原子1s轨道重叠形成两个s-sp σ键,
未参与杂化的2个2P轨道相互重叠形成__________。
2个π键
※杂化轨道只用于形成σ键和容纳孤电子对
杂化和杂化轨道(中心原子)
在外界条件影响下,中心原子能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
1、杂化
2、杂化轨道
轨道杂化后形成的一组新的原子轨道,叫做杂化轨道;形状哑铃型(s和p杂化),一头大、一头小
3、杂化的条件:
(1)只有在形成化学键时才能杂化
(2)只有能量相近的轨道间才能杂化
4、杂化的特点
(1)杂化轨道数=参加杂化的原子轨道数
(3)为使杂化轨道间的斥力最小,杂化轨道尽可能远离
(4)杂化轨道只用于形成σ键和容纳孤电子对
(2)各杂化轨道能量相同,但比原来的原子轨道能量低,更易成键
5、常见杂化类型
sp、sp2、sp3
sp3
思考讨论
确定BF3和H3O+的中心原子的杂化轨道类型,并与同学讨论
第一步 计算中心原子孤电子对数:
第二步 计算价层电子对数:
第四步 确定杂化轨道类型:
第三步 确定杂化轨道数:
BF3
H3O+
3+0=3
3+1=4
sp2
sp3
3
4
杂化轨道数=价层电子对数
