人教版(2019)高中化学选修二 3.3.2 离子晶体 课件(38张PPT)
文档属性
| 名称 | 人教版(2019)高中化学选修二 3.3.2 离子晶体 课件(38张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-16 15:28:14 | ||
图片预览







文档简介
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
学习目标
1.能辨识常见的离子晶体,理解离子晶体中的粒子及粒子间的相互作用,以及对晶体性质的影响。
2.掌握氯化钠、氯化铯等离子晶体的结构特点。
3.3.3 离子晶体
教材内容:P87-89
我们知道,熔融的NaCl或者NaCl的水溶液能够导电,
而NaCl晶体却不能导电,这是为什么呢?
没有自由移动的Na+和Cl-
1913年布拉格首次
用X射线衍射法
测定了氯化钠的
晶体结构
氯化钠晶体的微观结构
一种现代实验室使用的X射线衍射仪
胆矾
萤石
重晶石
烧碱
新课引入
阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
3.特点:
没有方向性和饱和性。
以离子键结合的化合物倾向于形成紧密堆积,使每个离子周围尽可能
多地与带相反电荷的离子接触,从而达到稳定的目的。
4.离子键的形成条件:活泼的金属元素和非金属元素间容易形成离子键;
形成化合物的元素的电负性之差>1.7
2.本质:静电作用(静电吸引力和静电排斥力)
1.成键过程:阴阳离子接近到某一定距离时,吸引和排斥 达到平衡,就形成了离子键。
5.影响离子键强度的因素:一般说来,阴、阳离子的电荷数越多,
离子半径越小,离子键越强
一、离子键
1.概念:
2.成键微粒:
4.相互作用:
5.常见的离子晶体:
由阳离子和阴离子相互作用而形成的晶体
强碱、大部分盐、活泼金属氧化物、过氧化物、活泼碳化物(CaC2)及氮化物(Mg3N2)
离子键 (有的还存在共价键、氢键)。
是由阳离子和阴离子构成,有的还存在电中性的分子(如H2O、NH3等)。阳离子或阴离子不仅指单原子离子,还包括复杂离子,如NH4+、SO42-。
3.离子晶体的化学式:
表示离子最简整数比,不存在分子式(无单个分子存在)
二、离子晶体
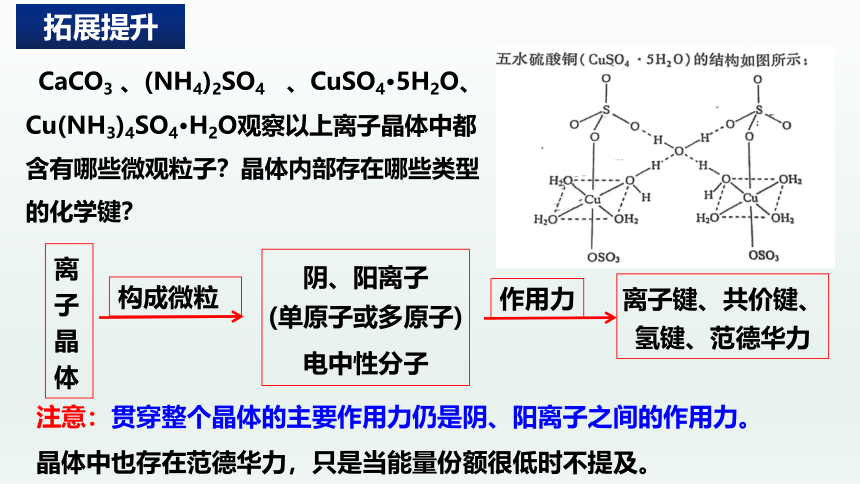
CaCO3 、(NH4)2SO4 、CuSO4·5H2O、 Cu(NH3)4SO4·H2O观察以上离子晶体中都含有哪些微观粒子?晶体内部存在哪些类型的化学键?
离子晶体
阴、阳离子
(单原子或多原子)
电中性分子
构成微粒
离子键、共价键、
氢键、范德华力
作用力
注意:贯穿整个晶体的主要作用力仍是阴、阳离子之间的作用力。
晶体中也存在范德华力,只是当能量份额很低时不提及。
拓展提升
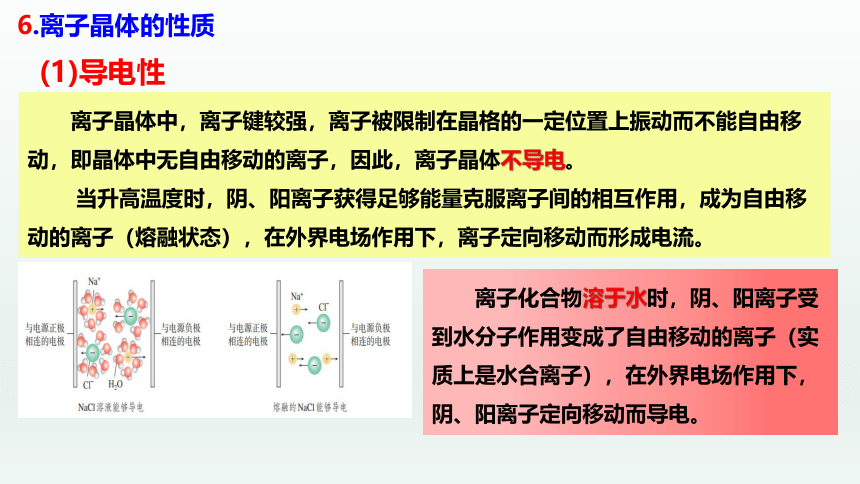
离子化合物溶于水时,阴、阳离子受到水分子作用变成了自由移动的离子(实质上是水合离子),在外界电场作用下,阴、阳离子定向移动而导电。
离子晶体中,离子键较强,离子被限制在晶格的一定位置上振动而不能自由移动,即晶体中无自由移动的离子,因此,离子晶体不导电。
当升高温度时,阴、阳离子获得足够能量克服离子间的相互作用,成为自由移动的离子(熔融状态),在外界电场作用下,离子定向移动而形成电流。
(1)导电性
6.离子晶体的性质
离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量。因此,离子晶体具有较高的熔、沸点和难挥发的性质。
(2)具有较高的熔、沸点,难挥发
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高。
结论:
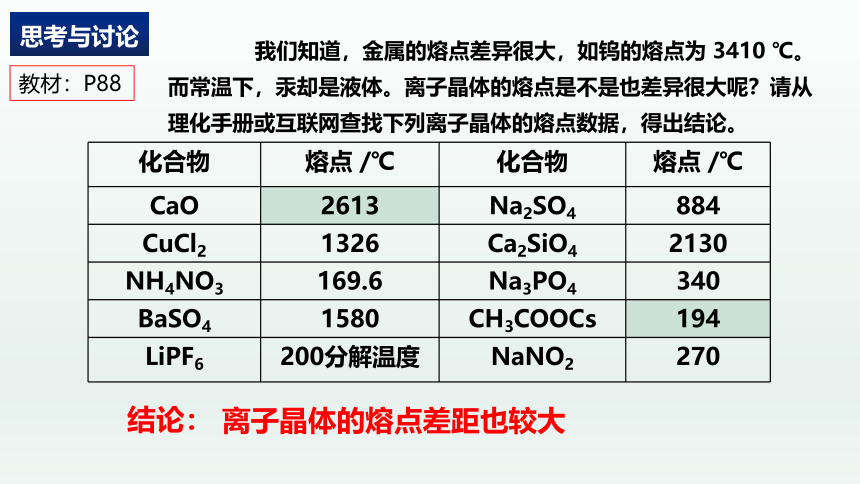
离子晶体的熔点差距也较大
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}化合物
熔点 /℃
化合物
熔点 /℃
CaO
2613
Na2SO4
884
CuCl2
1326
Ca2SiO4
2130
NH4NO3
169.6
Na3PO4
340
BaSO4
1580
CH3COOCs
194
LiPF6
200分解温度
NaNO2
270
我们知道,金属的熔点差异很大,如钨的熔点为 3410 ℃。而常温下,汞却是液体。离子晶体的熔点是不是也差异很大呢?请从理化手册或互联网查找下列离子晶体的熔点数据,得出结论。
思考与讨论
教材:P88
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
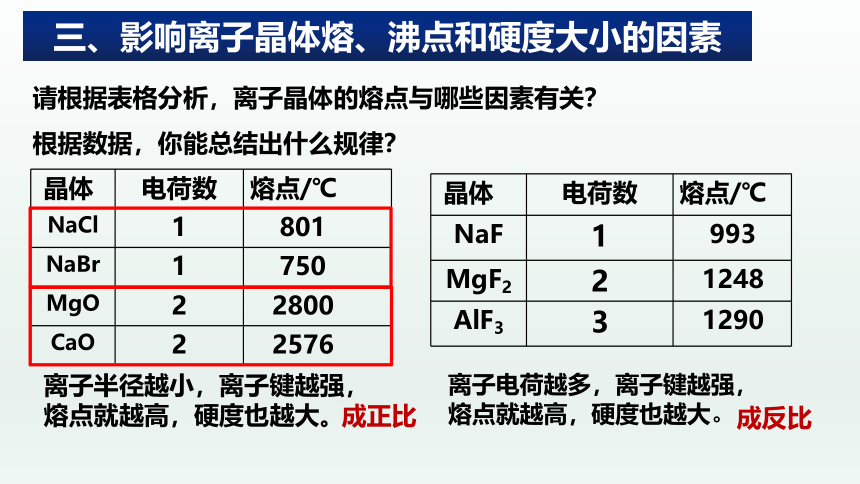
{5940675A-B579-460E-94D1-54222C63F5DA} 晶体
电荷数
熔点/℃
NaCl
1
801
NaBr
1
750
MgO
2
2800
CaO
2
2576
离子半径越小,离子键越强,
熔点就越高,硬度也越大。
{5940675A-B579-460E-94D1-54222C63F5DA} 晶体
电荷数
熔点/℃
NaF
1
993
MgF2
2
1248
AlF3
3
1290
离子电荷越多,离子键越强,
熔点就越高,硬度也越大。
成正比
成反比
三、影响离子晶体熔、沸点和硬度大小的因素
1、物质的状态,一般情况下是固体>液体>气体;
2、晶体类型,一般是共价晶体>离子晶体>分子晶体
(注意:不是绝对的,如氧化铝的熔点大于晶体硅)。
3、同类晶体比较思路:
共价晶体→共价键键能→键长→原子半径;
分子晶体→分子间作用力→相对分子质量、极性、氢键、支链;
离子晶体→离子键强弱→离子所带电荷数、离子半径;
金属晶体→金属键强弱→金属阳离子所带电荷、金属阳离子半径。
比较不同晶体熔、沸点的基本思路
归纳小结
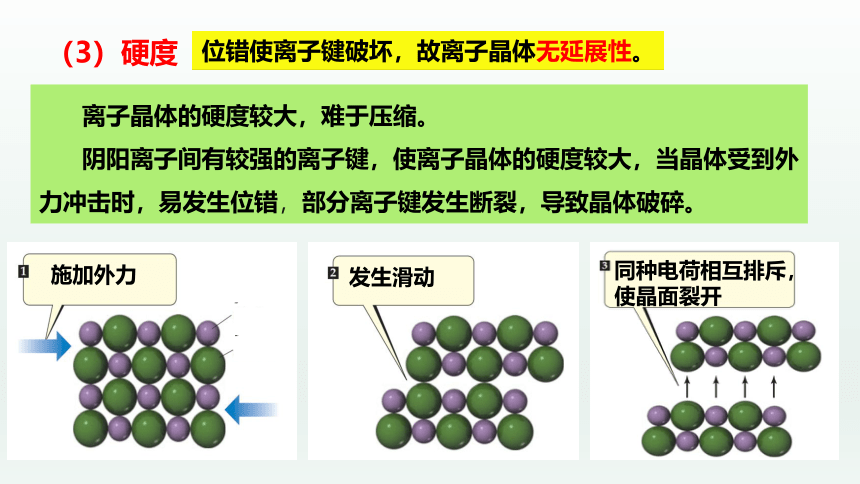
(3)硬度
离子晶体的硬度较大,难于压缩。
阴阳离子间有较强的离子键,使离子晶体的硬度较大,当晶体受到外力冲击时,易发生位错,部分离子键发生断裂,导致晶体破碎。
发生滑动
施加外力
阳离子
阴离子
同种电荷相互排斥,使晶面裂开
位错使离子键破坏,故离子晶体无延展性。
(4)溶解性
大多数离子晶体易溶于极性溶剂(如水),难溶于非极性溶剂(如汽油、苯等),遵循“相似相溶”规律。
当把离子晶体放入水中时,极性水分子对离子晶体中的离子产生吸引作用,使晶体中的离子克服了离子间的作用而电离,变成在水中自由移动的离子。
1.依据物质的分类判断
(4)金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。
(2)少数的非金属单质(金刚石、晶体Si)和少数的共价化合物(SiO2)等是共价晶体。
(1)大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2等外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)金属单质(除汞外)和合金是金属晶体
判断晶体类型的常用方法
归纳小结
2.依据物质的物理性质:
(1)在常温下呈气态或液态或易升华的物质,其晶体应属于分子晶体(Hg除外)。如H2O、H2、稀有气体等。
(2)在熔融状态下能导电的晶体(化合物)是离子晶体。如:NaCl熔融后电离出Na+和Cl-,能自由移动,所以能导电。
(3)有很高的熔、沸点,硬度大,并且难溶于水的物质大多为共价晶体,如晶体硅、二氧化硅、金刚石等。
(4)金属晶体多数硬度大,但也有较低的,且具有延展性,合金的硬度比其成分金属大,合金的熔点比其成分金属低。
分析下列物质的物理性质,判断其晶体类型。
(1)碳化铝,黄色晶体,熔点2 200 ℃,熔融态不导电:________。
(2)溴化铝,无色晶体,熔点98 ℃,熔融态不导电:________。
(3)五氟化矾,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮等:______。
(4)溴化钾,无色晶体,熔融时或溶于水中都能导电:________。
(5)SiI4:熔点120.5 ℃,沸点287.4 ℃,易水解:________。
(6)硼:熔点2 300 ℃,沸点2 550 ℃,硬度大:________。
(7)硒:熔点217 ℃,沸点685 ℃,溶于氯仿:________。
(8)锑:熔点630.74 ℃,沸点1 750 ℃,导电:________。
共价晶体
分子晶体
分子晶体
离子晶体
分子晶体
共价晶体
分子晶体
金属晶体
对点训练
四种晶体的结构性质比较
晶体结构
离子晶体
分子晶体
共价晶体
金属晶体
结构
构成微粒
作用力
性质
硬度
熔沸点
导电性
延展性
溶解性
实例
阴阳离子
分子
原子
阳离子、电子
离子键
分子间作用力
共价键
金属键
较大、脆
小
很大
差异大
较高
低
很高
差异大
固态、熔融态不导电,
酸在水溶液中导电
不导或半导
导电
差
差
差
好
①相似相溶②氢键③反应
不溶
干冰
金刚石
(原子晶体)
一般不导电,溶于水后有的导电
大多易溶于水等极性溶剂、不溶非极性
常见溶剂难溶
晶体不导电,水溶液或熔融态导电
食盐晶体
镁、铝
归纳小结
对于组成和结构相似的物质,阴、阳离子半径越小,所带电荷数越多,离子键越强,熔沸点越高,晶体越稳定。
离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。
如何判断离子晶体的稳定性和熔沸点高低?
晶格能
1、定义:气态离子形成1mol离子晶体时释放的能量,取正值,单位:kJ/mol
2、影响晶格能因素:(1)先看离子电荷:电荷量越多,晶格能越大
(2)再看离子半径:离子半径越小,晶格能越大
3、晶格能的应用:
(1)对晶体性质的影响:晶格能越大,离子晶体越稳定,熔点越高,硬度越大
(2)岩浆晶出规则与晶格能大小的关系,晶格能高的晶体熔点较高,更容易在岩浆冷却过程中冷却下来,从而先结晶。
思考与讨论
资料链接
应用:作溶剂。用作电化学研究的电解质、有机合成的溶剂和催化剂等
科学?技术?社会——离子液体
离子液体:室温或稍高于室温时呈液态的离子化合物
引入有机基团可降低离子化合物的熔点,如C2H5NH3NO3的熔点只有12℃,比NH4NO3低了158℃!
成分:常见的阴离子如四氯铝酸根( AlCl4-)、六氟磷酸根( PF6- 。)、四氟硼酸根( BF4- )等,常见的阳离子如季铵离子( R4N+ ,即 NH4+的 H 被烃基 R 取代)、带烃基侧链的咪唑、嘧啶等有环状含氮结构的有机胺正离子等。
性质:难挥发、有良好的导电性。
形成离子液体的阴、阳离子半径较大,体积较大,晶格能较小,离子间的作用力较弱。
熔点越来越低,有的离子晶体熔点稍高于室温或低于室温,称为离子液体。
判断正误,正确的画“√”,错误的画“?”。
(1)在晶体中只要有阴离子就一定有阳离子?( )
(2)在晶体中只要有阳离子就一定有阴离子?( )
(3)有些离子晶体中除含离子键外还存在共价键( )
(4)金属元素和非金属元素组成的晶体不一定是离子晶体 ( )
(5)离子晶体一定都含有金属元素 ( )
(6)离子晶体的熔点一定低于共价晶体的熔点( )
(7)离子晶体受热熔化,破坏化学键,吸收能量,属于化学变化( )
(8)某些离子晶体受热失去结晶水,属于物理变化( )
√
?
?
√
?
√
?
?
如NH4Cl、NH4NO3等铵盐
如AlCl3是分子晶体
如金属晶体由阳离子和自由电子构成
MgO的熔点高于SiO2的熔点
对点训练
NaCl的晶胞示意图
CsCl的晶胞示意图
CaF2的晶胞示意图
四、常见离子晶体的结构
空隙填入阳离子
NaCl的微观结构特征
面心立方堆积
NaCl晶胞可以看成是氯离子采取面心立方堆积,钠离子填充在氯离子形成的空隙中。
r(Cl-)>r(Na+)
形成的空隙形状
__________
正八面体
1. NaCl晶胞
Cl-:8×????????+6×????????=4
?
Cl?
Na+
1. NaCl晶胞
(2)晶体堆积方式:
(3)晶胞中含有的离子数:
化学式NaCl不表示分子式,而表示阴阳离子个数比1:1
钠离子:体心和棱中点
氯离子:面心和顶点
(1)Na+和Cl-的位置:
可互换,
交错排列
Na+:12×????????+1=4
?
由Cl-形成的面心立方晶格
(4)
与Na+等距离且最近的Na+ 有:
与Cl-等距离且最近的Cl-有:
12
12
1. NaCl晶胞
Cl?
Na+
Cl?
Na+
与Na+等距最近的Cl-共有 个。
这几个Cl-在空间构成的几何构型为 。
正八面体
与Cl- 等距最近的 Na+共有 个。
这几个Na+ 在空间构成的几何构型为 。
正八面体
6
6
一个离子周围最邻近(等距最近)的
带相反电荷的离子数目
Na+的配位数为: ;
Cl-的配位数为: 。
6
6
(5)NaCl晶体中阴、阳离子的配位数
Cl-: (0,0,0) (1/2,1/2,0) (1/2 ,0,1/2) (0,1/2,1/2)
Na+: (0, 0,1/2) (1/2,0,0) (0,1/2,0) (1/2,1/2,1/2)
LiH、LiF、LiCl、NaF、NaBr、NaI、CaO、MgO、CaS、BaS 等晶体都属于NaCl型。
(两种离子的坐标可以互换)
若晶胞参数为a pm,则氯化钠晶体的密度为
_________________________g·cm-3
(234)×10-30/ NA·a3
(6)分数坐标:
Cl-
Cs+
阴离子
简单立方堆积
阳离子填入立方体空隙
Cl-形成的空隙形状:
立方体(正六面体)
2.CsCl晶胞
Cl- 周围等距最近的 个 Cl- 的几何构型:
Cl- 周围等距最近的 个Cs+ 的几何构型:
(1)粒子位置:
8
1个Cl-, 1个Cs+
Cl-位于顶点
Cs+位于体心
6
6
8
(3)晶胞中含有的离子数:
可互换
无隙并置
阴阳离子个数比1:1
体心晶胞
正八面体
Cs+周围等距最近的 个Cs+ 的几何构型:
(4)阴、阳离子配位数均为:
Cs+ 周围等距最近的 个Cl- 的几何构型:
8
正六面体
(前后;左右; 上下各1)
(5)
2.CsCl晶胞
(2)晶体堆积方式:
Cl-(0,0,0)
Cs+(1/2,1/2,1/2)
CsBr, CsI, NH4Cl, NH4Br 等属CsCl型
若晶胞参数为a pm,则氯化铯晶体的密度为_________________________g·cm-3
(168.5)×10-30/ NA·a3
a
(6)分数坐标:
2.CsCl晶胞
(3)晶胞中含有的离子数:Zn2+______; S2- ______
(4)Zn2+配位数_____ ;S2-配位数_____
(1)粒子位置:Zn2+____________;S2-________
体内
顶点、面心
4
4
4
4
(2)晶体堆积方式:可类比金刚石的晶胞
S2-成面心立方密堆积,
内部4个Zn2+交错排列在4个小立方体的中心。
(5)晶胞边长为a,
最近阴阳离子间距(体对角线的1∕4)为:
3.ZnS晶胞
立方ZnS晶胞
CdS, CuCl, AgI, SiC, BN 等属立方ZnS型
(6)分数坐标:
(3)晶胞中含有的离子数:Ca2+____ ; F-______
Ca2+位于顶点和面心
F-位于立方体内
Ca2+
F-
4个 8个
Ca2+
F-
F- 配位数:4
配位多面体:正四面体
Ca2+配位数:
配位多面体:
8
立方体
(1)粒子位置:
(4) 正负离子配位数比:
(2)晶体堆积方式:可类比金刚石的晶胞
Ca2+成面心立方,F-在8个小立方体的中心。
8:4
4.CaF2晶胞
晶胞萤石CaF2
SrF2, UO2,HgF2等晶体属CaF2型
(5)晶胞边长为a,
该晶胞中Ca2+与F-的距离最近为______
4.CaF2晶胞
【思考】CaF2晶胞与ZnS晶胞类似,
为什么CaF2晶胞Ca2+的配位数为8个,而ZnS 晶胞中Zn2+配位数为4?
【提示】F-与Ca2+电荷比为1 : 2,而ZnS中,S2-与Zn2+电荷比为1 : 1
CaF2型晶胞
【注意】阴阳离子电荷比=阴阳离子配位数比=阴阳离子数目反比
晶体中正负离子的电荷相同,配位数就相同,
晶体中正负离子的电荷数不同,配位数就不相同。
思考与讨论
各类型离子晶体晶胞的比较
晶体类型
晶胞类型
晶胞结构示意图
配位数
距离最近且相等的同种离子
每个晶胞含有离子数
实例
NaCl型
AB
CsCl型
ZnS型
AB2
CaF2型
Na+:6
Cl-:6
Cs+:8
Cl-:8
Zn2+:4
S2-:4
Ca2+:8
F-:4
Na+:12
Cl-:12
Cs+:6
Cl-:6
Na+:4
Cl-:4
Cs+:1
Cl-:1
Zn2+:4
S2-:4
Ca2+:4
F-:8
碱金属的卤化物(除Cs)、银的卤化物(除AgI)、碱土金属(ⅡA)氧化物(除BeO)、硫化物(除ZnS)、硒化物
ZnS、AgI、BeO等
Cs的卤化物(除氟化物)
ThO2、UO2、CeO2、 BaF2、PbF2、SrF2等
归纳小结
晶胞萤石CaF2
立方ZnS晶胞
Zn2+周围最近的Zn2+数______
S2-周围最近的S2-数______
12
12
左右2个晶胞等价
每个Ca2+周围最近且等距离的Ca2+有 个
每个F-周围最近且等距离的F-有 个
12
6
拓展提升
各类型离子晶体晶胞的比较
晶体类型
晶胞类型
晶胞结构示意图
配位数
每个晶胞含有离子数
NaCl型
Na+:4
Cl-:4
Na+填入Cl-所形成的 空隙中
NaCl晶胞中有 个 空隙
Na+的填隙率为
AB
CsCl型
Cs+:1
Cl-:1
Cs+填入Cl-所形成的 空隙中
CsCl晶胞中有 个 空隙
Cs+的填隙率为
ZnS型
Zn2+:4
S2-:4
Zn2+填入S2-所形成的 空隙中
ZnS晶胞中有 个 空隙
Zn2+的填隙率为
AB2
CaF2型
Ca2+:4
F-:8
Ca2+填入F-所形成的 空隙中
CaF2晶胞中有 个 空隙
Ca2+的填隙率为
Na+:6
Cl-:6
Cs+:8
Cl-:8
Zn2+:4
S2-:4
Ca2+:8
F-:4
八面体
4
八面体
100%
立方体
1
立方体
100%
四面体
8
四面体
50%
立方体
8
50%
立方体
归纳小结
1.已知XYZ三种元素组成化合物是离子晶体其晶胞如图,XYZ分别处于立方体顶点、棱边中点、立方体体心。下面关于该化合物说法正确的是( )
A.该晶体的化学式为ZXY3
B.该晶体的熔点一定比金属晶体熔点高
C.每个X周围距离最近的Y有8个
D.每个Z周围距离最近的X有16个
晶胞内属于晶胞
1
顶点为8个共用
1
棱上为4个共用
3
√
金属晶体熔点差别大,无可比性
×
6个
×
8个
×
A
对点训练
2.如图是氯化铯晶体的晶胞,已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )
晶体密度
C
晶胞内属于晶胞
顶点8个晶胞共用
每个晶胞有1个Cs- 1个Cl-
1mol氯化铯 V= NA a3 cm3
对点训练
第三节 金属晶体与离子晶体
学习目标
1.能辨识常见的离子晶体,理解离子晶体中的粒子及粒子间的相互作用,以及对晶体性质的影响。
2.掌握氯化钠、氯化铯等离子晶体的结构特点。
3.3.3 离子晶体
教材内容:P87-89
我们知道,熔融的NaCl或者NaCl的水溶液能够导电,
而NaCl晶体却不能导电,这是为什么呢?
没有自由移动的Na+和Cl-
1913年布拉格首次
用X射线衍射法
测定了氯化钠的
晶体结构
氯化钠晶体的微观结构
一种现代实验室使用的X射线衍射仪
胆矾
萤石
重晶石
烧碱
新课引入
阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
3.特点:
没有方向性和饱和性。
以离子键结合的化合物倾向于形成紧密堆积,使每个离子周围尽可能
多地与带相反电荷的离子接触,从而达到稳定的目的。
4.离子键的形成条件:活泼的金属元素和非金属元素间容易形成离子键;
形成化合物的元素的电负性之差>1.7
2.本质:静电作用(静电吸引力和静电排斥力)
1.成键过程:阴阳离子接近到某一定距离时,吸引和排斥 达到平衡,就形成了离子键。
5.影响离子键强度的因素:一般说来,阴、阳离子的电荷数越多,
离子半径越小,离子键越强
一、离子键
1.概念:
2.成键微粒:
4.相互作用:
5.常见的离子晶体:
由阳离子和阴离子相互作用而形成的晶体
强碱、大部分盐、活泼金属氧化物、过氧化物、活泼碳化物(CaC2)及氮化物(Mg3N2)
离子键 (有的还存在共价键、氢键)。
是由阳离子和阴离子构成,有的还存在电中性的分子(如H2O、NH3等)。阳离子或阴离子不仅指单原子离子,还包括复杂离子,如NH4+、SO42-。
3.离子晶体的化学式:
表示离子最简整数比,不存在分子式(无单个分子存在)
二、离子晶体
CaCO3 、(NH4)2SO4 、CuSO4·5H2O、 Cu(NH3)4SO4·H2O观察以上离子晶体中都含有哪些微观粒子?晶体内部存在哪些类型的化学键?
离子晶体
阴、阳离子
(单原子或多原子)
电中性分子
构成微粒
离子键、共价键、
氢键、范德华力
作用力
注意:贯穿整个晶体的主要作用力仍是阴、阳离子之间的作用力。
晶体中也存在范德华力,只是当能量份额很低时不提及。
拓展提升
离子化合物溶于水时,阴、阳离子受到水分子作用变成了自由移动的离子(实质上是水合离子),在外界电场作用下,阴、阳离子定向移动而导电。
离子晶体中,离子键较强,离子被限制在晶格的一定位置上振动而不能自由移动,即晶体中无自由移动的离子,因此,离子晶体不导电。
当升高温度时,阴、阳离子获得足够能量克服离子间的相互作用,成为自由移动的离子(熔融状态),在外界电场作用下,离子定向移动而形成电流。
(1)导电性
6.离子晶体的性质
离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量。因此,离子晶体具有较高的熔、沸点和难挥发的性质。
(2)具有较高的熔、沸点,难挥发
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高。
结论:
离子晶体的熔点差距也较大
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}化合物
熔点 /℃
化合物
熔点 /℃
CaO
2613
Na2SO4
884
CuCl2
1326
Ca2SiO4
2130
NH4NO3
169.6
Na3PO4
340
BaSO4
1580
CH3COOCs
194
LiPF6
200分解温度
NaNO2
270
我们知道,金属的熔点差异很大,如钨的熔点为 3410 ℃。而常温下,汞却是液体。离子晶体的熔点是不是也差异很大呢?请从理化手册或互联网查找下列离子晶体的熔点数据,得出结论。
思考与讨论
教材:P88
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
{5940675A-B579-460E-94D1-54222C63F5DA} 晶体
电荷数
熔点/℃
NaCl
1
801
NaBr
1
750
MgO
2
2800
CaO
2
2576
离子半径越小,离子键越强,
熔点就越高,硬度也越大。
{5940675A-B579-460E-94D1-54222C63F5DA} 晶体
电荷数
熔点/℃
NaF
1
993
MgF2
2
1248
AlF3
3
1290
离子电荷越多,离子键越强,
熔点就越高,硬度也越大。
成正比
成反比
三、影响离子晶体熔、沸点和硬度大小的因素
1、物质的状态,一般情况下是固体>液体>气体;
2、晶体类型,一般是共价晶体>离子晶体>分子晶体
(注意:不是绝对的,如氧化铝的熔点大于晶体硅)。
3、同类晶体比较思路:
共价晶体→共价键键能→键长→原子半径;
分子晶体→分子间作用力→相对分子质量、极性、氢键、支链;
离子晶体→离子键强弱→离子所带电荷数、离子半径;
金属晶体→金属键强弱→金属阳离子所带电荷、金属阳离子半径。
比较不同晶体熔、沸点的基本思路
归纳小结
(3)硬度
离子晶体的硬度较大,难于压缩。
阴阳离子间有较强的离子键,使离子晶体的硬度较大,当晶体受到外力冲击时,易发生位错,部分离子键发生断裂,导致晶体破碎。
发生滑动
施加外力
阳离子
阴离子
同种电荷相互排斥,使晶面裂开
位错使离子键破坏,故离子晶体无延展性。
(4)溶解性
大多数离子晶体易溶于极性溶剂(如水),难溶于非极性溶剂(如汽油、苯等),遵循“相似相溶”规律。
当把离子晶体放入水中时,极性水分子对离子晶体中的离子产生吸引作用,使晶体中的离子克服了离子间的作用而电离,变成在水中自由移动的离子。
1.依据物质的分类判断
(4)金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。
(2)少数的非金属单质(金刚石、晶体Si)和少数的共价化合物(SiO2)等是共价晶体。
(1)大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2等外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)金属单质(除汞外)和合金是金属晶体
判断晶体类型的常用方法
归纳小结
2.依据物质的物理性质:
(1)在常温下呈气态或液态或易升华的物质,其晶体应属于分子晶体(Hg除外)。如H2O、H2、稀有气体等。
(2)在熔融状态下能导电的晶体(化合物)是离子晶体。如:NaCl熔融后电离出Na+和Cl-,能自由移动,所以能导电。
(3)有很高的熔、沸点,硬度大,并且难溶于水的物质大多为共价晶体,如晶体硅、二氧化硅、金刚石等。
(4)金属晶体多数硬度大,但也有较低的,且具有延展性,合金的硬度比其成分金属大,合金的熔点比其成分金属低。
分析下列物质的物理性质,判断其晶体类型。
(1)碳化铝,黄色晶体,熔点2 200 ℃,熔融态不导电:________。
(2)溴化铝,无色晶体,熔点98 ℃,熔融态不导电:________。
(3)五氟化矾,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮等:______。
(4)溴化钾,无色晶体,熔融时或溶于水中都能导电:________。
(5)SiI4:熔点120.5 ℃,沸点287.4 ℃,易水解:________。
(6)硼:熔点2 300 ℃,沸点2 550 ℃,硬度大:________。
(7)硒:熔点217 ℃,沸点685 ℃,溶于氯仿:________。
(8)锑:熔点630.74 ℃,沸点1 750 ℃,导电:________。
共价晶体
分子晶体
分子晶体
离子晶体
分子晶体
共价晶体
分子晶体
金属晶体
对点训练
四种晶体的结构性质比较
晶体结构
离子晶体
分子晶体
共价晶体
金属晶体
结构
构成微粒
作用力
性质
硬度
熔沸点
导电性
延展性
溶解性
实例
阴阳离子
分子
原子
阳离子、电子
离子键
分子间作用力
共价键
金属键
较大、脆
小
很大
差异大
较高
低
很高
差异大
固态、熔融态不导电,
酸在水溶液中导电
不导或半导
导电
差
差
差
好
①相似相溶②氢键③反应
不溶
干冰
金刚石
(原子晶体)
一般不导电,溶于水后有的导电
大多易溶于水等极性溶剂、不溶非极性
常见溶剂难溶
晶体不导电,水溶液或熔融态导电
食盐晶体
镁、铝
归纳小结
对于组成和结构相似的物质,阴、阳离子半径越小,所带电荷数越多,离子键越强,熔沸点越高,晶体越稳定。
离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。
如何判断离子晶体的稳定性和熔沸点高低?
晶格能
1、定义:气态离子形成1mol离子晶体时释放的能量,取正值,单位:kJ/mol
2、影响晶格能因素:(1)先看离子电荷:电荷量越多,晶格能越大
(2)再看离子半径:离子半径越小,晶格能越大
3、晶格能的应用:
(1)对晶体性质的影响:晶格能越大,离子晶体越稳定,熔点越高,硬度越大
(2)岩浆晶出规则与晶格能大小的关系,晶格能高的晶体熔点较高,更容易在岩浆冷却过程中冷却下来,从而先结晶。
思考与讨论
资料链接
应用:作溶剂。用作电化学研究的电解质、有机合成的溶剂和催化剂等
科学?技术?社会——离子液体
离子液体:室温或稍高于室温时呈液态的离子化合物
引入有机基团可降低离子化合物的熔点,如C2H5NH3NO3的熔点只有12℃,比NH4NO3低了158℃!
成分:常见的阴离子如四氯铝酸根( AlCl4-)、六氟磷酸根( PF6- 。)、四氟硼酸根( BF4- )等,常见的阳离子如季铵离子( R4N+ ,即 NH4+的 H 被烃基 R 取代)、带烃基侧链的咪唑、嘧啶等有环状含氮结构的有机胺正离子等。
性质:难挥发、有良好的导电性。
形成离子液体的阴、阳离子半径较大,体积较大,晶格能较小,离子间的作用力较弱。
熔点越来越低,有的离子晶体熔点稍高于室温或低于室温,称为离子液体。
判断正误,正确的画“√”,错误的画“?”。
(1)在晶体中只要有阴离子就一定有阳离子?( )
(2)在晶体中只要有阳离子就一定有阴离子?( )
(3)有些离子晶体中除含离子键外还存在共价键( )
(4)金属元素和非金属元素组成的晶体不一定是离子晶体 ( )
(5)离子晶体一定都含有金属元素 ( )
(6)离子晶体的熔点一定低于共价晶体的熔点( )
(7)离子晶体受热熔化,破坏化学键,吸收能量,属于化学变化( )
(8)某些离子晶体受热失去结晶水,属于物理变化( )
√
?
?
√
?
√
?
?
如NH4Cl、NH4NO3等铵盐
如AlCl3是分子晶体
如金属晶体由阳离子和自由电子构成
MgO的熔点高于SiO2的熔点
对点训练
NaCl的晶胞示意图
CsCl的晶胞示意图
CaF2的晶胞示意图
四、常见离子晶体的结构
空隙填入阳离子
NaCl的微观结构特征
面心立方堆积
NaCl晶胞可以看成是氯离子采取面心立方堆积,钠离子填充在氯离子形成的空隙中。
r(Cl-)>r(Na+)
形成的空隙形状
__________
正八面体
1. NaCl晶胞
Cl-:8×????????+6×????????=4
?
Cl?
Na+
1. NaCl晶胞
(2)晶体堆积方式:
(3)晶胞中含有的离子数:
化学式NaCl不表示分子式,而表示阴阳离子个数比1:1
钠离子:体心和棱中点
氯离子:面心和顶点
(1)Na+和Cl-的位置:
可互换,
交错排列
Na+:12×????????+1=4
?
由Cl-形成的面心立方晶格
(4)
与Na+等距离且最近的Na+ 有:
与Cl-等距离且最近的Cl-有:
12
12
1. NaCl晶胞
Cl?
Na+
Cl?
Na+
与Na+等距最近的Cl-共有 个。
这几个Cl-在空间构成的几何构型为 。
正八面体
与Cl- 等距最近的 Na+共有 个。
这几个Na+ 在空间构成的几何构型为 。
正八面体
6
6
一个离子周围最邻近(等距最近)的
带相反电荷的离子数目
Na+的配位数为: ;
Cl-的配位数为: 。
6
6
(5)NaCl晶体中阴、阳离子的配位数
Cl-: (0,0,0) (1/2,1/2,0) (1/2 ,0,1/2) (0,1/2,1/2)
Na+: (0, 0,1/2) (1/2,0,0) (0,1/2,0) (1/2,1/2,1/2)
LiH、LiF、LiCl、NaF、NaBr、NaI、CaO、MgO、CaS、BaS 等晶体都属于NaCl型。
(两种离子的坐标可以互换)
若晶胞参数为a pm,则氯化钠晶体的密度为
_________________________g·cm-3
(234)×10-30/ NA·a3
(6)分数坐标:
Cl-
Cs+
阴离子
简单立方堆积
阳离子填入立方体空隙
Cl-形成的空隙形状:
立方体(正六面体)
2.CsCl晶胞
Cl- 周围等距最近的 个 Cl- 的几何构型:
Cl- 周围等距最近的 个Cs+ 的几何构型:
(1)粒子位置:
8
1个Cl-, 1个Cs+
Cl-位于顶点
Cs+位于体心
6
6
8
(3)晶胞中含有的离子数:
可互换
无隙并置
阴阳离子个数比1:1
体心晶胞
正八面体
Cs+周围等距最近的 个Cs+ 的几何构型:
(4)阴、阳离子配位数均为:
Cs+ 周围等距最近的 个Cl- 的几何构型:
8
正六面体
(前后;左右; 上下各1)
(5)
2.CsCl晶胞
(2)晶体堆积方式:
Cl-(0,0,0)
Cs+(1/2,1/2,1/2)
CsBr, CsI, NH4Cl, NH4Br 等属CsCl型
若晶胞参数为a pm,则氯化铯晶体的密度为_________________________g·cm-3
(168.5)×10-30/ NA·a3
a
(6)分数坐标:
2.CsCl晶胞
(3)晶胞中含有的离子数:Zn2+______; S2- ______
(4)Zn2+配位数_____ ;S2-配位数_____
(1)粒子位置:Zn2+____________;S2-________
体内
顶点、面心
4
4
4
4
(2)晶体堆积方式:可类比金刚石的晶胞
S2-成面心立方密堆积,
内部4个Zn2+交错排列在4个小立方体的中心。
(5)晶胞边长为a,
最近阴阳离子间距(体对角线的1∕4)为:
3.ZnS晶胞
立方ZnS晶胞
CdS, CuCl, AgI, SiC, BN 等属立方ZnS型
(6)分数坐标:
(3)晶胞中含有的离子数:Ca2+____ ; F-______
Ca2+位于顶点和面心
F-位于立方体内
Ca2+
F-
4个 8个
Ca2+
F-
F- 配位数:4
配位多面体:正四面体
Ca2+配位数:
配位多面体:
8
立方体
(1)粒子位置:
(4) 正负离子配位数比:
(2)晶体堆积方式:可类比金刚石的晶胞
Ca2+成面心立方,F-在8个小立方体的中心。
8:4
4.CaF2晶胞
晶胞萤石CaF2
SrF2, UO2,HgF2等晶体属CaF2型
(5)晶胞边长为a,
该晶胞中Ca2+与F-的距离最近为______
4.CaF2晶胞
【思考】CaF2晶胞与ZnS晶胞类似,
为什么CaF2晶胞Ca2+的配位数为8个,而ZnS 晶胞中Zn2+配位数为4?
【提示】F-与Ca2+电荷比为1 : 2,而ZnS中,S2-与Zn2+电荷比为1 : 1
CaF2型晶胞
【注意】阴阳离子电荷比=阴阳离子配位数比=阴阳离子数目反比
晶体中正负离子的电荷相同,配位数就相同,
晶体中正负离子的电荷数不同,配位数就不相同。
思考与讨论
各类型离子晶体晶胞的比较
晶体类型
晶胞类型
晶胞结构示意图
配位数
距离最近且相等的同种离子
每个晶胞含有离子数
实例
NaCl型
AB
CsCl型
ZnS型
AB2
CaF2型
Na+:6
Cl-:6
Cs+:8
Cl-:8
Zn2+:4
S2-:4
Ca2+:8
F-:4
Na+:12
Cl-:12
Cs+:6
Cl-:6
Na+:4
Cl-:4
Cs+:1
Cl-:1
Zn2+:4
S2-:4
Ca2+:4
F-:8
碱金属的卤化物(除Cs)、银的卤化物(除AgI)、碱土金属(ⅡA)氧化物(除BeO)、硫化物(除ZnS)、硒化物
ZnS、AgI、BeO等
Cs的卤化物(除氟化物)
ThO2、UO2、CeO2、 BaF2、PbF2、SrF2等
归纳小结
晶胞萤石CaF2
立方ZnS晶胞
Zn2+周围最近的Zn2+数______
S2-周围最近的S2-数______
12
12
左右2个晶胞等价
每个Ca2+周围最近且等距离的Ca2+有 个
每个F-周围最近且等距离的F-有 个
12
6
拓展提升
各类型离子晶体晶胞的比较
晶体类型
晶胞类型
晶胞结构示意图
配位数
每个晶胞含有离子数
NaCl型
Na+:4
Cl-:4
Na+填入Cl-所形成的 空隙中
NaCl晶胞中有 个 空隙
Na+的填隙率为
AB
CsCl型
Cs+:1
Cl-:1
Cs+填入Cl-所形成的 空隙中
CsCl晶胞中有 个 空隙
Cs+的填隙率为
ZnS型
Zn2+:4
S2-:4
Zn2+填入S2-所形成的 空隙中
ZnS晶胞中有 个 空隙
Zn2+的填隙率为
AB2
CaF2型
Ca2+:4
F-:8
Ca2+填入F-所形成的 空隙中
CaF2晶胞中有 个 空隙
Ca2+的填隙率为
Na+:6
Cl-:6
Cs+:8
Cl-:8
Zn2+:4
S2-:4
Ca2+:8
F-:4
八面体
4
八面体
100%
立方体
1
立方体
100%
四面体
8
四面体
50%
立方体
8
50%
立方体
归纳小结
1.已知XYZ三种元素组成化合物是离子晶体其晶胞如图,XYZ分别处于立方体顶点、棱边中点、立方体体心。下面关于该化合物说法正确的是( )
A.该晶体的化学式为ZXY3
B.该晶体的熔点一定比金属晶体熔点高
C.每个X周围距离最近的Y有8个
D.每个Z周围距离最近的X有16个
晶胞内属于晶胞
1
顶点为8个共用
1
棱上为4个共用
3
√
金属晶体熔点差别大,无可比性
×
6个
×
8个
×
A
对点训练
2.如图是氯化铯晶体的晶胞,已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )
晶体密度
C
晶胞内属于晶胞
顶点8个晶胞共用
每个晶胞有1个Cs- 1个Cl-
1mol氯化铯 V= NA a3 cm3
对点训练
