2023年中考化学鲁教版(五四学制)一轮练习题-海水中的化学(含解析)
文档属性
| 名称 | 2023年中考化学鲁教版(五四学制)一轮练习题-海水中的化学(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 165.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-16 15:32:04 | ||
图片预览




文档简介
2023年中考化学鲁教版(五四学制)一轮练习题-海水中的化学
一、单选题
1.下列物质中,与CO2、CuCl2溶液、Na2CO3溶液都能发生反应,且都有明显现象的是
A.NaOH B.Ca(OH)2 C.H2SO4 D.HCl
2.下列有关实验现象的描述不正确的是
A.石灰石与稀盐酸反应产生大量气泡,该气体使燃着的木条熄灭
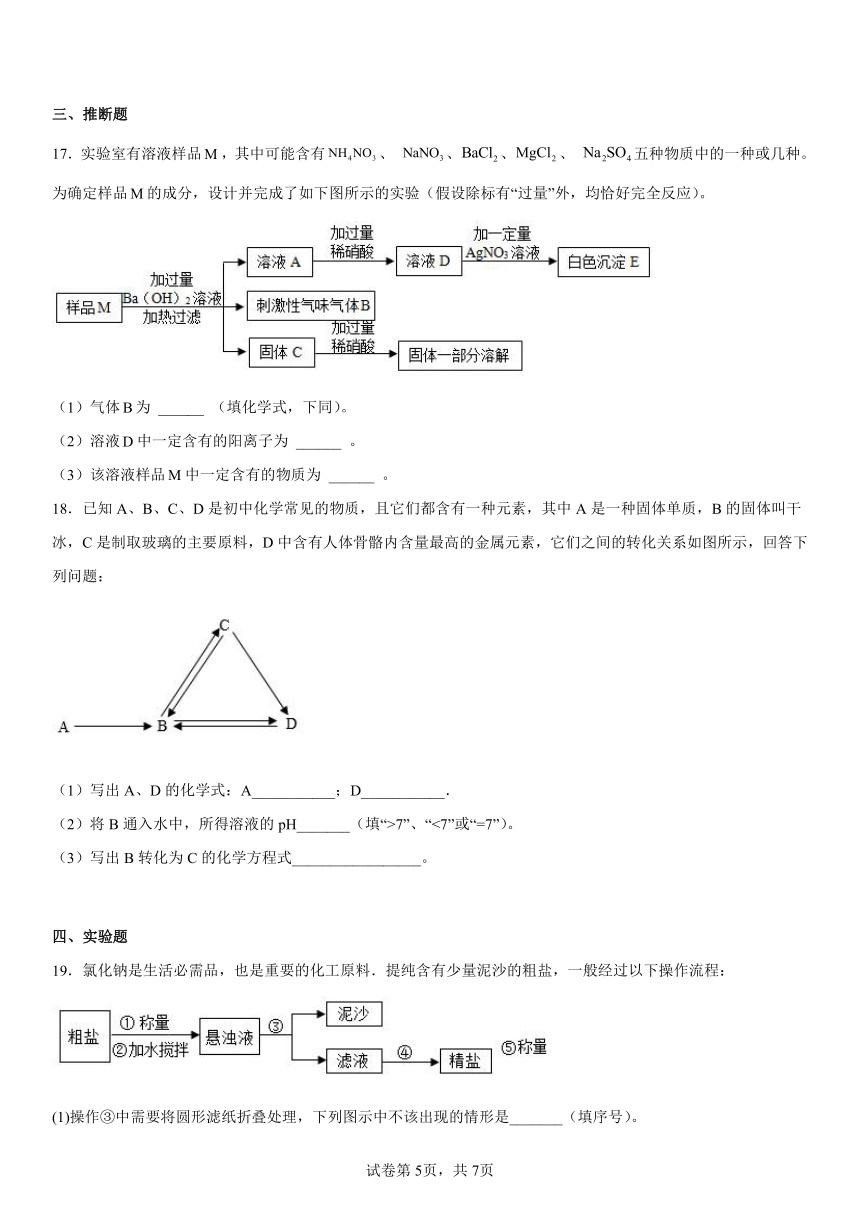
B.镁在空气中燃烧生成氧化镁
C.硫酸铜溶液与氢氧化钠溶液混合有蓝色沉淀生成
D.蜡烛燃烧放出了热量
3.除去下列各物质中的少量杂质,所选用的试剂和操作方法都正确的是
物质 杂质 试剂 操作方法
A MgCl2溶液 HCl 过量Mg(OH)2 过滤
B CO2 H2O NaOH固体 干燥
C NH4Cl溶液 (NH4)2SO4 适量硝酸钡溶液 过滤
D CaO 石灰石 无 高温燃烧
A.A B.B C.C D.D
4.海水中离子的分布情况如下图所示,由此得到的结论正确的是
A.海水中离子带的正电荷多负电荷少
B.海水是溶液,均一稳定的原因是其溶解的粒子大小和水分子差不多
C.海洋呈蓝色,表明将海水蒸发后得到的盐一定是蓝色的固体
D.海水的成分是固定不变的
5.关于海水的说法正确的是
A.海水中含量最多的元素是氯元素
B.海水中盐的质量分数约为3.5%
C.直接电解海水可获得金属镁
D.可燃冰的开采与利用不会带来环境问题
6.如图是A、B、C三种固体物质的溶解度曲线图,下列说法错误的是
A.t2℃时,A、B、C三种物质中,A物质的溶解度最大
B.P点表示t1℃时B、C两物质的溶解度大小相等
C.一定温度时,要将B物质的不饱和溶液转变成饱和溶液,可采取增加溶质的方法
D.20℃时,给A、B、C三种物质的饱和溶液加热(不考虑溶剂的蒸发),有晶体析出的是A物质
7.下列排序正确的是
A.金属活动性顺序: B.物质的溶解性:
C.空气中物质含量: D.铜元素质量分数:
8.某化工厂有甲、乙两个车间,它们排放的废水中均含三种离子,经分析这些离子是Ba2+、Cu2+、K+、NO、SO、CO甲车间废水呈碱性,若将甲、乙车间的废水按适当比例混合,使废水中的某些离子恰好完全反应转化为沉淀(如图所示)。下列分析正确的是
A.甲车间的废水含有的离子是K+、NO、CO
B.图中的沉淀是硫酸钡和碳酸钡
C.图中滤液所含阳离子与阴离子的数目比为1:1
D.若向乙车间的废水中加入适量铁粉,充分反应后过滤,滤液可直接排放
9.实验室中用下列装置进行的实验,达不到实验目的的是
A.用图 1 所示装置除去少量黄河水中的泥沙
B.用图 2 所示装置加热蒸发 NaCl饱和溶液制备 NaCl 晶体
C.用图 3 所示装置制取少量 CO2气体
D.用图 4 所示装置除去 CO2中含有的少量 HCl 气体
10.盐化工是我市的一项重点产业,绿色应用是化工生产的发展方向。为了除去NaCl溶液中含有少量的MgCl2、CaC12和Na2SO4等杂质,某小组同学选用Na2CO3溶液、稀盐酸、Ba(OH)2溶液三种试剂,按一定的顺序进行如图所示的实验。下列分析不正确的是
A.实验Ⅰ中加入试剂A除去的杂质是MgCl2和Na2SO4
B.实验Ⅱ中加入的试剂B是Na2CO3溶液
C.实验Ⅲ中有中和反应发生
D.滤液②中共有两种溶质
11.侯德榜是我国著名的化学家,他制取的“红三角”牌纯碱主要成分属于
A.碱 B.盐 C.氧化物 D.酸
12.某无色溶液中可能含有NaOH、Na2CO3、NaHCO3三种溶质中的一种或两种,向溶液中滴加稀盐酸并测定生成气体的体积,生成气体的体积与加入盐酸体积的关系如图所示。下列说法正确的是
A.无色溶液中可能含有NaHCO3
B.无色溶液中只含有Na2CO3
C.a→b段发生反应的离子方程式为+H+=CO2↑+H2O
D.无色溶液中NaOH与Na2CO3的质量之比为1:1
二、填空题
13.请从A或B两题中任选一个作答,若两题均作答,按A计分。
A用浓硫酸配制100g 9.8%的稀硫酸 B粗盐中难溶性杂质的去除
(1)实验需要5.4mL浓硫酸和90mL水。量取两种液体用到的仪器有________(填序号)。 (2)稀释时,需将浓硫酸缓慢倒入水中,并不断进行搅拌,其原因是________。 (1)过滤需要用到的仪器有________(填序号)。 (2)蒸发过程中,需不断进行搅拌,其原因是________。
可供选择的主要仪器: ①试管 ②烧杯 ③蒸发皿 ④托盘天平 ⑤10mL量筒 ⑥100mL量筒 ⑦药匙 ⑧胶头滴管 ⑨漏斗 ⑩酒精灯 铁架台 玻璃棒
14.氯碱工业是重要的化学工业,采用电解精制的饱和食盐水来制取NaOH,2NaCl+2H2O 2NaOH+H2↑+Cl2↑.但粗盐中含有杂质Na2SO4、MgCl2、CaCl2、泥沙等,必须经过提纯才能使用.提纯中常用下列操作步骤:①用稍过量的NaOH除去MgCl2;②过滤;③用稍过量的BaCl2除去Na2SO4;④用稍过量的Na2CO3除去CaCl2等;⑤用稍过量的HCl除去NaOH、Na2CO3;则:
(1)正确的操作顺序为__________或________(填步骤编号);
(2)加入Na2CO3溶液,其目的之一是除去CaCl2,还的一个目的,其反应的化学方程式为__________________________________.
15.现有四种物质:①浓硫酸、②石墨、③硫酸铜、④干冰,请选择相应物质的序号填空:
(1)可用于配制杀菌剂波尔多液的是______。
(2)可用作制冷剂的是______。
(3)能导电的是______。
(4)能做干燥剂的是______。
16.从H、C、O、Na、Ca四种元素中,选择适当元素填写符合下列要求的化学式:
(1)用于改良酸性土壤的碱______;
(2)常用于制作发面食品的纯碱______;
(3)由60个原子构成的形似足球的分子______。
三、推断题
17.实验室有溶液样品,其中可能含有、 、、、 五种物质中的一种或几种。为确定样品的成分,设计并完成了如下图所示的实验(假设除标有“过量”外,均恰好完全反应)。
(1)气体为 ______ (填化学式,下同)。
(2)溶液中一定含有的阳离子为 ______ 。
(3)该溶液样品中一定含有的物质为 ______ 。
18.已知A、B、C、D是初中化学常见的物质,且它们都含有一种元素,其中A是一种固体单质,B的固体叫干冰,C是制取玻璃的主要原料,D中含有人体骨骼内含量最高的金属元素,它们之间的转化关系如图所示,回答下列问题:
(1)写出A、D的化学式:A___________;D___________.
(2)将B通入水中,所得溶液的pH_______(填“>7”、“<7”或“=7”)。
(3)写出B转化为C的化学方程式_________________。
四、实验题
19.氯化钠是生活必需品,也是重要的化工原料.提纯含有少量泥沙的粗盐,一般经过以下操作流程:
(1)操作③中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是_______(填序号)。
(2)操作④中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到___________
等仪器.该操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外,你认为还可采取_______________________________等措施。
(3)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是___________(填序号)。
A.食盐没有全部溶解即过滤 B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿 D.器皿上沾有的精盐没全部转移到称量纸上
20. 在师生联谊晚会上,化学老师表演了“吹气生火”的魔术。用棉花将一种淡黄色的固体包裹其中,将一根长玻璃管插入棉花团中吹气,稍后棉花团剧烈燃烧起来。同学们为了揭开这个魔术的秘密,进行了如下探究。
【相关信息】①淡黄色固体成分是过氧化钠(Na2O2);②吹出的气体主要成分有氮气、二氧化碳和水蒸气;③过氧化钠与氮气不反应;④碳酸钠溶液呈碱性。
【分析讨论】根据棉花团剧烈燃烧的现象分析,反应中除了生成氧气外,还说明过氧化钠发生的反应是_____(填“吸热”或“放热”)反应。
【提出猜想】同学们发现燃烧后残留固体呈白色,对该固体成分进行猜想:
猜想Ⅰ:固体成分是Na2CO3, CO2参加反应。
猜想Ⅱ:固体成分是NaOH, H2O参加反应。
猜想Ⅲ:固体成分是______________,CO2和H2O均参加反应。
【实验探究】同学们在老师带领下用足量且潮湿的CO2气体通入过氧化钠粉末中,充分反应后,取白色固体于试管中配成溶液,设计实验对猜想进行验证。
验证Ⅰ:向溶液中滴加稀盐酸,发现有气泡产生。有同学认为固体成分仅含有Na2CO3。
验证Ⅱ:蘸取少量溶液滴到pH试纸上,与标准比色卡比较,pH大于7,有同学认为固体是NaOH。另外有同学认为此结论是错误的,错误的原因是:__________。
验证Ⅲ:先向溶液中加入足量的氯化钙溶液,看到白色沉淀产生,写出反应方程式_________;然后向上层清液中加入_____溶液,看到溶液呈红色,验证了猜想Ⅲ是正确的。
【实验反思】由验证Ⅲ的结果可知,验证Ⅰ的结论错误,因为它不能排除___的存在。
五、计算题
21.下图是某药厂生产的一种抗酸药(治疗胃酸过多的药物)的说明书的部分内容.阅读后回答下列问题.
说明书 主要成分:碳酸氢钠(NaHCO3) 适 应 症:用于缓解胃酸(含有 盐酸)过多引起的胃痛 用 法:嚼碎后服用 规 格:2.5g/片 注意事项:胃溃疡患者慎服
现取4片药片碾碎后,加到烧杯中,再往烧杯中加入60g稀盐酸,完全反应后,烧杯中物质的总质量为65.6g,(药品的其它成分不溶于水,也不参加反应),求:
(1)生成二氧化碳的质量是___________.
(2)此药片中碳酸氢钠的质量分数是__________.
22.向CuSO4溶液里加入一定溶质质量分数的NaOH溶液,实验过程中,生成沉淀的质量与加入NaOH溶液的质量关系如图所示。
(1)求CuSO4中硫元素与氧元素的质量比________。
(2)恰好完全反应时,产生沉淀的质量________g。
(3)求该NaOH溶液的溶质质量分数________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】NaOH能与CO2反应,但无明显现象,NaOH与Na2CO3溶液不反应,A不合题意;CO2能与Ca(OH)2的水溶液反应且能使其变浑浊,Ca(OH)2的水溶液能与CuCl2溶液反应产生蓝色沉淀,Ca(OH)2的水溶液能与Na2CO3溶液反应产生白色沉淀,所以B正确;H2SO4、HCl、与CO2、CuCl2溶液均不反应,C、D均不合题意。
2.B
【详解】A、石灰石与稀盐酸反应生成氯化钙、水和二氧化碳,可观察到产生大量气泡,且气体能使燃着的木条熄灭,故选项实验现象的描述正确;
B、镁在空气中燃烧生成氧化镁,是实验结论不是实验现象,故选项实验现象的描述不正确;
C、硫酸铜溶液与氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠,可观察到有蓝色沉淀生成,故选项实验现象的描述正确;
D、蜡烛燃烧,放出了热量,故选项实验现象的描述正确。
故选B。
3.A
【详解】A.能与反应生成和水,再过滤除去过量的,除去了杂质且没有引入新的杂质,该选项符合题意;
B.固体不仅能够除去水, 也能与二氧化碳反应,既除去了杂质,也除去了原物质,该选项不符合题意;
C.与硝酸钡反应生成硫酸钡沉淀和硝酸铵,引入了新杂质硝酸铵,该选项不符合题意;
D.石灰石的主要成分是碳酸钙,碳酸钙高温分解生成氧化钙和二氧化碳,但石灰石里还有其他杂质, 会引入新杂质,该选项不符合题意;
故选A。
4.B
【详解】A、海水中离子带的正电荷与负电荷数目相同,故A错误;
B、海水中溶解的粒子大小与水分子差不多,在条件不变的情况下,不会从水中分离出来,故海水具有均一、稳定性,故B正确;
C、海水蒸发得到的盐大多是白色固体,故C错误;
D、外界环境对海水有一定的影响,故D错误。
故选B。
5.B
【详解】A、海水中含量最多的物质是水,故含量最多的元素是氧元素,不符合题意;
B、海水中富含盐类,盐的质量分数约为3.5%,符合题意;
C、海水制镁时,不能直接电解海水,因为海水中氯化镁含量较少,应先富集氯化镁,然后电解,不符合题意;
D、可燃冰开采过程中,如果甲烷气体泄漏,会导致严重的温室效应,不符合题意。
故选B。
6.D
【分析】根据溶解度曲线的意义进行分析解答,交点表示在该温度下二者的溶解度相等,根据溶解度随温度的变化确定析出晶体的方法,根据已知的温度可以查出有关物质的溶解度,据此进行分析解答。
【详解】A、根据三种物质的溶解度曲线不难可知,在t2℃时,三物质的溶解度大小关系为:A>B>C,A物质的溶解度最大,故A选项说法正确;
B、由于在t1℃时,B和C溶解度曲线交于P点,即t1℃时,B、C两物质的溶解度相等,故B选项说法正确;
C、一定温度即溶解度不变时,将B物质的不饱和溶液变为饱和溶液,可以采用恒温蒸发溶剂或增加溶质的方法,故C选项说法正确;
D、由于C的溶解度随温度的升高而减小,而A和B的溶解度随温度的升高而增大,因此20℃时,给它们的饱和溶液升温时,只有C的溶液中会有晶体析出,故D选项说法错误。
故选D。
【点睛】本题考查的是溶解度曲线的应用,完成此题,可以依据已有的溶解度曲线的意义进行分析解答。
7.D
【详解】A.由金属活动性顺序表可知,三种金属活动性顺序由强到弱为:Fe、Cu、Ag,故选项A不正确;
B.碳酸钙难溶于水,氢氧化钙微溶于水,氯化钠易溶于水,三种物质的溶解性按由小到大的顺序是CaCO3、Ca(OH)2、NaCl,故选项B不正确;
C.空气的成分按体积分数计算,N278%、O221%、CO20.03%,空气中物质的含量由多到少的顺序是:N2、O2、CO2,故选项C不正确;
D.Cu2O可变形为CuO0.5,CuS可变形为CuO2,其它原子的相对质量之和越少的,在该化合物中铜元素的质量分数就越大,变形后CuO0.5中其它原子的相对质量之和最小,则铜元素的质量分数最大的为Cu2O,最小的是CuS,铜元素的质量分数有高到低的顺序是:Cu2O、CuO 、CuS ,故选项D正确。
故选D。
8.C
【详解】A、甲车间废水呈碱性,因此甲车间废水中一定含有碳酸根,则不能含有铜离子和钡离子,一定含有钾离子,含有硫酸根离子,否则硫酸根则在乙车间废水中,会形成沉淀,错误;
B、图中的沉淀是硫酸钡和碳酸钡,还有碳酸铜,错误;
C、甲、乙废水混合后生成的可溶性物质是 KNO3,所含阳离于与阴离子的数目比为1:1,正确,符合题意;
D、乙车间废水中的离子为钡离子、铜离子、硝酸根,若向乙车间的废水中加入适量铁粉,铁与铜离子发生置换反应生成亚铁离子和单质铜,充分反应后过滤,滤液中仍有亚铁离子和钡离子,不能直接排放,错误。
故选C。
9.D
【详解】A、该操作为过滤,过滤能够分离固体不溶物和液体,则可用图 1 所示装置除去少量黄河水中的泥沙,故A正确;
B、图示操作为蒸发,蒸发操作可将溶液中的溶质分离出来,所以可用该装置加热蒸发 NaCl饱和溶液制备 NaCl 晶体,故B正确;
C、碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水的反应为固液不加热型反应,所以可用如图的装置制取少量二氧化碳,故C正确;
D、二氧化碳能和氢氧化钠反应生成碳酸钠和水,欲保留的物质被除去,所以不能用如图装置处理CO2中含有的少量 HCl 气体,故D错误;
故选D。
10.D
【详解】A、除去NaCl溶液中含有少量的MgCl2、CaC12和Na2SO4等杂质,加入过量的氢氧化钡,氢氧化钡与氯化镁反应生成氢氧化镁沉淀和氯化钡,氢氧化钡与硫酸钠反应生成硫酸钡沉淀和氢氧化钠,实验Ⅰ中加入试剂A除去的杂质是MgCl2和Na2SO4,说法正确;
B、实验Ⅱ中加入的试剂B目的是除去钡离子,碳酸根与钡离子反应生成碳酸钡,且碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,容易除去,实验Ⅱ中加入的试剂B是Na2CO3溶液,说法正确;
C、氢氧化钡与硫酸钠反应生成硫酸钡沉淀和氢氧化钠,氢氧化钡与碳酸钠反应生成碳酸钡和氢氧化钠,滤液②含有氢氧化钠,氢氧化钠与适量的C盐酸反应生成氯化钠和水,酸与碱反应生成盐和水,该反应属于中和反应,说法正确;
D、滤液②中有氯化钠、生成的氢氧化钠和加入过量的B碳酸钠,有三种杂质,说法错误;
答案:D。
11.B
【分析】本题考查侯氏制碱法。
【详解】侯德榜制取的是纯碱碳酸钠,该物质属于盐类,故选B。
【点睛】本题难度不大,结合盐的概念进行判断即可。
12.C
【分析】根据向溶液中滴加稀盐酸,开始没有气体生成,加入一定体积的盐酸后有气体生成,且溶液中NaHCO3与NaOH不能同时存在,则溶液中一定含有Na2CO3,可能含有NaHCO3,假设溶液中只有Na2CO3,开始发生反应:,而后发生反应:,前后两阶段消耗盐酸体积相等,而图中第一阶段消耗盐酸体积大于第二阶段,故溶液含有NaOH、Na2CO3,不含NaHCO3。
【详解】A、由分析可知,无色溶液中一定没有NaHCO3,故A错误;
B、由分析可知,无色溶液含有NaOH、Na2CO3,故B错误;
C、a→b段发生反应:,反应的离子方程式为:,故C正确;
D、图中生成气体消耗2体积盐酸,由、可知,碳酸钠转化为碳酸氢钠也消耗2体积盐酸,故氢氧化钠反应消耗盐酸为4体积﹣2体积=2体积,结合,可知NaOH与Na2CO3的物质的量相等,所以二者质量之比为40:106,故D错误。
故选:C。
13.A(1)⑤⑥⑧;(2)浓硫酸密度比水大,溶于水放出大量热,用玻璃棒不断搅拌,散热,防止液滴飞溅。B(1)②⑨ ;(2)使液体均匀受热,防止局部温度过高,造成液滴飞溅。
【详解】A(1)考查量筒量取液体问题,需要选择合适量程,接近刻度线时需用胶头滴管滴加;故实验需要5.4mL浓硫酸和90mL水。量取两种液体用到的仪器有⑤10mL量筒 ⑥100mL量筒和⑧胶头滴管;
(2)稀释时,需将浓硫酸缓慢倒入水中,并不断进行搅拌,其原因是浓硫酸密度比水大,溶于水放出大量热,用玻璃棒不断搅拌,散热,防止液滴飞溅。
B(1)考查过滤时所使用的仪器,烧杯、漏斗、玻璃棒和铁架台(带铁圈);
(2)蒸发过程中,需不断进行搅拌,其原因是,搅拌使液体均匀受热,防止局部温度过高,造成液滴飞溅。
14. ① ③ ④ ② ⑤ ③ ① ④ ② ⑤ BaCl2+Na2CO3=BaCO3↓+2NaCl.
【详解】(1)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将除去MgCl2;硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将除去Na2SO4;至于先除氯化镁,还是先除硫酸钠都行,钙离子用碳酸根离子沉淀,除氯化钙加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡;离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为①③④②⑤或③①④②⑤或③④①②⑤,故填①③④②⑤或③①④②⑤或③④①②⑤。
(2)加入Na2CO3溶液,其目的之一是除去CaCl2,还有一个目的是除去多余的氯化钡,氯化钡与碳酸钠反应生成碳酸钡沉淀和氯化钠,故反应的化学方程式写为:BaCl2+Na2CO3=BaCO3↓+2NaCl。
15.(1)③
(2)④
(3)②
(4)①
【详解】(1)硫酸铜可用于配制杀菌剂波尔多液,故填:③;
(2)干冰升华时吸热,使周围的温度降低,可用作制冷剂,故填:④;
(3)石墨具有良好的导电性,故填:②;
(4)浓硫酸具有吸水性,可用做干燥剂,故填:①。
16.(1)Ca(OH)2
(2)Na2CO3
(3)C60
【分析】(1)
氢氧化钙属于碱,呈弱碱性,用于改良酸性土壤,中和土壤其酸性,其化学式为Ca(OH)2,故填:Ca(OH)2;
(2)
纯碱是碳酸钠的俗称,能与酸性物质反应生成二氧化碳,常用于制作发面食品,其化学式为Na2CO3,故填:Na2CO3;
(3)
C60分子是由60个原子构成的形似足球的分子,故填:C60。
17. 、、 、、
【分析】向样品中加过量的氢氧化钡生成刺激性气味的气体B,可知样品中一定有硝酸铵,B是氨气;氢氧化钡与氯化镁反应生成可溶于硝酸的氢氧化镁沉淀,硫酸钠与氢氧化钡反应生成难溶于硝酸的硫酸钡沉淀,固体C中加稀硝酸部分溶解,说明固体C中有硫酸钠和氢氧化镁;溶液D中加硝酸银产生白色沉淀E,说明E是氯化银,溶液D中一定有氯离子。
【详解】(1)根据分析知,气体B为NH3。
(2)样品M中有硫酸钠,加入的氢氧化钡和稀硝酸都过量,故溶液D中一定有、、。
(3)该溶液样品中一定含有的物质为、、。
18. C CaCO3 <7 CO2+2NaOH=Na2CO3+H2O
【分析】已知A、B、C、D是初中化学常见的物质,且它们都含有同一种元素,B的固体叫干冰,所以B为二氧化碳;C是制取玻璃的主要原料,C为碳酸钠;D中含有人体骨骼内含量最高的金属元素,则D中含有钙,并且C可以生成D,D为碳酸钙;其中A是一种固体单质,则A为碳,然后将推出的物质进行验证即可。
【详解】(1)已知A、B、C、D是初中化学常见的物质,且它们都含有同一种元素,B的固体叫干冰,所以B为二氧化碳;C是制取玻璃的主要原料,C为碳酸钠;D中含有人体骨骼内含量最高的金属元素,则D中含有钙,并且C可以生成D,D为碳酸钙;其中A是一种固体单质,则A为碳,经过验证,推导正确,则A、D的化学式为C、CaCO3;
故填:C:CaCO3
(2)B为二氧化碳,将B通入水中,二氧化碳与水反应生成碳酸,所得溶液的pH<7;
故填:<7
(3)B为二氧化碳,C为碳酸钠,二氧化碳与氢氧化钠反应生成碳酸钠和水,B转化为C的化学方程式为:CO2+2NaOH=Na2CO3+H2O。
故填:CO2+2NaOH=Na2CO3+H2O
【点睛】在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
19.(1)D
(2) 蒸发皿 来回移动酒精灯
(3)ABD
【详解】(1)根据图示中的滤纸的折叠处理进行分析,D打开方式不对,应该一边是一层,另一边是三层;
(2)根据粗盐提纯的步骤可知,④是蒸发,蒸发过程除了用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到蒸发皿等仪器,该操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续用玻璃棒搅拌外,还需要来回移动酒精灯使其受热均匀;
(3)根据精盐制得率=分析解答:
A.食盐没有全部溶解即过滤,蒸发后精盐的质量比正常值偏小;
B.蒸发时食盐飞溅剧烈,部分食盐溅出,精盐质量减少;
C.蒸发后,所得精盐很潮湿,造成精盐质量增加;
D.器皿上沾有的精盐没全部转移到称量纸上,精盐质量减少。
故选ABD。
20. 放热 Na2CO3和NaOH的混合物 可能有碳酸钠存在 CaCl2+Na2CO3=CaCO3↓+2NaCl 酚酞 NaOH
【详解】试题分析:根据棉花团剧烈燃烧的现象分析,反应中除了生成氧气外,还说明过氧化钠发生的反应是放热的反应,CO2和H2O均参加反应,所以固体是Na2CO3和NaOH,蘸取少量溶液滴到pH试纸上,与标准比色卡比较,pH大于7,有同学认为固体是NaOH。另外有同学认为此结论是错误的,错误的原因是:可能有碳酸钠存在,因为碳酸钠的溶液也显示碱性,加入足量的氯化钙溶液,看到白色沉淀产生,反应方程式CaCl2+Na2CO3=CaCO3↓+2NaCl;过程中将碱性的碳酸钠变为中性的氯化钠,然后向上层清液中加入酚酞溶液,看到溶液呈红色,验证了猜想Ⅲ是正确的。
考点:实验验证的方法及其过程
21.(1)4.4g(2)84%
【详解】解:(1)生成二氧化碳的质量:60g+2.5g/片×4片﹣65.6g═4.4g
(2)设4片药片中碳酸氢钠的质量为x
NaHCO3+HCl═NaCl+H2O+CO2↑
84 44
x 4.4g
x=8.4g
碳酸氢钠的质量分数为=×100%=84%
答:生成二氧化碳的质量是4.4g;碳酸氢钠的质量分数为84%。
22.(1)1﹕2
(2)9.8
(3)
解:设NaOH溶液的溶质的质量为x
=
x=8g
NaOH溶液的溶质质量分数=×100%=10%
答:NaOH溶液的溶质质量分数为10%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质中,与CO2、CuCl2溶液、Na2CO3溶液都能发生反应,且都有明显现象的是
A.NaOH B.Ca(OH)2 C.H2SO4 D.HCl
2.下列有关实验现象的描述不正确的是
A.石灰石与稀盐酸反应产生大量气泡,该气体使燃着的木条熄灭
B.镁在空气中燃烧生成氧化镁
C.硫酸铜溶液与氢氧化钠溶液混合有蓝色沉淀生成
D.蜡烛燃烧放出了热量
3.除去下列各物质中的少量杂质,所选用的试剂和操作方法都正确的是
物质 杂质 试剂 操作方法
A MgCl2溶液 HCl 过量Mg(OH)2 过滤
B CO2 H2O NaOH固体 干燥
C NH4Cl溶液 (NH4)2SO4 适量硝酸钡溶液 过滤
D CaO 石灰石 无 高温燃烧
A.A B.B C.C D.D
4.海水中离子的分布情况如下图所示,由此得到的结论正确的是
A.海水中离子带的正电荷多负电荷少
B.海水是溶液,均一稳定的原因是其溶解的粒子大小和水分子差不多
C.海洋呈蓝色,表明将海水蒸发后得到的盐一定是蓝色的固体
D.海水的成分是固定不变的
5.关于海水的说法正确的是
A.海水中含量最多的元素是氯元素
B.海水中盐的质量分数约为3.5%
C.直接电解海水可获得金属镁
D.可燃冰的开采与利用不会带来环境问题
6.如图是A、B、C三种固体物质的溶解度曲线图,下列说法错误的是
A.t2℃时,A、B、C三种物质中,A物质的溶解度最大
B.P点表示t1℃时B、C两物质的溶解度大小相等
C.一定温度时,要将B物质的不饱和溶液转变成饱和溶液,可采取增加溶质的方法
D.20℃时,给A、B、C三种物质的饱和溶液加热(不考虑溶剂的蒸发),有晶体析出的是A物质
7.下列排序正确的是
A.金属活动性顺序: B.物质的溶解性:
C.空气中物质含量: D.铜元素质量分数:
8.某化工厂有甲、乙两个车间,它们排放的废水中均含三种离子,经分析这些离子是Ba2+、Cu2+、K+、NO、SO、CO甲车间废水呈碱性,若将甲、乙车间的废水按适当比例混合,使废水中的某些离子恰好完全反应转化为沉淀(如图所示)。下列分析正确的是
A.甲车间的废水含有的离子是K+、NO、CO
B.图中的沉淀是硫酸钡和碳酸钡
C.图中滤液所含阳离子与阴离子的数目比为1:1
D.若向乙车间的废水中加入适量铁粉,充分反应后过滤,滤液可直接排放
9.实验室中用下列装置进行的实验,达不到实验目的的是
A.用图 1 所示装置除去少量黄河水中的泥沙
B.用图 2 所示装置加热蒸发 NaCl饱和溶液制备 NaCl 晶体
C.用图 3 所示装置制取少量 CO2气体
D.用图 4 所示装置除去 CO2中含有的少量 HCl 气体
10.盐化工是我市的一项重点产业,绿色应用是化工生产的发展方向。为了除去NaCl溶液中含有少量的MgCl2、CaC12和Na2SO4等杂质,某小组同学选用Na2CO3溶液、稀盐酸、Ba(OH)2溶液三种试剂,按一定的顺序进行如图所示的实验。下列分析不正确的是
A.实验Ⅰ中加入试剂A除去的杂质是MgCl2和Na2SO4
B.实验Ⅱ中加入的试剂B是Na2CO3溶液
C.实验Ⅲ中有中和反应发生
D.滤液②中共有两种溶质
11.侯德榜是我国著名的化学家,他制取的“红三角”牌纯碱主要成分属于
A.碱 B.盐 C.氧化物 D.酸
12.某无色溶液中可能含有NaOH、Na2CO3、NaHCO3三种溶质中的一种或两种,向溶液中滴加稀盐酸并测定生成气体的体积,生成气体的体积与加入盐酸体积的关系如图所示。下列说法正确的是
A.无色溶液中可能含有NaHCO3
B.无色溶液中只含有Na2CO3
C.a→b段发生反应的离子方程式为+H+=CO2↑+H2O
D.无色溶液中NaOH与Na2CO3的质量之比为1:1
二、填空题
13.请从A或B两题中任选一个作答,若两题均作答,按A计分。
A用浓硫酸配制100g 9.8%的稀硫酸 B粗盐中难溶性杂质的去除
(1)实验需要5.4mL浓硫酸和90mL水。量取两种液体用到的仪器有________(填序号)。 (2)稀释时,需将浓硫酸缓慢倒入水中,并不断进行搅拌,其原因是________。 (1)过滤需要用到的仪器有________(填序号)。 (2)蒸发过程中,需不断进行搅拌,其原因是________。
可供选择的主要仪器: ①试管 ②烧杯 ③蒸发皿 ④托盘天平 ⑤10mL量筒 ⑥100mL量筒 ⑦药匙 ⑧胶头滴管 ⑨漏斗 ⑩酒精灯 铁架台 玻璃棒
14.氯碱工业是重要的化学工业,采用电解精制的饱和食盐水来制取NaOH,2NaCl+2H2O 2NaOH+H2↑+Cl2↑.但粗盐中含有杂质Na2SO4、MgCl2、CaCl2、泥沙等,必须经过提纯才能使用.提纯中常用下列操作步骤:①用稍过量的NaOH除去MgCl2;②过滤;③用稍过量的BaCl2除去Na2SO4;④用稍过量的Na2CO3除去CaCl2等;⑤用稍过量的HCl除去NaOH、Na2CO3;则:
(1)正确的操作顺序为__________或________(填步骤编号);
(2)加入Na2CO3溶液,其目的之一是除去CaCl2,还的一个目的,其反应的化学方程式为__________________________________.
15.现有四种物质:①浓硫酸、②石墨、③硫酸铜、④干冰,请选择相应物质的序号填空:
(1)可用于配制杀菌剂波尔多液的是______。
(2)可用作制冷剂的是______。
(3)能导电的是______。
(4)能做干燥剂的是______。
16.从H、C、O、Na、Ca四种元素中,选择适当元素填写符合下列要求的化学式:
(1)用于改良酸性土壤的碱______;
(2)常用于制作发面食品的纯碱______;
(3)由60个原子构成的形似足球的分子______。
三、推断题
17.实验室有溶液样品,其中可能含有、 、、、 五种物质中的一种或几种。为确定样品的成分,设计并完成了如下图所示的实验(假设除标有“过量”外,均恰好完全反应)。
(1)气体为 ______ (填化学式,下同)。
(2)溶液中一定含有的阳离子为 ______ 。
(3)该溶液样品中一定含有的物质为 ______ 。
18.已知A、B、C、D是初中化学常见的物质,且它们都含有一种元素,其中A是一种固体单质,B的固体叫干冰,C是制取玻璃的主要原料,D中含有人体骨骼内含量最高的金属元素,它们之间的转化关系如图所示,回答下列问题:
(1)写出A、D的化学式:A___________;D___________.
(2)将B通入水中,所得溶液的pH_______(填“>7”、“<7”或“=7”)。
(3)写出B转化为C的化学方程式_________________。
四、实验题
19.氯化钠是生活必需品,也是重要的化工原料.提纯含有少量泥沙的粗盐,一般经过以下操作流程:
(1)操作③中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是_______(填序号)。
(2)操作④中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到___________
等仪器.该操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外,你认为还可采取_______________________________等措施。
(3)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是___________(填序号)。
A.食盐没有全部溶解即过滤 B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿 D.器皿上沾有的精盐没全部转移到称量纸上
20. 在师生联谊晚会上,化学老师表演了“吹气生火”的魔术。用棉花将一种淡黄色的固体包裹其中,将一根长玻璃管插入棉花团中吹气,稍后棉花团剧烈燃烧起来。同学们为了揭开这个魔术的秘密,进行了如下探究。
【相关信息】①淡黄色固体成分是过氧化钠(Na2O2);②吹出的气体主要成分有氮气、二氧化碳和水蒸气;③过氧化钠与氮气不反应;④碳酸钠溶液呈碱性。
【分析讨论】根据棉花团剧烈燃烧的现象分析,反应中除了生成氧气外,还说明过氧化钠发生的反应是_____(填“吸热”或“放热”)反应。
【提出猜想】同学们发现燃烧后残留固体呈白色,对该固体成分进行猜想:
猜想Ⅰ:固体成分是Na2CO3, CO2参加反应。
猜想Ⅱ:固体成分是NaOH, H2O参加反应。
猜想Ⅲ:固体成分是______________,CO2和H2O均参加反应。
【实验探究】同学们在老师带领下用足量且潮湿的CO2气体通入过氧化钠粉末中,充分反应后,取白色固体于试管中配成溶液,设计实验对猜想进行验证。
验证Ⅰ:向溶液中滴加稀盐酸,发现有气泡产生。有同学认为固体成分仅含有Na2CO3。
验证Ⅱ:蘸取少量溶液滴到pH试纸上,与标准比色卡比较,pH大于7,有同学认为固体是NaOH。另外有同学认为此结论是错误的,错误的原因是:__________。
验证Ⅲ:先向溶液中加入足量的氯化钙溶液,看到白色沉淀产生,写出反应方程式_________;然后向上层清液中加入_____溶液,看到溶液呈红色,验证了猜想Ⅲ是正确的。
【实验反思】由验证Ⅲ的结果可知,验证Ⅰ的结论错误,因为它不能排除___的存在。
五、计算题
21.下图是某药厂生产的一种抗酸药(治疗胃酸过多的药物)的说明书的部分内容.阅读后回答下列问题.
说明书 主要成分:碳酸氢钠(NaHCO3) 适 应 症:用于缓解胃酸(含有 盐酸)过多引起的胃痛 用 法:嚼碎后服用 规 格:2.5g/片 注意事项:胃溃疡患者慎服
现取4片药片碾碎后,加到烧杯中,再往烧杯中加入60g稀盐酸,完全反应后,烧杯中物质的总质量为65.6g,(药品的其它成分不溶于水,也不参加反应),求:
(1)生成二氧化碳的质量是___________.
(2)此药片中碳酸氢钠的质量分数是__________.
22.向CuSO4溶液里加入一定溶质质量分数的NaOH溶液,实验过程中,生成沉淀的质量与加入NaOH溶液的质量关系如图所示。
(1)求CuSO4中硫元素与氧元素的质量比________。
(2)恰好完全反应时,产生沉淀的质量________g。
(3)求该NaOH溶液的溶质质量分数________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】NaOH能与CO2反应,但无明显现象,NaOH与Na2CO3溶液不反应,A不合题意;CO2能与Ca(OH)2的水溶液反应且能使其变浑浊,Ca(OH)2的水溶液能与CuCl2溶液反应产生蓝色沉淀,Ca(OH)2的水溶液能与Na2CO3溶液反应产生白色沉淀,所以B正确;H2SO4、HCl、与CO2、CuCl2溶液均不反应,C、D均不合题意。
2.B
【详解】A、石灰石与稀盐酸反应生成氯化钙、水和二氧化碳,可观察到产生大量气泡,且气体能使燃着的木条熄灭,故选项实验现象的描述正确;
B、镁在空气中燃烧生成氧化镁,是实验结论不是实验现象,故选项实验现象的描述不正确;
C、硫酸铜溶液与氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠,可观察到有蓝色沉淀生成,故选项实验现象的描述正确;
D、蜡烛燃烧,放出了热量,故选项实验现象的描述正确。
故选B。
3.A
【详解】A.能与反应生成和水,再过滤除去过量的,除去了杂质且没有引入新的杂质,该选项符合题意;
B.固体不仅能够除去水, 也能与二氧化碳反应,既除去了杂质,也除去了原物质,该选项不符合题意;
C.与硝酸钡反应生成硫酸钡沉淀和硝酸铵,引入了新杂质硝酸铵,该选项不符合题意;
D.石灰石的主要成分是碳酸钙,碳酸钙高温分解生成氧化钙和二氧化碳,但石灰石里还有其他杂质, 会引入新杂质,该选项不符合题意;
故选A。
4.B
【详解】A、海水中离子带的正电荷与负电荷数目相同,故A错误;
B、海水中溶解的粒子大小与水分子差不多,在条件不变的情况下,不会从水中分离出来,故海水具有均一、稳定性,故B正确;
C、海水蒸发得到的盐大多是白色固体,故C错误;
D、外界环境对海水有一定的影响,故D错误。
故选B。
5.B
【详解】A、海水中含量最多的物质是水,故含量最多的元素是氧元素,不符合题意;
B、海水中富含盐类,盐的质量分数约为3.5%,符合题意;
C、海水制镁时,不能直接电解海水,因为海水中氯化镁含量较少,应先富集氯化镁,然后电解,不符合题意;
D、可燃冰开采过程中,如果甲烷气体泄漏,会导致严重的温室效应,不符合题意。
故选B。
6.D
【分析】根据溶解度曲线的意义进行分析解答,交点表示在该温度下二者的溶解度相等,根据溶解度随温度的变化确定析出晶体的方法,根据已知的温度可以查出有关物质的溶解度,据此进行分析解答。
【详解】A、根据三种物质的溶解度曲线不难可知,在t2℃时,三物质的溶解度大小关系为:A>B>C,A物质的溶解度最大,故A选项说法正确;
B、由于在t1℃时,B和C溶解度曲线交于P点,即t1℃时,B、C两物质的溶解度相等,故B选项说法正确;
C、一定温度即溶解度不变时,将B物质的不饱和溶液变为饱和溶液,可以采用恒温蒸发溶剂或增加溶质的方法,故C选项说法正确;
D、由于C的溶解度随温度的升高而减小,而A和B的溶解度随温度的升高而增大,因此20℃时,给它们的饱和溶液升温时,只有C的溶液中会有晶体析出,故D选项说法错误。
故选D。
【点睛】本题考查的是溶解度曲线的应用,完成此题,可以依据已有的溶解度曲线的意义进行分析解答。
7.D
【详解】A.由金属活动性顺序表可知,三种金属活动性顺序由强到弱为:Fe、Cu、Ag,故选项A不正确;
B.碳酸钙难溶于水,氢氧化钙微溶于水,氯化钠易溶于水,三种物质的溶解性按由小到大的顺序是CaCO3、Ca(OH)2、NaCl,故选项B不正确;
C.空气的成分按体积分数计算,N278%、O221%、CO20.03%,空气中物质的含量由多到少的顺序是:N2、O2、CO2,故选项C不正确;
D.Cu2O可变形为CuO0.5,CuS可变形为CuO2,其它原子的相对质量之和越少的,在该化合物中铜元素的质量分数就越大,变形后CuO0.5中其它原子的相对质量之和最小,则铜元素的质量分数最大的为Cu2O,最小的是CuS,铜元素的质量分数有高到低的顺序是:Cu2O、CuO 、CuS ,故选项D正确。
故选D。
8.C
【详解】A、甲车间废水呈碱性,因此甲车间废水中一定含有碳酸根,则不能含有铜离子和钡离子,一定含有钾离子,含有硫酸根离子,否则硫酸根则在乙车间废水中,会形成沉淀,错误;
B、图中的沉淀是硫酸钡和碳酸钡,还有碳酸铜,错误;
C、甲、乙废水混合后生成的可溶性物质是 KNO3,所含阳离于与阴离子的数目比为1:1,正确,符合题意;
D、乙车间废水中的离子为钡离子、铜离子、硝酸根,若向乙车间的废水中加入适量铁粉,铁与铜离子发生置换反应生成亚铁离子和单质铜,充分反应后过滤,滤液中仍有亚铁离子和钡离子,不能直接排放,错误。
故选C。
9.D
【详解】A、该操作为过滤,过滤能够分离固体不溶物和液体,则可用图 1 所示装置除去少量黄河水中的泥沙,故A正确;
B、图示操作为蒸发,蒸发操作可将溶液中的溶质分离出来,所以可用该装置加热蒸发 NaCl饱和溶液制备 NaCl 晶体,故B正确;
C、碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水的反应为固液不加热型反应,所以可用如图的装置制取少量二氧化碳,故C正确;
D、二氧化碳能和氢氧化钠反应生成碳酸钠和水,欲保留的物质被除去,所以不能用如图装置处理CO2中含有的少量 HCl 气体,故D错误;
故选D。
10.D
【详解】A、除去NaCl溶液中含有少量的MgCl2、CaC12和Na2SO4等杂质,加入过量的氢氧化钡,氢氧化钡与氯化镁反应生成氢氧化镁沉淀和氯化钡,氢氧化钡与硫酸钠反应生成硫酸钡沉淀和氢氧化钠,实验Ⅰ中加入试剂A除去的杂质是MgCl2和Na2SO4,说法正确;
B、实验Ⅱ中加入的试剂B目的是除去钡离子,碳酸根与钡离子反应生成碳酸钡,且碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,容易除去,实验Ⅱ中加入的试剂B是Na2CO3溶液,说法正确;
C、氢氧化钡与硫酸钠反应生成硫酸钡沉淀和氢氧化钠,氢氧化钡与碳酸钠反应生成碳酸钡和氢氧化钠,滤液②含有氢氧化钠,氢氧化钠与适量的C盐酸反应生成氯化钠和水,酸与碱反应生成盐和水,该反应属于中和反应,说法正确;
D、滤液②中有氯化钠、生成的氢氧化钠和加入过量的B碳酸钠,有三种杂质,说法错误;
答案:D。
11.B
【分析】本题考查侯氏制碱法。
【详解】侯德榜制取的是纯碱碳酸钠,该物质属于盐类,故选B。
【点睛】本题难度不大,结合盐的概念进行判断即可。
12.C
【分析】根据向溶液中滴加稀盐酸,开始没有气体生成,加入一定体积的盐酸后有气体生成,且溶液中NaHCO3与NaOH不能同时存在,则溶液中一定含有Na2CO3,可能含有NaHCO3,假设溶液中只有Na2CO3,开始发生反应:,而后发生反应:,前后两阶段消耗盐酸体积相等,而图中第一阶段消耗盐酸体积大于第二阶段,故溶液含有NaOH、Na2CO3,不含NaHCO3。
【详解】A、由分析可知,无色溶液中一定没有NaHCO3,故A错误;
B、由分析可知,无色溶液含有NaOH、Na2CO3,故B错误;
C、a→b段发生反应:,反应的离子方程式为:,故C正确;
D、图中生成气体消耗2体积盐酸,由、可知,碳酸钠转化为碳酸氢钠也消耗2体积盐酸,故氢氧化钠反应消耗盐酸为4体积﹣2体积=2体积,结合,可知NaOH与Na2CO3的物质的量相等,所以二者质量之比为40:106,故D错误。
故选:C。
13.A(1)⑤⑥⑧;(2)浓硫酸密度比水大,溶于水放出大量热,用玻璃棒不断搅拌,散热,防止液滴飞溅。B(1)②⑨ ;(2)使液体均匀受热,防止局部温度过高,造成液滴飞溅。
【详解】A(1)考查量筒量取液体问题,需要选择合适量程,接近刻度线时需用胶头滴管滴加;故实验需要5.4mL浓硫酸和90mL水。量取两种液体用到的仪器有⑤10mL量筒 ⑥100mL量筒和⑧胶头滴管;
(2)稀释时,需将浓硫酸缓慢倒入水中,并不断进行搅拌,其原因是浓硫酸密度比水大,溶于水放出大量热,用玻璃棒不断搅拌,散热,防止液滴飞溅。
B(1)考查过滤时所使用的仪器,烧杯、漏斗、玻璃棒和铁架台(带铁圈);
(2)蒸发过程中,需不断进行搅拌,其原因是,搅拌使液体均匀受热,防止局部温度过高,造成液滴飞溅。
14. ① ③ ④ ② ⑤ ③ ① ④ ② ⑤ BaCl2+Na2CO3=BaCO3↓+2NaCl.
【详解】(1)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将除去MgCl2;硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将除去Na2SO4;至于先除氯化镁,还是先除硫酸钠都行,钙离子用碳酸根离子沉淀,除氯化钙加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡;离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为①③④②⑤或③①④②⑤或③④①②⑤,故填①③④②⑤或③①④②⑤或③④①②⑤。
(2)加入Na2CO3溶液,其目的之一是除去CaCl2,还有一个目的是除去多余的氯化钡,氯化钡与碳酸钠反应生成碳酸钡沉淀和氯化钠,故反应的化学方程式写为:BaCl2+Na2CO3=BaCO3↓+2NaCl。
15.(1)③
(2)④
(3)②
(4)①
【详解】(1)硫酸铜可用于配制杀菌剂波尔多液,故填:③;
(2)干冰升华时吸热,使周围的温度降低,可用作制冷剂,故填:④;
(3)石墨具有良好的导电性,故填:②;
(4)浓硫酸具有吸水性,可用做干燥剂,故填:①。
16.(1)Ca(OH)2
(2)Na2CO3
(3)C60
【分析】(1)
氢氧化钙属于碱,呈弱碱性,用于改良酸性土壤,中和土壤其酸性,其化学式为Ca(OH)2,故填:Ca(OH)2;
(2)
纯碱是碳酸钠的俗称,能与酸性物质反应生成二氧化碳,常用于制作发面食品,其化学式为Na2CO3,故填:Na2CO3;
(3)
C60分子是由60个原子构成的形似足球的分子,故填:C60。
17. 、、 、、
【分析】向样品中加过量的氢氧化钡生成刺激性气味的气体B,可知样品中一定有硝酸铵,B是氨气;氢氧化钡与氯化镁反应生成可溶于硝酸的氢氧化镁沉淀,硫酸钠与氢氧化钡反应生成难溶于硝酸的硫酸钡沉淀,固体C中加稀硝酸部分溶解,说明固体C中有硫酸钠和氢氧化镁;溶液D中加硝酸银产生白色沉淀E,说明E是氯化银,溶液D中一定有氯离子。
【详解】(1)根据分析知,气体B为NH3。
(2)样品M中有硫酸钠,加入的氢氧化钡和稀硝酸都过量,故溶液D中一定有、、。
(3)该溶液样品中一定含有的物质为、、。
18. C CaCO3 <7 CO2+2NaOH=Na2CO3+H2O
【分析】已知A、B、C、D是初中化学常见的物质,且它们都含有同一种元素,B的固体叫干冰,所以B为二氧化碳;C是制取玻璃的主要原料,C为碳酸钠;D中含有人体骨骼内含量最高的金属元素,则D中含有钙,并且C可以生成D,D为碳酸钙;其中A是一种固体单质,则A为碳,然后将推出的物质进行验证即可。
【详解】(1)已知A、B、C、D是初中化学常见的物质,且它们都含有同一种元素,B的固体叫干冰,所以B为二氧化碳;C是制取玻璃的主要原料,C为碳酸钠;D中含有人体骨骼内含量最高的金属元素,则D中含有钙,并且C可以生成D,D为碳酸钙;其中A是一种固体单质,则A为碳,经过验证,推导正确,则A、D的化学式为C、CaCO3;
故填:C:CaCO3
(2)B为二氧化碳,将B通入水中,二氧化碳与水反应生成碳酸,所得溶液的pH<7;
故填:<7
(3)B为二氧化碳,C为碳酸钠,二氧化碳与氢氧化钠反应生成碳酸钠和水,B转化为C的化学方程式为:CO2+2NaOH=Na2CO3+H2O。
故填:CO2+2NaOH=Na2CO3+H2O
【点睛】在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
19.(1)D
(2) 蒸发皿 来回移动酒精灯
(3)ABD
【详解】(1)根据图示中的滤纸的折叠处理进行分析,D打开方式不对,应该一边是一层,另一边是三层;
(2)根据粗盐提纯的步骤可知,④是蒸发,蒸发过程除了用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到蒸发皿等仪器,该操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续用玻璃棒搅拌外,还需要来回移动酒精灯使其受热均匀;
(3)根据精盐制得率=分析解答:
A.食盐没有全部溶解即过滤,蒸发后精盐的质量比正常值偏小;
B.蒸发时食盐飞溅剧烈,部分食盐溅出,精盐质量减少;
C.蒸发后,所得精盐很潮湿,造成精盐质量增加;
D.器皿上沾有的精盐没全部转移到称量纸上,精盐质量减少。
故选ABD。
20. 放热 Na2CO3和NaOH的混合物 可能有碳酸钠存在 CaCl2+Na2CO3=CaCO3↓+2NaCl 酚酞 NaOH
【详解】试题分析:根据棉花团剧烈燃烧的现象分析,反应中除了生成氧气外,还说明过氧化钠发生的反应是放热的反应,CO2和H2O均参加反应,所以固体是Na2CO3和NaOH,蘸取少量溶液滴到pH试纸上,与标准比色卡比较,pH大于7,有同学认为固体是NaOH。另外有同学认为此结论是错误的,错误的原因是:可能有碳酸钠存在,因为碳酸钠的溶液也显示碱性,加入足量的氯化钙溶液,看到白色沉淀产生,反应方程式CaCl2+Na2CO3=CaCO3↓+2NaCl;过程中将碱性的碳酸钠变为中性的氯化钠,然后向上层清液中加入酚酞溶液,看到溶液呈红色,验证了猜想Ⅲ是正确的。
考点:实验验证的方法及其过程
21.(1)4.4g(2)84%
【详解】解:(1)生成二氧化碳的质量:60g+2.5g/片×4片﹣65.6g═4.4g
(2)设4片药片中碳酸氢钠的质量为x
NaHCO3+HCl═NaCl+H2O+CO2↑
84 44
x 4.4g
x=8.4g
碳酸氢钠的质量分数为=×100%=84%
答:生成二氧化碳的质量是4.4g;碳酸氢钠的质量分数为84%。
22.(1)1﹕2
(2)9.8
(3)
解:设NaOH溶液的溶质的质量为x
=
x=8g
NaOH溶液的溶质质量分数=×100%=10%
答:NaOH溶液的溶质质量分数为10%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
