化学人教版(2019)必修第二册6.1.3化学电池 (共40张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.1.3化学电池 (共40张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 43.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-17 09:04:58 | ||
图片预览







文档简介
(共40张PPT)
03
化学电池
通过前面的学习,我们了解了原电池的工作原理和构成条件。为了满足生产、生活、科学研究等各方面的需要,科学家根据原电池原理设计出了许许多多形状各异、用途不同的实用电池,极大地方便了我们的生活,也有力地促进了科学的发展。
一.化学电源(化学电池)
1.定义
将化学能变成电能的装置
2.分类
①一次电池又称不可充电电池——如:干电池
电池消耗到一定程度,就不能使用;(只放不充,环境污染)。如普通干电池、碱性锌锰电池、锌银纽扣电池等。
②二次电池又称充电电池——蓄电池
放电后可以再充电重新使用;放电为原电池,充电为电解池。(可放可充,发展方向)。如铅蓄电池、锌银蓄电池、镉镍电池、锂离子电池等。
③燃料电池
一种将燃料和氧化剂的化学能直接转换成电能的化学电池。(能量很高,前景远大)。如氢氧燃料电池、甲烷燃料电池、甲醇燃料电池等。
④其他电池:
如海水电池、心脏起搏电池等。(特殊用途,现代科技)
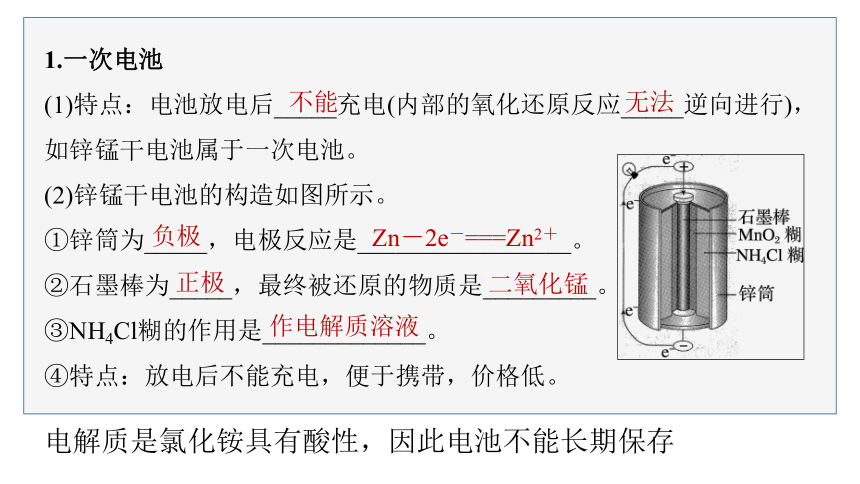
1.一次电池
(1)特点:电池放电后_____充电(内部的氧化还原反应_____逆向进行),如锌锰干电池属于一次电池。
(2)锌锰干电池的构造如图所示。
①锌筒为_____,电极反应是_________________。
②石墨棒为_____,最终被还原的物质是_________。
③NH4Cl糊的作用是_____________。
④特点:放电后不能充电,便于携带,价格低。
不能
无法
负极
Zn-2e-===Zn2+
正极
二氧化锰
作电解质溶液
电解质是氯化铵具有酸性,因此电池不能长期保存
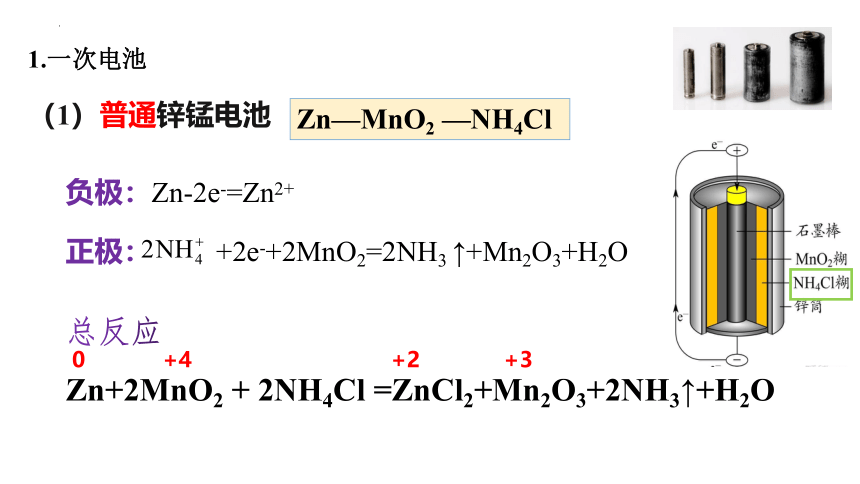
(1)普通锌锰电池
Zn—MnO2 —NH4Cl
负极:Zn-2e-=Zn2+
正极: +2e-+2MnO2=2NH3 ↑+Mn2O3+H2O
总反应
Zn+2MnO2 + 2NH4Cl =ZnCl2+Mn2O3+2NH3↑+H2O
0 +4 +2 +3
1.一次电池
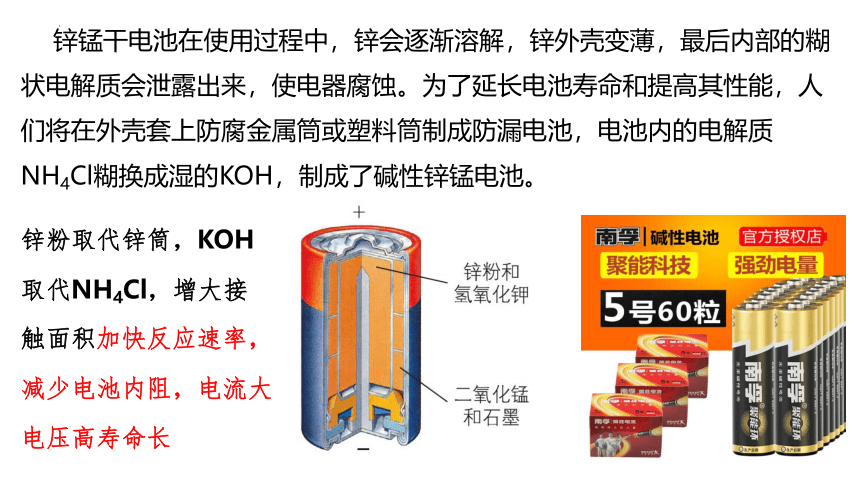
锌锰干电池在使用过程中,锌会逐渐溶解,锌外壳变薄,最后内部的糊状电解质会泄露出来,使电器腐蚀。为了延长电池寿命和提高其性能,人们将在外壳套上防腐金属筒或塑料筒制成防漏电池,电池内的电解质NH4Cl糊换成湿的KOH,制成了碱性锌锰电池。
锌粉取代锌筒,KOH取代NH4Cl,增大接触面积加快反应速率,减少电池内阻,电流大电压高寿命长
电池总反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
负极:Zn + 2OH– – 2e– =Zn(OH)2
正极:2MnO2 + 2H2O +2e– = 2MnOOH + 2OH–
锌粉取代锌筒,KOH取代NH4Cl,增大接触面积
加快反应速率,减少电池内阻,电流大电压高寿命长
0 +4 +3 +2
(2)碱性锌锰电池
Zn—MnO2 —KOH
1.一次电池
微型银—锌电池可用作电子仪器的电源,其电极分别是Ag/Ag2O和Zn,电解质为KOH溶液,电池总反应为Ag2O + Zn + H2O = 2Ag + Zn(OH)2,下列说法正确的是
A.电池工作过程中,KOH溶液浓度降低
B.电池工作过程中,电解液中OH-向正极迁移
C.负极发生反应Zn + 2OH- - 2e- = Zn(OH)2
D.正极发生反应Ag2O + 2H+ + 2e- = 2Ag + H2O
总反应未消耗KOH,但是耗水,所以C增大
+1
0
0
+2
(2)银锌纽扣电池
1.一次电池
(2)二次电池——充电电池
①特点:它在放电时进行氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。从而实现放电(化学能转化为电能)与充电(电能转化为化学能)的循环。
②实例:铅酸蓄电池、镍氢电池、锂离子电池等。目前汽车上使用的多数是铅酸蓄电池。手机、笔记本电脑、照相机和摄像机等电器所用的电池多数为锂离子电池。
化学能
电能
放电
充电
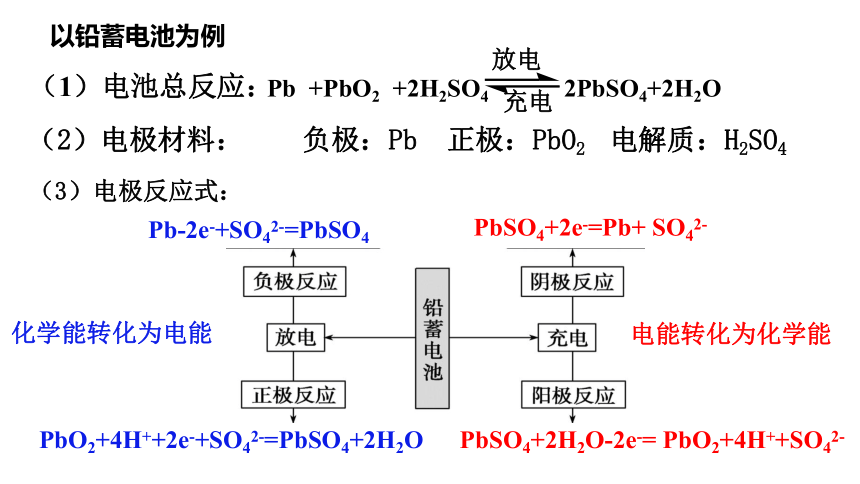
(2)电极材料: 负极:Pb 正极:PbO2 电解质:H2SO4
(3)电极反应式:
Pb-2e-+SO42-=PbSO4
PbO2+4H++2e-+SO42-=PbSO4+2H2O
PbSO4+2e-=Pb+ SO42-
PbSO4+2H2O-2e-= PbO2+4H++SO42-
化学能转化为电能
电能转化为化学能
(1)电池总反应:
Pb +PbO2 +2H2SO4 2PbSO4+2H2O
充电
放电
以铅蓄电池为例
铅蓄电池的优缺点
①优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉,在生产、生活中应用广泛。
②缺点:比能量低、笨重,废弃的电池污染环境。
(1)锌锰干电池工作一段时间后碳棒变细( )
(2)充电电池可以无限制地反复充电、放电( )
(3)二次电池充电时化学能转化为电能( )
×
正误判断
×
×
应用体验
1.某普通锌锰干电池的结构如图所示。下列说法正确的是
A.锌筒是原电池的正极
B.石墨电极上发生氧化反应
C.铵根离子流向石墨电极
D.电子经石墨棒沿电解质溶液流向锌筒
√
2.(2022·浙江舟山调研)氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上。其中一种氟离子电池的工作原理为3Mg
+2BiF3 3MgF2+2Bi(MgF2为难溶盐),电解质为熔融氟化物。下列
说法正确的是
A.放电时,负极的电极反应式为Mg-2e-+2F-===MgF2
B.放电时,电子从镁电极流出,经电解质流向正极
C.放电时,化学能完全转化为电能
D.放电时,F-向正极移动
√
(3)发展中的燃料电池(氢氧燃料电池、甲醇燃料电池)
是一种连续地将燃料和氧化剂的化学能直接转化为电能的装置,与火力发电相比燃料利用率高、能量转化率高,在放电时需要外部持续供给燃料和氧化剂
(3)发展中的燃料电池(氢氧燃料电池、甲醇燃料电池)
1.
原理
利用原电池的工作原理,燃料和氧化剂分别放在两个电极上发生氧化还原反应,将化学能直接转化为电能。
优点
2.
高效(能量转化率可以达到80%以上), 环境友好。
H2SO4(aq)
H2
O2
— +
负极:2H2 - 4e- = 4H+
正极:O2 + 4e- + 4H+ = 2H2O
总反应:2H2 + O2 = 2H2O
酸性:
NaOH(aq)
H2
O2
— +
碱性:
负极:2H2 - 4e- +4OH-= 4H2O
正极:O2 + 4e- + 2H2O = 4OH-
总反应:2H2 + O2 = 2H2O
(3)发展中的燃料电池(氢氧燃料电池、甲醇燃料电池)
介质 电池反应:2H2 +O2 == 2H2O
酸性 负极
正极
中性 负极
正极
碱性 负极
正极
2H2 - 4e- == 4H+
O2 + 4H+ + 4e- == 2H2O
2H2 - 4e- == 4H+
O2 + 2H2O + 4e- == 4OH-
2H2 + 4OH-- 4e- == 4H2O
O2 + 2H2O + 4e- == 4OH-
氢氧燃料电池
(3)发展中的燃料电池(氢氧燃料电池、甲醇燃料电池)
总: 2H2+O2=2H2O
MCFC型燃料电池(可同时供应电和水蒸气)
其工作温度为600℃-700℃
燃料为H2,电解质为熔融的K2CO3
负极
正极
+: O2 + 4e- + 2CO2 = 2CO32-
-: 2H2 - 4e- + 2CO32- = 2CO2 + 2H2O
以固体氧化锆—氧化钇为电解质这种固体电解质在高温下允许氧离子(O2-)在其间通过
+: O2 + 4e- = 2O2-
-: 2H2 - 4e- + 2O2- = 2H2O
总:2H2 + O2 = 2H2O
负极
正极
课堂练习:以CH3OH为燃料的燃料电池总反应和电极反应式的书写
1.酸性介质:
总反应:
负极:
正极:
2.碱性介质:
总反应:
负极:
正极:
3O2+6H2O+12e-=12OH-
2CH3OH+16OH--12e-=2CO32-+12H2O
2CH3OH+4OH-+3O2=2CO32-+6H2O
2CH3OH+3O2=2CO2+6H2O
2CH3OH+2H2O-12e-=2CO2+12H+
3O2+12H++12e-=6H2O
特别提醒 在书写电极反应式时应看清溶液的酸碱性,酸性条件下不出现OH-,碱性条件下不出现H+。
3.熔融Na2CO3介质:
总反应:
负极:
正极(充入CO2和O2):
4.熔融氧化物介质:
总反应:
负极:
正极:
2CH3OH+3O2=2CO2+6H2O
2CH3OH+3O2=2CO2+6H2O
2CH3OH-12e-+6CO32-=8CO2+4H2O
3O2+12e-+6CO2=6CO32-
2CH3OH-12e-+6O2-=2CO2+4H2O
3O2+12e-=12O2-
甲烷燃料电池
(1)燃料电池是利用燃料的燃烧发电( )
(2)燃料电池中,燃料在正极上发生氧化反应( )
(3)氢氧燃料电池将热能直接转变为电能( )
(4)原电池中正极材料一定发生还原反应( )
(5)原电池中的负极反应一定是电极材料失电子( )
×
正误判断
×
×
×
×
深度思考
将CH4设计成燃料电池,其利用率更高,装置如图
所示(A、B为多孔碳棒)。
(1)实验测得OH-定向移向A电极,则____(填“A”
或“B”)电极入口通CH4,其电极反应式为
_________________________________,另一电极
的电极反应式为_______________________。
A
O2+4e-+2H2O===4OH-
深度思考
(2)若将电解质溶液更换为稀H2SO4,实验测得B电
极附近的pH减小,则A处电极入口通入的气体是
____,其电极反应式为______________________,
B电极的电极反应式为______________________
______。
O2
O2+4e-+4H+===2H2O
CH4-8e-+2H2O===CO2
+8H+
应用体验
1.(2022·江西新余市第一中学高一期末)国家电投氢能公司全自主研发的“氢腾”燃料电池系统广泛应用于氢能大巴。某种氢燃料电池的内部结构如图,下列说法正确的是
A.电池工作时,电解质溶液中的H+向b极
移动
B.a极发生的电极反应为H2+2e-+2OH-
===2H2O
C.b极为正极,发生氧化反应
D.当外电路有1 mol电子转移时,b极消耗5.6 L O2
√
2.燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是
A.负极反应式:O2+2H2O+4e-===4OH-
B.负极反应式:CH4+8OH--8e-===CO2+6H2O
C.随着放电的进行,溶液的OH-浓度不变
D.放电时溶液中的阴离子向负极移动
√
1.如图为发光二极管连接柠檬电池装置,下列说法正确的是
A.铁环作为柠檬电池的正极
B.电流由铁环经导线流向发光二极管
C.负极的电极反应为Fe-2e-===Fe2+
D.可将柠檬替换成盛装乙醇溶液的装置
1
2
3
4
√
2.下列电池工作时,O2在正极得电子的是
1
2
3
4
A B C D
锌锰电池 铅酸蓄电池 氢氧燃料电池 镍镉电池
√
氢氧燃料电池的总反应是2H2+O2===2H2O,因而正极是O2得电子发生还原反应。
09
3.(2022·黑龙江大庆中学高一期中)纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和Ag2O,用KOH溶液作电解质溶液,电池的总反应为Zn+Ag2O===2Ag+ZnO。关于该电池下列叙述不正确的是
A.电池的正极发生还原反应
B.Zn为负极,发生氧化反应,反应过程中失去电子
C.电池工作时,电解质溶液中的阳离子移向正极
D.电池使用时,电子由Zn极经电解质溶液流向Ag2O极
1
2
3
4
√
4.一种直接铁燃料电池(电池反应为3Fe+2O2===Fe3O4)的装置如图所示,下列说法正确的是
A.Fe极为电池正极
B.KOH溶液为电池的电解质溶液
C.电子由多孔碳极沿导线移向Fe极
D.5.6 g Fe参与反应,导线中转移
1.204×1023个电子
1
2
3
4
√
1
2
3
4
5
1.有如图所示的装置,当电流表中显示产生持续电流时,下列说法正确的是
A.Cu作原电池的负极
B.Al作原电池的负极
C.电子由铝极沿导线流向铜极
D.铝片上的电极反应式为Al-3e-===Al3+
√
1
2
3
4
5
2.将Cu、Zn和稀硫酸组成原电池装置,当导线中有0.5 mol电子通过时,下列说法正确的是
A.锌电极反应:Zn-2e-===Zn2+,锌片上产生0.25 mol的H2
B.铜电极反应:2H++2e-===H2↑,锌片溶解16.25 g
C.电流由锌电极经导线流向铜电极
D.溶液中 移向铜电极
√
1
2
3
4
5
3.下列电极反应正确的是
A.以惰性材料为电极,以KOH溶液为电解质溶液构成的氢氧燃料电
池,负极反应为H2-2e-===2H+
B.铜、锌在稀硫酸中构成原电池,正极反应为2H++2e-===H2↑
C.以铜为电极,将2Fe3++Cu===2Fe2++Cu2+设计成原电池,正极
反应为Cu-2e-===Cu2+
D.以铝、铁为电极,在氢氧化钠溶液中构成原电池,负极反应为Al
-3e-===Al3+
√
1
2
3
4
5
4.锂电池是一代新型高能电池,它以质量轻、能量高等优点而受到了重视,目前已研制成功多种锂电池。某种锂电池的总反应为Li+MnO2===LiMnO2,下列说法正确的是
A.Li是正极,电极反应为Li-e-===Li+
B.Li是负极,电极反应为Li-e-===Li+
C.MnO2是负极,电极反应为MnO2+e-===
D.Li是负极,电极反应为Li-2e-===Li2+
√
1
2
3
4
5
5.人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛应用于日常生活、生产和科学技术等方面,请根据题中提供的信息,回答下列问题。
(1)铅酸蓄电池在放电时发生的电池反应式为Pb+PbO2+2H2SO4
===2PbSO4+2H2O。负极电极反应式为 ______________________。
1
2
3
4
5
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生反应:2FeCl3+Cu=== 2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为____,当线路中转移0.2 mol电子时,则被腐蚀铜的质量为____ g。
根据原电池的工作原理,负极电极反应式为Cu-2e-===Cu2+,正极电极反应式为2Fe3++2e-===2Fe2+,负极所用电极材料为Cu。当线路中转移0.2 mol电子时,被腐蚀Cu的物质的量为0.1 mol,其质量为0.1 mol×64 g·mol-1=6.4 g。
Cu
6.4
1
2
3
4
5
(3)燃料电池是一种高效、环境友好的供电
装置,以甲醇作燃料的电池,如图所示。
①负极反应物是_______,H+从__极移到__
极(填“a”或“b”)。
根据图示CH3OH发生失电子的氧化反应生成CO2,b极为负极;O2发生得电子的还原反应生成H2O,a极为正极。负极反应物为CH3OH,原电池中阳离子向正极迁移,H+从负极(b极)移到正极(a极)。
CH3OH b a
1
2
3
4
5
②正极电极反应式为____________________
_____,负极电极反应式为_______________
_____________________。
3O2+12e-+12H+===
2CH3OH-12e-
6H2O
+2H2O===2CO2+12H+
03
化学电池
通过前面的学习,我们了解了原电池的工作原理和构成条件。为了满足生产、生活、科学研究等各方面的需要,科学家根据原电池原理设计出了许许多多形状各异、用途不同的实用电池,极大地方便了我们的生活,也有力地促进了科学的发展。
一.化学电源(化学电池)
1.定义
将化学能变成电能的装置
2.分类
①一次电池又称不可充电电池——如:干电池
电池消耗到一定程度,就不能使用;(只放不充,环境污染)。如普通干电池、碱性锌锰电池、锌银纽扣电池等。
②二次电池又称充电电池——蓄电池
放电后可以再充电重新使用;放电为原电池,充电为电解池。(可放可充,发展方向)。如铅蓄电池、锌银蓄电池、镉镍电池、锂离子电池等。
③燃料电池
一种将燃料和氧化剂的化学能直接转换成电能的化学电池。(能量很高,前景远大)。如氢氧燃料电池、甲烷燃料电池、甲醇燃料电池等。
④其他电池:
如海水电池、心脏起搏电池等。(特殊用途,现代科技)
1.一次电池
(1)特点:电池放电后_____充电(内部的氧化还原反应_____逆向进行),如锌锰干电池属于一次电池。
(2)锌锰干电池的构造如图所示。
①锌筒为_____,电极反应是_________________。
②石墨棒为_____,最终被还原的物质是_________。
③NH4Cl糊的作用是_____________。
④特点:放电后不能充电,便于携带,价格低。
不能
无法
负极
Zn-2e-===Zn2+
正极
二氧化锰
作电解质溶液
电解质是氯化铵具有酸性,因此电池不能长期保存
(1)普通锌锰电池
Zn—MnO2 —NH4Cl
负极:Zn-2e-=Zn2+
正极: +2e-+2MnO2=2NH3 ↑+Mn2O3+H2O
总反应
Zn+2MnO2 + 2NH4Cl =ZnCl2+Mn2O3+2NH3↑+H2O
0 +4 +2 +3
1.一次电池
锌锰干电池在使用过程中,锌会逐渐溶解,锌外壳变薄,最后内部的糊状电解质会泄露出来,使电器腐蚀。为了延长电池寿命和提高其性能,人们将在外壳套上防腐金属筒或塑料筒制成防漏电池,电池内的电解质NH4Cl糊换成湿的KOH,制成了碱性锌锰电池。
锌粉取代锌筒,KOH取代NH4Cl,增大接触面积加快反应速率,减少电池内阻,电流大电压高寿命长
电池总反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
负极:Zn + 2OH– – 2e– =Zn(OH)2
正极:2MnO2 + 2H2O +2e– = 2MnOOH + 2OH–
锌粉取代锌筒,KOH取代NH4Cl,增大接触面积
加快反应速率,减少电池内阻,电流大电压高寿命长
0 +4 +3 +2
(2)碱性锌锰电池
Zn—MnO2 —KOH
1.一次电池
微型银—锌电池可用作电子仪器的电源,其电极分别是Ag/Ag2O和Zn,电解质为KOH溶液,电池总反应为Ag2O + Zn + H2O = 2Ag + Zn(OH)2,下列说法正确的是
A.电池工作过程中,KOH溶液浓度降低
B.电池工作过程中,电解液中OH-向正极迁移
C.负极发生反应Zn + 2OH- - 2e- = Zn(OH)2
D.正极发生反应Ag2O + 2H+ + 2e- = 2Ag + H2O
总反应未消耗KOH,但是耗水,所以C增大
+1
0
0
+2
(2)银锌纽扣电池
1.一次电池
(2)二次电池——充电电池
①特点:它在放电时进行氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。从而实现放电(化学能转化为电能)与充电(电能转化为化学能)的循环。
②实例:铅酸蓄电池、镍氢电池、锂离子电池等。目前汽车上使用的多数是铅酸蓄电池。手机、笔记本电脑、照相机和摄像机等电器所用的电池多数为锂离子电池。
化学能
电能
放电
充电
(2)电极材料: 负极:Pb 正极:PbO2 电解质:H2SO4
(3)电极反应式:
Pb-2e-+SO42-=PbSO4
PbO2+4H++2e-+SO42-=PbSO4+2H2O
PbSO4+2e-=Pb+ SO42-
PbSO4+2H2O-2e-= PbO2+4H++SO42-
化学能转化为电能
电能转化为化学能
(1)电池总反应:
Pb +PbO2 +2H2SO4 2PbSO4+2H2O
充电
放电
以铅蓄电池为例
铅蓄电池的优缺点
①优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉,在生产、生活中应用广泛。
②缺点:比能量低、笨重,废弃的电池污染环境。
(1)锌锰干电池工作一段时间后碳棒变细( )
(2)充电电池可以无限制地反复充电、放电( )
(3)二次电池充电时化学能转化为电能( )
×
正误判断
×
×
应用体验
1.某普通锌锰干电池的结构如图所示。下列说法正确的是
A.锌筒是原电池的正极
B.石墨电极上发生氧化反应
C.铵根离子流向石墨电极
D.电子经石墨棒沿电解质溶液流向锌筒
√
2.(2022·浙江舟山调研)氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上。其中一种氟离子电池的工作原理为3Mg
+2BiF3 3MgF2+2Bi(MgF2为难溶盐),电解质为熔融氟化物。下列
说法正确的是
A.放电时,负极的电极反应式为Mg-2e-+2F-===MgF2
B.放电时,电子从镁电极流出,经电解质流向正极
C.放电时,化学能完全转化为电能
D.放电时,F-向正极移动
√
(3)发展中的燃料电池(氢氧燃料电池、甲醇燃料电池)
是一种连续地将燃料和氧化剂的化学能直接转化为电能的装置,与火力发电相比燃料利用率高、能量转化率高,在放电时需要外部持续供给燃料和氧化剂
(3)发展中的燃料电池(氢氧燃料电池、甲醇燃料电池)
1.
原理
利用原电池的工作原理,燃料和氧化剂分别放在两个电极上发生氧化还原反应,将化学能直接转化为电能。
优点
2.
高效(能量转化率可以达到80%以上), 环境友好。
H2SO4(aq)
H2
O2
— +
负极:2H2 - 4e- = 4H+
正极:O2 + 4e- + 4H+ = 2H2O
总反应:2H2 + O2 = 2H2O
酸性:
NaOH(aq)
H2
O2
— +
碱性:
负极:2H2 - 4e- +4OH-= 4H2O
正极:O2 + 4e- + 2H2O = 4OH-
总反应:2H2 + O2 = 2H2O
(3)发展中的燃料电池(氢氧燃料电池、甲醇燃料电池)
介质 电池反应:2H2 +O2 == 2H2O
酸性 负极
正极
中性 负极
正极
碱性 负极
正极
2H2 - 4e- == 4H+
O2 + 4H+ + 4e- == 2H2O
2H2 - 4e- == 4H+
O2 + 2H2O + 4e- == 4OH-
2H2 + 4OH-- 4e- == 4H2O
O2 + 2H2O + 4e- == 4OH-
氢氧燃料电池
(3)发展中的燃料电池(氢氧燃料电池、甲醇燃料电池)
总: 2H2+O2=2H2O
MCFC型燃料电池(可同时供应电和水蒸气)
其工作温度为600℃-700℃
燃料为H2,电解质为熔融的K2CO3
负极
正极
+: O2 + 4e- + 2CO2 = 2CO32-
-: 2H2 - 4e- + 2CO32- = 2CO2 + 2H2O
以固体氧化锆—氧化钇为电解质这种固体电解质在高温下允许氧离子(O2-)在其间通过
+: O2 + 4e- = 2O2-
-: 2H2 - 4e- + 2O2- = 2H2O
总:2H2 + O2 = 2H2O
负极
正极
课堂练习:以CH3OH为燃料的燃料电池总反应和电极反应式的书写
1.酸性介质:
总反应:
负极:
正极:
2.碱性介质:
总反应:
负极:
正极:
3O2+6H2O+12e-=12OH-
2CH3OH+16OH--12e-=2CO32-+12H2O
2CH3OH+4OH-+3O2=2CO32-+6H2O
2CH3OH+3O2=2CO2+6H2O
2CH3OH+2H2O-12e-=2CO2+12H+
3O2+12H++12e-=6H2O
特别提醒 在书写电极反应式时应看清溶液的酸碱性,酸性条件下不出现OH-,碱性条件下不出现H+。
3.熔融Na2CO3介质:
总反应:
负极:
正极(充入CO2和O2):
4.熔融氧化物介质:
总反应:
负极:
正极:
2CH3OH+3O2=2CO2+6H2O
2CH3OH+3O2=2CO2+6H2O
2CH3OH-12e-+6CO32-=8CO2+4H2O
3O2+12e-+6CO2=6CO32-
2CH3OH-12e-+6O2-=2CO2+4H2O
3O2+12e-=12O2-
甲烷燃料电池
(1)燃料电池是利用燃料的燃烧发电( )
(2)燃料电池中,燃料在正极上发生氧化反应( )
(3)氢氧燃料电池将热能直接转变为电能( )
(4)原电池中正极材料一定发生还原反应( )
(5)原电池中的负极反应一定是电极材料失电子( )
×
正误判断
×
×
×
×
深度思考
将CH4设计成燃料电池,其利用率更高,装置如图
所示(A、B为多孔碳棒)。
(1)实验测得OH-定向移向A电极,则____(填“A”
或“B”)电极入口通CH4,其电极反应式为
_________________________________,另一电极
的电极反应式为_______________________。
A
O2+4e-+2H2O===4OH-
深度思考
(2)若将电解质溶液更换为稀H2SO4,实验测得B电
极附近的pH减小,则A处电极入口通入的气体是
____,其电极反应式为______________________,
B电极的电极反应式为______________________
______。
O2
O2+4e-+4H+===2H2O
CH4-8e-+2H2O===CO2
+8H+
应用体验
1.(2022·江西新余市第一中学高一期末)国家电投氢能公司全自主研发的“氢腾”燃料电池系统广泛应用于氢能大巴。某种氢燃料电池的内部结构如图,下列说法正确的是
A.电池工作时,电解质溶液中的H+向b极
移动
B.a极发生的电极反应为H2+2e-+2OH-
===2H2O
C.b极为正极,发生氧化反应
D.当外电路有1 mol电子转移时,b极消耗5.6 L O2
√
2.燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是
A.负极反应式:O2+2H2O+4e-===4OH-
B.负极反应式:CH4+8OH--8e-===CO2+6H2O
C.随着放电的进行,溶液的OH-浓度不变
D.放电时溶液中的阴离子向负极移动
√
1.如图为发光二极管连接柠檬电池装置,下列说法正确的是
A.铁环作为柠檬电池的正极
B.电流由铁环经导线流向发光二极管
C.负极的电极反应为Fe-2e-===Fe2+
D.可将柠檬替换成盛装乙醇溶液的装置
1
2
3
4
√
2.下列电池工作时,O2在正极得电子的是
1
2
3
4
A B C D
锌锰电池 铅酸蓄电池 氢氧燃料电池 镍镉电池
√
氢氧燃料电池的总反应是2H2+O2===2H2O,因而正极是O2得电子发生还原反应。
09
3.(2022·黑龙江大庆中学高一期中)纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和Ag2O,用KOH溶液作电解质溶液,电池的总反应为Zn+Ag2O===2Ag+ZnO。关于该电池下列叙述不正确的是
A.电池的正极发生还原反应
B.Zn为负极,发生氧化反应,反应过程中失去电子
C.电池工作时,电解质溶液中的阳离子移向正极
D.电池使用时,电子由Zn极经电解质溶液流向Ag2O极
1
2
3
4
√
4.一种直接铁燃料电池(电池反应为3Fe+2O2===Fe3O4)的装置如图所示,下列说法正确的是
A.Fe极为电池正极
B.KOH溶液为电池的电解质溶液
C.电子由多孔碳极沿导线移向Fe极
D.5.6 g Fe参与反应,导线中转移
1.204×1023个电子
1
2
3
4
√
1
2
3
4
5
1.有如图所示的装置,当电流表中显示产生持续电流时,下列说法正确的是
A.Cu作原电池的负极
B.Al作原电池的负极
C.电子由铝极沿导线流向铜极
D.铝片上的电极反应式为Al-3e-===Al3+
√
1
2
3
4
5
2.将Cu、Zn和稀硫酸组成原电池装置,当导线中有0.5 mol电子通过时,下列说法正确的是
A.锌电极反应:Zn-2e-===Zn2+,锌片上产生0.25 mol的H2
B.铜电极反应:2H++2e-===H2↑,锌片溶解16.25 g
C.电流由锌电极经导线流向铜电极
D.溶液中 移向铜电极
√
1
2
3
4
5
3.下列电极反应正确的是
A.以惰性材料为电极,以KOH溶液为电解质溶液构成的氢氧燃料电
池,负极反应为H2-2e-===2H+
B.铜、锌在稀硫酸中构成原电池,正极反应为2H++2e-===H2↑
C.以铜为电极,将2Fe3++Cu===2Fe2++Cu2+设计成原电池,正极
反应为Cu-2e-===Cu2+
D.以铝、铁为电极,在氢氧化钠溶液中构成原电池,负极反应为Al
-3e-===Al3+
√
1
2
3
4
5
4.锂电池是一代新型高能电池,它以质量轻、能量高等优点而受到了重视,目前已研制成功多种锂电池。某种锂电池的总反应为Li+MnO2===LiMnO2,下列说法正确的是
A.Li是正极,电极反应为Li-e-===Li+
B.Li是负极,电极反应为Li-e-===Li+
C.MnO2是负极,电极反应为MnO2+e-===
D.Li是负极,电极反应为Li-2e-===Li2+
√
1
2
3
4
5
5.人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛应用于日常生活、生产和科学技术等方面,请根据题中提供的信息,回答下列问题。
(1)铅酸蓄电池在放电时发生的电池反应式为Pb+PbO2+2H2SO4
===2PbSO4+2H2O。负极电极反应式为 ______________________。
1
2
3
4
5
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生反应:2FeCl3+Cu=== 2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为____,当线路中转移0.2 mol电子时,则被腐蚀铜的质量为____ g。
根据原电池的工作原理,负极电极反应式为Cu-2e-===Cu2+,正极电极反应式为2Fe3++2e-===2Fe2+,负极所用电极材料为Cu。当线路中转移0.2 mol电子时,被腐蚀Cu的物质的量为0.1 mol,其质量为0.1 mol×64 g·mol-1=6.4 g。
Cu
6.4
1
2
3
4
5
(3)燃料电池是一种高效、环境友好的供电
装置,以甲醇作燃料的电池,如图所示。
①负极反应物是_______,H+从__极移到__
极(填“a”或“b”)。
根据图示CH3OH发生失电子的氧化反应生成CO2,b极为负极;O2发生得电子的还原反应生成H2O,a极为正极。负极反应物为CH3OH,原电池中阳离子向正极迁移,H+从负极(b极)移到正极(a极)。
CH3OH b a
1
2
3
4
5
②正极电极反应式为____________________
_____,负极电极反应式为_______________
_____________________。
3O2+12e-+12H+===
2CH3OH-12e-
6H2O
+2H2O===2CO2+12H+
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
