2023年中考化学人教版(五四学制)专题练习--酸和碱(含解析)
文档属性
| 名称 | 2023年中考化学人教版(五四学制)专题练习--酸和碱(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 153.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-16 17:41:51 | ||
图片预览



文档简介
2023年中考化学人教版(五四学制)专题练习--酸和碱
一、单选题
1.下列物质名称与其主要成分不相匹配的是
A.大理石――SiO2 B.赤铁矿――Fe2O3
C.铝土矿――Al2O3 D.辉铜矿――Cu2S
2.向AgNO3溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法:
① 向滤渣中加入稀盐酸,一定有气泡产生。
② 向滤液中加入稀盐酸,一定有沉淀产生。
③ 滤渣中一定含有Ag。
④ 滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Al(NO3)3
以上说法正确的个数为
A.0个 B.1个 C.2个 D.3个
3.下列有关金属的说法正确的是
A.金属能导电,能导电的物质一定是金属
B.不是所有的金属都能和盐酸反应放出氢气
C.金属能和酸反应,能和酸反应的一定是金属
D.在空气不能燃烧的金属,在氧气中也不能燃烧
4.2022年北京冬奥会呈现“绿色办奥”的中国智慧。下列说法错误的是
A.雪车车体所用钢材的含碳量低于生铁
B.冬奥火炬“飞扬”采用氢气作燃料,低碳环保
C.使用石墨烯(单层石墨片)做成能够发热的“布”,石墨烯是一种新型化合物
D.采用CO2跨临界直冷制冰技术,避免了使用氟利昂等制冷剂对臭氧层的破坏
5.下列关于金属材料的说法正确的是( )
A.金属的性质是决定其用途的唯一因素
B.导电、导热性最好的金属是Au
C.合金相对于纯金属,其硬度更大、熔点更高
D.生铁和钢都是铁的合金,其中生铁含碳量比钢高
6.推理是化学学习中常用的思维方法,下列推理正确的是
A.离子是带电的粒子,所以带电的粒子一定是离子
B.置换反应有单质和化合物生成,所以有单质和化合物生成的反应一定是置换反应
C.化学变化伴随有能量变化,所以有能量变化的一定是化学变化
D.化合物含有不同种元素,所以由一种元素组成的物质一定不是化合物
7.下列实验方案不能达到目的的是
选项 实验目的 实验方案
A 区分白酒和白醋 闻气味,通过气味区分
B 区分黄铜和纯铜 相互刻画,通过划痕区分
C 区分铜粉和铁粉 分别滴加稀盐酸,通过是否有气泡区分
D 区分碳粉和MnO2 观察,通过颜色区分
A.A B.B C.C D.D
8.下列物质的用途主要与其化学性质有关的是
A.铁粉用作食品脱氧剂
B.干冰用于制作舞台云雾
C.活性炭用作冰箱除味剂
D.武德合金制作电路保险丝
9.取一定量的Al放入Cu(NO3)2和AgNO3的混合溶液中充分反应后过滤,得到固体和蓝色滤液,下列说法正确的是
A.固体中一定有Ag 与Cu
B.滤液中的溶质可能是AgNO3 Cu(NO3)2 Al(NO3)3
C.AgNO3一定完全反应
D.Cu(NO3)2 一定没有参加反应
10.“中国高铁,世界第一”,高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是:,下列说法错误的是
A.反应中NiO发生还原反应 B.气体产物中可能有CO
C.该不锈钢中还含有铁和碳 D.该不锈钢合金的硬度小于纯铁
11.化学源于生活,服务于生活,以下说法合理的是
A.高层楼房发生火灾时要乘电梯逃生
B.厨房燃气泄漏,要打开抽油烟机排气
C.净水时利用明矾溶于水生成胶状物吸附加快沉淀
D.铝制品易在表面形成氧化膜,要经常用钢丝球擦洗
12.除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是
A.N2气体(O2)一通过灼热的铜网
B.木炭粉(CuO)一在空气中灼烧
C.KCl固体(MnO2)一加入足量的水溶解,过滤,蒸发结晶
D.FeCl2溶液(CuCl2)一加入过量的铁粉,过滤
二、填空题
13.常见金属的活动性顺序如下:
请回答下面问题:
(1)金属活动性顺序表中的X是_____元素。
(2)若将一根铝丝浸入硫酸铜溶液中,一段时间后都没有观察到任何的现象,原因可能是_____。
(3)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间的变化情况如下图所示。
AB段发生的化学方程式_____。图中B点溶液中含有的溶质有_____。
14.将一定质量的铝丝投入含有Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤。
(1)滤液中一定含有的溶质是_____;
(2)若滤液呈蓝色,则滤渣中一定含有_____。
15.结合金属在溶液中的活动性顺序回答下列问题。
(1)锡(Sn)比铅(Pb)的活动性_________;
(2)利用铝丝、硫酸铜溶液、银丝来验证铝、铜、银的活动性顺序,若将铝丝和银丝同时放入取出的硫酸铜溶液,一段时间后,可在_________丝表面观察到有红色物质;
(3)向某AgNO3、Cu(NO3)2和KNO3的混合溶液中加入一定量的镁粉,充分反应后过滤,若向滤液样品中加入稀盐酸,无明显变化,则下列说法中正确的是_________。
A 滤渣中一定含有银和铜
B 滤渣中可能含有铜和镁
C 滤液中一定含有KNO3和Mg(NO3)2
D 滤液中一定含有AgNO3和Cu(NO3)2
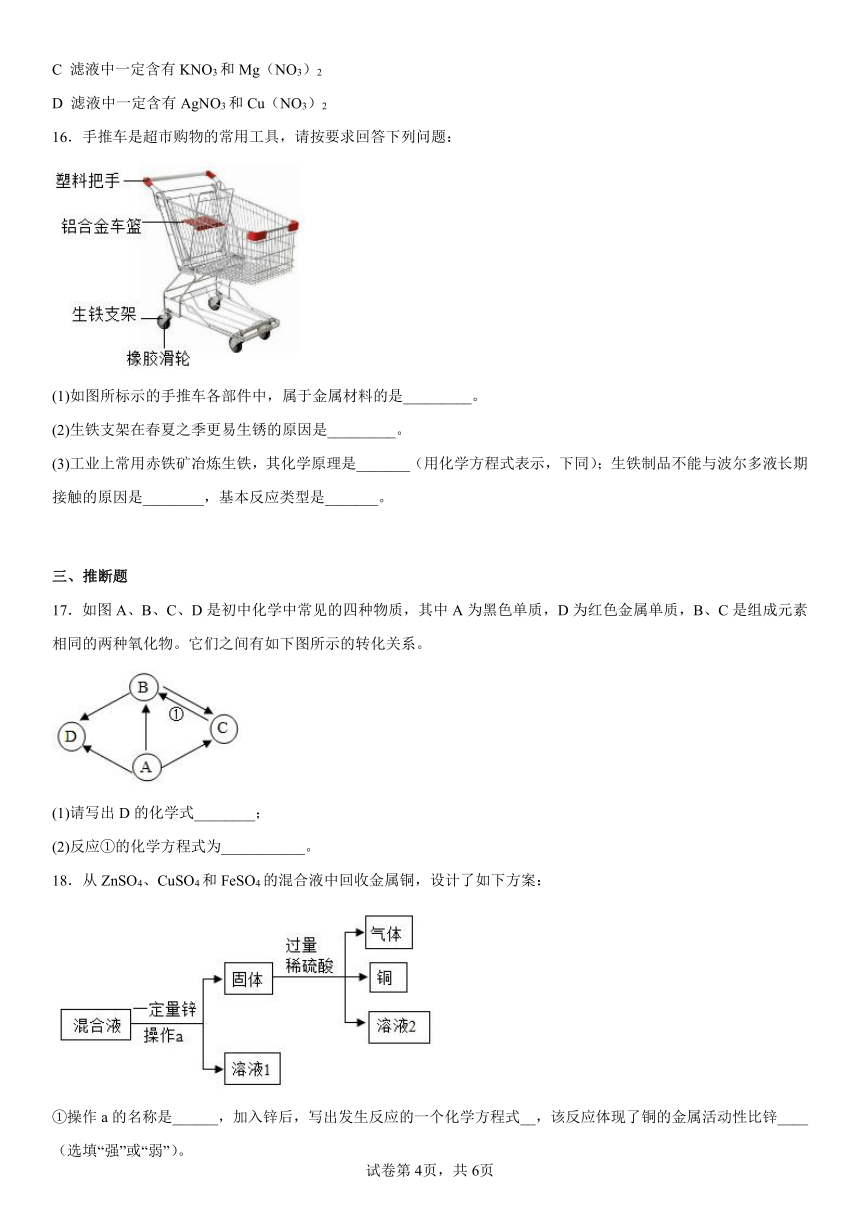
16.手推车是超市购物的常用工具,请按要求回答下列问题:
(1)如图所标示的手推车各部件中,属于金属材料的是_________。
(2)生铁支架在春夏之季更易生锈的原因是_________。
(3)工业上常用赤铁矿冶炼生铁,其化学原理是_______(用化学方程式表示,下同);生铁制品不能与波尔多液长期接触的原因是________,基本反应类型是_______。
三、推断题
17.如图A、B、C、D是初中化学中常见的四种物质,其中A为黑色单质,D为红色金属单质,B、C是组成元素相同的两种氧化物。它们之间有如下图所示的转化关系。
(1)请写出D的化学式________;
(2)反应①的化学方程式为___________。
18.从ZnSO4、CuSO4和FeSO4的混合液中回收金属铜,设计了如下方案:
①操作a的名称是______,加入锌后,写出发生反应的一个化学方程式__,该反应体现了铜的金属活动性比锌____(选填“强”或“弱”)。
②操作a后的固体中一定有的物质是____,生成气体的化学式是_____。
四、实验题
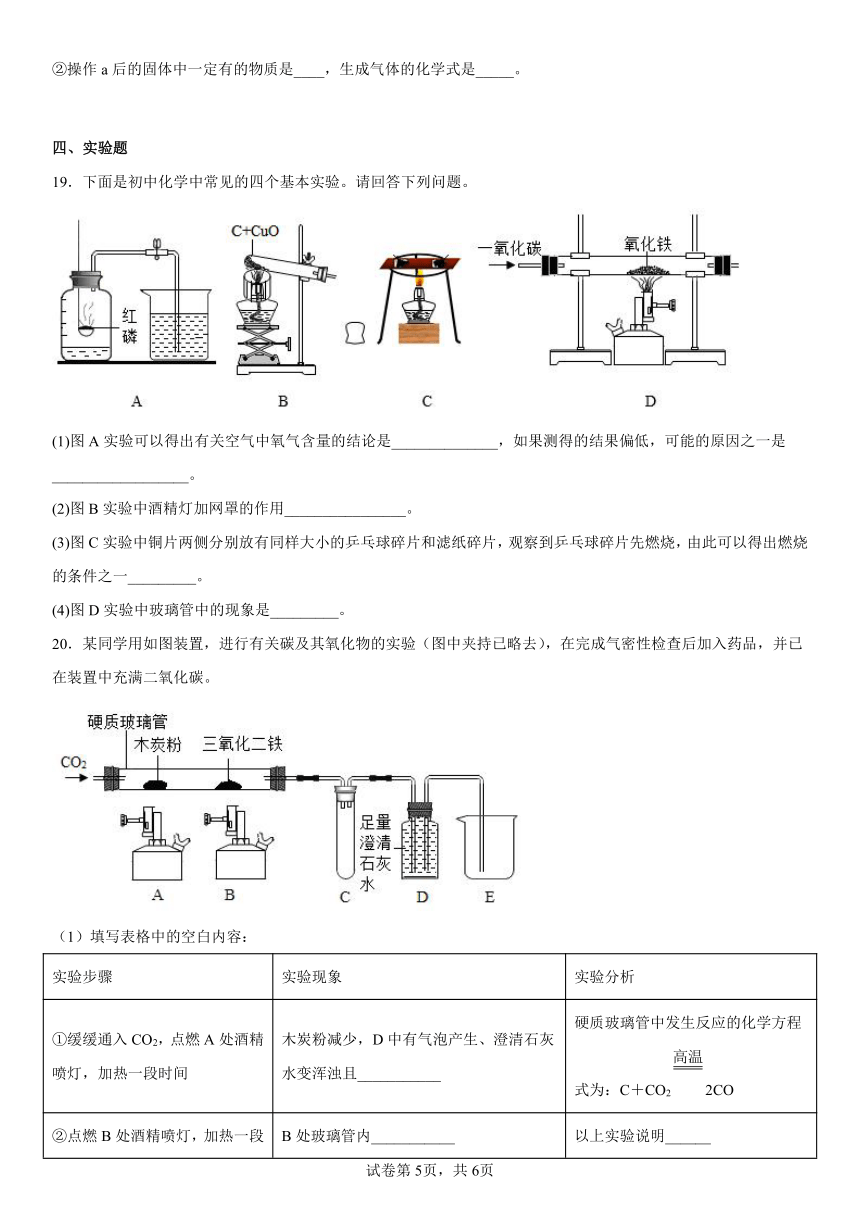
19.下面是初中化学中常见的四个基本实验。请回答下列问题。
(1)图A实验可以得出有关空气中氧气含量的结论是______________,如果测得的结果偏低,可能的原因之一是__________________。
(2)图B实验中酒精灯加网罩的作用________________。
(3)图C实验中铜片两侧分别放有同样大小的乒乓球碎片和滤纸碎片,观察到乒乓球碎片先燃烧,由此可以得出燃烧的条件之一_________。
(4)图D实验中玻璃管中的现象是_________。
20.某同学用如图装置,进行有关碳及其氧化物的实验(图中夹持已略去),在完成气密性检查后加入药品,并已在装置中充满二氧化碳。
(1)填写表格中的空白内容:
实验步骤 实验现象 实验分析
①缓缓通入CO2,点燃A处酒精喷灯,加热一段时间 木炭粉减少,D中有气泡产生、澄清石灰水变浑浊且___________ 硬质玻璃管中发生反应的化学方程式为:C+CO22CO
②点燃B处酒精喷灯,加热一段时间 B处玻璃管内___________ 以上实验说明______ 具有还原性
③停止通入二氧化碳,熄灭A、B两处的火焰 C中有D中液体进入
(2)有同学认为该装置需要添加尾气处理装置,你认为是否需要并说明理由___________。
五、计算题
21.铁的锈蚀对社会生产造成损害,但也有有利的一面,如某些食品包装袋内常放入还原性铁粉作“双吸剂”以防止食品腐败。某同学发现了一包破损的还原性铁粉(含少量杂质,杂质既不溶于水也不溶于酸),他们取六份样品,分别加稀硫酸反应。测得实验数据如下:
实验次数 1 2 3 4 5 6
取样品质量(g) 31.0 31.0 31.0 31.0 31.0 31.0
取稀硫酸质量(g) 30.0 90.0 120.0 150.0 180.0 210.0
产生气体质量(g) 0 a 0.3 0.5 0.6 0.6
(1)食品袋内放入“双吸剂”是为了吸收_____(填化学式),用铁粉而不用铁块作“双吸剂”的理由是_____。
(2)a的数值为_____。
(3)第4次实验,所得到溶液中溶质的化学式为_____。
(4)计算该样品中单质铁的质量分数(保留至0.1%)。
22.生活中常见的铁制品大多为铁合金(成分为铁和碳)材料,而非纯铁,铁合金又因其含碳量不同分为生铁和钢(生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%)。将一块质量为5.8 g的铁合金放入烧杯中,再向烧杯中加入98 g稀硫酸,恰好与铁合金中的铁完全反应,所得氢气的质量为0.2 g,通过计算回答:该铁合金是生铁还是钢?(写出计算过程,结果精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A、大理石的主要成分是碳酸钙,不是二氧化硅,选项错误;
B、赤铁矿的主要成分是氧化铁,化学式是,选项正确;
C、铝土矿的主要成分是氧化铝,化学式是 ,选项正确;
D、辉铜矿的主要成分是硫化亚铜,化学式是 ,选项正确;
故选:A。
2.B
【详解】①由于没有提及具体的铝和铁的量,所以不能判断金属是否剩余,而银不能和酸反应,所以不能判断一定产生气泡,故①错;
②由于没有提及具体的铝和铁的量,所以不能判断是否将硝酸银全部置换出来,所以不能判断一定产生沉淀,故②错;
③由于铁和铝的活动性都比银强,所以在滤渣中一定含有银单质,故③对;
④由于溶液是浅绿色溶液,可以推断有硝酸亚铁,铝的比铁活泼,所以铝应该先反应完了,所以一定有硝酸铝。所以一定有硝酸亚铁和硝酸铝,可能有硝酸银。,故④错;
即题中所给的说法正确的只有③,即只有一种说法正确。
故选B。
【点睛】解答这类题目时,首先,要熟记和理解金属活动性顺序及其应用,以及与之相关的知识等;然后,根据所给问题情景结合所学的相关知识和技能,细致地阅读、分析题意等细心地进行探究、推理,最后,按照题目的要求,认真地进行选择或解答即可
3.B
【详解】A、能导电的物质不一定是金属单质,例如石墨具有导电性,石墨属于非金属单质,故错误;
B、在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,不是所有的金属都能与稀盐酸反应,故正确;
C、与盐酸反应放出气体的物质不一定是金属,例如碳酸盐与稀盐酸反应能生成二氧化碳,故错误;
D、铁丝在空气中不能燃烧,而在氧气中能够燃烧生成四氧化三铁,故错误。
故选B。
4.C
【详解】A、生铁和钢都是铁的合金,生铁的含碳量为2%-4.3%,钢的含碳量为0.03%-2%,故雪车车体所用钢材的含碳量低于生铁,不符合题意;
B、氢气燃烧产物只有水,比较环保,不符合题意;
C、石墨烯是由碳元素组成的纯净物,属于单质,符合题意;
D、采用CO2跨临界直冷制冰技术,避免了使用氟利昂等制冷剂对臭氧层的破坏,比较环保,不符合题意。
故选C。
5.D
【详解】A、金属的性质是决定其用途的其中一个因素,还有价格、是否便于回收等因素,不符合题意;
B、导电、导热性最好的金属是Ag,不符合题意;
C、合金比组成它的纯金属,硬度大,熔点低,不符合题意;
D、生铁和钢都是铁的合金,其中生铁含碳量为2%-4.3%,钢的含碳量为:0.03%-2%,故生铁含碳量比钢高,符合题意。
故选D。
6.D
【详解】A、离子是带电的粒子,电子也是带电的粒子,所以带电的粒子不一定是离子,故A不符合题意;
B、置换反应有单质和化合物生成,但有单质和化合物生成的反应不一定是置换反应,如一氧化碳还原氧化铁,生成单质铁和化合物二氧化碳,但该反应不是置换反应,故B不符合题意;
C、化学变化伴随有能量变化,有的物理变化也伴随能量变化,如氢氧化钠固体溶于水放热,所以有能量变化的不一定是化学变化,故C不符合题意;
D、化合物含有不同种元素,所以由一种元素组成的物质要么是单质,要么是混合物,但一定不是化合物,故D符合题意。
故选D。
7.D
【详解】A、白酒具有酒香味,白醋具有醋酸味,气味不同,可以通过气味区分,不符合题意;
B、合金比组成它的纯金属的硬度大,黄铜是铜的合金,故相互刻画,留下划痕的是纯铜,没有划痕的是黄铜,不符合题意;
C、分别滴加稀盐酸,铁能与稀盐酸反应生成氯化亚铁和氢气,产生气泡,铜与稀盐酸不反应,无明显现象,故可通过是否有气泡区分,不符合题意;
D、碳粉和二氧化锰均是黑色的,观察颜色无法区分,符合题意。
故选D。
8.A
【分析】物质在化学变化中表现出来的性质叫化学性质,如可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等;物质不需要发生化学变化就表现出来的性质,叫物理性质;物理性质经常表现为:颜色、状态、气味、密度、硬度、熔点、沸点、导电性、导热性、溶解性、挥发性、吸附性等。
【详解】A、铁粉生锈时和氧气、水反应产生铁锈,所以作脱氧剂,属于化学性质;正确;
B、干冰可用作舞台云雾是利用干冰吸热升华,属于物理性质;错误;
C、活性炭用作冰箱除味剂是利用活性炭的吸附性,属于物理性质;错误;
D、合金的熔点比成分金属的低,所以武德合金制作电路保险丝,属于物理性质;错误。
故选A。
9.B
【分析】金属活动性:Al>Cu>Ag,取一定量的铝放入硝酸铜和硝酸银的混合溶液中,铝先与硝酸银反应生成硝酸铝和银,待硝酸银完全反应后,铝和硝酸铜反应生成硝酸铝和铜,充分反应后,得到固体和蓝色滤液,说明滤液中含硝酸铜,则铝已经完全反应。
【详解】A、铝一定与硝酸银反应生成了银,固体中一定含银,硝酸铜可能部分参与反应,也可能没有参与反应,故可能含铜,不符合题意;
B、铝与硝酸银反应生成了硝酸铝,由分析可知,滤液中一定含硝酸铜,硝酸银可能部分参与反应,也可能完全反应,故滤液中的溶质可能是AgNO3 Cu(NO3)2 Al(NO3)3,符合题意;
C、由B可知,硝酸银可能完全反应,也可能部分参与反应,不符合题意;
D、由以上分析可知,硝酸铜可能没有参与反应,也可能部分参与反应,不符合题意。
故选B。
10.D
【详解】A、由化学方程式可知,反应中NiO失去了氧元素,发生了还原反应,选项A说法正确;
B、碳与二氧化碳在高温下反应可生成一氧化碳,故气体产物中可能有CO,选项B说法正确;
C、钢是含碳量在0.03%~2%之间的铁合金,钢都是铁碳合金,一定含有铁和碳,因此该不锈钢中除了含有镍外还含有铁和碳,选项C说法正确;
D、因为合金硬度比纯金属硬度大,所以该不锈钢合金硬度大于纯铁,选项D说法错误。
故选D。
11.C
【详解】A、火灾时不能乘坐电梯逃生,以防断电后被困电梯内,直接威胁到人的生命;不符合题意;
B、燃气泄漏空间内有大量的可燃性气体和氧气混合,不能打开抽油烟机,以免产生火花,从而发生爆炸;不符合题意;
C、明矾溶于水生成胶状物,吸附杂质产生沉淀,使悬浮的小颗粒聚成大颗粒快速沉降,达到净水的目的;符合题意;
D、铝制品易在表面形成氧化膜,此氧化膜不能用钢丝球擦洗,否则会破坏氧化铝薄膜,影响使用寿命;不符合题意;
故选C。
12.B
【详解】A、N2与O2的混合气体通过灼热的铜网时,氧气与灼热的铜反应生成氧化铜固体,氮气与灼热的铜不反应,反应后得到纯净的氮气,符合除杂原则,选项正确;
B、木炭粉在空气中灼烧会与空气中的氧气反应生成二氧化碳,将欲保留的物质转化为其它物质,不符合除杂原则,选项错误;
C、KCl溶于水,MnO2不溶于水,采用加入足量的水溶解,过滤,蒸发结晶的方法,能够除去二氧化锰,得到纯净的KCl,符合除杂原则,选项正确;
D、向FeCl2和CuCl2混合溶液中加入过量的铁粉,铁与氯化铜反应生成氯化亚铁和铜,过滤掉过量的铁粉和生成的铜,得到氯化亚铁溶液,将杂质转化为欲保留的物质,符合除杂原则,选项正确,故选B。
【点睛】除杂的原则:
1、不能引入新杂质;
2、除杂剂只能与杂质反应,不能与欲保留的物质发生反应;
3、最佳的除杂方法是除杂剂与杂质反应生成欲保留的物质。
13. Sn 铝丝没有打磨,表面生成了致密的氧化铝薄膜,不能与硫酸铜反应 Cu(NO3)2和Zn(NO3)2
【详解】(1)金属活动性顺序表中的X是锡(Sn)元素。
(2)若将一根铝丝浸入硫酸铜溶液中,一段时间后都没有观察到任何的现象,原因可能是:铝的化学性质活泼,铝丝没有打磨,表面生成了致密的氧化铝薄膜,不能与硫酸铜反应。
(3)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,锌先与硝酸银反应,每65份质量的锌置换出216份质量的银,溶液得质量减小;硝酸银反应完后,锌再与硝酸铜反应,每65份质量的锌置换出64份质量的铜,溶液质量会增加;则AB段表示锌和硝酸银反应产生硝酸锌和银的化学方程式:。图中B点表示锌和硝酸银恰好完全反应,溶液中含有的溶质有硝酸锌和硝酸铜。
14. Al(NO3)3 银(Ag)
【分析】将一定质量的铝丝投入含有Cu(NO3)2和AgNO3的混合溶液中,金属活动性:铝>铜大于银,铝先与硝酸银反应生成硝酸铝和银,待硝酸银完全反应后,铝再与硝酸铜反应生成硝酸铝和铜。
【详解】(1)由于铝一定与硝酸银反应生成了硝酸铝和银,故滤液中一定含硝酸铝,可能含硝酸银、硝酸铜;
(2)若滤液呈蓝色,说明硝酸铜未完全反应,说明铝含量不足,滤渣中一定不含铝,由于铝先与硝酸银反应生成硝酸铝和银,故滤渣中一定含银,铝可能置换了部分硝酸铜,故可能含铜。
15. 强 铝 BC
【详解】(1)通过金属活动性顺序表可知,锡在铅的前面,所以锡的活动性比铅强。故答案为:强;
(2)通过金属活动性顺序表可知,铝、铜、银的金属活动性顺序为:铝>铜>银。将铝丝和银丝同时放入硫酸铜溶液中,铝会和硫酸铜反应生成硫酸铝和铜,观察到溶液由蓝色变为无色、铝丝表面有红色物质析出。而银不会反应。所以一段时间后,能够在铝丝表面观察到有红色的物质析出。故答案为:铝;
(3)通过金属活动性顺序表可知,银、铜、钾、镁四种金属的活动性顺序为:钾>镁>铜>银。所以将镁粉放入到混合溶液中,不会和KNO3反应,会优先置换AgNO3中的Ag。等硝酸银全部反应完毕,而且此时镁粉仍有剩余时,则镁粉会置换出Cu(NO3)2中的Cu。若向滤液样品中加入稀盐酸,无明显变化,则说明滤液中的硝酸银已经完全反应,滤液中一定没有硝酸银。
A、若镁粉的量很少,恰好和硝酸银反应,则此时滤渣只有金属银。A错误;
B、若镁粉的量恰好与硝酸银反应完全,则此时滤渣有银。若镁粉的量恰好与硝酸银、硝酸铜反应完全,则此时滤渣有银、铜。若镁粉过量,则滤渣有银、铜、镁。B正确;
C、镁和硝酸银反应生成硝酸镁和银。镁和硝酸铜反应生成硝酸镁和铜。那么滤液中一定含有未被反应的硝酸钾和反应生成的硝酸镁,可能含有硝酸铜,一定没有硝酸银。C正确;
D、镁和硝酸银反应生成硝酸镁和银。镁和硝酸铜反应生成硝酸镁和铜。那么滤液中一定含有未被反应的硝酸钾和反应生成的硝酸镁。若向滤液样品中加入稀盐酸,无明显变化,则说明滤液中的硝酸银已经完全反应,滤液中一定没有硝酸银,但不能确定硝酸铜反应的程度,滤液中不能确定是否含有硝酸铜。D错误。
故答案为:BC。
16.(1)铝合金车篮和生铁支架
(2)春夏之季空气更潮湿(或湿度大,水蒸气含量高等合理即可)
(3) 置换反应
【详解】(1)金属材料包括纯金属和合金,则如图所标示的手推车各部件中,属于金属材料的是铝合金车篮和生铁支架。
(2)铁与氧气和水生成铁锈,则生铁支架在春夏之季更易生锈的原因是春夏之季空气更潮湿(或湿度大,水蒸气含量高等合理即可)。
(3)一氧化碳和氧化铁高温生成铁和二氧化碳,则工业上常用赤铁矿冶炼生铁,其化学原理用化学方程式表示为,铁和硫酸铜反应生成硫酸亚铁和铜,则生铁制品不能与波尔多液长期接触的原因用化学方程式表示为,反应符合一种单质和一种化合物生成另一种单质和另一种化合物,则基本反应类型是置换反应。
17.(1)Cu
(2)
【分析】D为红色金属单质,为铜;B和C能相互转化且B、C是组成元素相同的两种氧化物,所以B、C为二氧化碳、一氧化碳的一种;A为黑色单质,且A能生成铜、二氧化碳、一氧化碳,所以A为碳单质;B能生成铜,则B为CO,所以C为二氧化碳;
(1)
D为铜,化学式为Cu;
(2)
反应①是二氧化碳和碳在高温条件下反应生成一氧化碳,化学反应方程式为:。
18. 过滤 弱 Fe、Cu H2
【详解】操作a能将不溶固体与液体分离,是过滤,加入锌后,由于活动性锌>铁>铜,所以锌先与硫酸铜反应生成硫酸锌和铜,后与硫酸亚铁反应生成硫酸锌和铁,锌和硫酸铜的反应一定发生反应,化学方程式,该反应体现了铜的金属活动性比锌弱;
锌和硫酸铜的反应一定发生,操作a后的固体中一定有铜,加入过量的硫酸后,产生气体,操作a后的固体中一定还有的物质是铁,即固体中一定有铜和铁,可能有锌,铁和硫酸反应生成硫酸亚铁和氢气,生成气体的化学式是H2。
19. 氧气约占空气体积的五分之一 红磷的量不足(合理即可) 集中火焰,提高温度 温度到达可燃物的着火点 红色固体逐渐变成黑色
【详解】(1)图A实验是测定空气中氧气含量的实验,得出的有关空气中氧气含量的结论是氧气约占空气体积的五分之一;
如果测得的结果偏低,可能的原因之一是红磷的量不足(氧气未被完全消耗,水进入偏少),装置漏气(进入水的同时有空气进入,进入的水偏少),未冷却到室温就打开止水夹(气体膨胀,水进入偏少)。
(2)酒精灯加网罩可以集中火焰,提高温度。
(3)乒乓球碎片先燃烧,滤纸碎片未燃烧,乒乓球碎片和滤纸碎片都是可燃物,也都与空气接触,但是不同的物质着火点不同,所以可以得出燃烧的条件之一是温度到达可燃物的着火点;
(4)图D实验是一氧化碳还原氧化铁的实验。一氧化碳可以将氧化铁(红棕色)还原为铁(铁粉为黑色)。所以观察到的现象是红色固体逐渐变成黑色。
20. 液面下降(或石灰水沿右侧导管进入E) 红色粉末变黑 碳和一氧化碳(或C、CO) 不需要,未反应的CO进入D装置后不会逸散到空气中(合理即可)
【详解】(1)①点燃A处酒精喷灯,加热一段时间,硬质玻璃管中木炭粉与二氧化碳在高温条件下反应生成一氧化碳,一氧化碳和剩余的CO2进入D中,CO2能使澄清石灰水变浑浊,同时澄清石灰水沿右侧导管进入E,D中液面下降;
②点燃B处酒精喷灯,加热一段时间,硬质玻璃管中的一氧化碳与氧化铁反应生成铁和二氧化碳,红色粉末变黑;上述实验说明碳和一氧化碳具有还原性;碳与二氧化碳化碳高温条件生成一氧化碳,碳夺取二氧化碳中的氧元素,作还原剂,具有还原性;
(2)该实验不需要添加尾气处理装置,因为未反应的CO进入D装置后不会逸散到空气中。
21.(1)O2、H2O;增大与氧气、水分的接触面积,加快反应速率;(2)0.1;(3)Fe2(SO4)3、FeSO4;(4)54.2%
【分析】氧化铁和稀硫酸反应生成硫酸铁和水,铁和稀硫酸反应生成硫酸亚铁和氢气。
【详解】(1)铁粉主要吸收空气中的两种物质是食物保鲜所以也称“双吸剂”,是铁与氧气、水分接触容易生锈,故吸收水和氧气,化学式为O2、H2O,铁粉接触面积大,用铁粉而不用铁块作“双吸剂”的理由是增大与氧气、水分的接触面积,加快反应速率。
(2)根据表中数据可知:第1次30g稀硫酸没产生氢气是稀硫酸和铁锈反应,3、4可以看出每30g稀硫酸可以产生0.2g氢气,则a的数值为0.1。
(3)第4次实验发生的反应是氧化铁和稀硫酸反应生成硫酸铁和水,铁和稀硫酸反应生成硫酸亚铁和氢气,则所得到溶液中溶质是硫酸铁和硫酸亚铁,故化学式为Fe2(SO4)3、FeSO4。
(4)设该样品中单质铁的质量为x
该样品中单质铁的质量分数为
【点睛】
22.解:设铁合金中参加反应的铁的质量为x。
x=5.6 g
该铁合金中的含碳量=
因为2%<3.4%<4.3%,故该铁合金是生铁。
答:该铁合金是生铁。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质名称与其主要成分不相匹配的是
A.大理石――SiO2 B.赤铁矿――Fe2O3
C.铝土矿――Al2O3 D.辉铜矿――Cu2S
2.向AgNO3溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法:
① 向滤渣中加入稀盐酸,一定有气泡产生。
② 向滤液中加入稀盐酸,一定有沉淀产生。
③ 滤渣中一定含有Ag。
④ 滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Al(NO3)3
以上说法正确的个数为
A.0个 B.1个 C.2个 D.3个
3.下列有关金属的说法正确的是
A.金属能导电,能导电的物质一定是金属
B.不是所有的金属都能和盐酸反应放出氢气
C.金属能和酸反应,能和酸反应的一定是金属
D.在空气不能燃烧的金属,在氧气中也不能燃烧
4.2022年北京冬奥会呈现“绿色办奥”的中国智慧。下列说法错误的是
A.雪车车体所用钢材的含碳量低于生铁
B.冬奥火炬“飞扬”采用氢气作燃料,低碳环保
C.使用石墨烯(单层石墨片)做成能够发热的“布”,石墨烯是一种新型化合物
D.采用CO2跨临界直冷制冰技术,避免了使用氟利昂等制冷剂对臭氧层的破坏
5.下列关于金属材料的说法正确的是( )
A.金属的性质是决定其用途的唯一因素
B.导电、导热性最好的金属是Au
C.合金相对于纯金属,其硬度更大、熔点更高
D.生铁和钢都是铁的合金,其中生铁含碳量比钢高
6.推理是化学学习中常用的思维方法,下列推理正确的是
A.离子是带电的粒子,所以带电的粒子一定是离子
B.置换反应有单质和化合物生成,所以有单质和化合物生成的反应一定是置换反应
C.化学变化伴随有能量变化,所以有能量变化的一定是化学变化
D.化合物含有不同种元素,所以由一种元素组成的物质一定不是化合物
7.下列实验方案不能达到目的的是
选项 实验目的 实验方案
A 区分白酒和白醋 闻气味,通过气味区分
B 区分黄铜和纯铜 相互刻画,通过划痕区分
C 区分铜粉和铁粉 分别滴加稀盐酸,通过是否有气泡区分
D 区分碳粉和MnO2 观察,通过颜色区分
A.A B.B C.C D.D
8.下列物质的用途主要与其化学性质有关的是
A.铁粉用作食品脱氧剂
B.干冰用于制作舞台云雾
C.活性炭用作冰箱除味剂
D.武德合金制作电路保险丝
9.取一定量的Al放入Cu(NO3)2和AgNO3的混合溶液中充分反应后过滤,得到固体和蓝色滤液,下列说法正确的是
A.固体中一定有Ag 与Cu
B.滤液中的溶质可能是AgNO3 Cu(NO3)2 Al(NO3)3
C.AgNO3一定完全反应
D.Cu(NO3)2 一定没有参加反应
10.“中国高铁,世界第一”,高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是:,下列说法错误的是
A.反应中NiO发生还原反应 B.气体产物中可能有CO
C.该不锈钢中还含有铁和碳 D.该不锈钢合金的硬度小于纯铁
11.化学源于生活,服务于生活,以下说法合理的是
A.高层楼房发生火灾时要乘电梯逃生
B.厨房燃气泄漏,要打开抽油烟机排气
C.净水时利用明矾溶于水生成胶状物吸附加快沉淀
D.铝制品易在表面形成氧化膜,要经常用钢丝球擦洗
12.除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是
A.N2气体(O2)一通过灼热的铜网
B.木炭粉(CuO)一在空气中灼烧
C.KCl固体(MnO2)一加入足量的水溶解,过滤,蒸发结晶
D.FeCl2溶液(CuCl2)一加入过量的铁粉,过滤
二、填空题
13.常见金属的活动性顺序如下:
请回答下面问题:
(1)金属活动性顺序表中的X是_____元素。
(2)若将一根铝丝浸入硫酸铜溶液中,一段时间后都没有观察到任何的现象,原因可能是_____。
(3)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间的变化情况如下图所示。
AB段发生的化学方程式_____。图中B点溶液中含有的溶质有_____。
14.将一定质量的铝丝投入含有Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤。
(1)滤液中一定含有的溶质是_____;
(2)若滤液呈蓝色,则滤渣中一定含有_____。
15.结合金属在溶液中的活动性顺序回答下列问题。
(1)锡(Sn)比铅(Pb)的活动性_________;
(2)利用铝丝、硫酸铜溶液、银丝来验证铝、铜、银的活动性顺序,若将铝丝和银丝同时放入取出的硫酸铜溶液,一段时间后,可在_________丝表面观察到有红色物质;
(3)向某AgNO3、Cu(NO3)2和KNO3的混合溶液中加入一定量的镁粉,充分反应后过滤,若向滤液样品中加入稀盐酸,无明显变化,则下列说法中正确的是_________。
A 滤渣中一定含有银和铜
B 滤渣中可能含有铜和镁
C 滤液中一定含有KNO3和Mg(NO3)2
D 滤液中一定含有AgNO3和Cu(NO3)2
16.手推车是超市购物的常用工具,请按要求回答下列问题:
(1)如图所标示的手推车各部件中,属于金属材料的是_________。
(2)生铁支架在春夏之季更易生锈的原因是_________。
(3)工业上常用赤铁矿冶炼生铁,其化学原理是_______(用化学方程式表示,下同);生铁制品不能与波尔多液长期接触的原因是________,基本反应类型是_______。
三、推断题
17.如图A、B、C、D是初中化学中常见的四种物质,其中A为黑色单质,D为红色金属单质,B、C是组成元素相同的两种氧化物。它们之间有如下图所示的转化关系。
(1)请写出D的化学式________;
(2)反应①的化学方程式为___________。
18.从ZnSO4、CuSO4和FeSO4的混合液中回收金属铜,设计了如下方案:
①操作a的名称是______,加入锌后,写出发生反应的一个化学方程式__,该反应体现了铜的金属活动性比锌____(选填“强”或“弱”)。
②操作a后的固体中一定有的物质是____,生成气体的化学式是_____。
四、实验题
19.下面是初中化学中常见的四个基本实验。请回答下列问题。
(1)图A实验可以得出有关空气中氧气含量的结论是______________,如果测得的结果偏低,可能的原因之一是__________________。
(2)图B实验中酒精灯加网罩的作用________________。
(3)图C实验中铜片两侧分别放有同样大小的乒乓球碎片和滤纸碎片,观察到乒乓球碎片先燃烧,由此可以得出燃烧的条件之一_________。
(4)图D实验中玻璃管中的现象是_________。
20.某同学用如图装置,进行有关碳及其氧化物的实验(图中夹持已略去),在完成气密性检查后加入药品,并已在装置中充满二氧化碳。
(1)填写表格中的空白内容:
实验步骤 实验现象 实验分析
①缓缓通入CO2,点燃A处酒精喷灯,加热一段时间 木炭粉减少,D中有气泡产生、澄清石灰水变浑浊且___________ 硬质玻璃管中发生反应的化学方程式为:C+CO22CO
②点燃B处酒精喷灯,加热一段时间 B处玻璃管内___________ 以上实验说明______ 具有还原性
③停止通入二氧化碳,熄灭A、B两处的火焰 C中有D中液体进入
(2)有同学认为该装置需要添加尾气处理装置,你认为是否需要并说明理由___________。
五、计算题
21.铁的锈蚀对社会生产造成损害,但也有有利的一面,如某些食品包装袋内常放入还原性铁粉作“双吸剂”以防止食品腐败。某同学发现了一包破损的还原性铁粉(含少量杂质,杂质既不溶于水也不溶于酸),他们取六份样品,分别加稀硫酸反应。测得实验数据如下:
实验次数 1 2 3 4 5 6
取样品质量(g) 31.0 31.0 31.0 31.0 31.0 31.0
取稀硫酸质量(g) 30.0 90.0 120.0 150.0 180.0 210.0
产生气体质量(g) 0 a 0.3 0.5 0.6 0.6
(1)食品袋内放入“双吸剂”是为了吸收_____(填化学式),用铁粉而不用铁块作“双吸剂”的理由是_____。
(2)a的数值为_____。
(3)第4次实验,所得到溶液中溶质的化学式为_____。
(4)计算该样品中单质铁的质量分数(保留至0.1%)。
22.生活中常见的铁制品大多为铁合金(成分为铁和碳)材料,而非纯铁,铁合金又因其含碳量不同分为生铁和钢(生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%)。将一块质量为5.8 g的铁合金放入烧杯中,再向烧杯中加入98 g稀硫酸,恰好与铁合金中的铁完全反应,所得氢气的质量为0.2 g,通过计算回答:该铁合金是生铁还是钢?(写出计算过程,结果精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A、大理石的主要成分是碳酸钙,不是二氧化硅,选项错误;
B、赤铁矿的主要成分是氧化铁,化学式是,选项正确;
C、铝土矿的主要成分是氧化铝,化学式是 ,选项正确;
D、辉铜矿的主要成分是硫化亚铜,化学式是 ,选项正确;
故选:A。
2.B
【详解】①由于没有提及具体的铝和铁的量,所以不能判断金属是否剩余,而银不能和酸反应,所以不能判断一定产生气泡,故①错;
②由于没有提及具体的铝和铁的量,所以不能判断是否将硝酸银全部置换出来,所以不能判断一定产生沉淀,故②错;
③由于铁和铝的活动性都比银强,所以在滤渣中一定含有银单质,故③对;
④由于溶液是浅绿色溶液,可以推断有硝酸亚铁,铝的比铁活泼,所以铝应该先反应完了,所以一定有硝酸铝。所以一定有硝酸亚铁和硝酸铝,可能有硝酸银。,故④错;
即题中所给的说法正确的只有③,即只有一种说法正确。
故选B。
【点睛】解答这类题目时,首先,要熟记和理解金属活动性顺序及其应用,以及与之相关的知识等;然后,根据所给问题情景结合所学的相关知识和技能,细致地阅读、分析题意等细心地进行探究、推理,最后,按照题目的要求,认真地进行选择或解答即可
3.B
【详解】A、能导电的物质不一定是金属单质,例如石墨具有导电性,石墨属于非金属单质,故错误;
B、在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,不是所有的金属都能与稀盐酸反应,故正确;
C、与盐酸反应放出气体的物质不一定是金属,例如碳酸盐与稀盐酸反应能生成二氧化碳,故错误;
D、铁丝在空气中不能燃烧,而在氧气中能够燃烧生成四氧化三铁,故错误。
故选B。
4.C
【详解】A、生铁和钢都是铁的合金,生铁的含碳量为2%-4.3%,钢的含碳量为0.03%-2%,故雪车车体所用钢材的含碳量低于生铁,不符合题意;
B、氢气燃烧产物只有水,比较环保,不符合题意;
C、石墨烯是由碳元素组成的纯净物,属于单质,符合题意;
D、采用CO2跨临界直冷制冰技术,避免了使用氟利昂等制冷剂对臭氧层的破坏,比较环保,不符合题意。
故选C。
5.D
【详解】A、金属的性质是决定其用途的其中一个因素,还有价格、是否便于回收等因素,不符合题意;
B、导电、导热性最好的金属是Ag,不符合题意;
C、合金比组成它的纯金属,硬度大,熔点低,不符合题意;
D、生铁和钢都是铁的合金,其中生铁含碳量为2%-4.3%,钢的含碳量为:0.03%-2%,故生铁含碳量比钢高,符合题意。
故选D。
6.D
【详解】A、离子是带电的粒子,电子也是带电的粒子,所以带电的粒子不一定是离子,故A不符合题意;
B、置换反应有单质和化合物生成,但有单质和化合物生成的反应不一定是置换反应,如一氧化碳还原氧化铁,生成单质铁和化合物二氧化碳,但该反应不是置换反应,故B不符合题意;
C、化学变化伴随有能量变化,有的物理变化也伴随能量变化,如氢氧化钠固体溶于水放热,所以有能量变化的不一定是化学变化,故C不符合题意;
D、化合物含有不同种元素,所以由一种元素组成的物质要么是单质,要么是混合物,但一定不是化合物,故D符合题意。
故选D。
7.D
【详解】A、白酒具有酒香味,白醋具有醋酸味,气味不同,可以通过气味区分,不符合题意;
B、合金比组成它的纯金属的硬度大,黄铜是铜的合金,故相互刻画,留下划痕的是纯铜,没有划痕的是黄铜,不符合题意;
C、分别滴加稀盐酸,铁能与稀盐酸反应生成氯化亚铁和氢气,产生气泡,铜与稀盐酸不反应,无明显现象,故可通过是否有气泡区分,不符合题意;
D、碳粉和二氧化锰均是黑色的,观察颜色无法区分,符合题意。
故选D。
8.A
【分析】物质在化学变化中表现出来的性质叫化学性质,如可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等;物质不需要发生化学变化就表现出来的性质,叫物理性质;物理性质经常表现为:颜色、状态、气味、密度、硬度、熔点、沸点、导电性、导热性、溶解性、挥发性、吸附性等。
【详解】A、铁粉生锈时和氧气、水反应产生铁锈,所以作脱氧剂,属于化学性质;正确;
B、干冰可用作舞台云雾是利用干冰吸热升华,属于物理性质;错误;
C、活性炭用作冰箱除味剂是利用活性炭的吸附性,属于物理性质;错误;
D、合金的熔点比成分金属的低,所以武德合金制作电路保险丝,属于物理性质;错误。
故选A。
9.B
【分析】金属活动性:Al>Cu>Ag,取一定量的铝放入硝酸铜和硝酸银的混合溶液中,铝先与硝酸银反应生成硝酸铝和银,待硝酸银完全反应后,铝和硝酸铜反应生成硝酸铝和铜,充分反应后,得到固体和蓝色滤液,说明滤液中含硝酸铜,则铝已经完全反应。
【详解】A、铝一定与硝酸银反应生成了银,固体中一定含银,硝酸铜可能部分参与反应,也可能没有参与反应,故可能含铜,不符合题意;
B、铝与硝酸银反应生成了硝酸铝,由分析可知,滤液中一定含硝酸铜,硝酸银可能部分参与反应,也可能完全反应,故滤液中的溶质可能是AgNO3 Cu(NO3)2 Al(NO3)3,符合题意;
C、由B可知,硝酸银可能完全反应,也可能部分参与反应,不符合题意;
D、由以上分析可知,硝酸铜可能没有参与反应,也可能部分参与反应,不符合题意。
故选B。
10.D
【详解】A、由化学方程式可知,反应中NiO失去了氧元素,发生了还原反应,选项A说法正确;
B、碳与二氧化碳在高温下反应可生成一氧化碳,故气体产物中可能有CO,选项B说法正确;
C、钢是含碳量在0.03%~2%之间的铁合金,钢都是铁碳合金,一定含有铁和碳,因此该不锈钢中除了含有镍外还含有铁和碳,选项C说法正确;
D、因为合金硬度比纯金属硬度大,所以该不锈钢合金硬度大于纯铁,选项D说法错误。
故选D。
11.C
【详解】A、火灾时不能乘坐电梯逃生,以防断电后被困电梯内,直接威胁到人的生命;不符合题意;
B、燃气泄漏空间内有大量的可燃性气体和氧气混合,不能打开抽油烟机,以免产生火花,从而发生爆炸;不符合题意;
C、明矾溶于水生成胶状物,吸附杂质产生沉淀,使悬浮的小颗粒聚成大颗粒快速沉降,达到净水的目的;符合题意;
D、铝制品易在表面形成氧化膜,此氧化膜不能用钢丝球擦洗,否则会破坏氧化铝薄膜,影响使用寿命;不符合题意;
故选C。
12.B
【详解】A、N2与O2的混合气体通过灼热的铜网时,氧气与灼热的铜反应生成氧化铜固体,氮气与灼热的铜不反应,反应后得到纯净的氮气,符合除杂原则,选项正确;
B、木炭粉在空气中灼烧会与空气中的氧气反应生成二氧化碳,将欲保留的物质转化为其它物质,不符合除杂原则,选项错误;
C、KCl溶于水,MnO2不溶于水,采用加入足量的水溶解,过滤,蒸发结晶的方法,能够除去二氧化锰,得到纯净的KCl,符合除杂原则,选项正确;
D、向FeCl2和CuCl2混合溶液中加入过量的铁粉,铁与氯化铜反应生成氯化亚铁和铜,过滤掉过量的铁粉和生成的铜,得到氯化亚铁溶液,将杂质转化为欲保留的物质,符合除杂原则,选项正确,故选B。
【点睛】除杂的原则:
1、不能引入新杂质;
2、除杂剂只能与杂质反应,不能与欲保留的物质发生反应;
3、最佳的除杂方法是除杂剂与杂质反应生成欲保留的物质。
13. Sn 铝丝没有打磨,表面生成了致密的氧化铝薄膜,不能与硫酸铜反应 Cu(NO3)2和Zn(NO3)2
【详解】(1)金属活动性顺序表中的X是锡(Sn)元素。
(2)若将一根铝丝浸入硫酸铜溶液中,一段时间后都没有观察到任何的现象,原因可能是:铝的化学性质活泼,铝丝没有打磨,表面生成了致密的氧化铝薄膜,不能与硫酸铜反应。
(3)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,锌先与硝酸银反应,每65份质量的锌置换出216份质量的银,溶液得质量减小;硝酸银反应完后,锌再与硝酸铜反应,每65份质量的锌置换出64份质量的铜,溶液质量会增加;则AB段表示锌和硝酸银反应产生硝酸锌和银的化学方程式:。图中B点表示锌和硝酸银恰好完全反应,溶液中含有的溶质有硝酸锌和硝酸铜。
14. Al(NO3)3 银(Ag)
【分析】将一定质量的铝丝投入含有Cu(NO3)2和AgNO3的混合溶液中,金属活动性:铝>铜大于银,铝先与硝酸银反应生成硝酸铝和银,待硝酸银完全反应后,铝再与硝酸铜反应生成硝酸铝和铜。
【详解】(1)由于铝一定与硝酸银反应生成了硝酸铝和银,故滤液中一定含硝酸铝,可能含硝酸银、硝酸铜;
(2)若滤液呈蓝色,说明硝酸铜未完全反应,说明铝含量不足,滤渣中一定不含铝,由于铝先与硝酸银反应生成硝酸铝和银,故滤渣中一定含银,铝可能置换了部分硝酸铜,故可能含铜。
15. 强 铝 BC
【详解】(1)通过金属活动性顺序表可知,锡在铅的前面,所以锡的活动性比铅强。故答案为:强;
(2)通过金属活动性顺序表可知,铝、铜、银的金属活动性顺序为:铝>铜>银。将铝丝和银丝同时放入硫酸铜溶液中,铝会和硫酸铜反应生成硫酸铝和铜,观察到溶液由蓝色变为无色、铝丝表面有红色物质析出。而银不会反应。所以一段时间后,能够在铝丝表面观察到有红色的物质析出。故答案为:铝;
(3)通过金属活动性顺序表可知,银、铜、钾、镁四种金属的活动性顺序为:钾>镁>铜>银。所以将镁粉放入到混合溶液中,不会和KNO3反应,会优先置换AgNO3中的Ag。等硝酸银全部反应完毕,而且此时镁粉仍有剩余时,则镁粉会置换出Cu(NO3)2中的Cu。若向滤液样品中加入稀盐酸,无明显变化,则说明滤液中的硝酸银已经完全反应,滤液中一定没有硝酸银。
A、若镁粉的量很少,恰好和硝酸银反应,则此时滤渣只有金属银。A错误;
B、若镁粉的量恰好与硝酸银反应完全,则此时滤渣有银。若镁粉的量恰好与硝酸银、硝酸铜反应完全,则此时滤渣有银、铜。若镁粉过量,则滤渣有银、铜、镁。B正确;
C、镁和硝酸银反应生成硝酸镁和银。镁和硝酸铜反应生成硝酸镁和铜。那么滤液中一定含有未被反应的硝酸钾和反应生成的硝酸镁,可能含有硝酸铜,一定没有硝酸银。C正确;
D、镁和硝酸银反应生成硝酸镁和银。镁和硝酸铜反应生成硝酸镁和铜。那么滤液中一定含有未被反应的硝酸钾和反应生成的硝酸镁。若向滤液样品中加入稀盐酸,无明显变化,则说明滤液中的硝酸银已经完全反应,滤液中一定没有硝酸银,但不能确定硝酸铜反应的程度,滤液中不能确定是否含有硝酸铜。D错误。
故答案为:BC。
16.(1)铝合金车篮和生铁支架
(2)春夏之季空气更潮湿(或湿度大,水蒸气含量高等合理即可)
(3) 置换反应
【详解】(1)金属材料包括纯金属和合金,则如图所标示的手推车各部件中,属于金属材料的是铝合金车篮和生铁支架。
(2)铁与氧气和水生成铁锈,则生铁支架在春夏之季更易生锈的原因是春夏之季空气更潮湿(或湿度大,水蒸气含量高等合理即可)。
(3)一氧化碳和氧化铁高温生成铁和二氧化碳,则工业上常用赤铁矿冶炼生铁,其化学原理用化学方程式表示为,铁和硫酸铜反应生成硫酸亚铁和铜,则生铁制品不能与波尔多液长期接触的原因用化学方程式表示为,反应符合一种单质和一种化合物生成另一种单质和另一种化合物,则基本反应类型是置换反应。
17.(1)Cu
(2)
【分析】D为红色金属单质,为铜;B和C能相互转化且B、C是组成元素相同的两种氧化物,所以B、C为二氧化碳、一氧化碳的一种;A为黑色单质,且A能生成铜、二氧化碳、一氧化碳,所以A为碳单质;B能生成铜,则B为CO,所以C为二氧化碳;
(1)
D为铜,化学式为Cu;
(2)
反应①是二氧化碳和碳在高温条件下反应生成一氧化碳,化学反应方程式为:。
18. 过滤 弱 Fe、Cu H2
【详解】操作a能将不溶固体与液体分离,是过滤,加入锌后,由于活动性锌>铁>铜,所以锌先与硫酸铜反应生成硫酸锌和铜,后与硫酸亚铁反应生成硫酸锌和铁,锌和硫酸铜的反应一定发生反应,化学方程式,该反应体现了铜的金属活动性比锌弱;
锌和硫酸铜的反应一定发生,操作a后的固体中一定有铜,加入过量的硫酸后,产生气体,操作a后的固体中一定还有的物质是铁,即固体中一定有铜和铁,可能有锌,铁和硫酸反应生成硫酸亚铁和氢气,生成气体的化学式是H2。
19. 氧气约占空气体积的五分之一 红磷的量不足(合理即可) 集中火焰,提高温度 温度到达可燃物的着火点 红色固体逐渐变成黑色
【详解】(1)图A实验是测定空气中氧气含量的实验,得出的有关空气中氧气含量的结论是氧气约占空气体积的五分之一;
如果测得的结果偏低,可能的原因之一是红磷的量不足(氧气未被完全消耗,水进入偏少),装置漏气(进入水的同时有空气进入,进入的水偏少),未冷却到室温就打开止水夹(气体膨胀,水进入偏少)。
(2)酒精灯加网罩可以集中火焰,提高温度。
(3)乒乓球碎片先燃烧,滤纸碎片未燃烧,乒乓球碎片和滤纸碎片都是可燃物,也都与空气接触,但是不同的物质着火点不同,所以可以得出燃烧的条件之一是温度到达可燃物的着火点;
(4)图D实验是一氧化碳还原氧化铁的实验。一氧化碳可以将氧化铁(红棕色)还原为铁(铁粉为黑色)。所以观察到的现象是红色固体逐渐变成黑色。
20. 液面下降(或石灰水沿右侧导管进入E) 红色粉末变黑 碳和一氧化碳(或C、CO) 不需要,未反应的CO进入D装置后不会逸散到空气中(合理即可)
【详解】(1)①点燃A处酒精喷灯,加热一段时间,硬质玻璃管中木炭粉与二氧化碳在高温条件下反应生成一氧化碳,一氧化碳和剩余的CO2进入D中,CO2能使澄清石灰水变浑浊,同时澄清石灰水沿右侧导管进入E,D中液面下降;
②点燃B处酒精喷灯,加热一段时间,硬质玻璃管中的一氧化碳与氧化铁反应生成铁和二氧化碳,红色粉末变黑;上述实验说明碳和一氧化碳具有还原性;碳与二氧化碳化碳高温条件生成一氧化碳,碳夺取二氧化碳中的氧元素,作还原剂,具有还原性;
(2)该实验不需要添加尾气处理装置,因为未反应的CO进入D装置后不会逸散到空气中。
21.(1)O2、H2O;增大与氧气、水分的接触面积,加快反应速率;(2)0.1;(3)Fe2(SO4)3、FeSO4;(4)54.2%
【分析】氧化铁和稀硫酸反应生成硫酸铁和水,铁和稀硫酸反应生成硫酸亚铁和氢气。
【详解】(1)铁粉主要吸收空气中的两种物质是食物保鲜所以也称“双吸剂”,是铁与氧气、水分接触容易生锈,故吸收水和氧气,化学式为O2、H2O,铁粉接触面积大,用铁粉而不用铁块作“双吸剂”的理由是增大与氧气、水分的接触面积,加快反应速率。
(2)根据表中数据可知:第1次30g稀硫酸没产生氢气是稀硫酸和铁锈反应,3、4可以看出每30g稀硫酸可以产生0.2g氢气,则a的数值为0.1。
(3)第4次实验发生的反应是氧化铁和稀硫酸反应生成硫酸铁和水,铁和稀硫酸反应生成硫酸亚铁和氢气,则所得到溶液中溶质是硫酸铁和硫酸亚铁,故化学式为Fe2(SO4)3、FeSO4。
(4)设该样品中单质铁的质量为x
该样品中单质铁的质量分数为
【点睛】
22.解:设铁合金中参加反应的铁的质量为x。
x=5.6 g
该铁合金中的含碳量=
因为2%<3.4%<4.3%,故该铁合金是生铁。
答:该铁合金是生铁。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
