第三章 简单的有机化合物 同步练习(含解析) 2022-2023学年下学期高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 第三章 简单的有机化合物 同步练习(含解析) 2022-2023学年下学期高一化学鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 440.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-16 16:48:30 | ||
图片预览




文档简介
第三章 简单的有机化合物 同步练习
一、单选题
1.国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法不正确的是( )
A.CH3CH2OH能与水互溶
B.NaClO通过氧化灭活病毒
C.过氧乙酸的摩尔质量为76g·mol-1
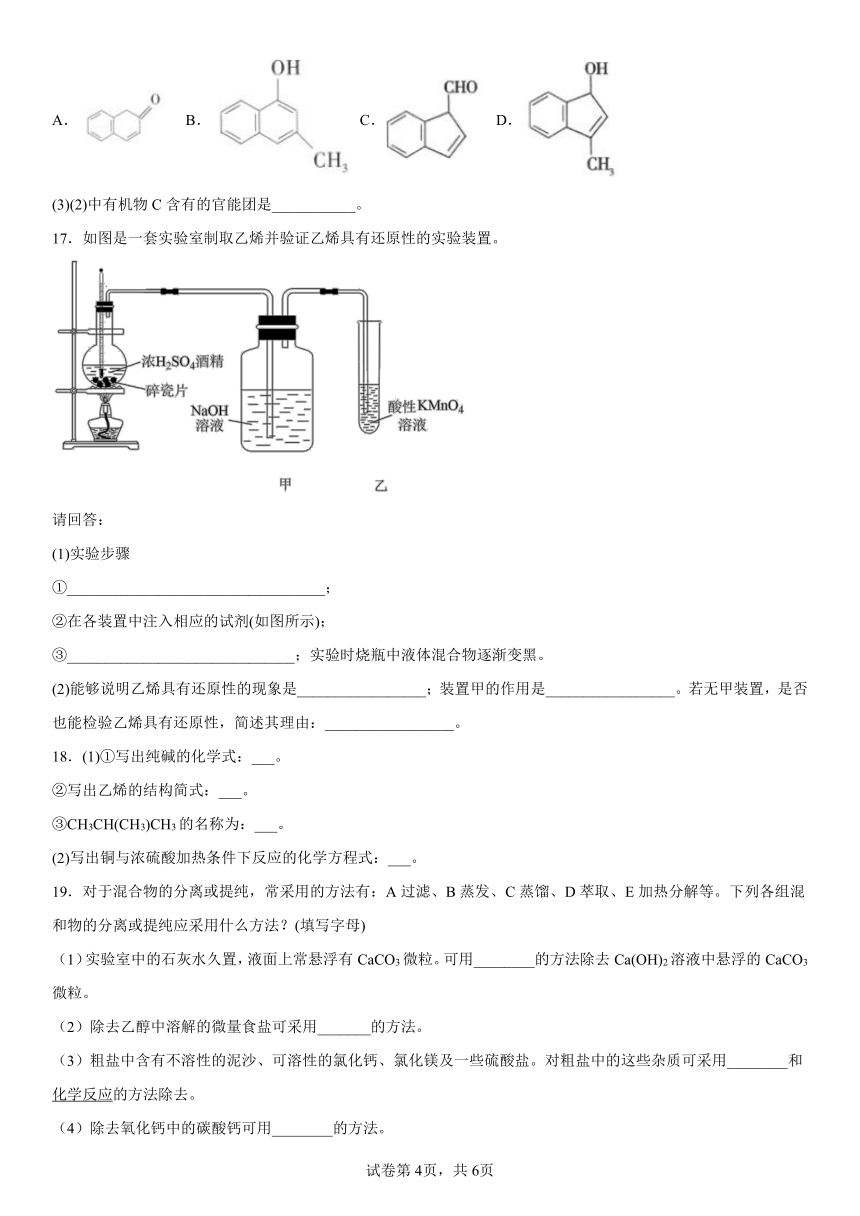
D.乙酸与过氧乙酸互为同素异形体
2.下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去SiO2中少量的Al2O3:用稀盐酸洗涤,过滤、洗涤、干燥;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的水:加足量生右灰,蒸馏。
A.①② B.②④ C.③④ D.②③
3.制取CH3CH2Cl最好采用的方法是
A.乙烷和Cl2取代 B.乙烯和Cl2加成
C.乙烯和HCl加成 D.乙烯和H2加成后再与Cl2取代
4.关于乙醇的用途中错误的是
A.配消毒剂 B.制药酒 C.作燃料 D.作麻醉剂
5.有机物M的结构简式为,下列说法正确的是
A.有机物M既能使酸性KMnO4溶液褪色又能使溴水褪色,且反应类型相同
B.与有机物M具有相同的官能团,且不包括M的同分异构体有3种
C.1mol有机物M与足量氢气反应,消耗氢气4mol
D.有机物M能发生取代、加成、氧化、水解等反应
6.将淀粉浆和淀粉酶混合,充分反应后,分别取少量液体与①碘水 ②新制的(加热) ③饱和溶液混合,其现象依次是
A.显蓝色、没有砖红色沉淀产生、有沉淀产生
B.不显蓝色、没有砖红色沉淀产生、有沉淀产生
C.显蓝色、有砖红色沉淀产生、没有沉淀产生
D.不显蓝色、有砖红色沉淀产生、有沉淀产生
7.化学与人类生产、生活,社会可持续发展密切相关,下列说法错误的是
A.酒精可用于杀菌消毒,还可用作食品添加剂
B.我国发射的“天舟三号”使用的光导纤维是一种有机高分子材料
C.三星堆3号坑最新出土了青铜神树残件,青铜属于合金
D.燃煤气化、脱硫、钙基固硫等措施有利于减少的排放
8.已知一组有机物的分子式通式,按某种规律排列成下表
项序 1 2 3 4 5 6 7 ……
通式 C2H4 C2H4O C2H4O2 C3H6 C3H6O C3H6O2 C4H8 ……
各项物质均存在数量不等的同分异构体。其中第12项的异构体中,属于酯类的有(不考虑立体异构)A.8种 B.9种 C.多于9种 D.7种
9.下列说法正确的是
A.按系统命名法,有机物 可命名为3,7-二甲基-4-乙基辛烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C.苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段为的高聚物,其单体是甲醛和苯酚
10.下列物质的应用中,利用了氧化还原反应的是( )
A.用石灰乳脱除烟气中的SO2
B.用84消毒液(有效成分NaClO)杀灭细菌
C.用明矾[KAl(SO4)2 12H2O]处理污水
D.用盐酸去除铁锈(Fe2O3 xH2O)
11.化学与生活、社会、科技发展息息相关,下列化学反应过程不涉及氧化还原反应的是
A.溶洞的形成 B.天然气燃烧 C.植物光合作用 D.火箭发射
A.A B.B C.C D.D
12.节约资源、保护环境,共同守护我们赖以生存的地球是每个人的责任。下列做法值得提倡的是
A.推进垃圾分类处理 B.将秸秆就地焚烧
C.加快开采化石燃料 D.使用含磷洗涤剂
13.下列实验操作、现象和结论都正确且有对应关系的是( )
选项 操作 现象 结论
A 在Fe(NO3)2溶液中滴加硫酸酸化的H2O2 溶液颜色加深 氧化性:H2O2>Fe3+
B 在苯中加入溴水和溴化铁,振荡、静置 水层颜色变浅 溴与苯发生取代反应
C 溶有SO2的BaCl2溶液中通入气体X 有白色沉淀生成 X可能是Cl2
D 在FeS中滴加盐酸,将产生的气体 通入溴水 溴水褪色并产生 黄色沉淀 非金属性:Cl>Br>S
A.A B.B C.C D.D
14.下列说法中正确的一组是
A.H2和D2互为同素异形体
B. 和是氧元素的两种核素,二者互为同位素
C.正丁烷和2-甲基丙烷(异丁烷)互为同系物
D.和 互为同分异构体
二、填空题
15.“酒是陈的香”,酒在存放过程中会产生酯类,以乙醇为例写出酒在存放过程中发生反应的化学方程式,并指明反应类型___。
16.苏丹红一号是一种偶氮染料,不能作为食品添加剂使用。它是以苯胺和2-萘酚为主要原料制备得到的,苏丹红一号和2-萘酚的结构简式如下所示:
(1)苏丹红一号的分子式为___________。
(2)下列化合物A~D中,与2-萘酚互为同系物的是___________(填序号)。
A. B.C.D.
(3)(2)中有机物C含有的官能团是___________。
17.如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置。
请回答:
(1)实验步骤
①__________________________________;
②在各装置中注入相应的试剂(如图所示);
③______________________________;实验时烧瓶中液体混合物逐渐变黑。
(2)能够说明乙烯具有还原性的现象是_________________;装置甲的作用是_________________。若无甲装置,是否也能检验乙烯具有还原性,简述其理由:_________________。
18.(1)①写出纯碱的化学式:___。
②写出乙烯的结构简式:___。
③CH3CH(CH3)CH3的名称为:___。
(2)写出铜与浓硫酸加热条件下反应的化学方程式:___。
19.对于混合物的分离或提纯,常采用的方法有:A过滤、B蒸发、C蒸馏、D萃取、E加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填写字母)
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用________的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)除去乙醇中溶解的微量食盐可采用_______的方法。
(3)粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。对粗盐中的这些杂质可采用________和化学反应的方法除去。
(4)除去氧化钙中的碳酸钙可用________的方法。
20.甲烷是最简单的有机化合物,很早就被人类发现。然而化学家为搞清楚甲烷的结构却用了上百年的时间,期间曾相继提出下列图示来表示甲烷的结构:
请分析以上图示所蕴含的化学信息__________,与同学交流讨论,并对其进行评价,从中体验人类对物质结构认识不断深化的探索历程。
21.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题:
(1)乙烯的电子式为____;结构简式为_____。
(2)鉴别甲烷和乙烯的试剂是_______(填字母)。
A.稀硫酸 B.溴的四氯化碳溶液 C.水 D.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯发生加成反应得到的是_______(填字母)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)写出乙烯生成聚乙烯的化学反应方程式:_______。
22.NA为阿伏加德罗常数的值。下列说法正确的是___________。
A.12g石墨烯和12g金刚石均含有NA个碳原子
B.标准状况下,11.2LCO和H2的混合气体中分子数为0.5NA
C.1mol的CO和N2混合气体中含有的质子数为14NA
D.0.1mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3NA
E.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
F.28g的乙烯和环己烷混合气体中所含原子总数为6NA
G.48g正丁烷和10g异丁烷的混合物中共价键数目为13NA
23.(1)若型分子的中心原子上有一对孤电子对未能成键,当时,其分子的空间结构为______,中心原子的杂化方式为______;当时,其分子的空间结构为______形,中心原子的杂化方式为______。
(2)、、、中,都是以杂化轨道与O成键,则呈______形,_呈_____形,呈______形,呈______形。
(3)“笑气”()是人类最早应用于医疗的麻醉剂之一。
有关理论认为与分子具有相似的结构(包括电子式);又已知分子中氧原子只与一个氮原子相连,则的电子式可表示为______,由此可知它______(填“含有”或“不含”)非极性键。
(4)分子的空间结构是平面正方形。它有两种空间异构体——俗称顺铂和反铂,其结构简式为
①试对顺铂和反铂的水溶性作出预测______。
②分子是否具有手性______?
24.化学工业为疫情防控提供了强有力的物质支撑。常用的消毒剂产品按成分可以分为含氯消毒剂、醇类消毒剂、含碘消毒剂等9种。回答下列问题:
(1)①碘酊又称碘酒,常见配制方法是将一定质量的单质碘溶于适量酒精,再加水稀释。碘酒属于___________。(选填:溶液、胶体、悬浊液、乳浊液)
②I4O9是碘元素最稳定的氧化物之一,已知其中碘元素的化合价为+3、+5价,则I4O9中+3价和+5价的碘原子数目之比为___________,若I4O9溶于水会生成两种含氧酸,写出该过程的化学方程式___________。
(2)乙醇是生活中最常见的醇类消毒剂。
①下列关于乙醇的说法正确的是___________。
a.将日常饮用的白酒直接蒸馏即可得到无水乙醇
b.95%的酒精消毒杀菌效果比浓度为75%的酒精好
c.表面氧化的铜丝在酒精灯内焰加热时会恢复红色,说明酒精具有挥发性和还原性
d.平时生活中,可以采用大面积喷洒酒精的方式对室内等封闭空间消毒
②酒驾的检测原理是乙醇使酸化的K2Cr2O7橙色溶液迅速还原成绿色的Cr2O3,同时生成无色无味气体,写出该反应的离子方程式___________。
(3)“84”消毒液的有效成分是NaClO,某同学用广泛PH试纸测量该种市售消毒液的PH,观察到的现象是___________,造成该现象的原因是___________。
(4)广谱消毒剂ClO2可利用电解饱和食盐水的方法制得,写出该电极反应方程式___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.乙醇分子中有羟基,其与水分子间可以形成氢键,因此乙醇能与水互溶,A说法正确;
B.次氯酸钠具有强氧化性,其能使蛋白质变性,故其能通过氧化灭活病毒,B说法正确;
C.过氧乙酸的分子式为C2H4O3,故其摩尔质量为76g·mol-1,C说法正确;
D.同素异形体是指同种元素形成的不同种单质,而乙酸与过氧乙酸均为化合物,故两者不是同素异形体,D说法错误;
答案选D。
2.B
【详解】①光照条件下乙烷和氯气能发生取代反应,一般用溴水除乙烷中的乙烯,故①错误;
②二氧化硅和盐酸不反应,氧化铝和盐酸反应生成氯化铝和水,用稀盐酸可除去SiO2中少量的Al2O3,故②正确;
③二氧化碳和碳酸钠溶液反应生成碳酸氢钠,一般用通过盛饱和碳酸氢钠溶液的洗气瓶除去CO2中少量的SO2,故③错误;
④乙醇易挥发,氧化钙和水反应生成氢氧化钙,加足量生右灰、蒸馏,可除去乙醇中少量的水,故④正确;
正确的是②④,故选B。
3.C
【详解】A.乙烷与Cl2发生取代反应除生成CH3CH2Cl外,还有二氯乙烷、三氯乙烷等多种取代物生成;
B.乙烯与Cl2发生加成反应生成ClCH2CH2Cl,不能制得CH3CH2Cl;
C.乙烯与HCl发生加成反应生成CH3CH2Cl,原子利用率高,产物纯净;
D.乙烯与H2加成生成CH3CH3,CH3CH3与Cl2发生取代反应除生成CH3CH2Cl外,还有二氯乙烷、三氯乙烷等多种取代物生成;
故最好的方法是乙烯和HCl加成,答案选C。
4.D
【详解】乙醇常用作配消毒剂、制药酒和作燃料;常用乙醚作麻醉剂,故D错误。
综上所述,答案为D。
5.C
【详解】A.分子结构中含有碳碳双键,能与Br2发生加成反应而使溴水褪色,能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色,褪色原理不一样,故A错误;
B.含有苯环、碳碳双键和羧基,其具有相同官能团的同分异构体共有4种,其中乙烯基与羧基在苯环的间位和对位有2种,另外苯环上只有一个取代基为-CH=CHCOOH或-C(COOH)=CH2有2种,故B错误;
C.苯环和碳碳双键均可与H2发生加成反应,则1mol与足量氢气反应,消耗氢气4mol,故C正确;
D.能发生取代、加成、氧化,但不能发生水解反应,故D错误;
故答案为C。
【点睛】以有机物M的结构简式为载体,考查官能团的性质,熟悉常见官能团的性质,进行知识迁移运用,根据有机物结构特点,有碳碳双键决定具有烯烃的性质,有羧基决定具有羧酸的性质,有苯环还具有苯的性质,难点是满足条件的同分异构体的判断。
6.D
【详解】在淀粉酶的作用下,淀粉水解生成葡萄糖,遇碘水不显蓝色;葡萄糖与新制的加热反应产生砖红色沉淀;淀粉酶是一种蛋白质,加入饱和溶液发生盐析,有沉淀产生;故D项正确。
故选D。
7.B
【详解】A.酒精能使蛋白质变性,可用于杀菌消毒,食品厂中可用酒精调味、杀菌,故酒精还可用作食品添加剂,A正确;
B.光导纤维的成分为SiO2,属于无机非金属材料,B错误;
C.青铜是在纯铜中加入锡或铅的合金,C正确;
D.燃煤气化是将煤转化为可燃性气体的过程,主要反应是碳与水蒸气反应生成水煤气等,钙基固硫主要将S元素转化为固态物质CaSO4,故燃煤气化、脱硫、钙基固硫等措施均有利于减少 SO2的排放,D正确;
答案选B。
8.B
【分析】由表中规律可知,3、6、9、12项符合CnH2nO2,由C原子数的变化可知,第12项为C5H10O2,属于酯类物质一定含-COOC-。
【详解】①为甲酸丁酯时,丁基有4种,符合条件的酯有4种;
②为乙酸丙酯时,丙基有2种,符合条件的酯有2种;
③为丙酸乙酯只有1种;
④为丁酸甲酯时,丁酸中-COOH连接丙基,丙基有2种,符合条件的酯有2种,
属于酯类的有4+2+1+2=9种,
故选:B。
9.D
【详解】A.的命名中,取代基的编号之和不是最小的,应该从左端开始给主链上C原子编号,正确命名为2,6-二甲基-5-乙基辛烷,A错误;
B. 苯C6H6燃烧消耗O2的物质的量n=)mol=1.5 mol,即1 mol苯消耗氧气7.5 mol,苯甲酸(C6H5-COOH)的n=(7+)mol=7.5 mol,即1 mol苯甲酸消耗氧气7.5 mol,所以等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等,B错误;
C. 苯和甲苯互为同系物,但苯不能使KMnO4酸性溶液褪色,C错误;
D. 苯酚和甲醛发生缩聚反应得到酚醛树酯,结构片段为,D正确;
故合理选项是D。
10.B
【详解】A.SO2是酸性氧化物,可与碱反应,用石灰乳脱除烟气中的SO2时,SO2与氢氧化钙反应生成亚硫酸钙或亚硫酸氢钙,反应过程中无元素的化合价变化,没有利用氧化还原反应,故A错误;
B.用84消毒液有效成分NaClO,具有强氧化性,能使蛋白质发生变性从而杀死细菌病毒,杀菌消毒的过程利用了氧化还原反应,故B正确;
C.用明矾[KAl(SO4)2 12H2O]溶于水中,电离出的铝离子发生水解生成氢氧化铝胶体,利用胶体的吸附性可吸附污水中的固体颗粒物,该过程利用胶体的吸附性,发生的反应没有发生化合价变化,没有利用氧化还原反应,故C错误;
D.用盐酸去除铁锈(主要成分Fe2O3 xH2O),发生的主要反应为:6HCl+Fe2O3=2FeCl3+3H2O,反应中没有元素化合价的变化,没有利用氧化还原反应,故D错误;
故答案为B。
11.A
【详解】A.溶洞形成时,发生反应CaCO3+CO2+H2O=Ca(HCO3)2,此反应为非氧化还原反应,A符合题意;
B.天然气燃烧时,发生反应CH4+2O2CO2+2H2O,此反应为氧化还原反应,B不符合题意;
C.植物光合作用时,发生反应6CO2+6H2OC6H12O6+6O2,此反应为氧化还原反应,C不符合题意;
D.火箭发射时,火箭燃料发生燃烧,发生氧化还原反应,同时放出能量,D不符合题意;
故选A。
12.A
【详解】A. 推进垃圾分类处理,可健全再生资源回收利用网络,节能环保,故A正确;
B. 就地焚烧秸秆会产生有害气体,污染空气,故B错误;
C. 加快开采化石燃料会造成大量空气污染物排放,故C错误;
D. 使用含磷洗涤剂会造成水体富营养化,故D错误;
故答案为A。
13.C
【分析】
【详解】
A.在Fe(NO3)2溶液中滴加酸化的H2O2,由于酸性条件下硝酸根离子具有强氧化性,能够氧化亚铁离子,干扰了检验结果,因此无法判断H2O2与Fe3+的氧化性强弱,故A不符合题意;
B.该过程是发生了萃取导致水层颜色变浅,并不是发生了取代反应,故B不符合题意;
C.通入的气体X具有氧化性或碱性,能够将该溶液中的H2SO3氧化为H2SO4或生成亚硫酸盐,SO32-或SO42-与Ba2+发生反应生成白色沉淀,Cl2具有氧化性,满足题意,故C符合题意;
D.该过程中发生的反应依次为:FeS+2HCl=FeCl2+H2S↑、H2S+Br2=S↓+2HBr,前者能够证明酸性:HCl>H2S,但其并非是该元素对应最高价氧化物对应水化物,因此无法判断元素的非金属性强弱关系,后者反应说明氧化性:Br2>S,能够说明非金属性:Br>S,故D不符合题意;
答案为C。
14.B
【详解】A.由同种元素形成的不同单质互为同素异形体,如金刚石和石墨都是由碳元素形成的,二者互为同素异形体,但H2和D2都是由两个氢原子构成的氢分子,二者不互为同素异形体,故A错误;
B.质子数相同中子数不同的同一元素的不同原子互称为同位素, 和质子数都是8,中子数分别为8、10,二者互为同位素,故B正确;
C.正丁烷和2-甲基丙烷的分子式相同,结构不同,所以互为同分异构体,不互为同系物,故C错误;
D. 和 分子式不相同,分子式相差一个CH2,所以互为同系物,故D错误;
答案选B。
15.C2H5OH+O2CH3COOH+H2O,氧化反应;C2H5OH+CH3COOHCH3COOC2H5+H2O,酯化反应(或取代反应)
【详解】酒在存放过程中,乙醇被氧化为乙酸,发生氧化反应:C2H5OH+O2CH3COOH+H2O;乙酸与乙醇发生酯化反应(或取代反应)生成乙酸乙酯和水,反应的化学方程式为C2H5OH+CH3COOHCH3COOC2H5+H2O。
16. B 碳碳双键、醛基
【详解】(1)根据苏丹红一号的结构简式可以推出苏丹红一号的分子式是;
(2)根据2-萘酚与各物质的结构简式可判断出只有B与2-萘酚结构相似且分子组成相差一个原子团,答案选B;
(3)(2)中有机物C含有的官能团是碳碳双键、醛基。
17. 组装仪器,检验装置的气密性 加热,使温度迅速升到170℃ 乙中酸性KMnO4溶液紫色褪去 除去乙烯中混有的SO2、CO2等酸性气体 不能,因SO2具有还原性,也可以使酸性KMnO4溶液褪色
【详解】(1)①制取气体的装置气密性必须良好,实验前需要检验装置的气密性。
②实验室制乙烯时应使反应混合物的温度迅速升到170℃,而减少乙醚的生成。
(2)乙烯具有还原性是根据氧化剂酸性KMnO4溶液褪色来判断的。由于烧瓶中混合物变黑,则说明生成了碳,联想浓H2SO2具有强氧化性,可知在乙烯中含有还原性气体SO2,由于SO2也会使酸性KMnO4溶液褪色,会干扰验证乙烯的还原性,所以检验乙烯的还原性前必须除净SO2,则装置甲的作用是除去SO2。
18. Na2CO3 CH2=CH2 2-甲基丙烷或为异丁烷 C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
【详解】(1)①碳酸钠的俗称纯碱,化学式为Na2CO3;
②乙烯属于不饱和烯烃,分子式为C2H4,结构中含有碳碳双键,结构简式:CH2=CH2;
③CH3CH(CH3)CH3属于烷烃,主碳链为3个碳,甲基在2号碳上,为2-甲基丙烷或为异丁烷;
(2)铜与浓硫酸加热条件下反应生成硫酸铜、二氧化硫和水,反应的化学方程式:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。
19. A C A E
【详解】(1)根据CaCO3的溶解性,是不溶于水的物质,要和石灰水分离,可以采用过滤的方法,答案选A;(2)根据乙醇易挥发,除去乙醇中溶解的微量食盐可采用蒸馏的方法,将乙醇蒸馏出来,答案选C;(3)过滤可除去不溶性杂质,粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。对粗盐中的这些杂质可采用过滤和化学反应的方法除去,答案选A;(4)碳酸钙受热分解为氧化钙、二氧化碳,而氧化钙受热稳定,故可以用加热分解法来分离,答案选E。
点睛:本题考查混合物分离提纯方法的选择和应用,为高频考点,把握物质的性质及性质差异为解答的关键,侧重物质性质及混合物分离原理的考查。
20.第一个表示的甲烷的组成与结构是错误的;第二个只能表示出甲烷的组成,没有体现结构;第三个体现了组成和结构,但平面的结构是错误的;第四个结构是体现了组成和化学键,但空间结构仍没有体现出来;第五个体现了甲烷的组成和空间结构,是甲烷结构的正确表示(合理即可)
【详解】从这一组图可以知道:科学家对甲烷结构的认识过程经历了由表及里、由定性到定量、由平面对立体的过程:第一个表示的甲烷的组成与结构是错误的;第二个只能表示出甲烷的组成,没有体现结构;第三个体现了组成和结构,但平面的结构是错误的;第四个结构是体现了组成和化学键,但空间结构仍没有体现出来;第五个体现了甲烷的组成和空间结构,是甲烷结构的正确表示(合理即可)
21. CH2=CH2 BD ACD nCH2=CH2
【详解】(1)乙烯分子式为C2H4,该分子中碳原子之间形成2对共用电子对,碳原子与氢原子之间形成1对共用电子对,其电子式为,结构简式为CH2=CH2;答案为,CH2=CH2。
(2)甲烷与乙烯均不与硫酸反应,均不溶于水,但乙烯含有碳碳双键,可与溴的四氯化碳溶液发生加成反应而使溴的四氯化碳溶液褪色;也被酸性高锰酸钾发生氧化而使高锰酸钾溶液褪色;甲烷性质稳定,与溴的四氯化碳溶液和酸性高锰酸钾溶液都不反应,可以用溴的四氯化碳溶液水、酸性高锰酸钾溶液鉴别甲烷与乙烯;答案为BD。
(3)乙烯与氢气加成生成乙烷,即CH2=CH2+H2CH3CH3,乙烯与水加成生成乙醇,即CH2=CH2+H2OCH3CH2OH,乙烯与溴化氢发生加成生成溴乙烷,即CH2=CH2+HBrCH3CH2Br,但是无法通过加成反应获得CH3CHCl2;答案为ACD。
(4)乙烯通过加聚反应生成聚乙烯,故其反应的化学方程式为nCH2=CH2。
22.ABCDEFG
【详解】石墨烯和金刚石均为碳单质,12g石墨烯和12g金刚石均相当于12g碳原子,即n(C)==1molC原子,所含碳原子数目为NA,故A正确;标准状况下,11.2LCO和H2的混合气体为0.5mol,分子数为0.5NA,选项B正确;1molCO含有质子物质的量为(6+8)mol=14mol,1molN2中含有质子物质的量为2×7mol=14mol,因此1molN2和CO的混合气体中含有质子物质的量为14mol,故C正确;1mol乙醇或乙烯完全燃烧消耗的氧气都为3mol,0.1mol混合气体(任意比例混合)完全燃烧消耗氧气为0.3mol,故D正确;甲烷和乙烯的分子式分别为CH4和C2H4,因此混合物中氢原子的平均值为4,故标准状况下,11.2L二者的混合气体的物质的量为0.5mol,含有的氢原子数为2NA,故E正确;乙烯和环己烷的最简式相同,都是CH2,所以28g乙烯和环己烷混合气体相当于28gCH2,其物质的量为2mol,含有的原子的物质的量为3×2mol=6mol,即所含原子总数为6NA,故F正确;正丁烷与异丁烷的分子式相同(为C4H10),1个分子内所含共价键数目均为13个(10个C-H键和3个C-C键),则48g正丁烷与10g异丁烷所得的混合物中共价键数目为×13×NAmol-1=NA,G项正确;综上所述,正确答案为ABCDEFG。
23. 角形 三角锥 直线 角 三角锥 正四面体 含有 顺铂是极性分子,反铂是非极性分子,故顺铂相对易溶于水,反铂难溶于水 不具有手性
【详解】(1)若型分子的中心原子A上有一对孤电子对未能成键,则分子的空间结构将会发生变化。当时,中心原子的价电子对数为3,因此是杂化,分子的空间结构为角形;当时,中心原子的价电子对数为4,因此是杂化,分子的空间结构为三角锥形;故答案为:角形;;;三角形;
(2)由题意知,都是以杂化轨道与O成键,杂化轨道的空间结构为正四面体形,的成键电子对数为1,孤电子对数为3,则空间构型为直线形;的成键电子对数为2,孤电子对数为2,则空间构型为角形;的成键电子对数为3,孤电子对数为1,则空间构型为三角锥形;的成键电子对数为4,孤电子对数为0,则空间构型为正四面体;故答案为:直线;角;三角锥;正四面体;
(3)根据等电子原理,与分子具有相似的结构(包括电子式),则电子式为,分子中含有非极性键,故答案为:;含有;
(4)①根据分子的空间结构可知,顺铂的正、负电荷重心不重合,为极性分子,反铂的正、负电荷重心重合,为非极性分子,水分子为极性分子,因而顺铂相对易溶于水,故答案为:顺铂是极性分子,反铂是非极性分子,故顺铂相对易溶于水,反铂难溶于水;
②由于铂原子所连的四个原子或基团两两相同,因而不是手性分子,故答案为:不具有手性。
24. 溶液 1:3 I4O9+2H2O=HIO2+3HIO3 C 2+CH3CH2OH+4H+= 2Cr2O3+2CO2↑+5H2O PH试纸先变成蓝色,然后迅速变为无色 NaClO溶液水解成碱性,生成的HClO具有漂白性 Cl--2e-+2H2O=ClO2↑+4H+
【详解】
(1)①从常见配制方法可知,碘酒是碘的酒精溶液,碘酒属于溶液。②I4O9中碘元素的化合价为+3、+5价,碘酸根中I的化合价为+5价,碘酸根为 1价,则I4O9可写成Im(IO3)n形式,所以前面的I的化合价为+3价,则I4O9化学式为I(IO3)3, I4O9+3价和+5价的碘原子数目之比为1:3,若I4O9溶于水会生成两种含氧酸,则元素化合价不变,故生成的酸为HIO2和HIO3,该过程的化学方程式为:I4O9+2H2O=HIO2+3HIO3。
(2)①a. 将日常饮用的白酒直接蒸馏,会有少量水随酒精一起蒸馏出来,无法得到无水乙醇,加入新制的生石灰吸水再蒸馏可得到无水乙醇,故a错误;b. 医用酒精是75%的酒精,95%的酒精消毒杀菌效果比浓度为75%的酒精差,b错误;c. 表面氧化的铜丝在酒精灯内焰加热时会恢复红色,是因为氧化铜和焰心、内焰处乙醇发生氧化还原反应重新生成了铜,说明酒精具有挥发性和还原性,c正确;d.酒精是易燃物,封闭空间大面积喷洒酒精有易燃易爆的可能,这种做法极其危险,d错误;则说法正确的是c。
②酒驾的检测原理是:乙醇具有还原性,使酸化的K2Cr2O7橙色溶液迅速还原成绿色的Cr2O3,同时生成无色无味气体二氧化碳,该反应的离子方程式为:2+CH3CH2OH+4H+= 2Cr2O3+2CO2↑+5H2O。
(3)“84”消毒液的有效成分是NaClO,是一种强碱弱酸盐,若用PH试纸测量该种市售消毒液的p H,观察到的现象是p H试纸先变成蓝色,然后迅速变为无色,原因是NaClO溶液水解成碱性,生成的HClO具有漂白性。
(4) ClO2可利用电解饱和食盐水的方法制得,则氯元素化合价升高被氧化,在阳极上发生氧化反应,该电极反应方程式为:Cl--2e-+2H2O=ClO2↑+4H+。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法不正确的是( )
A.CH3CH2OH能与水互溶
B.NaClO通过氧化灭活病毒
C.过氧乙酸的摩尔质量为76g·mol-1
D.乙酸与过氧乙酸互为同素异形体
2.下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去SiO2中少量的Al2O3:用稀盐酸洗涤,过滤、洗涤、干燥;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的水:加足量生右灰,蒸馏。
A.①② B.②④ C.③④ D.②③
3.制取CH3CH2Cl最好采用的方法是
A.乙烷和Cl2取代 B.乙烯和Cl2加成
C.乙烯和HCl加成 D.乙烯和H2加成后再与Cl2取代
4.关于乙醇的用途中错误的是
A.配消毒剂 B.制药酒 C.作燃料 D.作麻醉剂
5.有机物M的结构简式为,下列说法正确的是
A.有机物M既能使酸性KMnO4溶液褪色又能使溴水褪色,且反应类型相同
B.与有机物M具有相同的官能团,且不包括M的同分异构体有3种
C.1mol有机物M与足量氢气反应,消耗氢气4mol
D.有机物M能发生取代、加成、氧化、水解等反应
6.将淀粉浆和淀粉酶混合,充分反应后,分别取少量液体与①碘水 ②新制的(加热) ③饱和溶液混合,其现象依次是
A.显蓝色、没有砖红色沉淀产生、有沉淀产生
B.不显蓝色、没有砖红色沉淀产生、有沉淀产生
C.显蓝色、有砖红色沉淀产生、没有沉淀产生
D.不显蓝色、有砖红色沉淀产生、有沉淀产生
7.化学与人类生产、生活,社会可持续发展密切相关,下列说法错误的是
A.酒精可用于杀菌消毒,还可用作食品添加剂
B.我国发射的“天舟三号”使用的光导纤维是一种有机高分子材料
C.三星堆3号坑最新出土了青铜神树残件,青铜属于合金
D.燃煤气化、脱硫、钙基固硫等措施有利于减少的排放
8.已知一组有机物的分子式通式,按某种规律排列成下表
项序 1 2 3 4 5 6 7 ……
通式 C2H4 C2H4O C2H4O2 C3H6 C3H6O C3H6O2 C4H8 ……
各项物质均存在数量不等的同分异构体。其中第12项的异构体中,属于酯类的有(不考虑立体异构)A.8种 B.9种 C.多于9种 D.7种
9.下列说法正确的是
A.按系统命名法,有机物 可命名为3,7-二甲基-4-乙基辛烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C.苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段为的高聚物,其单体是甲醛和苯酚
10.下列物质的应用中,利用了氧化还原反应的是( )
A.用石灰乳脱除烟气中的SO2
B.用84消毒液(有效成分NaClO)杀灭细菌
C.用明矾[KAl(SO4)2 12H2O]处理污水
D.用盐酸去除铁锈(Fe2O3 xH2O)
11.化学与生活、社会、科技发展息息相关,下列化学反应过程不涉及氧化还原反应的是
A.溶洞的形成 B.天然气燃烧 C.植物光合作用 D.火箭发射
A.A B.B C.C D.D
12.节约资源、保护环境,共同守护我们赖以生存的地球是每个人的责任。下列做法值得提倡的是
A.推进垃圾分类处理 B.将秸秆就地焚烧
C.加快开采化石燃料 D.使用含磷洗涤剂
13.下列实验操作、现象和结论都正确且有对应关系的是( )
选项 操作 现象 结论
A 在Fe(NO3)2溶液中滴加硫酸酸化的H2O2 溶液颜色加深 氧化性:H2O2>Fe3+
B 在苯中加入溴水和溴化铁,振荡、静置 水层颜色变浅 溴与苯发生取代反应
C 溶有SO2的BaCl2溶液中通入气体X 有白色沉淀生成 X可能是Cl2
D 在FeS中滴加盐酸,将产生的气体 通入溴水 溴水褪色并产生 黄色沉淀 非金属性:Cl>Br>S
A.A B.B C.C D.D
14.下列说法中正确的一组是
A.H2和D2互为同素异形体
B. 和是氧元素的两种核素,二者互为同位素
C.正丁烷和2-甲基丙烷(异丁烷)互为同系物
D.和 互为同分异构体
二、填空题
15.“酒是陈的香”,酒在存放过程中会产生酯类,以乙醇为例写出酒在存放过程中发生反应的化学方程式,并指明反应类型___。
16.苏丹红一号是一种偶氮染料,不能作为食品添加剂使用。它是以苯胺和2-萘酚为主要原料制备得到的,苏丹红一号和2-萘酚的结构简式如下所示:
(1)苏丹红一号的分子式为___________。
(2)下列化合物A~D中,与2-萘酚互为同系物的是___________(填序号)。
A. B.C.D.
(3)(2)中有机物C含有的官能团是___________。
17.如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置。
请回答:
(1)实验步骤
①__________________________________;
②在各装置中注入相应的试剂(如图所示);
③______________________________;实验时烧瓶中液体混合物逐渐变黑。
(2)能够说明乙烯具有还原性的现象是_________________;装置甲的作用是_________________。若无甲装置,是否也能检验乙烯具有还原性,简述其理由:_________________。
18.(1)①写出纯碱的化学式:___。
②写出乙烯的结构简式:___。
③CH3CH(CH3)CH3的名称为:___。
(2)写出铜与浓硫酸加热条件下反应的化学方程式:___。
19.对于混合物的分离或提纯,常采用的方法有:A过滤、B蒸发、C蒸馏、D萃取、E加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填写字母)
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用________的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)除去乙醇中溶解的微量食盐可采用_______的方法。
(3)粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。对粗盐中的这些杂质可采用________和化学反应的方法除去。
(4)除去氧化钙中的碳酸钙可用________的方法。
20.甲烷是最简单的有机化合物,很早就被人类发现。然而化学家为搞清楚甲烷的结构却用了上百年的时间,期间曾相继提出下列图示来表示甲烷的结构:
请分析以上图示所蕴含的化学信息__________,与同学交流讨论,并对其进行评价,从中体验人类对物质结构认识不断深化的探索历程。
21.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题:
(1)乙烯的电子式为____;结构简式为_____。
(2)鉴别甲烷和乙烯的试剂是_______(填字母)。
A.稀硫酸 B.溴的四氯化碳溶液 C.水 D.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯发生加成反应得到的是_______(填字母)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)写出乙烯生成聚乙烯的化学反应方程式:_______。
22.NA为阿伏加德罗常数的值。下列说法正确的是___________。
A.12g石墨烯和12g金刚石均含有NA个碳原子
B.标准状况下,11.2LCO和H2的混合气体中分子数为0.5NA
C.1mol的CO和N2混合气体中含有的质子数为14NA
D.0.1mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3NA
E.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
F.28g的乙烯和环己烷混合气体中所含原子总数为6NA
G.48g正丁烷和10g异丁烷的混合物中共价键数目为13NA
23.(1)若型分子的中心原子上有一对孤电子对未能成键,当时,其分子的空间结构为______,中心原子的杂化方式为______;当时,其分子的空间结构为______形,中心原子的杂化方式为______。
(2)、、、中,都是以杂化轨道与O成键,则呈______形,_呈_____形,呈______形,呈______形。
(3)“笑气”()是人类最早应用于医疗的麻醉剂之一。
有关理论认为与分子具有相似的结构(包括电子式);又已知分子中氧原子只与一个氮原子相连,则的电子式可表示为______,由此可知它______(填“含有”或“不含”)非极性键。
(4)分子的空间结构是平面正方形。它有两种空间异构体——俗称顺铂和反铂,其结构简式为
①试对顺铂和反铂的水溶性作出预测______。
②分子是否具有手性______?
24.化学工业为疫情防控提供了强有力的物质支撑。常用的消毒剂产品按成分可以分为含氯消毒剂、醇类消毒剂、含碘消毒剂等9种。回答下列问题:
(1)①碘酊又称碘酒,常见配制方法是将一定质量的单质碘溶于适量酒精,再加水稀释。碘酒属于___________。(选填:溶液、胶体、悬浊液、乳浊液)
②I4O9是碘元素最稳定的氧化物之一,已知其中碘元素的化合价为+3、+5价,则I4O9中+3价和+5价的碘原子数目之比为___________,若I4O9溶于水会生成两种含氧酸,写出该过程的化学方程式___________。
(2)乙醇是生活中最常见的醇类消毒剂。
①下列关于乙醇的说法正确的是___________。
a.将日常饮用的白酒直接蒸馏即可得到无水乙醇
b.95%的酒精消毒杀菌效果比浓度为75%的酒精好
c.表面氧化的铜丝在酒精灯内焰加热时会恢复红色,说明酒精具有挥发性和还原性
d.平时生活中,可以采用大面积喷洒酒精的方式对室内等封闭空间消毒
②酒驾的检测原理是乙醇使酸化的K2Cr2O7橙色溶液迅速还原成绿色的Cr2O3,同时生成无色无味气体,写出该反应的离子方程式___________。
(3)“84”消毒液的有效成分是NaClO,某同学用广泛PH试纸测量该种市售消毒液的PH,观察到的现象是___________,造成该现象的原因是___________。
(4)广谱消毒剂ClO2可利用电解饱和食盐水的方法制得,写出该电极反应方程式___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.乙醇分子中有羟基,其与水分子间可以形成氢键,因此乙醇能与水互溶,A说法正确;
B.次氯酸钠具有强氧化性,其能使蛋白质变性,故其能通过氧化灭活病毒,B说法正确;
C.过氧乙酸的分子式为C2H4O3,故其摩尔质量为76g·mol-1,C说法正确;
D.同素异形体是指同种元素形成的不同种单质,而乙酸与过氧乙酸均为化合物,故两者不是同素异形体,D说法错误;
答案选D。
2.B
【详解】①光照条件下乙烷和氯气能发生取代反应,一般用溴水除乙烷中的乙烯,故①错误;
②二氧化硅和盐酸不反应,氧化铝和盐酸反应生成氯化铝和水,用稀盐酸可除去SiO2中少量的Al2O3,故②正确;
③二氧化碳和碳酸钠溶液反应生成碳酸氢钠,一般用通过盛饱和碳酸氢钠溶液的洗气瓶除去CO2中少量的SO2,故③错误;
④乙醇易挥发,氧化钙和水反应生成氢氧化钙,加足量生右灰、蒸馏,可除去乙醇中少量的水,故④正确;
正确的是②④,故选B。
3.C
【详解】A.乙烷与Cl2发生取代反应除生成CH3CH2Cl外,还有二氯乙烷、三氯乙烷等多种取代物生成;
B.乙烯与Cl2发生加成反应生成ClCH2CH2Cl,不能制得CH3CH2Cl;
C.乙烯与HCl发生加成反应生成CH3CH2Cl,原子利用率高,产物纯净;
D.乙烯与H2加成生成CH3CH3,CH3CH3与Cl2发生取代反应除生成CH3CH2Cl外,还有二氯乙烷、三氯乙烷等多种取代物生成;
故最好的方法是乙烯和HCl加成,答案选C。
4.D
【详解】乙醇常用作配消毒剂、制药酒和作燃料;常用乙醚作麻醉剂,故D错误。
综上所述,答案为D。
5.C
【详解】A.分子结构中含有碳碳双键,能与Br2发生加成反应而使溴水褪色,能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色,褪色原理不一样,故A错误;
B.含有苯环、碳碳双键和羧基,其具有相同官能团的同分异构体共有4种,其中乙烯基与羧基在苯环的间位和对位有2种,另外苯环上只有一个取代基为-CH=CHCOOH或-C(COOH)=CH2有2种,故B错误;
C.苯环和碳碳双键均可与H2发生加成反应,则1mol与足量氢气反应,消耗氢气4mol,故C正确;
D.能发生取代、加成、氧化,但不能发生水解反应,故D错误;
故答案为C。
【点睛】以有机物M的结构简式为载体,考查官能团的性质,熟悉常见官能团的性质,进行知识迁移运用,根据有机物结构特点,有碳碳双键决定具有烯烃的性质,有羧基决定具有羧酸的性质,有苯环还具有苯的性质,难点是满足条件的同分异构体的判断。
6.D
【详解】在淀粉酶的作用下,淀粉水解生成葡萄糖,遇碘水不显蓝色;葡萄糖与新制的加热反应产生砖红色沉淀;淀粉酶是一种蛋白质,加入饱和溶液发生盐析,有沉淀产生;故D项正确。
故选D。
7.B
【详解】A.酒精能使蛋白质变性,可用于杀菌消毒,食品厂中可用酒精调味、杀菌,故酒精还可用作食品添加剂,A正确;
B.光导纤维的成分为SiO2,属于无机非金属材料,B错误;
C.青铜是在纯铜中加入锡或铅的合金,C正确;
D.燃煤气化是将煤转化为可燃性气体的过程,主要反应是碳与水蒸气反应生成水煤气等,钙基固硫主要将S元素转化为固态物质CaSO4,故燃煤气化、脱硫、钙基固硫等措施均有利于减少 SO2的排放,D正确;
答案选B。
8.B
【分析】由表中规律可知,3、6、9、12项符合CnH2nO2,由C原子数的变化可知,第12项为C5H10O2,属于酯类物质一定含-COOC-。
【详解】①为甲酸丁酯时,丁基有4种,符合条件的酯有4种;
②为乙酸丙酯时,丙基有2种,符合条件的酯有2种;
③为丙酸乙酯只有1种;
④为丁酸甲酯时,丁酸中-COOH连接丙基,丙基有2种,符合条件的酯有2种,
属于酯类的有4+2+1+2=9种,
故选:B。
9.D
【详解】A.的命名中,取代基的编号之和不是最小的,应该从左端开始给主链上C原子编号,正确命名为2,6-二甲基-5-乙基辛烷,A错误;
B. 苯C6H6燃烧消耗O2的物质的量n=)mol=1.5 mol,即1 mol苯消耗氧气7.5 mol,苯甲酸(C6H5-COOH)的n=(7+)mol=7.5 mol,即1 mol苯甲酸消耗氧气7.5 mol,所以等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等,B错误;
C. 苯和甲苯互为同系物,但苯不能使KMnO4酸性溶液褪色,C错误;
D. 苯酚和甲醛发生缩聚反应得到酚醛树酯,结构片段为,D正确;
故合理选项是D。
10.B
【详解】A.SO2是酸性氧化物,可与碱反应,用石灰乳脱除烟气中的SO2时,SO2与氢氧化钙反应生成亚硫酸钙或亚硫酸氢钙,反应过程中无元素的化合价变化,没有利用氧化还原反应,故A错误;
B.用84消毒液有效成分NaClO,具有强氧化性,能使蛋白质发生变性从而杀死细菌病毒,杀菌消毒的过程利用了氧化还原反应,故B正确;
C.用明矾[KAl(SO4)2 12H2O]溶于水中,电离出的铝离子发生水解生成氢氧化铝胶体,利用胶体的吸附性可吸附污水中的固体颗粒物,该过程利用胶体的吸附性,发生的反应没有发生化合价变化,没有利用氧化还原反应,故C错误;
D.用盐酸去除铁锈(主要成分Fe2O3 xH2O),发生的主要反应为:6HCl+Fe2O3=2FeCl3+3H2O,反应中没有元素化合价的变化,没有利用氧化还原反应,故D错误;
故答案为B。
11.A
【详解】A.溶洞形成时,发生反应CaCO3+CO2+H2O=Ca(HCO3)2,此反应为非氧化还原反应,A符合题意;
B.天然气燃烧时,发生反应CH4+2O2CO2+2H2O,此反应为氧化还原反应,B不符合题意;
C.植物光合作用时,发生反应6CO2+6H2OC6H12O6+6O2,此反应为氧化还原反应,C不符合题意;
D.火箭发射时,火箭燃料发生燃烧,发生氧化还原反应,同时放出能量,D不符合题意;
故选A。
12.A
【详解】A. 推进垃圾分类处理,可健全再生资源回收利用网络,节能环保,故A正确;
B. 就地焚烧秸秆会产生有害气体,污染空气,故B错误;
C. 加快开采化石燃料会造成大量空气污染物排放,故C错误;
D. 使用含磷洗涤剂会造成水体富营养化,故D错误;
故答案为A。
13.C
【分析】
【详解】
A.在Fe(NO3)2溶液中滴加酸化的H2O2,由于酸性条件下硝酸根离子具有强氧化性,能够氧化亚铁离子,干扰了检验结果,因此无法判断H2O2与Fe3+的氧化性强弱,故A不符合题意;
B.该过程是发生了萃取导致水层颜色变浅,并不是发生了取代反应,故B不符合题意;
C.通入的气体X具有氧化性或碱性,能够将该溶液中的H2SO3氧化为H2SO4或生成亚硫酸盐,SO32-或SO42-与Ba2+发生反应生成白色沉淀,Cl2具有氧化性,满足题意,故C符合题意;
D.该过程中发生的反应依次为:FeS+2HCl=FeCl2+H2S↑、H2S+Br2=S↓+2HBr,前者能够证明酸性:HCl>H2S,但其并非是该元素对应最高价氧化物对应水化物,因此无法判断元素的非金属性强弱关系,后者反应说明氧化性:Br2>S,能够说明非金属性:Br>S,故D不符合题意;
答案为C。
14.B
【详解】A.由同种元素形成的不同单质互为同素异形体,如金刚石和石墨都是由碳元素形成的,二者互为同素异形体,但H2和D2都是由两个氢原子构成的氢分子,二者不互为同素异形体,故A错误;
B.质子数相同中子数不同的同一元素的不同原子互称为同位素, 和质子数都是8,中子数分别为8、10,二者互为同位素,故B正确;
C.正丁烷和2-甲基丙烷的分子式相同,结构不同,所以互为同分异构体,不互为同系物,故C错误;
D. 和 分子式不相同,分子式相差一个CH2,所以互为同系物,故D错误;
答案选B。
15.C2H5OH+O2CH3COOH+H2O,氧化反应;C2H5OH+CH3COOHCH3COOC2H5+H2O,酯化反应(或取代反应)
【详解】酒在存放过程中,乙醇被氧化为乙酸,发生氧化反应:C2H5OH+O2CH3COOH+H2O;乙酸与乙醇发生酯化反应(或取代反应)生成乙酸乙酯和水,反应的化学方程式为C2H5OH+CH3COOHCH3COOC2H5+H2O。
16. B 碳碳双键、醛基
【详解】(1)根据苏丹红一号的结构简式可以推出苏丹红一号的分子式是;
(2)根据2-萘酚与各物质的结构简式可判断出只有B与2-萘酚结构相似且分子组成相差一个原子团,答案选B;
(3)(2)中有机物C含有的官能团是碳碳双键、醛基。
17. 组装仪器,检验装置的气密性 加热,使温度迅速升到170℃ 乙中酸性KMnO4溶液紫色褪去 除去乙烯中混有的SO2、CO2等酸性气体 不能,因SO2具有还原性,也可以使酸性KMnO4溶液褪色
【详解】(1)①制取气体的装置气密性必须良好,实验前需要检验装置的气密性。
②实验室制乙烯时应使反应混合物的温度迅速升到170℃,而减少乙醚的生成。
(2)乙烯具有还原性是根据氧化剂酸性KMnO4溶液褪色来判断的。由于烧瓶中混合物变黑,则说明生成了碳,联想浓H2SO2具有强氧化性,可知在乙烯中含有还原性气体SO2,由于SO2也会使酸性KMnO4溶液褪色,会干扰验证乙烯的还原性,所以检验乙烯的还原性前必须除净SO2,则装置甲的作用是除去SO2。
18. Na2CO3 CH2=CH2 2-甲基丙烷或为异丁烷 C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
【详解】(1)①碳酸钠的俗称纯碱,化学式为Na2CO3;
②乙烯属于不饱和烯烃,分子式为C2H4,结构中含有碳碳双键,结构简式:CH2=CH2;
③CH3CH(CH3)CH3属于烷烃,主碳链为3个碳,甲基在2号碳上,为2-甲基丙烷或为异丁烷;
(2)铜与浓硫酸加热条件下反应生成硫酸铜、二氧化硫和水,反应的化学方程式:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。
19. A C A E
【详解】(1)根据CaCO3的溶解性,是不溶于水的物质,要和石灰水分离,可以采用过滤的方法,答案选A;(2)根据乙醇易挥发,除去乙醇中溶解的微量食盐可采用蒸馏的方法,将乙醇蒸馏出来,答案选C;(3)过滤可除去不溶性杂质,粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。对粗盐中的这些杂质可采用过滤和化学反应的方法除去,答案选A;(4)碳酸钙受热分解为氧化钙、二氧化碳,而氧化钙受热稳定,故可以用加热分解法来分离,答案选E。
点睛:本题考查混合物分离提纯方法的选择和应用,为高频考点,把握物质的性质及性质差异为解答的关键,侧重物质性质及混合物分离原理的考查。
20.第一个表示的甲烷的组成与结构是错误的;第二个只能表示出甲烷的组成,没有体现结构;第三个体现了组成和结构,但平面的结构是错误的;第四个结构是体现了组成和化学键,但空间结构仍没有体现出来;第五个体现了甲烷的组成和空间结构,是甲烷结构的正确表示(合理即可)
【详解】从这一组图可以知道:科学家对甲烷结构的认识过程经历了由表及里、由定性到定量、由平面对立体的过程:第一个表示的甲烷的组成与结构是错误的;第二个只能表示出甲烷的组成,没有体现结构;第三个体现了组成和结构,但平面的结构是错误的;第四个结构是体现了组成和化学键,但空间结构仍没有体现出来;第五个体现了甲烷的组成和空间结构,是甲烷结构的正确表示(合理即可)
21. CH2=CH2 BD ACD nCH2=CH2
【详解】(1)乙烯分子式为C2H4,该分子中碳原子之间形成2对共用电子对,碳原子与氢原子之间形成1对共用电子对,其电子式为,结构简式为CH2=CH2;答案为,CH2=CH2。
(2)甲烷与乙烯均不与硫酸反应,均不溶于水,但乙烯含有碳碳双键,可与溴的四氯化碳溶液发生加成反应而使溴的四氯化碳溶液褪色;也被酸性高锰酸钾发生氧化而使高锰酸钾溶液褪色;甲烷性质稳定,与溴的四氯化碳溶液和酸性高锰酸钾溶液都不反应,可以用溴的四氯化碳溶液水、酸性高锰酸钾溶液鉴别甲烷与乙烯;答案为BD。
(3)乙烯与氢气加成生成乙烷,即CH2=CH2+H2CH3CH3,乙烯与水加成生成乙醇,即CH2=CH2+H2OCH3CH2OH,乙烯与溴化氢发生加成生成溴乙烷,即CH2=CH2+HBrCH3CH2Br,但是无法通过加成反应获得CH3CHCl2;答案为ACD。
(4)乙烯通过加聚反应生成聚乙烯,故其反应的化学方程式为nCH2=CH2。
22.ABCDEFG
【详解】石墨烯和金刚石均为碳单质,12g石墨烯和12g金刚石均相当于12g碳原子,即n(C)==1molC原子,所含碳原子数目为NA,故A正确;标准状况下,11.2LCO和H2的混合气体为0.5mol,分子数为0.5NA,选项B正确;1molCO含有质子物质的量为(6+8)mol=14mol,1molN2中含有质子物质的量为2×7mol=14mol,因此1molN2和CO的混合气体中含有质子物质的量为14mol,故C正确;1mol乙醇或乙烯完全燃烧消耗的氧气都为3mol,0.1mol混合气体(任意比例混合)完全燃烧消耗氧气为0.3mol,故D正确;甲烷和乙烯的分子式分别为CH4和C2H4,因此混合物中氢原子的平均值为4,故标准状况下,11.2L二者的混合气体的物质的量为0.5mol,含有的氢原子数为2NA,故E正确;乙烯和环己烷的最简式相同,都是CH2,所以28g乙烯和环己烷混合气体相当于28gCH2,其物质的量为2mol,含有的原子的物质的量为3×2mol=6mol,即所含原子总数为6NA,故F正确;正丁烷与异丁烷的分子式相同(为C4H10),1个分子内所含共价键数目均为13个(10个C-H键和3个C-C键),则48g正丁烷与10g异丁烷所得的混合物中共价键数目为×13×NAmol-1=NA,G项正确;综上所述,正确答案为ABCDEFG。
23. 角形 三角锥 直线 角 三角锥 正四面体 含有 顺铂是极性分子,反铂是非极性分子,故顺铂相对易溶于水,反铂难溶于水 不具有手性
【详解】(1)若型分子的中心原子A上有一对孤电子对未能成键,则分子的空间结构将会发生变化。当时,中心原子的价电子对数为3,因此是杂化,分子的空间结构为角形;当时,中心原子的价电子对数为4,因此是杂化,分子的空间结构为三角锥形;故答案为:角形;;;三角形;
(2)由题意知,都是以杂化轨道与O成键,杂化轨道的空间结构为正四面体形,的成键电子对数为1,孤电子对数为3,则空间构型为直线形;的成键电子对数为2,孤电子对数为2,则空间构型为角形;的成键电子对数为3,孤电子对数为1,则空间构型为三角锥形;的成键电子对数为4,孤电子对数为0,则空间构型为正四面体;故答案为:直线;角;三角锥;正四面体;
(3)根据等电子原理,与分子具有相似的结构(包括电子式),则电子式为,分子中含有非极性键,故答案为:;含有;
(4)①根据分子的空间结构可知,顺铂的正、负电荷重心不重合,为极性分子,反铂的正、负电荷重心重合,为非极性分子,水分子为极性分子,因而顺铂相对易溶于水,故答案为:顺铂是极性分子,反铂是非极性分子,故顺铂相对易溶于水,反铂难溶于水;
②由于铂原子所连的四个原子或基团两两相同,因而不是手性分子,故答案为:不具有手性。
24. 溶液 1:3 I4O9+2H2O=HIO2+3HIO3 C 2+CH3CH2OH+4H+= 2Cr2O3+2CO2↑+5H2O PH试纸先变成蓝色,然后迅速变为无色 NaClO溶液水解成碱性,生成的HClO具有漂白性 Cl--2e-+2H2O=ClO2↑+4H+
【详解】
(1)①从常见配制方法可知,碘酒是碘的酒精溶液,碘酒属于溶液。②I4O9中碘元素的化合价为+3、+5价,碘酸根中I的化合价为+5价,碘酸根为 1价,则I4O9可写成Im(IO3)n形式,所以前面的I的化合价为+3价,则I4O9化学式为I(IO3)3, I4O9+3价和+5价的碘原子数目之比为1:3,若I4O9溶于水会生成两种含氧酸,则元素化合价不变,故生成的酸为HIO2和HIO3,该过程的化学方程式为:I4O9+2H2O=HIO2+3HIO3。
(2)①a. 将日常饮用的白酒直接蒸馏,会有少量水随酒精一起蒸馏出来,无法得到无水乙醇,加入新制的生石灰吸水再蒸馏可得到无水乙醇,故a错误;b. 医用酒精是75%的酒精,95%的酒精消毒杀菌效果比浓度为75%的酒精差,b错误;c. 表面氧化的铜丝在酒精灯内焰加热时会恢复红色,是因为氧化铜和焰心、内焰处乙醇发生氧化还原反应重新生成了铜,说明酒精具有挥发性和还原性,c正确;d.酒精是易燃物,封闭空间大面积喷洒酒精有易燃易爆的可能,这种做法极其危险,d错误;则说法正确的是c。
②酒驾的检测原理是:乙醇具有还原性,使酸化的K2Cr2O7橙色溶液迅速还原成绿色的Cr2O3,同时生成无色无味气体二氧化碳,该反应的离子方程式为:2+CH3CH2OH+4H+= 2Cr2O3+2CO2↑+5H2O。
(3)“84”消毒液的有效成分是NaClO,是一种强碱弱酸盐,若用PH试纸测量该种市售消毒液的p H,观察到的现象是p H试纸先变成蓝色,然后迅速变为无色,原因是NaClO溶液水解成碱性,生成的HClO具有漂白性。
(4) ClO2可利用电解饱和食盐水的方法制得,则氯元素化合价升高被氧化,在阳极上发生氧化反应,该电极反应方程式为:Cl--2e-+2H2O=ClO2↑+4H+。
答案第1页,共2页
答案第1页,共2页
