化学人教版(2019)选择性必修1 2.2.3 活化能(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.2.3 活化能(共20张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 14.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-17 09:58:50 | ||
图片预览





文档简介
(共20张PPT)
第二章 化学反应速率和化学平衡
2.1 化学反应速率
人教版 选修1
第三课时
活化能
1. 了解活化能、活化分子的概念;
2. 运用简单碰撞理论和活化分子等知识解释外界条件对化学反应速率的影响。
活化能
一
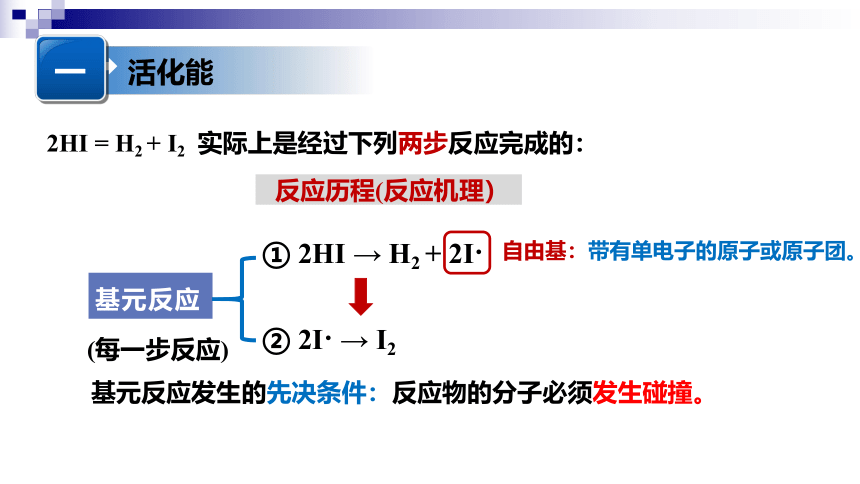
基元反应
2HI = H2 + I2 实际上是经过下列两步反应完成的:
① 2HI → H2 + 2I
② 2I → I2
自由基:带有单电子的原子或原子团。
(每一步反应)
反应历程(反应机理)
基元反应发生的先决条件:反应物的分子必须发生碰撞。
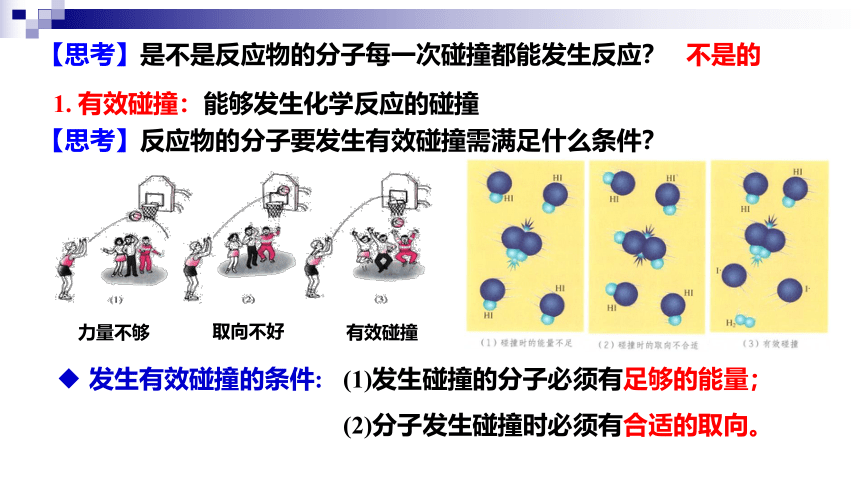
【思考】是不是反应物的分子每一次碰撞都能发生反应?
不是的
1. 有效碰撞:能够发生化学反应的碰撞
力量不够
取向不好
有效碰撞
【思考】反应物的分子要发生有效碰撞需满足什么条件?
发生有效碰撞的条件:
(1)发生碰撞的分子必须有足够的能量;
(2)分子发生碰撞时必须有合适的取向。
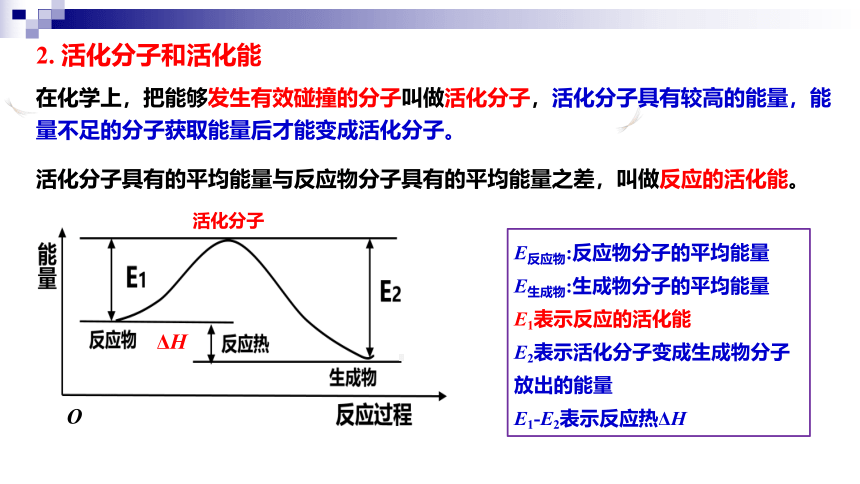
活化分子
ΔH
O
在化学上,把能够发生有效碰撞的分子叫做活化分子,活化分子具有较高的能量,能量不足的分子获取能量后才能变成活化分子。
活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。
E反应物:反应物分子的平均能量
E生成物:生成物分子的平均能量
E1表示反应的活化能
E2表示活化分子变成生成物分子
放出的能量
E1-E2表示反应热ΔH
2. 活化分子和活化能
③有效碰撞的次数与单位体积内反应物中活化分子的数目有关。
3. 化学反应历程
普通分子
发生反应
活化分子
吸收能量
(活化能)
有效碰撞
合适取向
注意:
①能发生有效碰撞的分子一定是活化分子;
②活化分子的碰撞不一定是有效碰撞;(由于取向问题)
■化学反应速率与单位时间内分子间有效碰撞次数(有效碰撞频率)有关
【思考与讨论】
请尝试用碰撞理论解释:
1. 当其他条件相同时,为什么增大反应物的浓度会使化学反应速率增大,而降低反应物的浓度会使化学反应速率减小?
2. 当其他条件相同时,为什么升高温度会使化学反应速率增大,而降低温度会使化学反应速率减小?
3. 催化剂如何改变反应速率?
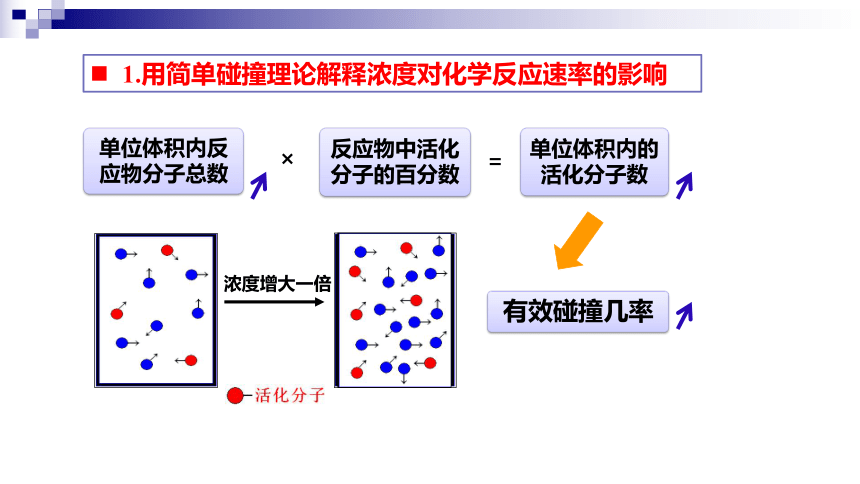
1.用简单碰撞理论解释浓度对化学反应速率的影响
单位体积内反应物分子总数
×
反应物中活化分子的百分数
=
单位体积内的
活化分子数
有效碰撞几率
浓度增大一倍
注意:
1. 此规律只适用于气体或溶液的反应,对于纯固体或液体的反应物,一般情况下其浓度是常数,改变它们的用量不会改变化学反应速率。
2. 若随着浓度的改变,物质的本质发生了变化,反应速率的含义也将不同,如:浓硫酸与铁的反应。
其他条件相同时,增大反应物浓度,单位体积内活化分子数目增多,单位体积内活化分子百分数不变,单位时间内有效碰撞次数增多,化学反应速率增大。
其他条件相同时,增大反应体系压强,相当于增大反应物浓度,单位体积内活化分子数目增多,单位体积内活化分子百分数不变,单位时间内有效碰撞次数增多,化学反应速率增大。
2.用简单碰撞理论解释压强对化学反应速率的影响
体积缩小
注意:
1. 压强影响,只适用于讨论有气体参加的反应,若压强变化能引起参与反应物质的浓度发生变化时,化学反应速率才能发生变化
2. 注意“真”变和“假”变:若体系的压强变化而使反应物或生成物的浓度发生变化即“真”变,否则是“假”变。
a. 恒压时充入He:由于SO2、O2、SO3的物质的量不变,体积V变大,浓度降低相当于“减压”,反应速率降低。
b. 恒容时充入He:由于反应物、生成物浓度不变,反应体系压强不变相当于“假”变。
如: 2SO2+O2 2SO3
3.用简单碰撞理论解释温度对化学反应速率的影响
有效碰撞几率
碰撞频率
升高温度
单位体积内反应物分子总数
×
反应物中活化分子的百分数
=
单位体积内的
活化分子数
其他条件相同时,升高温度,单位体积内活化分子数目增多,单位体积内活化分子百分数增多,单位时间内有效碰撞次数增多,化学反应速率增大。
注意:
(1) 反应若是可逆反应,升高温度,正、逆反应速率都加快,降低温度,正、逆反应速率都减小。
(2) 一般,温度每升高10℃,化学反应速率增大2~4倍。
其他条件相同时,使用催化剂,改变反应历程,降低反应活化能,单位体积内活化分子数目增多,单位体积内活化分子百分数增多,单位时间内有效碰撞次数增多,化学反应速率增大。
4.用简单碰撞理论解释催化剂对化学反应速率的影响
未使用催化剂时:反应的活化能为Ea
使用催化剂K后,反应分两步
第一步:活化能为Eal
第二步:活化能为Ea2
这两个分步反应的活化能都比原来的Ea要小,因此反应速率加快。
又因为Ea1>Ea2,所以第一步是慢反应,第二步是快反应。而整个反应的速率是由慢反应决定的,也叫“决速步骤”。所以第一步的活化能Eal 就是在催化剂条件下整个反应的活化能。
注意:
(1) 催化剂只能改变反应速率,不能改变反应方向,反应热没变。
(2) 对于可逆反应,同一催化剂能同等程度的改变正、逆化学反应的速率。
(3) 催化剂有一定的选择性和活化温度。
1. 下列说法错误的是( )
①碰撞理论认为,反应物分子间进行碰撞才可能发生化学反应
②活化分子间的碰撞一定是有效碰撞
③催化剂加快反应速率的本质是降低了反应的活化能
④只有增加活化分子的百分含量才能加快反应速率
⑤对于基元反应而言,温度升高,反应速率一定增加
A. ①④ B. ②④ C. ③⑤ D. ②⑤
B
2. 能改变反应物分子中活化分子百分数的条件是( )
①浓度 ②压强 ③温度 ④催化剂
A. ①③ B. ②④ C. ③④ D. ①②③④
C
外界条件对反应速率的影响
条件 变化 活化分子百分数 单位体积内 单位时间内有效碰撞次数 化学反应速率
分子总数 活化分子数目 浓度 增大
压强 增大
温度 升高
催化剂 使用
不变 增加 增加 增加 加快
不变 增加 增加 增加 加快
增加 不变 增加 增加 加快
增加 不变 增加 增加 加快
【归纳小结】
本课时结束
人教版 选修1
第二章 化学反应速率和化学平衡
2.1 化学反应速率
人教版 选修1
第三课时
活化能
1. 了解活化能、活化分子的概念;
2. 运用简单碰撞理论和活化分子等知识解释外界条件对化学反应速率的影响。
活化能
一
基元反应
2HI = H2 + I2 实际上是经过下列两步反应完成的:
① 2HI → H2 + 2I
② 2I → I2
自由基:带有单电子的原子或原子团。
(每一步反应)
反应历程(反应机理)
基元反应发生的先决条件:反应物的分子必须发生碰撞。
【思考】是不是反应物的分子每一次碰撞都能发生反应?
不是的
1. 有效碰撞:能够发生化学反应的碰撞
力量不够
取向不好
有效碰撞
【思考】反应物的分子要发生有效碰撞需满足什么条件?
发生有效碰撞的条件:
(1)发生碰撞的分子必须有足够的能量;
(2)分子发生碰撞时必须有合适的取向。
活化分子
ΔH
O
在化学上,把能够发生有效碰撞的分子叫做活化分子,活化分子具有较高的能量,能量不足的分子获取能量后才能变成活化分子。
活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。
E反应物:反应物分子的平均能量
E生成物:生成物分子的平均能量
E1表示反应的活化能
E2表示活化分子变成生成物分子
放出的能量
E1-E2表示反应热ΔH
2. 活化分子和活化能
③有效碰撞的次数与单位体积内反应物中活化分子的数目有关。
3. 化学反应历程
普通分子
发生反应
活化分子
吸收能量
(活化能)
有效碰撞
合适取向
注意:
①能发生有效碰撞的分子一定是活化分子;
②活化分子的碰撞不一定是有效碰撞;(由于取向问题)
■化学反应速率与单位时间内分子间有效碰撞次数(有效碰撞频率)有关
【思考与讨论】
请尝试用碰撞理论解释:
1. 当其他条件相同时,为什么增大反应物的浓度会使化学反应速率增大,而降低反应物的浓度会使化学反应速率减小?
2. 当其他条件相同时,为什么升高温度会使化学反应速率增大,而降低温度会使化学反应速率减小?
3. 催化剂如何改变反应速率?
1.用简单碰撞理论解释浓度对化学反应速率的影响
单位体积内反应物分子总数
×
反应物中活化分子的百分数
=
单位体积内的
活化分子数
有效碰撞几率
浓度增大一倍
注意:
1. 此规律只适用于气体或溶液的反应,对于纯固体或液体的反应物,一般情况下其浓度是常数,改变它们的用量不会改变化学反应速率。
2. 若随着浓度的改变,物质的本质发生了变化,反应速率的含义也将不同,如:浓硫酸与铁的反应。
其他条件相同时,增大反应物浓度,单位体积内活化分子数目增多,单位体积内活化分子百分数不变,单位时间内有效碰撞次数增多,化学反应速率增大。
其他条件相同时,增大反应体系压强,相当于增大反应物浓度,单位体积内活化分子数目增多,单位体积内活化分子百分数不变,单位时间内有效碰撞次数增多,化学反应速率增大。
2.用简单碰撞理论解释压强对化学反应速率的影响
体积缩小
注意:
1. 压强影响,只适用于讨论有气体参加的反应,若压强变化能引起参与反应物质的浓度发生变化时,化学反应速率才能发生变化
2. 注意“真”变和“假”变:若体系的压强变化而使反应物或生成物的浓度发生变化即“真”变,否则是“假”变。
a. 恒压时充入He:由于SO2、O2、SO3的物质的量不变,体积V变大,浓度降低相当于“减压”,反应速率降低。
b. 恒容时充入He:由于反应物、生成物浓度不变,反应体系压强不变相当于“假”变。
如: 2SO2+O2 2SO3
3.用简单碰撞理论解释温度对化学反应速率的影响
有效碰撞几率
碰撞频率
升高温度
单位体积内反应物分子总数
×
反应物中活化分子的百分数
=
单位体积内的
活化分子数
其他条件相同时,升高温度,单位体积内活化分子数目增多,单位体积内活化分子百分数增多,单位时间内有效碰撞次数增多,化学反应速率增大。
注意:
(1) 反应若是可逆反应,升高温度,正、逆反应速率都加快,降低温度,正、逆反应速率都减小。
(2) 一般,温度每升高10℃,化学反应速率增大2~4倍。
其他条件相同时,使用催化剂,改变反应历程,降低反应活化能,单位体积内活化分子数目增多,单位体积内活化分子百分数增多,单位时间内有效碰撞次数增多,化学反应速率增大。
4.用简单碰撞理论解释催化剂对化学反应速率的影响
未使用催化剂时:反应的活化能为Ea
使用催化剂K后,反应分两步
第一步:活化能为Eal
第二步:活化能为Ea2
这两个分步反应的活化能都比原来的Ea要小,因此反应速率加快。
又因为Ea1>Ea2,所以第一步是慢反应,第二步是快反应。而整个反应的速率是由慢反应决定的,也叫“决速步骤”。所以第一步的活化能Eal 就是在催化剂条件下整个反应的活化能。
注意:
(1) 催化剂只能改变反应速率,不能改变反应方向,反应热没变。
(2) 对于可逆反应,同一催化剂能同等程度的改变正、逆化学反应的速率。
(3) 催化剂有一定的选择性和活化温度。
1. 下列说法错误的是( )
①碰撞理论认为,反应物分子间进行碰撞才可能发生化学反应
②活化分子间的碰撞一定是有效碰撞
③催化剂加快反应速率的本质是降低了反应的活化能
④只有增加活化分子的百分含量才能加快反应速率
⑤对于基元反应而言,温度升高,反应速率一定增加
A. ①④ B. ②④ C. ③⑤ D. ②⑤
B
2. 能改变反应物分子中活化分子百分数的条件是( )
①浓度 ②压强 ③温度 ④催化剂
A. ①③ B. ②④ C. ③④ D. ①②③④
C
外界条件对反应速率的影响
条件 变化 活化分子百分数 单位体积内 单位时间内有效碰撞次数 化学反应速率
分子总数 活化分子数目 浓度 增大
压强 增大
温度 升高
催化剂 使用
不变 增加 增加 增加 加快
不变 增加 增加 增加 加快
增加 不变 增加 增加 加快
增加 不变 增加 增加 加快
【归纳小结】
本课时结束
人教版 选修1
