化学人教版(2019)选择性必修3 2.2.1 烯烃的结构与性质、立体异构 课件(共38张PPT含视频)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 2.2.1 烯烃的结构与性质、立体异构 课件(共38张PPT含视频) |  | |
| 格式 | zip | ||
| 文件大小 | 25.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-17 16:45:16 | ||
图片预览




文档简介
(共38张PPT)
网
科
第二节 烯烃 炔烃
1. 结合代表物,认识烯烃的组成和结构特点。
2.了解烯烃物理性质的变化规律,掌握烯烃的化学性质及应用。
3.了解二烯烃的加成、加聚反应及烯烃的顺反异构。
第二章 烃
2.2.1 烯烃的结构和性质、立体异构
教材内容:P32-34
学习目标
自然界里存在许多烯烃,如番茄中的番茄红素、鲨鱼油中的角鲨烯都是烯烃。
番茄中存在番茄红素
乙烯的产量则是衡量国家石油化工水平的重要标志
乙烯是常见的烯烃。
新冠疫情爆发之初,口罩一度成为畅销品,甚至脱销,N95口罩成了抗疫“明星”,
丙烯是制造N95口罩的原料之一。
新课导入
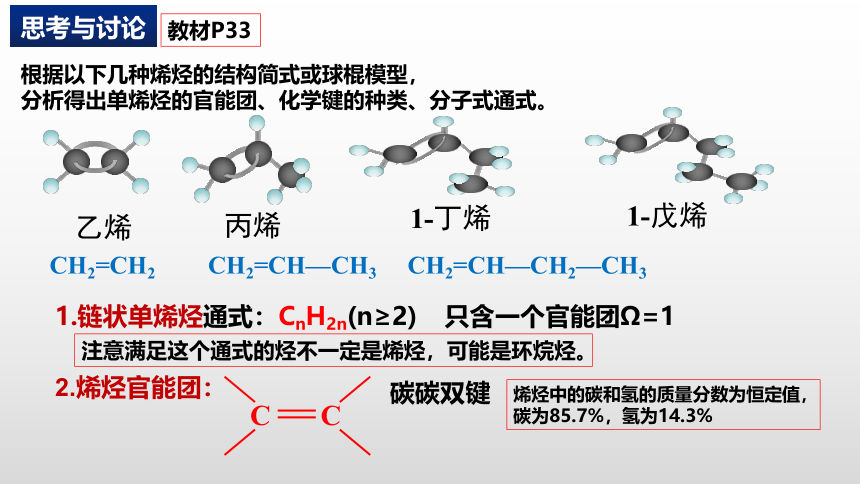
乙烯
丙烯
1-丁烯
1-戊烯
根据以下几种烯烃的结构简式或球棍模型,
分析得出单烯烃的官能团、化学键的种类、分子式通式。
C C
1.链状单烯烃通式:CnH2n(n≥2) 只含一个官能团Ω=1
CH2=CH2
CH2=CH—CH3
CH2=CH—CH2—CH3
2.烯烃官能团:
碳碳双键
烯烃中的碳和氢的质量分数为恒定值,碳为85.7%,氢为14.3%
注意满足这个通式的烃不一定是烯烃,可能是环烷烃。
教材P33
思考与讨论
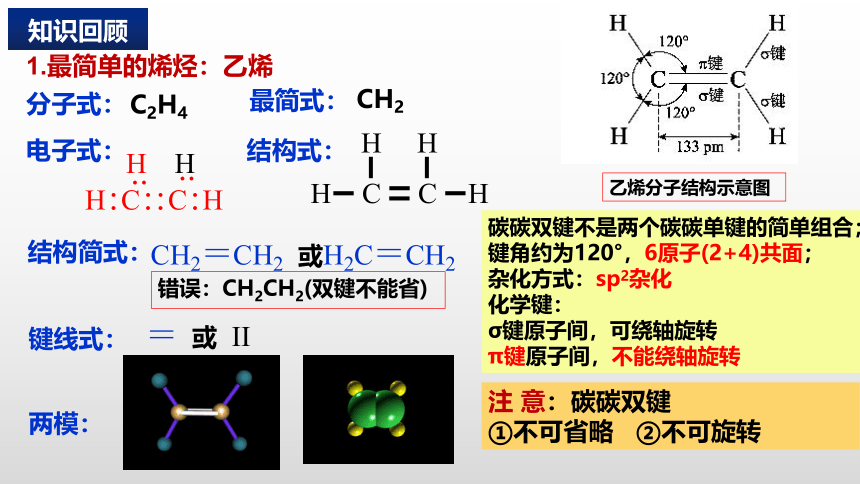
乙烯分子结构示意图
1.最简单的烯烃:乙烯
分子式:
电子式:
结构式:
结构简式:
C2H4
H
H
..
H : C : : C : H
..
C
C
H
H
H
H
CH2=CH2 或H2C=CH2
最简式:
CH2
键线式:
= 或 II
两模:
碳碳双键不是两个碳碳单键的简单组合;
键角约为120°,6原子(2+4)共面;
杂化方式:sp2杂化
化学键:
σ键原子间,可绕轴旋转
π键原子间,不能绕轴旋转
错误:CH2CH2(双键不能省)
注 意:碳碳双键
①不可省略 ②不可旋转
知识回顾
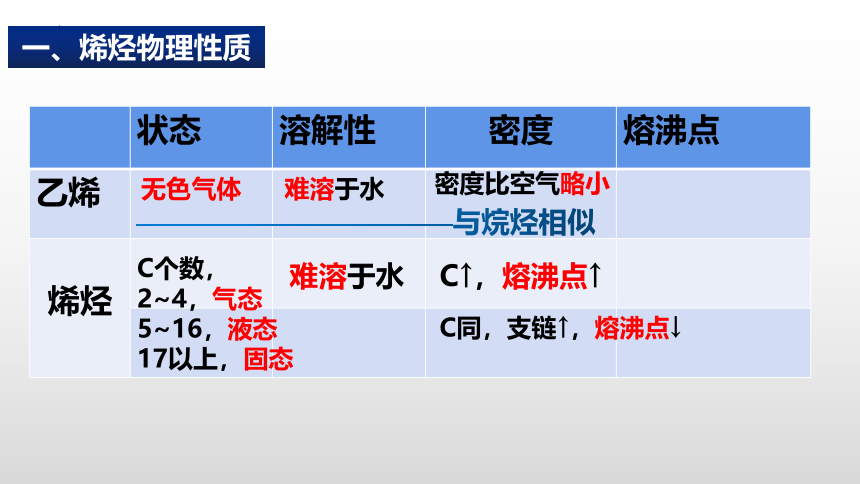
状态 溶解性 密度 熔沸点
乙烯
烯烃
难溶于水
密度比空气略小
无色气体
———————————与烷烃相似
难溶于水
C↑,熔沸点↑
C同,支链↑,熔沸点↓
C个数,
2~4,气态
5~16,液态
17以上,固态
一、烯烃物理性质
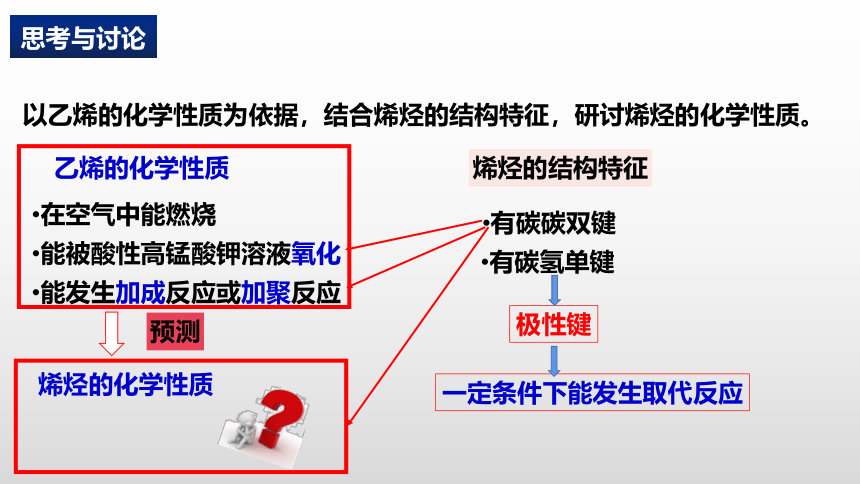
以乙烯的化学性质为依据,结合烯烃的结构特征,研讨烯烃的化学性质。
乙烯的化学性质
在空气中能燃烧
能被酸性高锰酸钾溶液氧化
能发生加成反应或加聚反应
烯烃的结构特征
有碳碳双键
有碳氢单键
一定条件下能发生取代反应
极性键
烯烃的化学性质
预测
思考与讨论
CH4
C2H4
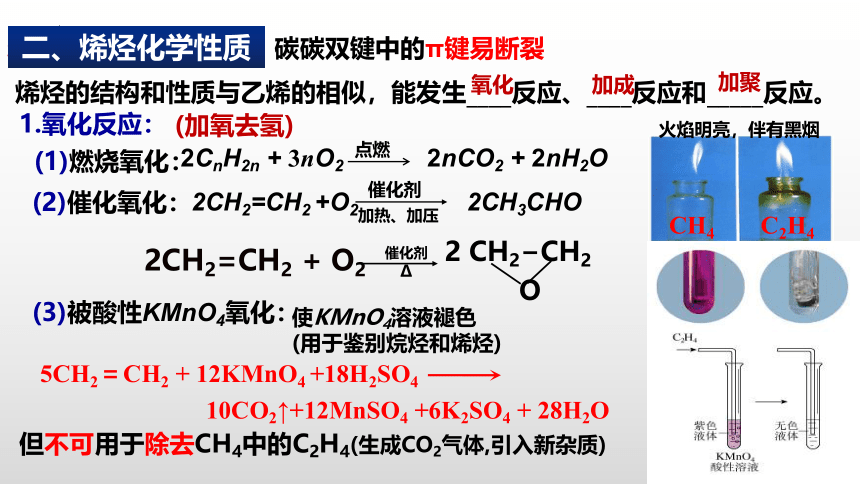
3.烯烃的化学性质:
碳碳双键中的π键易断裂
烯烃的结构和性质与乙烯的相似,能发生____反应、____反应和_____反应。
加成
氧化
加聚
1.氧化反应:
(1)燃烧氧化:
(2)催化氧化:
(3)被酸性KMnO4氧化:
2CH2=CH2 +O2 2CH3CHO
催化剂
加热、加压
使KMnO4溶液褪色
(用于鉴别烷烃和烯烃)
2CnH2n + 3nO2 2nCO2 + 2nH2O
点燃
(加氧去氢)
火焰明亮,伴有黑烟
5CH2=CH2 + 12KMnO4 +18H2SO4
10CO2↑+12MnSO4 +6K2SO4 + 28H2O
2CH2=CH2 + O2
催化剂
2 CH2 CH2
O
但不可用于除去CH4中的C2H4(生成CO2气体,引入新杂质)
二、烯烃化学性质
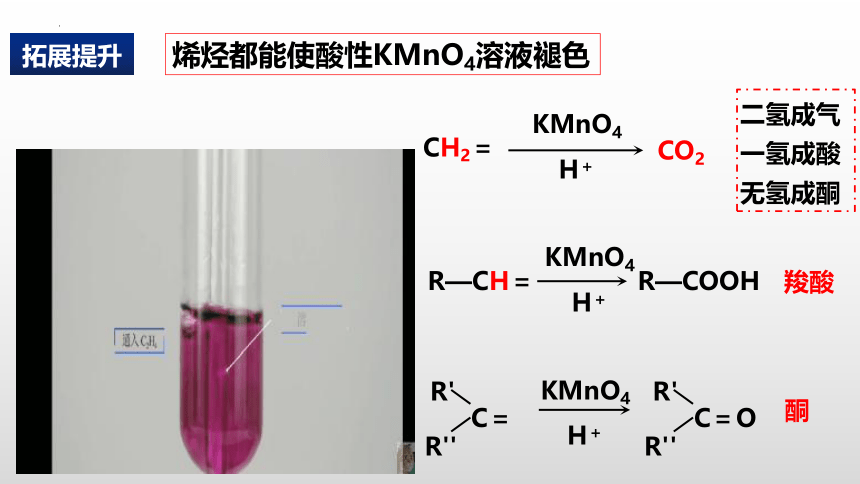
CH2=
CO2
KMnO4
H+
KMnO4
H+
C=O
R'
R''
C=
R'
R''
酮
R—CH=
R—COOH
KMnO4
H+
羧酸
烯烃都能使酸性KMnO4溶液褪色
二氢成气
一氢成酸
无氢成酮
拓展提升
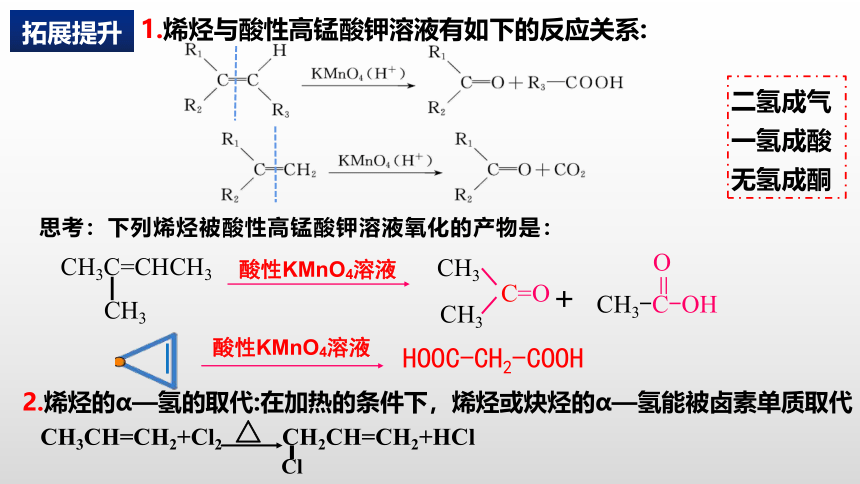
1.烯烃与酸性高锰酸钾溶液有如下的反应关系:
思考:下列烯烃被酸性高锰酸钾溶液氧化的产物是:
二氢成气
一氢成酸
无氢成酮
酸性KMnO4溶液
CH3C=CHCH3
▏
CH3
CH3-C-OH
=
O
CH3
C=O
CH3
+
酸性KMnO4溶液
HOOC-CH2-COOH
2.烯烃的α—氢的取代:在加热的条件下,烯烃或炔烃的α—氢能被卤素单质取代
CH3CH=CH2+Cl2 CH2CH=CH2+HCl
△
拓展提升
Cl
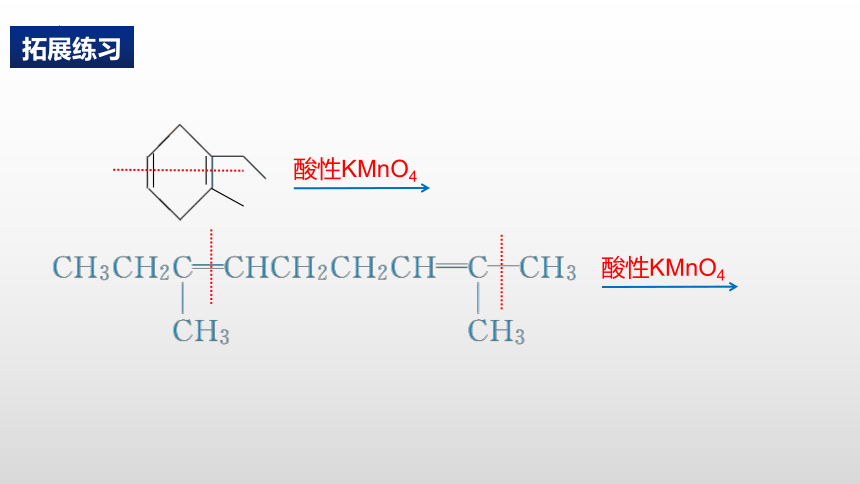
酸性KMnO4
酸性KMnO4
拓展练习
2.加成反应(与H2、Br2、HX、H2O等):
碳碳双键中的π键电子云重叠程度小,容易断裂,能发生加成反应
烯烃的结构和性质与乙烯的相似,能发生____反应、____反应和_____反应。
加成
氧化
加聚
CH3CH=CH2 + H2 CH3CH2CH3
催化剂
Δ
CH2 = CH2 + Br 2 → CH2Br – CH2Br
(1)以检验烯烃与烷烃
(2)除去气态烷烃中的气态烯烃
乙烯能使酸性高锰酸钾、溴的四氯化碳溶液褪色,原理一样吗
提示:乙烯使酸性高锰酸钾溶液褪色是发生了氧化反应,
使溴的四氯化碳溶液褪色是发生了加成反应,因此原理不一样。
溴水褪色/溴的四氯化碳溶液褪色
溴水洗气法
加成原理:双键的π键打开
二、烯烃化学性质
既可以用来鉴别乙烯和乙烷,又可以用来除去乙烷中混有的乙烯的方法是( )
A.通入溴水中
B.将气体点燃
C.通入酸性高锰酸钾溶液中
D.一定条件下与H2反应
E.通入溴的四氯化碳溶液中
A
√
H2的量不好控制
C2H6也能溶于CCl4中
对点训练
含不饱和键的有机物的π键断裂,两端碳原子上直接连接其他原子
或原子团的反应。“只进不出”。
加成反应:
加成反应和取代反应的区别
加成反应是有机化合物分子中不饱和键(双键或三键)两端的原子与其他原子或原子团直接结合生成新的化合物的反应,其特点是“断一加二”。
“断一”是指双键中的π键断裂;
“加二”是指加两个其他原子或原子团,即每一个不饱和碳原子上各加上一个。
取代反应是分子中某些原子或原子团被其他原子或原子团所代替的反应。其特点是“上一下一, 有上有下”。
对比分析
某烯烃和氢气加成后的产物如图:
CH3—C—CH2—CH3
CH3
CH3
①
②
③
④
⑤
⑥
该烯烃的双键在哪两个碳原子之间?
只能是③④之间
该烯烃的结构式可能有 种。
3
③④之间
①②或②⑤之间有双键
②③之间
相邻C上有H才可考虑双键
等效位置不要重复计算。
CH3—CH—CH2—CH3
CH3
①
②
③
④
⑤
提升训练
试剂 乙烯 丙烯
溴
氯化氢
水
CH3CH=CH2+Br2 → CH3CHBrCH2Br
CH2=CH2+Br2 → CH2BrCH2Br
CH2=CH2+HCl CH3CH2Cl
催化剂
Δ
CH3CH=CH2+HCl CH3CH2CH2Cl
催化剂
Δ
CH3CH=CH2+HCl CH3CHClCH3
催化剂
Δ
CH2=CH2+H2O CH3CH2OH
催化剂
加热加压
CH3CH=CH2+H2O CH3CH2CH2OH
催化剂
加热加压
CH3CH=CH2+H2O CH3CHCH3
OH
催化剂
加热加压
(主产物)
(主产物)
马氏规则:不对称烯烃和HX、H2O加成时,氢主要加在含氢多的双键碳原子上。
即:氢上加氢(主产物)
(乙烯制氯乙烷)
(乙烯水化法制乙醇)
在过氧化物存在的条件下,生成反马氏规则的产物。
思考与讨论
教材P33
根据已有的知识设计制备氯乙烷的实验方案。
方案1:乙烯和氯化氢的加成反应制备
方案二:利用乙烷和氯气发生取代反应制备
原子利用率达到100%(没有副产物)
乙烷和氯气发生取代反应,产物较多,
除了生成一氯乙烷,还会有氯化氢、二氯乙烷、三氯乙烷……,
副产物多,产率低,物质的分离提纯也难。
思考与讨论
CnH2n-2
典例:
1,3-丁二烯:CH2=CH-CH=CH2
2、链状二烯烃的通式:
CH2=C-CH=CH2
CH3
2-甲基-1,3-丁二烯
[也叫:异戊二烯]
【思考】 1,3-丁二烯分子中最少有多少个C原子在同一平面上?最多可以有多少个原子在同一平面上?
1、概念:
含有两个碳碳双键( )的烯烃
C=C
3个
10个(全部)
n≥3 Ω=2
说明:未注明时,烯烃指“单烯烃”
三、二烯烃
3、类别:
①累积二烯烃
②共轭二烯烃
③孤立二烯烃
依据两个双键在碳链中的不同位置:
C-C=C=C-C
C=C-C=C-C
C=C-C-C=C
1,2-加成、1,4-加成
[性质同单烯烃]
稳 定
不稳定
4、二烯烃的化学性质
氧化、加成、加聚
与烯烃相似:
思考(2):当1molCH2=CH-CH=CH2与1molCl2加成时,其加成产物是什么
CH2=CH-CH=CH2 + 2 Cl2
CH2-CH-CH-CH2
Cl
Cl
Cl
Cl
如,
完全加成
高中阶段常出现
思考(1):1,3-丁二烯CH2=CH-CH=CH2与足量氯气的加成反应
最简单的共轭二烯烃:
1,3-丁二烯
CH2=CH—CH=CH2
平面型分子
CH2-CH-CH=CH2
Cl
Cl
CH2-CH-CH-CH2
Cl
Cl
1,2 加成
CH2-CH-CH-CH2
(中间体1)
1,4-二氯-2-丁烯
二烯烃
CH2=CH-CH=CH2+ Cl2
(1)1、2-加成
CH2=CH-CH=CH2+ Cl2
(2)1、4-加成
1,4 加成
1 2 3 4
1 2 3 4
1 2 3 4
CH2-CH-CH-CH2
Cl
Cl
4 3 2 1
1 2 3 4
(中间体2)
1 2 3 4
资料卡片
教材P33
3,4-二氯-1-丁烯
+ Cl2
Cl
Cl
1,2—加成
+ Cl2
Cl
Cl
1,4—加成
1,3-丁二烯加成反应——键线表示
1
2
3
4
1
2
3
4
1
2
3
4
1
2
3
4
1,3-丁二烯的1,2-加成和1,4-加成是竞争反应,
到底哪一种加成占优势,取决于反应条件。
在温度较高的条件下大多发生1,4-加成,
在温度较低的条件下大多发生1,2-加成。
拓展提升
3.加聚反应:
聚合反应:由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应。
加聚反应:由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的聚合物,既是加成又是聚合的反应。
n CH2=CH2
[ CH2—CH2 ]n
催化剂
(聚乙烯PE)
原理:双键中的π键打开,双键碳原子在主链,其余C成为支链。
单体:合成高分子的小分子
链节:高分子中重复的结构单元
聚合度
注意:n的值不固定,
所得的聚乙烯是混合物。
聚乙烯保鲜膜
一定条件下
nCH2=CH—CH3 [ CH2—CH ]n
CH3
CH3
CH3
(聚氯乙烯PVC)
(聚丙烯PP)
(聚异丁烯PC)
一定条件下
nCH2=CH [ CH2—CH ]n
Cl
Cl
一定条件下
nCH2=CH [ CH2—CH ]n
CH3
CH3
典例分析
CH=CH
CH2CH3
CH3
CH2=CH
CH2CH3
分别写出下列烯烃加聚产物的结构简式:
CH2=CHCH2CH3
CH3CH=CHCH2CH3
-CH2-CH-
CH2CH3
[ ]
n
[ ]
-CH-CH-
CH2CH3
n
CH3
CH2=CCOOCH3
CH3
CH2=C
CH3
COOCH3
-CH2-C-
CH3
COOCH3
[ ]
n
双键变单键,两端伸出手,组成不改变
单烯烃型加聚反应通式:
一定条件下
nY—C=C—B [ C—C ]n
X
A
X
A
Y
B
基团上/下接,
H/卤链节C后
对点训练
nCH2=CH—CH=CH2 [ CH2—CH=CH—CH2]n
一定条件
天然橡胶(聚异戊二烯)
nCH2=C—CH=CH2 [CH2—C=CH—CH2]n
CH3
CH3
一定条件
聚1,3-丁二烯
共轭二烯烃的加聚反应
1 2 3 4
(类似1、4-加成)
(1,3-丁二烯)
俗称:异戊二烯
系统:2-甲基-1,3-丁二烯
拓展提升
在疫情防控中,橡胶医用手套也是功不可没,医用手套作为医护人员重要的防护措施之一,可以起到很好的防护隔离作用,让医护人员免除细菌和病毒的伤害。 天然橡胶可用于制造医用手套。
CH2=C-CH=CH-CH3
|
CH3
写出下列物质发生加聚反应的化学方程式
nCH2=C-CH=CH
|
CH3
|
CH3
主链
CH2=CH-CH2-CH=CH2
(1)
(2)
(孤立二烯烃:类似单烯烃加聚)
[ CH2—CH ] n
CH2-CH=CH2
n
“基团上/下接”
“基团上/下接”
[ CH2-C=CH-CH ]n
|
CH3
|
CH3
对点训练
聚合物单体判断:
1.聚乙烯型(链节2C):
凡链节的主碳链上有两个碳原子,其单体必为一种。将链节的两个半键闭合即是单体。
拓展提升
2.聚1,3-丁二烯型(链节4C):
3.混合型:
凡链节的主碳链上有4个碳原子,且无双键。其单体为两种,即是两种乙烯型单体。
①
⑤
②
③
④
(3)重要的化工原料:生产聚乙烯、聚氯乙烯塑料
烯烃CnH2n不饱和烃
类别
结构
性质
官能团:碳碳双键
(1)氧化反应:燃烧,使酸性KMnO4褪色
(2)加成反应
(3)加聚反应
用途
(1)水果催熟剂
(2)植物生长调节剂
决定
归纳小结
1.为什么香蕉密封保存最终会腐烂掉呢?
2.如何解决水果运输过程中的自催熟问题?
★采用冷链运输
★采摘未成熟的水果
★吸收水果释放的乙烯
浸泡有KMnO4酸性溶液的硅藻土
思考与讨论
写出下列反应方程式,指出反应类型
对点训练
n CH2=CH2
[ CH2—CH2 ]n
催化剂
①CH2=CH2+Br2 → CH2BrCH2Br
CH2=CH2+H2O CH3CH2OH
催化剂
加热加压
2C2H4 + 3O2 2CO2 + 2H2O
点燃
②
③
④
加成反应
加聚反应
加成反应
氧还反应
烷烃与烯烃化学性质的比较
烷烃 烯烃
通式
分子结构特点
主要化学性质 与溴的四氯化碳溶液
与酸性高锰酸钾溶液
主要反应类型
CnH2n+2
不反应
全部单键,饱和
不反应
CnH2n
有碳碳双键,不饱和
加成
被氧化
取代
加成,聚合
对比小结
烯烃的同分异构
构造异构
立体异构
碳架异构
位置异构
官能团异构
顺反异构
烯烃分子结构中因存在碳碳双键,又与环烷烃的分子通式相同,故其构造异构共三种类型:碳架异构、位置异构、官能团异构。
顺反异构,原子或原子团的连接顺序以及双键的位置相同,只是空间排列方式不同。
因此,两者化学性质基本相同,物理性质有一定差异。
四、烯烃的同分异构类型
例:丁烯C4H8的同分异构体
烯烃的同分异构——官能团位置异构
——插入法(适用于烯烃、炔烃、醚、酮、酯等)
C—C—C—C
C—C—C
C
C=C—C—C
C—C=C—C
C=C—C
C
②CH2=CH—CH2—CH3
①CH3—CH=CH—CH3
③CH2=C—CH3
CH3
碳链异构
官能团位置异构
类别异构
:烯烃与环烷烃存在类别异构
(2种环烷烃+3种烯烃)
(2种)
每减少两个H,分子内增加一个C=C或一个环
①②有顺反异构类型
③④无顺反异构类型
形成顺反异构的条件:
(1)有碳碳双键
(2)双键的每个碳原子必须连接
两个不同的原子或原子团.
C== C
a
a
b
b
C== C
a
a
b
d
C== C
a
a
a
b
C== C
a
d
b
d
① ② ③ ④
即:a b
且a b
1.通过碳碳双键连接的原子或原子团不能绕键轴旋转会导致其空间排列方式不同,产生顺反异构现象。
【思考】哪些烯烃能有这样的异构现象?
①CH3—CH=CH—CH3
②CH2=CH—CH2—CH3
③CH2=C—CH3
CH3
五、烯烃的顺反异构(属于立体异构)
熔点/℃ -138.9 -105.5
沸点/℃ 3.7 0.9
密度/(g·cm-3) 0.621 0.604
相同的原子或原子团位于双键同一侧为顺式结构;
相同的原子或原子团位于双键两侧为为反式结构。
2.命名时,在系统命名的名称前加上以“顺”或“反”字。
------------------------
----------------------
顺-2-丁烯
反-2-丁烯
五、烯烃的顺反异构(属于立体异构)
化学性质基本相同,物理性质有一定差异
天然橡胶(聚异戊二烯)
三叶橡胶
杜仲橡胶
拓展视野
2.写出满足分子式C5H10的所有同分异构体[包括顺反异构]
书写顺序:
类别异构 → 碳链异构 → 位置异构 → 顺反异构
5种环烷烃 + 6种烯烃(其中2-戊烯存在顺反异构)
对点训练
1.分子式为C5H10的烯烃的同分异构体共有[考虑顺反异构]( )
A.5种 B.6种 C. 7种 D.8种
B
(1)CH3-CH2-CH2-CH = CH2
(2)CH3-CH2-CH = CH-CH3
(3)
(4)
(5)
存在顺反异构
5种环烷烃
6种烯烃
(1)
(2)
(3)
(4)
(5)
3.下列物质中不存在顺反异构的是( )
A.1,2-二氯乙烯 B.1,2-二氯丙烯
C.2-甲基-2-丁烯 D.2-氯-2-丁烯
【思考2】炔烃存在顺反异构吗?
碳碳三键成直线,线形分子不具备构成的条件。
特别提醒:只有含碳碳双键的分子才需要考虑顺反异构
C
【思考1】烷烃是否也有顺反异构现象?
烷烃分子中的碳碳单键可以旋转,所以不会产生顺反异构现象。
不存在
否
对点训练
网
科
第二节 烯烃 炔烃
1. 结合代表物,认识烯烃的组成和结构特点。
2.了解烯烃物理性质的变化规律,掌握烯烃的化学性质及应用。
3.了解二烯烃的加成、加聚反应及烯烃的顺反异构。
第二章 烃
2.2.1 烯烃的结构和性质、立体异构
教材内容:P32-34
学习目标
自然界里存在许多烯烃,如番茄中的番茄红素、鲨鱼油中的角鲨烯都是烯烃。
番茄中存在番茄红素
乙烯的产量则是衡量国家石油化工水平的重要标志
乙烯是常见的烯烃。
新冠疫情爆发之初,口罩一度成为畅销品,甚至脱销,N95口罩成了抗疫“明星”,
丙烯是制造N95口罩的原料之一。
新课导入
乙烯
丙烯
1-丁烯
1-戊烯
根据以下几种烯烃的结构简式或球棍模型,
分析得出单烯烃的官能团、化学键的种类、分子式通式。
C C
1.链状单烯烃通式:CnH2n(n≥2) 只含一个官能团Ω=1
CH2=CH2
CH2=CH—CH3
CH2=CH—CH2—CH3
2.烯烃官能团:
碳碳双键
烯烃中的碳和氢的质量分数为恒定值,碳为85.7%,氢为14.3%
注意满足这个通式的烃不一定是烯烃,可能是环烷烃。
教材P33
思考与讨论
乙烯分子结构示意图
1.最简单的烯烃:乙烯
分子式:
电子式:
结构式:
结构简式:
C2H4
H
H
..
H : C : : C : H
..
C
C
H
H
H
H
CH2=CH2 或H2C=CH2
最简式:
CH2
键线式:
= 或 II
两模:
碳碳双键不是两个碳碳单键的简单组合;
键角约为120°,6原子(2+4)共面;
杂化方式:sp2杂化
化学键:
σ键原子间,可绕轴旋转
π键原子间,不能绕轴旋转
错误:CH2CH2(双键不能省)
注 意:碳碳双键
①不可省略 ②不可旋转
知识回顾
状态 溶解性 密度 熔沸点
乙烯
烯烃
难溶于水
密度比空气略小
无色气体
———————————与烷烃相似
难溶于水
C↑,熔沸点↑
C同,支链↑,熔沸点↓
C个数,
2~4,气态
5~16,液态
17以上,固态
一、烯烃物理性质
以乙烯的化学性质为依据,结合烯烃的结构特征,研讨烯烃的化学性质。
乙烯的化学性质
在空气中能燃烧
能被酸性高锰酸钾溶液氧化
能发生加成反应或加聚反应
烯烃的结构特征
有碳碳双键
有碳氢单键
一定条件下能发生取代反应
极性键
烯烃的化学性质
预测
思考与讨论
CH4
C2H4
3.烯烃的化学性质:
碳碳双键中的π键易断裂
烯烃的结构和性质与乙烯的相似,能发生____反应、____反应和_____反应。
加成
氧化
加聚
1.氧化反应:
(1)燃烧氧化:
(2)催化氧化:
(3)被酸性KMnO4氧化:
2CH2=CH2 +O2 2CH3CHO
催化剂
加热、加压
使KMnO4溶液褪色
(用于鉴别烷烃和烯烃)
2CnH2n + 3nO2 2nCO2 + 2nH2O
点燃
(加氧去氢)
火焰明亮,伴有黑烟
5CH2=CH2 + 12KMnO4 +18H2SO4
10CO2↑+12MnSO4 +6K2SO4 + 28H2O
2CH2=CH2 + O2
催化剂
2 CH2 CH2
O
但不可用于除去CH4中的C2H4(生成CO2气体,引入新杂质)
二、烯烃化学性质
CH2=
CO2
KMnO4
H+
KMnO4
H+
C=O
R'
R''
C=
R'
R''
酮
R—CH=
R—COOH
KMnO4
H+
羧酸
烯烃都能使酸性KMnO4溶液褪色
二氢成气
一氢成酸
无氢成酮
拓展提升
1.烯烃与酸性高锰酸钾溶液有如下的反应关系:
思考:下列烯烃被酸性高锰酸钾溶液氧化的产物是:
二氢成气
一氢成酸
无氢成酮
酸性KMnO4溶液
CH3C=CHCH3
▏
CH3
CH3-C-OH
=
O
CH3
C=O
CH3
+
酸性KMnO4溶液
HOOC-CH2-COOH
2.烯烃的α—氢的取代:在加热的条件下,烯烃或炔烃的α—氢能被卤素单质取代
CH3CH=CH2+Cl2 CH2CH=CH2+HCl
△
拓展提升
Cl
酸性KMnO4
酸性KMnO4
拓展练习
2.加成反应(与H2、Br2、HX、H2O等):
碳碳双键中的π键电子云重叠程度小,容易断裂,能发生加成反应
烯烃的结构和性质与乙烯的相似,能发生____反应、____反应和_____反应。
加成
氧化
加聚
CH3CH=CH2 + H2 CH3CH2CH3
催化剂
Δ
CH2 = CH2 + Br 2 → CH2Br – CH2Br
(1)以检验烯烃与烷烃
(2)除去气态烷烃中的气态烯烃
乙烯能使酸性高锰酸钾、溴的四氯化碳溶液褪色,原理一样吗
提示:乙烯使酸性高锰酸钾溶液褪色是发生了氧化反应,
使溴的四氯化碳溶液褪色是发生了加成反应,因此原理不一样。
溴水褪色/溴的四氯化碳溶液褪色
溴水洗气法
加成原理:双键的π键打开
二、烯烃化学性质
既可以用来鉴别乙烯和乙烷,又可以用来除去乙烷中混有的乙烯的方法是( )
A.通入溴水中
B.将气体点燃
C.通入酸性高锰酸钾溶液中
D.一定条件下与H2反应
E.通入溴的四氯化碳溶液中
A
√
H2的量不好控制
C2H6也能溶于CCl4中
对点训练
含不饱和键的有机物的π键断裂,两端碳原子上直接连接其他原子
或原子团的反应。“只进不出”。
加成反应:
加成反应和取代反应的区别
加成反应是有机化合物分子中不饱和键(双键或三键)两端的原子与其他原子或原子团直接结合生成新的化合物的反应,其特点是“断一加二”。
“断一”是指双键中的π键断裂;
“加二”是指加两个其他原子或原子团,即每一个不饱和碳原子上各加上一个。
取代反应是分子中某些原子或原子团被其他原子或原子团所代替的反应。其特点是“上一下一, 有上有下”。
对比分析
某烯烃和氢气加成后的产物如图:
CH3—C—CH2—CH3
CH3
CH3
①
②
③
④
⑤
⑥
该烯烃的双键在哪两个碳原子之间?
只能是③④之间
该烯烃的结构式可能有 种。
3
③④之间
①②或②⑤之间有双键
②③之间
相邻C上有H才可考虑双键
等效位置不要重复计算。
CH3—CH—CH2—CH3
CH3
①
②
③
④
⑤
提升训练
试剂 乙烯 丙烯
溴
氯化氢
水
CH3CH=CH2+Br2 → CH3CHBrCH2Br
CH2=CH2+Br2 → CH2BrCH2Br
CH2=CH2+HCl CH3CH2Cl
催化剂
Δ
CH3CH=CH2+HCl CH3CH2CH2Cl
催化剂
Δ
CH3CH=CH2+HCl CH3CHClCH3
催化剂
Δ
CH2=CH2+H2O CH3CH2OH
催化剂
加热加压
CH3CH=CH2+H2O CH3CH2CH2OH
催化剂
加热加压
CH3CH=CH2+H2O CH3CHCH3
OH
催化剂
加热加压
(主产物)
(主产物)
马氏规则:不对称烯烃和HX、H2O加成时,氢主要加在含氢多的双键碳原子上。
即:氢上加氢(主产物)
(乙烯制氯乙烷)
(乙烯水化法制乙醇)
在过氧化物存在的条件下,生成反马氏规则的产物。
思考与讨论
教材P33
根据已有的知识设计制备氯乙烷的实验方案。
方案1:乙烯和氯化氢的加成反应制备
方案二:利用乙烷和氯气发生取代反应制备
原子利用率达到100%(没有副产物)
乙烷和氯气发生取代反应,产物较多,
除了生成一氯乙烷,还会有氯化氢、二氯乙烷、三氯乙烷……,
副产物多,产率低,物质的分离提纯也难。
思考与讨论
CnH2n-2
典例:
1,3-丁二烯:CH2=CH-CH=CH2
2、链状二烯烃的通式:
CH2=C-CH=CH2
CH3
2-甲基-1,3-丁二烯
[也叫:异戊二烯]
【思考】 1,3-丁二烯分子中最少有多少个C原子在同一平面上?最多可以有多少个原子在同一平面上?
1、概念:
含有两个碳碳双键( )的烯烃
C=C
3个
10个(全部)
n≥3 Ω=2
说明:未注明时,烯烃指“单烯烃”
三、二烯烃
3、类别:
①累积二烯烃
②共轭二烯烃
③孤立二烯烃
依据两个双键在碳链中的不同位置:
C-C=C=C-C
C=C-C=C-C
C=C-C-C=C
1,2-加成、1,4-加成
[性质同单烯烃]
稳 定
不稳定
4、二烯烃的化学性质
氧化、加成、加聚
与烯烃相似:
思考(2):当1molCH2=CH-CH=CH2与1molCl2加成时,其加成产物是什么
CH2=CH-CH=CH2 + 2 Cl2
CH2-CH-CH-CH2
Cl
Cl
Cl
Cl
如,
完全加成
高中阶段常出现
思考(1):1,3-丁二烯CH2=CH-CH=CH2与足量氯气的加成反应
最简单的共轭二烯烃:
1,3-丁二烯
CH2=CH—CH=CH2
平面型分子
CH2-CH-CH=CH2
Cl
Cl
CH2-CH-CH-CH2
Cl
Cl
1,2 加成
CH2-CH-CH-CH2
(中间体1)
1,4-二氯-2-丁烯
二烯烃
CH2=CH-CH=CH2+ Cl2
(1)1、2-加成
CH2=CH-CH=CH2+ Cl2
(2)1、4-加成
1,4 加成
1 2 3 4
1 2 3 4
1 2 3 4
CH2-CH-CH-CH2
Cl
Cl
4 3 2 1
1 2 3 4
(中间体2)
1 2 3 4
资料卡片
教材P33
3,4-二氯-1-丁烯
+ Cl2
Cl
Cl
1,2—加成
+ Cl2
Cl
Cl
1,4—加成
1,3-丁二烯加成反应——键线表示
1
2
3
4
1
2
3
4
1
2
3
4
1
2
3
4
1,3-丁二烯的1,2-加成和1,4-加成是竞争反应,
到底哪一种加成占优势,取决于反应条件。
在温度较高的条件下大多发生1,4-加成,
在温度较低的条件下大多发生1,2-加成。
拓展提升
3.加聚反应:
聚合反应:由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应。
加聚反应:由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的聚合物,既是加成又是聚合的反应。
n CH2=CH2
[ CH2—CH2 ]n
催化剂
(聚乙烯PE)
原理:双键中的π键打开,双键碳原子在主链,其余C成为支链。
单体:合成高分子的小分子
链节:高分子中重复的结构单元
聚合度
注意:n的值不固定,
所得的聚乙烯是混合物。
聚乙烯保鲜膜
一定条件下
nCH2=CH—CH3 [ CH2—CH ]n
CH3
CH3
CH3
(聚氯乙烯PVC)
(聚丙烯PP)
(聚异丁烯PC)
一定条件下
nCH2=CH [ CH2—CH ]n
Cl
Cl
一定条件下
nCH2=CH [ CH2—CH ]n
CH3
CH3
典例分析
CH=CH
CH2CH3
CH3
CH2=CH
CH2CH3
分别写出下列烯烃加聚产物的结构简式:
CH2=CHCH2CH3
CH3CH=CHCH2CH3
-CH2-CH-
CH2CH3
[ ]
n
[ ]
-CH-CH-
CH2CH3
n
CH3
CH2=CCOOCH3
CH3
CH2=C
CH3
COOCH3
-CH2-C-
CH3
COOCH3
[ ]
n
双键变单键,两端伸出手,组成不改变
单烯烃型加聚反应通式:
一定条件下
nY—C=C—B [ C—C ]n
X
A
X
A
Y
B
基团上/下接,
H/卤链节C后
对点训练
nCH2=CH—CH=CH2 [ CH2—CH=CH—CH2]n
一定条件
天然橡胶(聚异戊二烯)
nCH2=C—CH=CH2 [CH2—C=CH—CH2]n
CH3
CH3
一定条件
聚1,3-丁二烯
共轭二烯烃的加聚反应
1 2 3 4
(类似1、4-加成)
(1,3-丁二烯)
俗称:异戊二烯
系统:2-甲基-1,3-丁二烯
拓展提升
在疫情防控中,橡胶医用手套也是功不可没,医用手套作为医护人员重要的防护措施之一,可以起到很好的防护隔离作用,让医护人员免除细菌和病毒的伤害。 天然橡胶可用于制造医用手套。
CH2=C-CH=CH-CH3
|
CH3
写出下列物质发生加聚反应的化学方程式
nCH2=C-CH=CH
|
CH3
|
CH3
主链
CH2=CH-CH2-CH=CH2
(1)
(2)
(孤立二烯烃:类似单烯烃加聚)
[ CH2—CH ] n
CH2-CH=CH2
n
“基团上/下接”
“基团上/下接”
[ CH2-C=CH-CH ]n
|
CH3
|
CH3
对点训练
聚合物单体判断:
1.聚乙烯型(链节2C):
凡链节的主碳链上有两个碳原子,其单体必为一种。将链节的两个半键闭合即是单体。
拓展提升
2.聚1,3-丁二烯型(链节4C):
3.混合型:
凡链节的主碳链上有4个碳原子,且无双键。其单体为两种,即是两种乙烯型单体。
①
⑤
②
③
④
(3)重要的化工原料:生产聚乙烯、聚氯乙烯塑料
烯烃CnH2n不饱和烃
类别
结构
性质
官能团:碳碳双键
(1)氧化反应:燃烧,使酸性KMnO4褪色
(2)加成反应
(3)加聚反应
用途
(1)水果催熟剂
(2)植物生长调节剂
决定
归纳小结
1.为什么香蕉密封保存最终会腐烂掉呢?
2.如何解决水果运输过程中的自催熟问题?
★采用冷链运输
★采摘未成熟的水果
★吸收水果释放的乙烯
浸泡有KMnO4酸性溶液的硅藻土
思考与讨论
写出下列反应方程式,指出反应类型
对点训练
n CH2=CH2
[ CH2—CH2 ]n
催化剂
①CH2=CH2+Br2 → CH2BrCH2Br
CH2=CH2+H2O CH3CH2OH
催化剂
加热加压
2C2H4 + 3O2 2CO2 + 2H2O
点燃
②
③
④
加成反应
加聚反应
加成反应
氧还反应
烷烃与烯烃化学性质的比较
烷烃 烯烃
通式
分子结构特点
主要化学性质 与溴的四氯化碳溶液
与酸性高锰酸钾溶液
主要反应类型
CnH2n+2
不反应
全部单键,饱和
不反应
CnH2n
有碳碳双键,不饱和
加成
被氧化
取代
加成,聚合
对比小结
烯烃的同分异构
构造异构
立体异构
碳架异构
位置异构
官能团异构
顺反异构
烯烃分子结构中因存在碳碳双键,又与环烷烃的分子通式相同,故其构造异构共三种类型:碳架异构、位置异构、官能团异构。
顺反异构,原子或原子团的连接顺序以及双键的位置相同,只是空间排列方式不同。
因此,两者化学性质基本相同,物理性质有一定差异。
四、烯烃的同分异构类型
例:丁烯C4H8的同分异构体
烯烃的同分异构——官能团位置异构
——插入法(适用于烯烃、炔烃、醚、酮、酯等)
C—C—C—C
C—C—C
C
C=C—C—C
C—C=C—C
C=C—C
C
②CH2=CH—CH2—CH3
①CH3—CH=CH—CH3
③CH2=C—CH3
CH3
碳链异构
官能团位置异构
类别异构
:烯烃与环烷烃存在类别异构
(2种环烷烃+3种烯烃)
(2种)
每减少两个H,分子内增加一个C=C或一个环
①②有顺反异构类型
③④无顺反异构类型
形成顺反异构的条件:
(1)有碳碳双键
(2)双键的每个碳原子必须连接
两个不同的原子或原子团.
C== C
a
a
b
b
C== C
a
a
b
d
C== C
a
a
a
b
C== C
a
d
b
d
① ② ③ ④
即:a b
且a b
1.通过碳碳双键连接的原子或原子团不能绕键轴旋转会导致其空间排列方式不同,产生顺反异构现象。
【思考】哪些烯烃能有这样的异构现象?
①CH3—CH=CH—CH3
②CH2=CH—CH2—CH3
③CH2=C—CH3
CH3
五、烯烃的顺反异构(属于立体异构)
熔点/℃ -138.9 -105.5
沸点/℃ 3.7 0.9
密度/(g·cm-3) 0.621 0.604
相同的原子或原子团位于双键同一侧为顺式结构;
相同的原子或原子团位于双键两侧为为反式结构。
2.命名时,在系统命名的名称前加上以“顺”或“反”字。
------------------------
----------------------
顺-2-丁烯
反-2-丁烯
五、烯烃的顺反异构(属于立体异构)
化学性质基本相同,物理性质有一定差异
天然橡胶(聚异戊二烯)
三叶橡胶
杜仲橡胶
拓展视野
2.写出满足分子式C5H10的所有同分异构体[包括顺反异构]
书写顺序:
类别异构 → 碳链异构 → 位置异构 → 顺反异构
5种环烷烃 + 6种烯烃(其中2-戊烯存在顺反异构)
对点训练
1.分子式为C5H10的烯烃的同分异构体共有[考虑顺反异构]( )
A.5种 B.6种 C. 7种 D.8种
B
(1)CH3-CH2-CH2-CH = CH2
(2)CH3-CH2-CH = CH-CH3
(3)
(4)
(5)
存在顺反异构
5种环烷烃
6种烯烃
(1)
(2)
(3)
(4)
(5)
3.下列物质中不存在顺反异构的是( )
A.1,2-二氯乙烯 B.1,2-二氯丙烯
C.2-甲基-2-丁烯 D.2-氯-2-丁烯
【思考2】炔烃存在顺反异构吗?
碳碳三键成直线,线形分子不具备构成的条件。
特别提醒:只有含碳碳双键的分子才需要考虑顺反异构
C
【思考1】烷烃是否也有顺反异构现象?
烷烃分子中的碳碳单键可以旋转,所以不会产生顺反异构现象。
不存在
否
对点训练
