第五单元_定量研究化学反应 学案
图片预览

文档简介
第五单元 定量研究化学反应复习学案
教师寄语:细节决定成败,习惯成就未来
学习任务:
1、通过自主学习,梳理知识,能自主形成知识网络。
2、通过复习质量守恒定律,能解释化学反应中的质量关系,能推断化学反应中某物质的组成元素。
3、通过复习化学方程式的意义、写法,能根据反应事实书写化学方程式。
4,根据化学方程式进行简单计算。
任务导学
知识点一、质量守恒定律
1、内容:__________化学反应的 ( http: / / www.21cnjy.com )各物质的质量总和等于反应后______ 的各物质的质量总和,这个规律叫做质量守恒定律。
注意:(1)适用范围是所有的化学变化,对物理变化_________。
(2)是__________守恒而不是体积守恒。
(3)杂质和剩余物质都没有参加反应,不属于“参加反应的各物质”不能计算在内。
(4) 生成的各物质的质量总和包括固、液、气三种状态的物质的质量,不能因为生成了气体而误认为该反应不符合质量守恒定律。
2、微观解释:
在化学反应前后,原子的 ______、_____、____均保持不变(原子的三不变)
3、化学反应前后:
(1)六不变
宏观:物质的总质量不变
元素的 _____和_____不变
微观:原子的______ 、_______、______不变
两改变
宏观:_____________的种类一定改变
微观:_____________的种类一定改变
(3)一个可能变 ___________的数目可能改变
【典型知识点辨析】
考点 1如何用实验来探究化学反应中的质量守恒
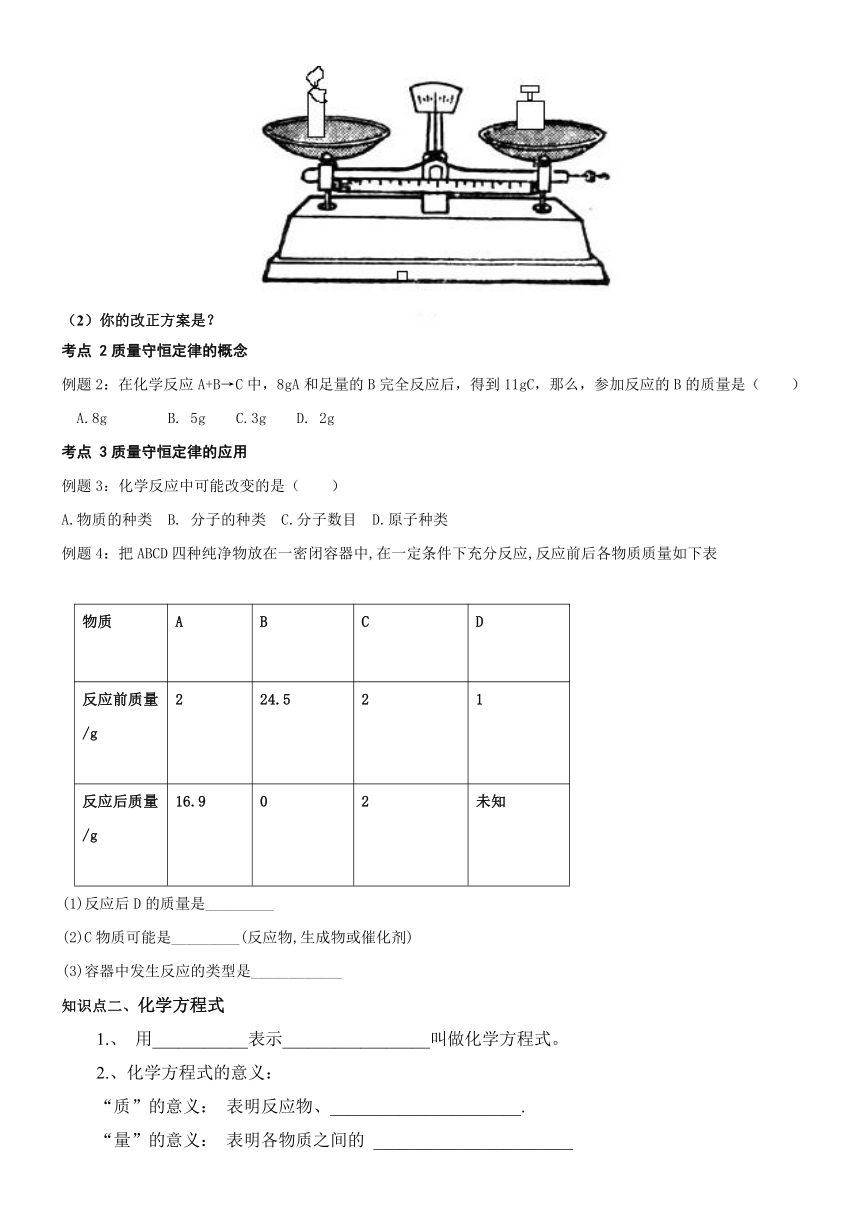
【例1】小明用按右图所示先测定蜡烛燃烧前的 ( http: / / www.21cnjy.com )质量,然后点燃蜡烛,燃烧一段时间后,他发现天平的指针偏向右边。由此小明得出“蜡烛燃烧后质量减少,不符合质量守恒定律”的错误结论。
(1)你认为实验失败的原因是?
(2)你的改正方案是?
考点 2质量守恒定律的概念
例题2:在化学反应A+B→C中,8gA和足量的B完全反应后,得到11gC,那么,参加反应的B的质量是( )
A.8g B. 5g C.3g D. 2g
考点 3质量守恒定律的应用
例题3:化学反应中可能改变的是( )
A.物质的种类 B. 分子的种类 C.分子数目 D.原子种类
例题4:把ABCD四种纯净物放在一密闭容器中,在一定条件下充分反应,反应前后各物质质量如下表
物质 A B C D
反应前质量/g 2 24.5 2 1
反应后质量/g 16.9 0 2 未知
(1)反应后D的质量是_________
(2)C物质可能是_________(反应物,生成物或催化剂)
(3)容器中发生反应的类型是____________
知识点二、化学方程式
1.、 用___________表示_________________叫做化学方程式。
2.、化学方程式的意义:
“质”的意义: 表明反应物、______________________.
“量”的意义: 表明各物质之间的 _______________________
“微观” 意义:表明反应物、生成物各物质之间的 _______________
如.在4P + 5O2 点燃2P2O5的反 ( http: / / www.21cnjy.com )应中表示__________ 与_________在点燃的条件下生成了__________;若从反应物、生成物之间的原子、分子个数比来看表示:________个磷原子与________氧分子生成了_______个五氧化二磷分子;从它们的质量比来看表示:每_________份质量的磷跟 _________份质量的氧气完全反应,生成 __________份质量的五氧化二磷。
3、书写原则
(1)_______________________(2)_____________________
4、书写步骤:________________________________________________。
化学反应中的有关计算
1、根据化学方程式计算的理 ( http: / / www.21cnjy.com )论依据是______________,计算所依据的是_____________。在化学方程式中,各物质之间的_________________是一定的。物质质量与化学式的________和化学式的______________是密不可分的。
2、在化学反应中A+B=C+D,其中A ( http: / / www.21cnjy.com )与B参加反应的质量比为3:2,若反应后生成C和D的质量共10 g,则消耗反应物A为__________。
3、18 g水完全反应可生成氧气多少克
其步骤是:
设未知数:_______________________________,
写出反应的方程式:_________________________,
找出已知量和未知量之间的关系______________________,
列比例式求解:__________ ___________________,
写出答案:________________________________________。
【典型知识点辨析】
考点 4正确书写化学方程式
例题5:某学生书写了以下化学方程式,正确的是( )
A.C+O2 == CO2 B.2H2O HYPERLINK "http://www.21cnjy.com" 2H2+O2
C.Mg+O2 HYPERLINK "http://www.21cnjy.com" MgO2 D.3Fe+2O2 HYPERLINK "http://www.21cnjy.com" Fe3O4
考点 5根据题意信息,按要求书写化学方程式
例题6:用纳米级某种氧化物做催化剂 ( http: / / www.21cnjy.com ),使汽车尾气中的CO和NO反应,转化成两种气体,其中一种可参与植物的光合作用,另一种是空气中含量最多的气体。请根据所给信息,写出相应的化学方程式。
考点 6 常见计算题型
1.质量与相对质量的关系
例题7: 在反应2A+B=2C中,1.6g的A完全反应生成2gC,又已知B的相对分子质量为32,则C的相对分子质量是( )
A、28 B、64 C、80 D、44
2.由反应前后元素的种类和质量守恒,推断物质的组成
例题8:某可燃气体A与7.2gO2恰好完全反应,生成3.6g H2O和8.8g CO2,则A气体中( )
A.一定含C、H元素,不含O元素
B.可能含C、H、O三种元素
C.一定含C、H、O三种元素
D.不能确定
3.根据化学方程式的计算
例题9:发射火箭用联氨(N2H4)做燃料,用四氧化氮(N2O4)助燃,生成物不会对大气污染。
(1)反应的化学方程式为:2N2H4+N2O4 ( http: / / www.21cnjy.com )3 +4H2O,请在横线上填写化学式以完成该化学方程式。
(2)请计算9.6N2H4完全燃烧需要N2O4的质量。
【课堂小结】
【课堂达标测试】
1、下列叙述完全符合质量守恒定律的是 ( )
A.水结成冰前后,质量保持不变
B.50 mL水和50 mL乙醇混合后总体积小于100 mL
C.在100 g过氧化氢溶液中,含有30 g过氧化氢和70 g水
D.1.2 g碳与3.2 g氧气恰好完全反应,可生成4.4 g二氧化碳
2、(2011.桂林市)某纯净物M微热就能分解生成NH3、H2O和CO2,由此还不能得出的结论是 ( )
A.M不稳定 B.M是化合物 C.M中含有水 D.M由四种元素组成
3、(2012.青岛市)以下是某化 ( http: / / www.21cnjy.com )学反应的微观示意图( 、 分别表示不同元素的原子),下列对图示反应的理解中,正确的是 ( )
A.反应物和生成物中共含有三种元素 B.参加反应的物质分子个数之比为1:1
C.反应物和生成物中只有一种单质 D.该反应属于化合反应
4、(2013泰安)关于化学方程式CH4+2O2CO2+2H2O的描述正确的是( )
A.甲烷加氧气在点燃条件下,反应生成二氧化碳和水
B.1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水
C.1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子
D.1 g CH4和2 g O2在点燃条件下,生成1 g CO2和2 g H2O
5、(2011.淄博市)在化学反应A+B=C ( http: / / www.21cnjy.com )+D中,若12 g A与一定量的B恰好完全反应,生成28 g C和2 g D,则参加反应的B的质量为 ( )
A.8 g B.18 g C.28 g D.30 g
6、(2012.鸡西市)氯 ( http: / / www.21cnjy.com )气是一种有毒的气体,实验室制取氯气时,可以用氢氧化钠溶液来吸收尾气,其反应原理为Cl2 + 2NaOH = X + NaClO + H2O, 则X 的化学式为 ( )
A. NaCl B. H2 C. HCl D. HClO
7、(2012.宜宾市)一定条件下,下列物质在密闭容器内反应一段时间,测得反应产前后各物质的质量如下:
物质 X Y Z W
反应前质量/g 10 2.2 16.2 0.9
反应后质量/g a 4.4 8.1 1.8
根据上表信息判断,下列说法中不正确的是 ( )
A.X、Z是反应物,Y、W是生成物 B.a=15
C.反应中Y、W两种物质变化的质量比为22︰9 D.Z为化合物
8.(2013 长沙)实 ( http: / / www.21cnjy.com )验室常用过氧化氢溶液与二氧化锰混合制取氧气.现将2.5g二氧化锰放入盛有100g过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到1.6g气体.请完成下列问题:
(1)反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量为 g.
(2)计算原过氧化氢溶液中溶质的质量分数.
+
教师寄语:细节决定成败,习惯成就未来
学习任务:
1、通过自主学习,梳理知识,能自主形成知识网络。
2、通过复习质量守恒定律,能解释化学反应中的质量关系,能推断化学反应中某物质的组成元素。
3、通过复习化学方程式的意义、写法,能根据反应事实书写化学方程式。
4,根据化学方程式进行简单计算。
任务导学
知识点一、质量守恒定律
1、内容:__________化学反应的 ( http: / / www.21cnjy.com )各物质的质量总和等于反应后______ 的各物质的质量总和,这个规律叫做质量守恒定律。
注意:(1)适用范围是所有的化学变化,对物理变化_________。
(2)是__________守恒而不是体积守恒。
(3)杂质和剩余物质都没有参加反应,不属于“参加反应的各物质”不能计算在内。
(4) 生成的各物质的质量总和包括固、液、气三种状态的物质的质量,不能因为生成了气体而误认为该反应不符合质量守恒定律。
2、微观解释:
在化学反应前后,原子的 ______、_____、____均保持不变(原子的三不变)
3、化学反应前后:
(1)六不变
宏观:物质的总质量不变
元素的 _____和_____不变
微观:原子的______ 、_______、______不变
两改变
宏观:_____________的种类一定改变
微观:_____________的种类一定改变
(3)一个可能变 ___________的数目可能改变
【典型知识点辨析】
考点 1如何用实验来探究化学反应中的质量守恒
【例1】小明用按右图所示先测定蜡烛燃烧前的 ( http: / / www.21cnjy.com )质量,然后点燃蜡烛,燃烧一段时间后,他发现天平的指针偏向右边。由此小明得出“蜡烛燃烧后质量减少,不符合质量守恒定律”的错误结论。
(1)你认为实验失败的原因是?
(2)你的改正方案是?
考点 2质量守恒定律的概念
例题2:在化学反应A+B→C中,8gA和足量的B完全反应后,得到11gC,那么,参加反应的B的质量是( )
A.8g B. 5g C.3g D. 2g
考点 3质量守恒定律的应用
例题3:化学反应中可能改变的是( )
A.物质的种类 B. 分子的种类 C.分子数目 D.原子种类
例题4:把ABCD四种纯净物放在一密闭容器中,在一定条件下充分反应,反应前后各物质质量如下表
物质 A B C D
反应前质量/g 2 24.5 2 1
反应后质量/g 16.9 0 2 未知
(1)反应后D的质量是_________
(2)C物质可能是_________(反应物,生成物或催化剂)
(3)容器中发生反应的类型是____________
知识点二、化学方程式
1.、 用___________表示_________________叫做化学方程式。
2.、化学方程式的意义:
“质”的意义: 表明反应物、______________________.
“量”的意义: 表明各物质之间的 _______________________
“微观” 意义:表明反应物、生成物各物质之间的 _______________
如.在4P + 5O2 点燃2P2O5的反 ( http: / / www.21cnjy.com )应中表示__________ 与_________在点燃的条件下生成了__________;若从反应物、生成物之间的原子、分子个数比来看表示:________个磷原子与________氧分子生成了_______个五氧化二磷分子;从它们的质量比来看表示:每_________份质量的磷跟 _________份质量的氧气完全反应,生成 __________份质量的五氧化二磷。
3、书写原则
(1)_______________________(2)_____________________
4、书写步骤:________________________________________________。
化学反应中的有关计算
1、根据化学方程式计算的理 ( http: / / www.21cnjy.com )论依据是______________,计算所依据的是_____________。在化学方程式中,各物质之间的_________________是一定的。物质质量与化学式的________和化学式的______________是密不可分的。
2、在化学反应中A+B=C+D,其中A ( http: / / www.21cnjy.com )与B参加反应的质量比为3:2,若反应后生成C和D的质量共10 g,则消耗反应物A为__________。
3、18 g水完全反应可生成氧气多少克
其步骤是:
设未知数:_______________________________,
写出反应的方程式:_________________________,
找出已知量和未知量之间的关系______________________,
列比例式求解:__________ ___________________,
写出答案:________________________________________。
【典型知识点辨析】
考点 4正确书写化学方程式
例题5:某学生书写了以下化学方程式,正确的是( )
A.C+O2 == CO2 B.2H2O HYPERLINK "http://www.21cnjy.com" 2H2+O2
C.Mg+O2 HYPERLINK "http://www.21cnjy.com" MgO2 D.3Fe+2O2 HYPERLINK "http://www.21cnjy.com" Fe3O4
考点 5根据题意信息,按要求书写化学方程式
例题6:用纳米级某种氧化物做催化剂 ( http: / / www.21cnjy.com ),使汽车尾气中的CO和NO反应,转化成两种气体,其中一种可参与植物的光合作用,另一种是空气中含量最多的气体。请根据所给信息,写出相应的化学方程式。
考点 6 常见计算题型
1.质量与相对质量的关系
例题7: 在反应2A+B=2C中,1.6g的A完全反应生成2gC,又已知B的相对分子质量为32,则C的相对分子质量是( )
A、28 B、64 C、80 D、44
2.由反应前后元素的种类和质量守恒,推断物质的组成
例题8:某可燃气体A与7.2gO2恰好完全反应,生成3.6g H2O和8.8g CO2,则A气体中( )
A.一定含C、H元素,不含O元素
B.可能含C、H、O三种元素
C.一定含C、H、O三种元素
D.不能确定
3.根据化学方程式的计算
例题9:发射火箭用联氨(N2H4)做燃料,用四氧化氮(N2O4)助燃,生成物不会对大气污染。
(1)反应的化学方程式为:2N2H4+N2O4 ( http: / / www.21cnjy.com )3 +4H2O,请在横线上填写化学式以完成该化学方程式。
(2)请计算9.6N2H4完全燃烧需要N2O4的质量。
【课堂小结】
【课堂达标测试】
1、下列叙述完全符合质量守恒定律的是 ( )
A.水结成冰前后,质量保持不变
B.50 mL水和50 mL乙醇混合后总体积小于100 mL
C.在100 g过氧化氢溶液中,含有30 g过氧化氢和70 g水
D.1.2 g碳与3.2 g氧气恰好完全反应,可生成4.4 g二氧化碳
2、(2011.桂林市)某纯净物M微热就能分解生成NH3、H2O和CO2,由此还不能得出的结论是 ( )
A.M不稳定 B.M是化合物 C.M中含有水 D.M由四种元素组成
3、(2012.青岛市)以下是某化 ( http: / / www.21cnjy.com )学反应的微观示意图( 、 分别表示不同元素的原子),下列对图示反应的理解中,正确的是 ( )
A.反应物和生成物中共含有三种元素 B.参加反应的物质分子个数之比为1:1
C.反应物和生成物中只有一种单质 D.该反应属于化合反应
4、(2013泰安)关于化学方程式CH4+2O2CO2+2H2O的描述正确的是( )
A.甲烷加氧气在点燃条件下,反应生成二氧化碳和水
B.1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水
C.1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子
D.1 g CH4和2 g O2在点燃条件下,生成1 g CO2和2 g H2O
5、(2011.淄博市)在化学反应A+B=C ( http: / / www.21cnjy.com )+D中,若12 g A与一定量的B恰好完全反应,生成28 g C和2 g D,则参加反应的B的质量为 ( )
A.8 g B.18 g C.28 g D.30 g
6、(2012.鸡西市)氯 ( http: / / www.21cnjy.com )气是一种有毒的气体,实验室制取氯气时,可以用氢氧化钠溶液来吸收尾气,其反应原理为Cl2 + 2NaOH = X + NaClO + H2O, 则X 的化学式为 ( )
A. NaCl B. H2 C. HCl D. HClO
7、(2012.宜宾市)一定条件下,下列物质在密闭容器内反应一段时间,测得反应产前后各物质的质量如下:
物质 X Y Z W
反应前质量/g 10 2.2 16.2 0.9
反应后质量/g a 4.4 8.1 1.8
根据上表信息判断,下列说法中不正确的是 ( )
A.X、Z是反应物,Y、W是生成物 B.a=15
C.反应中Y、W两种物质变化的质量比为22︰9 D.Z为化合物
8.(2013 长沙)实 ( http: / / www.21cnjy.com )验室常用过氧化氢溶液与二氧化锰混合制取氧气.现将2.5g二氧化锰放入盛有100g过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到1.6g气体.请完成下列问题:
(1)反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量为 g.
(2)计算原过氧化氢溶液中溶质的质量分数.
+
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
