化学人教版(2019)选择性必修2 3.3.2 离子晶体 课件(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.3.2 离子晶体 课件(共18张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-18 09:18:49 | ||
图片预览





文档简介
(共18张PPT)
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
第2课时 离子晶体
高二化学
胆矾
萤石
重晶石
烧碱
CuSO4·5H2O
CaF2
BaSO4
NaOH
【问题引入】
1、下列晶体构成微粒有什么共同点?
2、微粒之间存在哪种相同的作用力?
强碱、活泼金属的氧化物和过氧化物、大多数盐
由阴离子和阳离子相互作用而形成的晶体,叫做离子晶体
常见的离子晶体
概念:
构成微粒:
微粒间的作用力:
阴、阳离子(有的还存在电中性的分子,例如H2O、NH3)
离子键(静电作用:包括静电引力和静电斥力)
(一些离子晶体中还存在共价键、氢键等)
一、离子晶体
【学习评价】教材P94
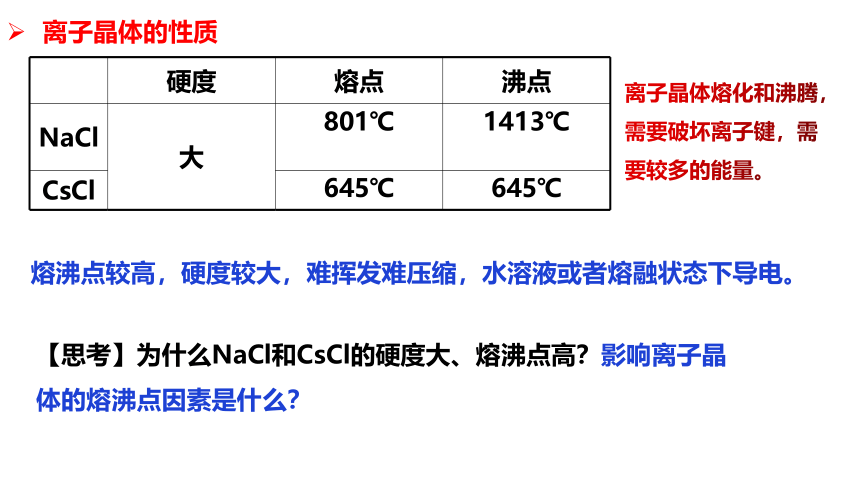
硬度 熔点 沸点
NaCl 大 801℃ 1413℃
CsCl 645℃ 645℃
离子晶体的性质
熔沸点较高,硬度较大,难挥发难压缩,水溶液或者熔融状态下导电。
【思考】为什么NaCl和CsCl的硬度大、熔沸点高?影响离子晶体的熔沸点因素是什么?
离子晶体熔化和沸腾,需要破坏离子键,需要较多的能量。
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强。
2、影响离子键强弱的因素
二、离子键
1、离子键:
3、离子键对离子晶体性质的影响
离子键越强,形成的离子晶体越稳定,离子晶体的熔、沸点越高,硬度越大。
阴、阳离子之间的作用力
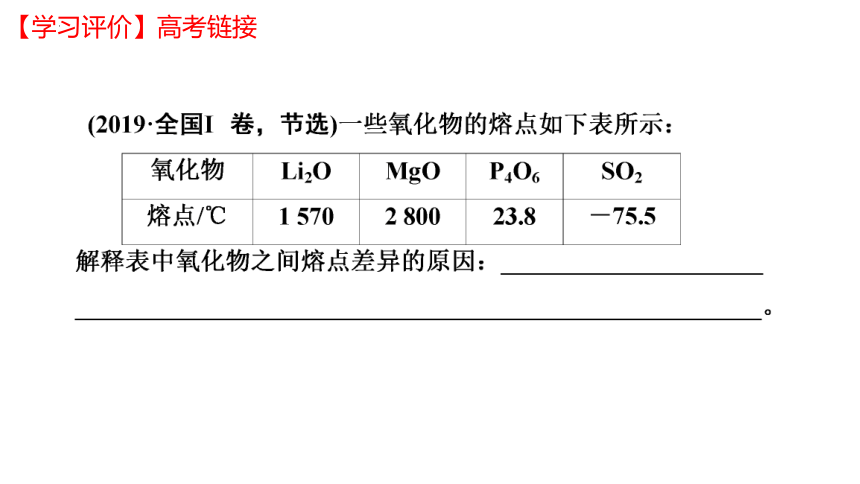
【学习评价】高考链接
(1)首先看物质的状态,一般情况下是固体>液体>气体;再看物质所属类型,一般是共价晶体>离子晶体>分子晶体
(2)结构类型相同时再根据相应规律进行判断。同类晶体熔、沸点比较思路:
分子晶体→分子间作用力→相对分子质量;
共价晶体→共价键键能→键长→原子半径;
离子晶体→离子键强弱→离子所带电荷数、离子半径;
金属晶体→金属键强弱→金属阳离子所带电荷、金属阳离子半径。
【归纳总结】比较不同晶体熔、沸点的基本思路
NaCl的晶胞示意图
CsCl的晶胞示意图
CaF2的晶胞示意图
二、离子晶体的晶胞
思考:氯化钠晶体中钠离子和氯离子分别处于晶胞的什么位置?
顶点和面心是钠离子
棱上和体心是氯离子
每个晶胞含钠离子和氯离子的个数:
钠离子和氯离子的个数比为
4、4
1:1
NaCl的晶胞
化学式:NaCl
每个Na+周围与之等距且距离最近的Cl-有___个,Na+有___个。
每个Cl-周围与之等距且距离最近的Na+有____个,Cl-有____个。
Cl-
Na+
6
12
6
12
配位数:一种离子周围最邻近的带相反电荷的离子数目
Na+的配位数为: ;
Cl-的配位数为: 。
6
6
NaCl晶体
Na+
Cl-
3
1
5
6
2
4
1
5
4
2
3
6
这几个Na+在空间构成的几何构型为__________
正八面体
NaCl晶体
CsCl晶体
(1)铯离子和氯离子的位置?
铯离子:
氯离子:
(2)每个晶胞含铯离子、氯离子的个数?
铯离子:
氯离子:
或者反之
1个;
1个。
体心
顶点
Cl-
Cs+
(3)配位数
它们所围成的空间几何构型是 。
8
正六面体
Cs+的配位数为: ;Cl-的配位数为: 。
8
CsCl晶体
2.下列有关晶体的叙述中,错误的是( )。
A.干冰晶体中,每个CO 周围紧邻12个CO
B.氯化钠晶体中,每个Na+周围紧邻且距离相等的Na+共有6个
C.氯化铯晶体中,每个Cs周围紧邻8个CI-
D.金刚石为三维骨架结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
【学习评价】教材P102 2
B
晶体类型 分子晶体 共价晶体 金属晶体 离子晶体
实例
构成晶体的离子
粒子间的相互作用或化学键类型
课堂总结:四类晶体的结构特点
熔沸点比较:一般是共价晶体>离子晶体>分子晶体
金属晶体的熔沸点差异性较大。
【补充习题】
C
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
第2课时 离子晶体
高二化学
胆矾
萤石
重晶石
烧碱
CuSO4·5H2O
CaF2
BaSO4
NaOH
【问题引入】
1、下列晶体构成微粒有什么共同点?
2、微粒之间存在哪种相同的作用力?
强碱、活泼金属的氧化物和过氧化物、大多数盐
由阴离子和阳离子相互作用而形成的晶体,叫做离子晶体
常见的离子晶体
概念:
构成微粒:
微粒间的作用力:
阴、阳离子(有的还存在电中性的分子,例如H2O、NH3)
离子键(静电作用:包括静电引力和静电斥力)
(一些离子晶体中还存在共价键、氢键等)
一、离子晶体
【学习评价】教材P94
硬度 熔点 沸点
NaCl 大 801℃ 1413℃
CsCl 645℃ 645℃
离子晶体的性质
熔沸点较高,硬度较大,难挥发难压缩,水溶液或者熔融状态下导电。
【思考】为什么NaCl和CsCl的硬度大、熔沸点高?影响离子晶体的熔沸点因素是什么?
离子晶体熔化和沸腾,需要破坏离子键,需要较多的能量。
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强。
2、影响离子键强弱的因素
二、离子键
1、离子键:
3、离子键对离子晶体性质的影响
离子键越强,形成的离子晶体越稳定,离子晶体的熔、沸点越高,硬度越大。
阴、阳离子之间的作用力
【学习评价】高考链接
(1)首先看物质的状态,一般情况下是固体>液体>气体;再看物质所属类型,一般是共价晶体>离子晶体>分子晶体
(2)结构类型相同时再根据相应规律进行判断。同类晶体熔、沸点比较思路:
分子晶体→分子间作用力→相对分子质量;
共价晶体→共价键键能→键长→原子半径;
离子晶体→离子键强弱→离子所带电荷数、离子半径;
金属晶体→金属键强弱→金属阳离子所带电荷、金属阳离子半径。
【归纳总结】比较不同晶体熔、沸点的基本思路
NaCl的晶胞示意图
CsCl的晶胞示意图
CaF2的晶胞示意图
二、离子晶体的晶胞
思考:氯化钠晶体中钠离子和氯离子分别处于晶胞的什么位置?
顶点和面心是钠离子
棱上和体心是氯离子
每个晶胞含钠离子和氯离子的个数:
钠离子和氯离子的个数比为
4、4
1:1
NaCl的晶胞
化学式:NaCl
每个Na+周围与之等距且距离最近的Cl-有___个,Na+有___个。
每个Cl-周围与之等距且距离最近的Na+有____个,Cl-有____个。
Cl-
Na+
6
12
6
12
配位数:一种离子周围最邻近的带相反电荷的离子数目
Na+的配位数为: ;
Cl-的配位数为: 。
6
6
NaCl晶体
Na+
Cl-
3
1
5
6
2
4
1
5
4
2
3
6
这几个Na+在空间构成的几何构型为__________
正八面体
NaCl晶体
CsCl晶体
(1)铯离子和氯离子的位置?
铯离子:
氯离子:
(2)每个晶胞含铯离子、氯离子的个数?
铯离子:
氯离子:
或者反之
1个;
1个。
体心
顶点
Cl-
Cs+
(3)配位数
它们所围成的空间几何构型是 。
8
正六面体
Cs+的配位数为: ;Cl-的配位数为: 。
8
CsCl晶体
2.下列有关晶体的叙述中,错误的是( )。
A.干冰晶体中,每个CO 周围紧邻12个CO
B.氯化钠晶体中,每个Na+周围紧邻且距离相等的Na+共有6个
C.氯化铯晶体中,每个Cs周围紧邻8个CI-
D.金刚石为三维骨架结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
【学习评价】教材P102 2
B
晶体类型 分子晶体 共价晶体 金属晶体 离子晶体
实例
构成晶体的离子
粒子间的相互作用或化学键类型
课堂总结:四类晶体的结构特点
熔沸点比较:一般是共价晶体>离子晶体>分子晶体
金属晶体的熔沸点差异性较大。
【补充习题】
C
