化学人教版(2019)必修第二册6.1.2 化学反应与电能(共49张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.1.2 化学反应与电能(共49张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 12.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-20 08:35:58 | ||
图片预览




文档简介
(共49张PPT)
第六章 化学反应与能量
第一节 化学反应与能量变化
第2课时 化学反应与电能
【学习目标】
1.掌握原电池的工作原理。
2.掌握原电池的构成条件。
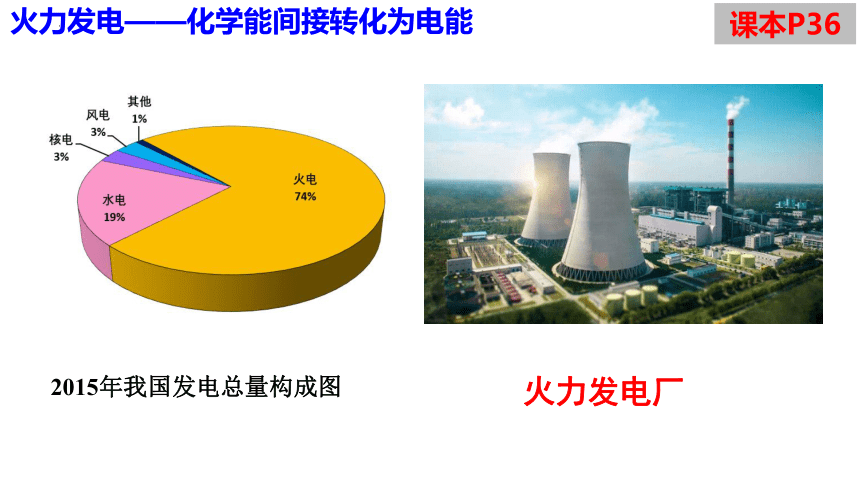
火力发电厂
2015年我国发电总量构成图
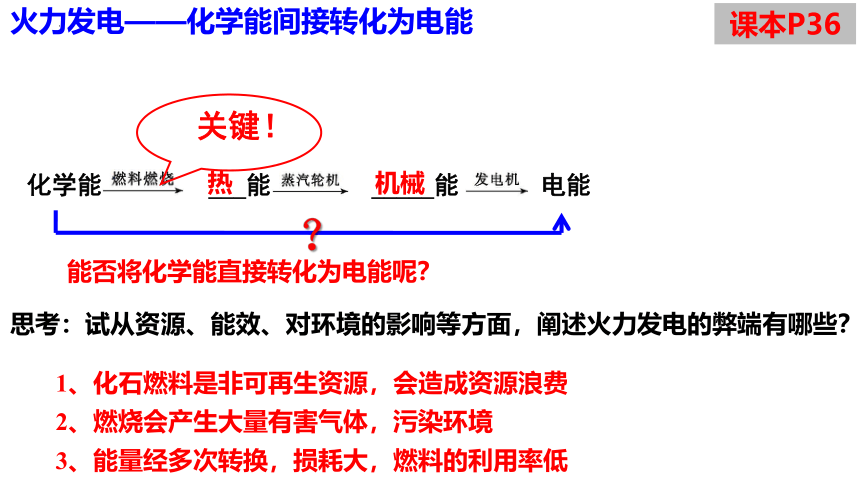
火力发电——化学能间接转化为电能
课本P36
化学能 ___能 _____能 电能
热
机械
关键!
?
1、化石燃料是非可再生资源,会造成资源浪费
2、燃烧会产生大量有害气体,污染环境
3、能量经多次转换,损耗大,燃料的利用率低
能否将化学能直接转化为电能呢?
火力发电——化学能间接转化为电能
思考:试从资源、能效、对环境的影响等方面,阐述火力发电的弊端有哪些?
课本P36
判断正误
(1)火力发电是将化学能首先转化为热能,然后转化为电能的过程( )
(2)火力发电过程中,机械能转化为电能是整个能量转化的关键( )
(3)火力发电能量利用率低、环境污染大,应彻底摒弃( )
×
×
×
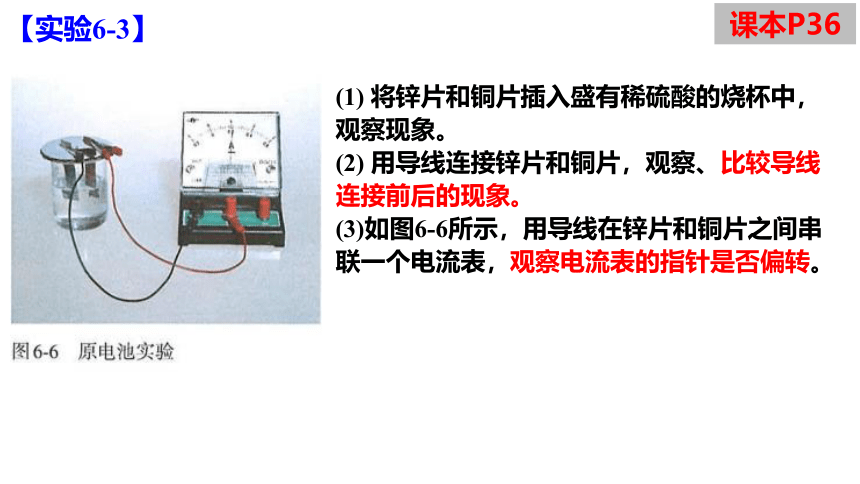
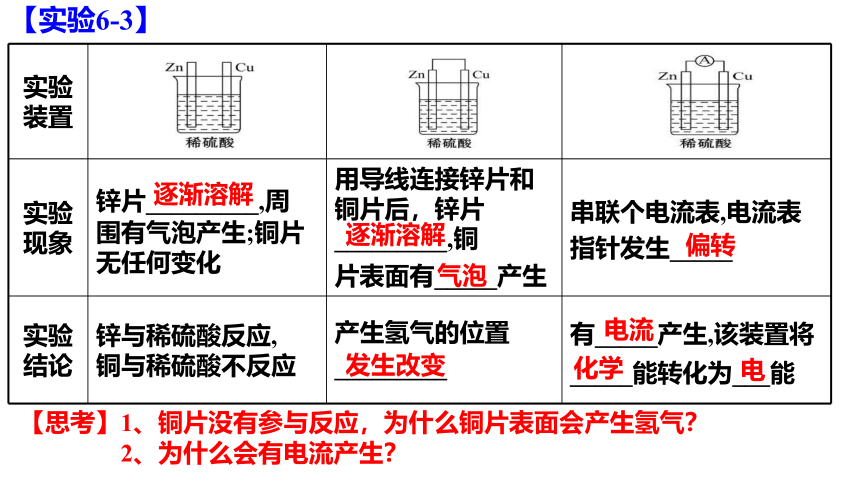
【实验6-3】
(1) 将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
(2) 用导线连接锌片和铜片,观察、比较导线连接前后的现象。
(3)如图6-6所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
课本P36
实验装置
实验 现象 锌片_________,周 围有气泡产生;铜片 无任何变化 用导线连接锌片和铜片后,锌片_________,铜 片表面有_____产生 串联个电流表,电流表
指针发生_____
实验 结论 锌与稀硫酸反应, 铜与稀硫酸不反应 产生氢气的位置 _________ 有_____产生,该装置将
_____能转化为___能
逐渐溶解
逐渐溶解
气泡
偏转
发生改变
电流
化学
电
【思考】1、铜片没有参与反应,为什么铜片表面会产生氢气?
2、为什么会有电流产生?
【实验6-3】
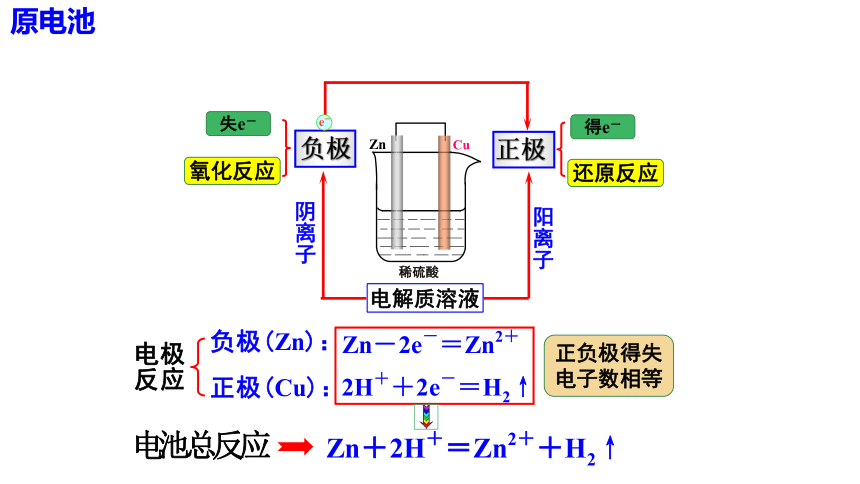
负极
正极
失e-
氧化反应
得e-
还原反应
正负极得失
电子数相等
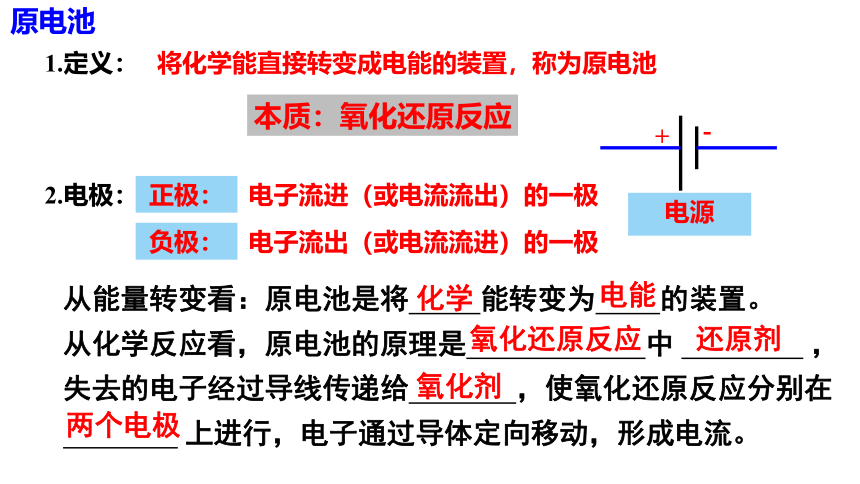
原电池
1.定义:
将化学能直接转变成电能的装置,称为原电池
电源
2.电极:
+
-
负极:
电子流进(或电流流出)的一极
正极:
电子流出(或电流流进)的一极
原电池
从能量转变看:原电池是将 能转变为 的装置。
从化学反应看,原电池的原理是 中 ,
失去的电子经过导线传递给 ,使氧化还原反应分别在
上进行,电子通过导体定向移动,形成电流。
化学
电能
氧化还原反应
还原剂
氧化剂
两个电极
本质:氧化还原反应
判断正误
(1)HCl+NaOH===NaCl+H2O是放热反应,可以设计成原电池( )
(2)将铜片和锌片用导线连接插入酒精中,电流表指针发生偏转( )
(3)在铜—锌—稀硫酸原电池中,电子由锌极通过导线流向铜极,再由铜极通过电解质溶液到达锌极( )
(4)原电池中阳离子向正极移动( )
(5)原电池中的负极反应一定是电极材料失电子( )
×
√
×
×
×
燃料电池
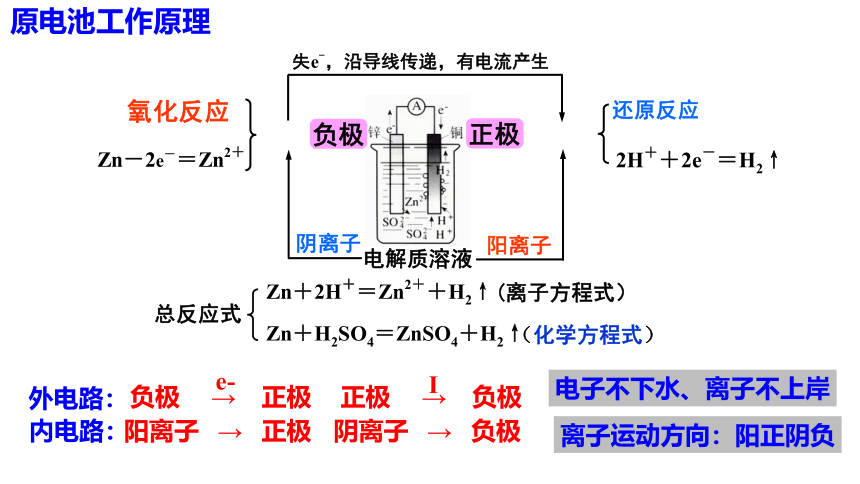
离子运动方向:阳正阴负
电子不下水、离子不上岸
本质:氧化还原反应
外电路:
内电路:
阳离子 → 正极
阴离子 → 负极
负极 → 正极
e-
正极 → 负极
Ⅰ
电子不下水、离子不上岸
离子运动方向:阳正阴负
原电池工作原理
原电池正负两极的判断方法
① 电子流向:
② 离子流向:
③ 电极材料:
④ 得失电子:
⑤ 电极现象:
电子流出的一极是负极;电子流入的一极是正极
阴离子移向的为负极;阳离子移向的为正极
较活泼金属为负极;较不活泼金属、非金属导体(石墨)为正极
负极发生氧化反应;正极发生还原反应
溶解、质量减小的为负极;电极增重或有气体产生的为正极
原电池正负两极的判断方法
【当堂检测】1、判断下列原电池的正负极
Zn
Cu
稀硫酸
Zn
Fe
A
稀硫酸
C
Zn
Fe
C
A
稀硫酸
A
稀硫酸
A
-
+
-
+
-
+
-
+
2、下列有关原电池的说法中正确的是( )
A.在外电路中,电子由负极经导线流向正极
B.在内电路中,电子由正极经电解质溶液流向负极
C.原电池工作时,正极表面一定有气泡产生
D.原电池工作时,一定不会伴随着热能变化
A
原电池的构成条件
(无电流)
Ag
(有电流)
构成条件1:能自发进行的、放热的氧化还原反应
铜-锌-稀硫酸原电池中,铜换成石墨棒能不能产生电流?
构成条件2:活泼性不同,可以导电的两极
负极: 较活泼的金属;正极: 较不活泼的金属或非金属导体(石墨)
原电池的构成条件
构成条件3:电极需插进电解质溶液中
(无电流)
(有电流)
原电池的构成条件
电解质溶液一般要能和某极发生氧化还原反应
构成条件4:必须形成闭合回路
(无电流)
(有电流)
原电池的构成条件
①
②
③
④
⑤
×
×
∨
∨
当堂检测:1、判断能否构成原电池?
原电池的构成条件
活泼性不同
电解质
闭合回路
氧化还原
∨
P10
P18
2、理论上不能设计为原电池的化学反应是( )
A.CH4 + 2O2 === CO2 + 2H2O
B.2FeCl3 + Fe === 3FeCl2
C.2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2↑
D.HNO3 + NaOH === NaNO3 + H2O
D
本质:氧化还原反应,发生电子的转移
当堂检测
3.下列装置中能够组成原电池的是_______(填序号),其他不能构成原电池的试分别说明理由:__________________________________________
______________________________________________________________________________。
③⑤
①中只有一个电极,②中两个电极的活泼性相
同,④中酒精为非电解质溶液,不能导电,⑥中电解质溶液(内电路)未形成闭合回路
当堂检测
4.根据原电池原理,结合装置图,按要求解答问题:
(1)若X为Zn,Y为硫酸铜溶液,则X为______(填电极名称),判断依据:______________________________
________;铜电极的名称是______,溶液中的Cu2+移向____(填“Cu”或“X”)电极。
负极
锌的活泼性比铜强(或Zn的还原性
比Cu强)
正极
Cu
(2)若X为银,Y为硝酸银溶液,则X为______(填电极名称),判断依据:______________________________________;铜电极的名称是______,溶液中的Ag+移向____(填“Cu”或“X”)电极。
正极
铜的活泼性比银强(或Cu的还原性比Ag强)
负极
X
当堂检测
已知:金属Sn、Pb与盐酸反应快慢无法区别,另锡与铅的颜色相近。
设计实验比较金属Sn、Pb的活泼性。
原电池原理的应用
金属活泼性判断
1
两电极均为金属(设还原性:A>B)
电极名称
A极为负极
反应类型
A极为氧化反应
电子流向
A极电子流出
反应现象
A极无气泡
A极溶解
02
04
01
03
方法
把A、B、C、D四块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若A、B相连时,A为负极;
C、D相连时,D上产生大量气泡;
A、C相连时,电流由C经导线流向A;
B、D相连时,电子由D经导线流向B。
则此4种金属的活动性由强到弱的顺序为
① A>B>C>D ② A>C>D>B
③ C>A>B>D ④ B>A>C>D
A>B
C>D
A>C
D>B
金属活泼性判断
1
实验室制取氢气时,常在稀硫酸中加入少量的硫酸铜溶液,其目的是什么?
H+
H+
H+
H+
加快反应速率
2
锌与置换出的铜形成原电池,加快了锌与酸的反应速率。
原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
【当堂检测】
过量铁与少量稀硫酸反应,为了加快反应速率,但是又不影响生成氢气的总量,可以采取的措施是 ( )
A.加入适量NaCl溶液 B.加入适量的水
C.加入几滴硫酸铜溶液 D.再加入少量稀硫酸
C
加快反应速率
2
金属的保护
3
使被保护的金属制品作原电池正极而得到保护。
思考:船身如何防腐蚀的?
用牺牲锌块(作负极)的方法来保护船身(作正极)
船身上装锌块
在图上标出电子和电流的流动方向,判断正负极,写出电极反应式和总反应式。
H2SO4 (aq)
Zn
Cu
负极( ): .
正极( ): .
总反应式: .
e-
I
Zn
Cu
Zn-2e - = Zn2+
2H++2e-=H2↑
Zn+2H+===Zn2++H2↑
电极反应式书写
①负极反应:还原剂-ne-===氧化产物
一般电极本身失电子 R-ne-===Rn+
负极溶解,质量减小
②正极反应:氧化剂+ne-===还原产物
一般电解质溶液中的阳离子得电子
2H++2e-===H2↑ 气体放出
或Tn++ne-===T 质量增大
③根据得失电子守恒,将正负反应式相加,得到总电极反应式。
若电极产物与电解液中的粒子反应,要求一并写入电极反应式。
设计原电池
4
在图上标出电子和电流的流动方向,判断正负极,写出电极反应式和总反应式。
CuSO4 (aq)
Zn
Cu
负极( ): .
正极( ): .
总反应式: .
e-
I
Zn
Cu
Zn-2e - = Zn2+
Cu2+ +2e - = Cu
Zn+Cu2+ = Zn2 ++ Cu
电极反应式的书写
H2SO4 (aq)
负极( ): .
正极( ): .
总反应式: .
Ag
Fe
I
e-
Fe
Ag
Fe-2e - = Fe2+
2H++2e - = H2↑
Fe+2H+ = Fe2+ +H2↑
如果将Cu改成C,还能形成原电池吗?
能;
一样
正负极和总反应式一样吗?
设计原电池
4
设计原电池装置证明Fe3+的氧化性比Cu2+强。
(1)写出能说明氧化性Fe3+大于Cu2+的离子方程式:______________。
(2)若将上述反应设计成原电池,电极反应式为
①负极: ______________。 ②正极:_________________。
2Fe3++Cu====2Fe2++Cu2+
Cu-2e-====Cu2+
2Fe3++2e-====2Fe2+
(3)画出装置图,指出电极材料和电解质溶液:
设计原电池
4
(1)将已知氧化还原反应拆分成两个半反应
氧化反应:还原剂-ne-===氧化产物 负极
还原反应:氧化剂+ne-===还原产物 正极
正极反应式+负极反应式―→电池总反应式
(2)根据总反应式并结合两个半反应,找出正、负极材料及电解质溶液
①电极材料的选择:选活泼性较强的金属作负极,活泼性较弱的 金属或能导电的惰性材料(如石墨)作正极。
②电解质溶液的选择:电解质溶液一般要能与负极发生反应,可参照总反应式选择电解质溶液。
设计原电池的一般思路
1.以Fe+CuSO4===FeSO4+Cu为例设计原电池
电极反应式 材料选择 装置
负极: _______________ 正极: _______________ 负极:___ 正极:Cu或C等(活泼性比Fe差的金属或导电的石墨棒均可) 电解质溶液: 溶液
Fe
CuSO4
Fe-2e-===Fe2+
Cu2++2e-===Cu
当堂检测
当堂检测
2.下列有关原电池的说法正确的是( )
A.将反应2Fe3++Fe=3Fe2+设计为原电池,则可用Zn为负极,Fe为 正极,FeCl3为电解质
B.铜片和铝片用导线连接后插入浓硝酸中,铜作负极
C.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
D.铝片和镁片用导线连接后插入NaOH溶液中,Mg较活泼作负极
B
(1)若a电极为铝,b电极为锌,X为稀硫酸,则a、b各为什么电极
(2)若a电极为铝,b电极为锌,X为浓硫酸,则a、b各为
什么电极
(3)若a电极为铜,b电极为石墨,则X是什么才能使该装置构成原电池
【拓展思考】如图所示原电池装置,试判断其电极情况:
a为负极,b为正极。因为铝的活动性大于锌。
a为正极,b为负极。因Al可被浓硫酸钝化而不能继续反应,而锌可以与浓硫酸反应,锌失电子发生氧化反应,故铝电极为正极,锌电极为负极。
石墨是稳定的电极,一般不发生反应,若使该装置构成原电池,则应使铜作负极,电解质溶液X应与铜发生反应。故可选AgNO3溶液或硝酸溶液或FeCl3溶液等。
(2)在判断原电池正负极时,不要只根据金属活动性的相对强弱还要考虑电解质溶液的特点。
①Mg—Al和稀盐酸构成的原电池中,Mg作负极,Al作正极;
而若把稀盐酸换为NaOH溶液,Al作负极,Mg作正极。
②Al—Cu和NaOH溶液构成的原电池中,Al作负极;
而若把NaOH溶液换为浓硝酸,Cu作负极。
【注意】
(1)原电池一般负极参加反应,表现为溶解、质量减小。但负极参加反应,质量不一定减小。如铅蓄电池放电时,负极反应为Pb-2e-+ SO42- ==PbSO4,负极质量不但没有减小,反而增加。
设计原电池
4
[例题] 请写出右边原电池的电极反应式。
Mg Al
NaOH溶液
A
①先写出总反应:即负极与电解质溶液反应
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
2Al + 2H2O + 2 OH- = 2AlO2- + 3H2↑
拆成离子方程式:
②确定该溶液为强碱性溶液,并根据化合价升降判断正负极
③负极:Al,失e- 。
2Al - 6e- = 2Al3+
2Al3+ + 8OH- =2AlO2- + 4H2O
负极总反应: 2Al +8OH- -6e- =2AlO2- + 4H2O
正极:总反应-负极反应:
6H2O +6e- =6OH-+ 3H2↑
-6e-
+6e-
1.一次电池
(1)特点:电池放电后 充电(内部的氧化还原反应 逆向进行),如锌锰干电池、碱性锌锰干电池、锌银电池(钮扣电池)等。。
(2)锌锰干电池的构造如图所示。
①锌筒为 ,电极反应是 。
②石墨棒为 ,最终被还原的物质是 。
③NH4Cl糊的作用是 。
不能
无法
负极
正极
二氧化锰
作电解质溶液
Zn-2e-===Zn2+
化学电池
课本P38
电极反应式:
负极:
正极:
总反应:
Zn+2MnO2 + 2NH4Cl =ZnCl2+Mn2O3+2NH3+H2O
普通锌锰干电池
Zn - 2e-=Zn2+
2MnO2 + 2NH4++ 2e- =Mn2O3+2NH3 +H2O
特点:制作简单、价格便宜、便于携带;
但不能充电,放电时间短,电压下降快
化学电池
1.一次电池
课本P38
2.二次电池
化学电池
镍氢电池
铅酸蓄电池
锂离子电池
课本P38
铅酸蓄电池的电极反应:
2.二次电池
化学电池
思考:1.负极的质量是增加还是减重?
2.阴阳离子往那个方向迁移?
3.溶液中PH值如何变化?
汽车的启动电源常用蓄电池。其结构如图所示,放电时其电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断,下列叙述中不正确的是:
A.Pb作为负极,失去电子,被氧化
B.PbO2得电子,被还原
C.负极反应是Pb+SO42- -2e- =PbSO4
D.电池放电时,溶液酸性增强
当堂检测
D
(1)概念:一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置。
(2)优点:①具有清洁、安全、高效等特点;
②能量转化率可以达到 _____ 以上;
③反应物不在电池内部,而是从外部提供,供电量易于调节。
(3)燃料电池常用的燃料有: 、 、乙醇等;常用氧化剂:氧气。
80%
氢气
甲烷
3.燃料电池
化学电池
课本P39
(1)锌锰干电池工作一段时间后碳棒变细( )
(2)氢氧燃料电池是将热能直接转变为电能( )
(3)充电电池可以无限制地反复充电、放电( )
(4)氢氧燃料电池比氢气直接燃烧发电能量利用率高( )
×
×
×
√
当堂检测
1.判断正误
2.下列有关锌锰干电池的说法中正确的是( )
A.锌外壳是负极材料,石墨棒是正极材料
B.在外电路中电子从石墨棒流向锌外壳
C.在外电路中电流从锌外壳流向石墨棒
D.在电池内部阳离子从石墨棒向锌外壳移动
A
当堂检测
当堂检测
3.下列关于化学电源的说法正确的是( )
A.干电池放电之后还能再充电
B.充电电池在放电和充电时都将化学能转化为电能
C.充电电池可以无限制地反复放电、充电
D.氢氧燃料电池是一种环境友好型电池
D
当堂检测
介质 电池总反应:2H2 +O2 == 2H2O
酸性 负极
正极
中性 负极
正极
碱性 负极
正极
氢氧燃料电池
2H2 - 4e- == 4H+
O2 + 4H+ + 4e-== 2H2O
2H2 - 4e- == 4H+
O2 + 2H2O + 4e-== 4OH-
2H2 +4OH-- 4e- == 4H2O
O2 + 2H2O + 4e-== 4OH-
注意:
1.燃料电池不燃烧,不写“点燃”条件。
2.电极不参与反应,一般正负电极都为 Pt 。
3.输入燃料的一极为负极,输入O2的一极为正极。
4.电解质酸碱性不同,电极反应不同:
在碱溶液中,不可能有H+出现;
在酸溶液中,不可能出现OH-。
燃料电池的规律
第六章 化学反应与能量
第一节 化学反应与能量变化
第2课时 化学反应与电能
【学习目标】
1.掌握原电池的工作原理。
2.掌握原电池的构成条件。
火力发电厂
2015年我国发电总量构成图
火力发电——化学能间接转化为电能
课本P36
化学能 ___能 _____能 电能
热
机械
关键!
?
1、化石燃料是非可再生资源,会造成资源浪费
2、燃烧会产生大量有害气体,污染环境
3、能量经多次转换,损耗大,燃料的利用率低
能否将化学能直接转化为电能呢?
火力发电——化学能间接转化为电能
思考:试从资源、能效、对环境的影响等方面,阐述火力发电的弊端有哪些?
课本P36
判断正误
(1)火力发电是将化学能首先转化为热能,然后转化为电能的过程( )
(2)火力发电过程中,机械能转化为电能是整个能量转化的关键( )
(3)火力发电能量利用率低、环境污染大,应彻底摒弃( )
×
×
×
【实验6-3】
(1) 将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
(2) 用导线连接锌片和铜片,观察、比较导线连接前后的现象。
(3)如图6-6所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
课本P36
实验装置
实验 现象 锌片_________,周 围有气泡产生;铜片 无任何变化 用导线连接锌片和铜片后,锌片_________,铜 片表面有_____产生 串联个电流表,电流表
指针发生_____
实验 结论 锌与稀硫酸反应, 铜与稀硫酸不反应 产生氢气的位置 _________ 有_____产生,该装置将
_____能转化为___能
逐渐溶解
逐渐溶解
气泡
偏转
发生改变
电流
化学
电
【思考】1、铜片没有参与反应,为什么铜片表面会产生氢气?
2、为什么会有电流产生?
【实验6-3】
负极
正极
失e-
氧化反应
得e-
还原反应
正负极得失
电子数相等
原电池
1.定义:
将化学能直接转变成电能的装置,称为原电池
电源
2.电极:
+
-
负极:
电子流进(或电流流出)的一极
正极:
电子流出(或电流流进)的一极
原电池
从能量转变看:原电池是将 能转变为 的装置。
从化学反应看,原电池的原理是 中 ,
失去的电子经过导线传递给 ,使氧化还原反应分别在
上进行,电子通过导体定向移动,形成电流。
化学
电能
氧化还原反应
还原剂
氧化剂
两个电极
本质:氧化还原反应
判断正误
(1)HCl+NaOH===NaCl+H2O是放热反应,可以设计成原电池( )
(2)将铜片和锌片用导线连接插入酒精中,电流表指针发生偏转( )
(3)在铜—锌—稀硫酸原电池中,电子由锌极通过导线流向铜极,再由铜极通过电解质溶液到达锌极( )
(4)原电池中阳离子向正极移动( )
(5)原电池中的负极反应一定是电极材料失电子( )
×
√
×
×
×
燃料电池
离子运动方向:阳正阴负
电子不下水、离子不上岸
本质:氧化还原反应
外电路:
内电路:
阳离子 → 正极
阴离子 → 负极
负极 → 正极
e-
正极 → 负极
Ⅰ
电子不下水、离子不上岸
离子运动方向:阳正阴负
原电池工作原理
原电池正负两极的判断方法
① 电子流向:
② 离子流向:
③ 电极材料:
④ 得失电子:
⑤ 电极现象:
电子流出的一极是负极;电子流入的一极是正极
阴离子移向的为负极;阳离子移向的为正极
较活泼金属为负极;较不活泼金属、非金属导体(石墨)为正极
负极发生氧化反应;正极发生还原反应
溶解、质量减小的为负极;电极增重或有气体产生的为正极
原电池正负两极的判断方法
【当堂检测】1、判断下列原电池的正负极
Zn
Cu
稀硫酸
Zn
Fe
A
稀硫酸
C
Zn
Fe
C
A
稀硫酸
A
稀硫酸
A
-
+
-
+
-
+
-
+
2、下列有关原电池的说法中正确的是( )
A.在外电路中,电子由负极经导线流向正极
B.在内电路中,电子由正极经电解质溶液流向负极
C.原电池工作时,正极表面一定有气泡产生
D.原电池工作时,一定不会伴随着热能变化
A
原电池的构成条件
(无电流)
Ag
(有电流)
构成条件1:能自发进行的、放热的氧化还原反应
铜-锌-稀硫酸原电池中,铜换成石墨棒能不能产生电流?
构成条件2:活泼性不同,可以导电的两极
负极: 较活泼的金属;正极: 较不活泼的金属或非金属导体(石墨)
原电池的构成条件
构成条件3:电极需插进电解质溶液中
(无电流)
(有电流)
原电池的构成条件
电解质溶液一般要能和某极发生氧化还原反应
构成条件4:必须形成闭合回路
(无电流)
(有电流)
原电池的构成条件
①
②
③
④
⑤
×
×
∨
∨
当堂检测:1、判断能否构成原电池?
原电池的构成条件
活泼性不同
电解质
闭合回路
氧化还原
∨
P10
P18
2、理论上不能设计为原电池的化学反应是( )
A.CH4 + 2O2 === CO2 + 2H2O
B.2FeCl3 + Fe === 3FeCl2
C.2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2↑
D.HNO3 + NaOH === NaNO3 + H2O
D
本质:氧化还原反应,发生电子的转移
当堂检测
3.下列装置中能够组成原电池的是_______(填序号),其他不能构成原电池的试分别说明理由:__________________________________________
______________________________________________________________________________。
③⑤
①中只有一个电极,②中两个电极的活泼性相
同,④中酒精为非电解质溶液,不能导电,⑥中电解质溶液(内电路)未形成闭合回路
当堂检测
4.根据原电池原理,结合装置图,按要求解答问题:
(1)若X为Zn,Y为硫酸铜溶液,则X为______(填电极名称),判断依据:______________________________
________;铜电极的名称是______,溶液中的Cu2+移向____(填“Cu”或“X”)电极。
负极
锌的活泼性比铜强(或Zn的还原性
比Cu强)
正极
Cu
(2)若X为银,Y为硝酸银溶液,则X为______(填电极名称),判断依据:______________________________________;铜电极的名称是______,溶液中的Ag+移向____(填“Cu”或“X”)电极。
正极
铜的活泼性比银强(或Cu的还原性比Ag强)
负极
X
当堂检测
已知:金属Sn、Pb与盐酸反应快慢无法区别,另锡与铅的颜色相近。
设计实验比较金属Sn、Pb的活泼性。
原电池原理的应用
金属活泼性判断
1
两电极均为金属(设还原性:A>B)
电极名称
A极为负极
反应类型
A极为氧化反应
电子流向
A极电子流出
反应现象
A极无气泡
A极溶解
02
04
01
03
方法
把A、B、C、D四块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若A、B相连时,A为负极;
C、D相连时,D上产生大量气泡;
A、C相连时,电流由C经导线流向A;
B、D相连时,电子由D经导线流向B。
则此4种金属的活动性由强到弱的顺序为
① A>B>C>D ② A>C>D>B
③ C>A>B>D ④ B>A>C>D
A>B
C>D
A>C
D>B
金属活泼性判断
1
实验室制取氢气时,常在稀硫酸中加入少量的硫酸铜溶液,其目的是什么?
H+
H+
H+
H+
加快反应速率
2
锌与置换出的铜形成原电池,加快了锌与酸的反应速率。
原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
【当堂检测】
过量铁与少量稀硫酸反应,为了加快反应速率,但是又不影响生成氢气的总量,可以采取的措施是 ( )
A.加入适量NaCl溶液 B.加入适量的水
C.加入几滴硫酸铜溶液 D.再加入少量稀硫酸
C
加快反应速率
2
金属的保护
3
使被保护的金属制品作原电池正极而得到保护。
思考:船身如何防腐蚀的?
用牺牲锌块(作负极)的方法来保护船身(作正极)
船身上装锌块
在图上标出电子和电流的流动方向,判断正负极,写出电极反应式和总反应式。
H2SO4 (aq)
Zn
Cu
负极( ): .
正极( ): .
总反应式: .
e-
I
Zn
Cu
Zn-2e - = Zn2+
2H++2e-=H2↑
Zn+2H+===Zn2++H2↑
电极反应式书写
①负极反应:还原剂-ne-===氧化产物
一般电极本身失电子 R-ne-===Rn+
负极溶解,质量减小
②正极反应:氧化剂+ne-===还原产物
一般电解质溶液中的阳离子得电子
2H++2e-===H2↑ 气体放出
或Tn++ne-===T 质量增大
③根据得失电子守恒,将正负反应式相加,得到总电极反应式。
若电极产物与电解液中的粒子反应,要求一并写入电极反应式。
设计原电池
4
在图上标出电子和电流的流动方向,判断正负极,写出电极反应式和总反应式。
CuSO4 (aq)
Zn
Cu
负极( ): .
正极( ): .
总反应式: .
e-
I
Zn
Cu
Zn-2e - = Zn2+
Cu2+ +2e - = Cu
Zn+Cu2+ = Zn2 ++ Cu
电极反应式的书写
H2SO4 (aq)
负极( ): .
正极( ): .
总反应式: .
Ag
Fe
I
e-
Fe
Ag
Fe-2e - = Fe2+
2H++2e - = H2↑
Fe+2H+ = Fe2+ +H2↑
如果将Cu改成C,还能形成原电池吗?
能;
一样
正负极和总反应式一样吗?
设计原电池
4
设计原电池装置证明Fe3+的氧化性比Cu2+强。
(1)写出能说明氧化性Fe3+大于Cu2+的离子方程式:______________。
(2)若将上述反应设计成原电池,电极反应式为
①负极: ______________。 ②正极:_________________。
2Fe3++Cu====2Fe2++Cu2+
Cu-2e-====Cu2+
2Fe3++2e-====2Fe2+
(3)画出装置图,指出电极材料和电解质溶液:
设计原电池
4
(1)将已知氧化还原反应拆分成两个半反应
氧化反应:还原剂-ne-===氧化产物 负极
还原反应:氧化剂+ne-===还原产物 正极
正极反应式+负极反应式―→电池总反应式
(2)根据总反应式并结合两个半反应,找出正、负极材料及电解质溶液
①电极材料的选择:选活泼性较强的金属作负极,活泼性较弱的 金属或能导电的惰性材料(如石墨)作正极。
②电解质溶液的选择:电解质溶液一般要能与负极发生反应,可参照总反应式选择电解质溶液。
设计原电池的一般思路
1.以Fe+CuSO4===FeSO4+Cu为例设计原电池
电极反应式 材料选择 装置
负极: _______________ 正极: _______________ 负极:___ 正极:Cu或C等(活泼性比Fe差的金属或导电的石墨棒均可) 电解质溶液: 溶液
Fe
CuSO4
Fe-2e-===Fe2+
Cu2++2e-===Cu
当堂检测
当堂检测
2.下列有关原电池的说法正确的是( )
A.将反应2Fe3++Fe=3Fe2+设计为原电池,则可用Zn为负极,Fe为 正极,FeCl3为电解质
B.铜片和铝片用导线连接后插入浓硝酸中,铜作负极
C.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
D.铝片和镁片用导线连接后插入NaOH溶液中,Mg较活泼作负极
B
(1)若a电极为铝,b电极为锌,X为稀硫酸,则a、b各为什么电极
(2)若a电极为铝,b电极为锌,X为浓硫酸,则a、b各为
什么电极
(3)若a电极为铜,b电极为石墨,则X是什么才能使该装置构成原电池
【拓展思考】如图所示原电池装置,试判断其电极情况:
a为负极,b为正极。因为铝的活动性大于锌。
a为正极,b为负极。因Al可被浓硫酸钝化而不能继续反应,而锌可以与浓硫酸反应,锌失电子发生氧化反应,故铝电极为正极,锌电极为负极。
石墨是稳定的电极,一般不发生反应,若使该装置构成原电池,则应使铜作负极,电解质溶液X应与铜发生反应。故可选AgNO3溶液或硝酸溶液或FeCl3溶液等。
(2)在判断原电池正负极时,不要只根据金属活动性的相对强弱还要考虑电解质溶液的特点。
①Mg—Al和稀盐酸构成的原电池中,Mg作负极,Al作正极;
而若把稀盐酸换为NaOH溶液,Al作负极,Mg作正极。
②Al—Cu和NaOH溶液构成的原电池中,Al作负极;
而若把NaOH溶液换为浓硝酸,Cu作负极。
【注意】
(1)原电池一般负极参加反应,表现为溶解、质量减小。但负极参加反应,质量不一定减小。如铅蓄电池放电时,负极反应为Pb-2e-+ SO42- ==PbSO4,负极质量不但没有减小,反而增加。
设计原电池
4
[例题] 请写出右边原电池的电极反应式。
Mg Al
NaOH溶液
A
①先写出总反应:即负极与电解质溶液反应
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
2Al + 2H2O + 2 OH- = 2AlO2- + 3H2↑
拆成离子方程式:
②确定该溶液为强碱性溶液,并根据化合价升降判断正负极
③负极:Al,失e- 。
2Al - 6e- = 2Al3+
2Al3+ + 8OH- =2AlO2- + 4H2O
负极总反应: 2Al +8OH- -6e- =2AlO2- + 4H2O
正极:总反应-负极反应:
6H2O +6e- =6OH-+ 3H2↑
-6e-
+6e-
1.一次电池
(1)特点:电池放电后 充电(内部的氧化还原反应 逆向进行),如锌锰干电池、碱性锌锰干电池、锌银电池(钮扣电池)等。。
(2)锌锰干电池的构造如图所示。
①锌筒为 ,电极反应是 。
②石墨棒为 ,最终被还原的物质是 。
③NH4Cl糊的作用是 。
不能
无法
负极
正极
二氧化锰
作电解质溶液
Zn-2e-===Zn2+
化学电池
课本P38
电极反应式:
负极:
正极:
总反应:
Zn+2MnO2 + 2NH4Cl =ZnCl2+Mn2O3+2NH3+H2O
普通锌锰干电池
Zn - 2e-=Zn2+
2MnO2 + 2NH4++ 2e- =Mn2O3+2NH3 +H2O
特点:制作简单、价格便宜、便于携带;
但不能充电,放电时间短,电压下降快
化学电池
1.一次电池
课本P38
2.二次电池
化学电池
镍氢电池
铅酸蓄电池
锂离子电池
课本P38
铅酸蓄电池的电极反应:
2.二次电池
化学电池
思考:1.负极的质量是增加还是减重?
2.阴阳离子往那个方向迁移?
3.溶液中PH值如何变化?
汽车的启动电源常用蓄电池。其结构如图所示,放电时其电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断,下列叙述中不正确的是:
A.Pb作为负极,失去电子,被氧化
B.PbO2得电子,被还原
C.负极反应是Pb+SO42- -2e- =PbSO4
D.电池放电时,溶液酸性增强
当堂检测
D
(1)概念:一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置。
(2)优点:①具有清洁、安全、高效等特点;
②能量转化率可以达到 _____ 以上;
③反应物不在电池内部,而是从外部提供,供电量易于调节。
(3)燃料电池常用的燃料有: 、 、乙醇等;常用氧化剂:氧气。
80%
氢气
甲烷
3.燃料电池
化学电池
课本P39
(1)锌锰干电池工作一段时间后碳棒变细( )
(2)氢氧燃料电池是将热能直接转变为电能( )
(3)充电电池可以无限制地反复充电、放电( )
(4)氢氧燃料电池比氢气直接燃烧发电能量利用率高( )
×
×
×
√
当堂检测
1.判断正误
2.下列有关锌锰干电池的说法中正确的是( )
A.锌外壳是负极材料,石墨棒是正极材料
B.在外电路中电子从石墨棒流向锌外壳
C.在外电路中电流从锌外壳流向石墨棒
D.在电池内部阳离子从石墨棒向锌外壳移动
A
当堂检测
当堂检测
3.下列关于化学电源的说法正确的是( )
A.干电池放电之后还能再充电
B.充电电池在放电和充电时都将化学能转化为电能
C.充电电池可以无限制地反复放电、充电
D.氢氧燃料电池是一种环境友好型电池
D
当堂检测
介质 电池总反应:2H2 +O2 == 2H2O
酸性 负极
正极
中性 负极
正极
碱性 负极
正极
氢氧燃料电池
2H2 - 4e- == 4H+
O2 + 4H+ + 4e-== 2H2O
2H2 - 4e- == 4H+
O2 + 2H2O + 4e-== 4OH-
2H2 +4OH-- 4e- == 4H2O
O2 + 2H2O + 4e-== 4OH-
注意:
1.燃料电池不燃烧,不写“点燃”条件。
2.电极不参与反应,一般正负电极都为 Pt 。
3.输入燃料的一极为负极,输入O2的一极为正极。
4.电解质酸碱性不同,电极反应不同:
在碱溶液中,不可能有H+出现;
在酸溶液中,不可能出现OH-。
燃料电池的规律
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
