人教版(2019)高中化学必修第二册 《硫和二氧化硫》优质课件(共35张PPT)
文档属性
| 名称 | 人教版(2019)高中化学必修第二册 《硫和二氧化硫》优质课件(共35张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 97.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-20 11:06:51 | ||
图片预览









文档简介
(共35张PPT)
雄枪何正拟俯乒洲羊虎阔季价塔枯做端媳摹廖根寺茧组孙仍献菱己哲销求硫及硫的氧化物硫及硫的氧化物
硅抖劫巷位辗糖展矛佃圃协抱鲁县皂屁瓤奋缀昼讣腻凄缉箱鹰免闸饭蒂膊硫及硫的氧化物硫及硫的氧化物
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
课时1 硫和硫的氧化物
空气中往往弥漫着特殊的火药味,这是什么物质的气味呢?
新课导入
四
大
发
明
火
新课导入
火药中含有硝酸钾、木炭和硫(俗称硫黄),其中硫燃烧时会产生这种有刺激性气味的气体。
学习目标
1.认识硫的存在与性质。
2.会依据酸性氧化物的通性及硫元素的化合价分析理解硫的氧化物的性质,会比较二氧化硫和氯水漂白性的区别。
3.了解可逆反应的特点。
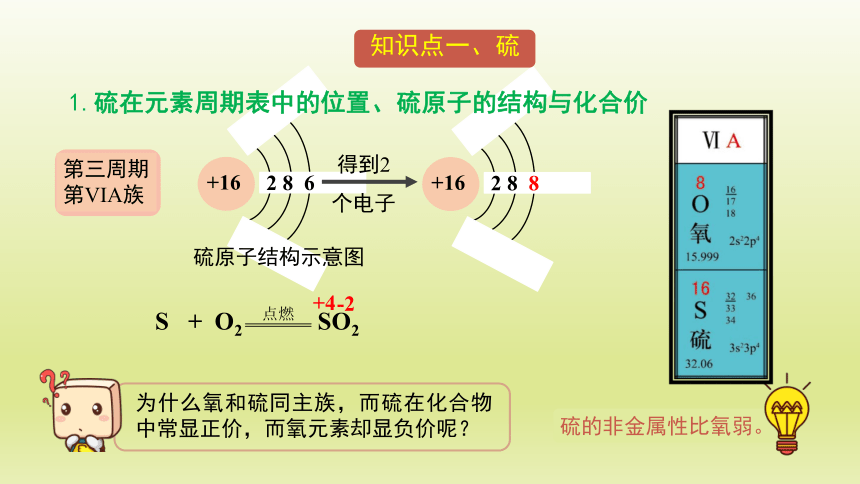
2 8 8
+16
2 8 6
硫原子结构示意图
+16
知识点一、硫
1.硫在元素周期表中的位置、硫原子的结构与化合价
-2
+4
为什么氧和硫同主族,而硫在化合物中常显正价,而氧元素却显负价呢?
硫的非金属性比氧弱。
S + O2 SO2
第三周期
第VIA族
得到2
个电子
硫元素的存在形式有哪些呢?
游离态:火山口附近或地壳的岩石
硫化物:硫铁矿(FeS2)
黄铜矿(CuFeS2)
硫酸盐:石膏(CaSO4·2H2O)
芒硝(Na2SO4·10H2O)
化合态
存在形式
2.硫元素的存在形式
硫铁矿
黄铜矿
石膏
芒硝
单质硫
观察·讨论
硫粉
火山喷发口的硫
晶体硫
(1)观察图片,归纳硫的物理性质。
硫,俗称硫黄,是一种黄色晶体,质脆,易研成粉末。
3.硫的物理性质
观察·讨论
(2)实验探究硫的溶解性
溶剂 水 酒精 二硫化碳
现象
难溶
微溶
易溶
二硫化碳是一种无机物,化学式为CS ,常见溶剂,无色液体。它可溶解硫单质。二硫化碳用于制造人造丝、杀虫剂、促进剂等。
二硫化碳
硫的物理性质:
①硫是一种黄色晶体,质脆,易研成粉末。
②硫难溶于水,微溶于酒精,易溶于二硫化碳。
如何除去试管内壁附着的硫?
用二硫化碳洗涤。
实验探究
4.硫的化学性质
(1)硫与金属铁、铜的反应
化学方程式:2Cu+S Cu2S(硫化亚铜,黑色)
Fe+S FeS(硫化亚铁,黑色)
硫单质具有什么性质?
硫单质具有氧化性。
观察·讨论
2 8 7
氯原子结构示意图
+17
2 8 6
硫原子结构示意图
+16
铁 铜
与氯气反应产物
与硫反应的产物
金属元素化合价不同的原因 2FeCl3(铁显+3价)
CuCl2(铜显+2价)
FeS(铁显+2价)
Cu2S(铁显+1价)
硫的非金属性比氯的非金属性弱
对比氯气和硫与铁、铜反应
硫的非金属性较弱,与金属反应都生成低价态的化合物,具有弱氧化性。
讨论·小结
(2)硫与非金属氢气、氧气反应
H2 + S H2S(硫化氢)
S +O2 SO2
氧化剂
还原剂
硫单质既具有氧化性,又具有还原性。
-2 0 +4 +6
硫元素的化合价
S
硫与过量氧气反应会产生SO3吗?
不会。
观察·讨论
4.硫的用途
蛋白质的重要组成元素
制硫酸
制肥料
制火药
制润滑剂
制抗真菌剂
观察·小结
知识点二、二氧化硫
1.二氧化硫的物理性质
实验活动:收集一试管SO2气体,观察其颜色,并闻其味道(注意操作方法)。
SO2是一种无色、有刺激性气味的有毒气体,密度比空气的大。
能引发呼吸道疾病、浓度高时会令人死亡
和空气的平均相对分子质量对比
观察·讨论
SO2在水中的溶解性如何?怎样通过实验证明?
实验步骤:
①把充满SO2、塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内液面的上升情况。
二氧化硫易溶于水,通常情况下,1体积的水可以溶解约40体积的二氧化硫。
实验·思考
②待液面高度不再发生明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度(保留该溶液供实验5-2使用)。
二氧化硫溶于水后的溶液显酸性。
实验·思考
2.二氧化硫的化学性质
(1)二氧化硫与水反应
为什么SO2溶于水后会显酸性呢?
二氧化碳溶于水后的溶液显酸性,是因为二氧化碳与水能反应生成碳酸,且碳酸不稳定。
SO2是一种酸性氧化物,SO2溶于水生成亚硫酸(H2SO3),亚硫酸不稳定,又易分解生成SO2和水。
思考·讨论
SO2和水反应的化学方程为:SO2+H2O H2SO3。
此化学方程式与通常所写的化学方程式有何区别?
像这种在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应。用可逆号“ ”表示。
思考·讨论
不是,反应条件不同
一级电离:H2SO3 H++HSO3-
二级电离:HSO3- H++SO32-
氢气在氧气中燃烧和电解水是可逆反应吗?
类比碳酸的电离方程式,写出亚硫酸的电离方程式。
思考·讨论
(2)二氧化硫酸性氧化物的性质
①与碱反应
SO2(少量)+2NaOH=Na2SO3+H2O
SO2(足量)+NaOH=NaHSO3
SO2足量时实际上发生了两步反应:
SO2(少量)+2NaOH=Na2SO3+H2O;
Na2SO3+SO2+H2O=2NaHSO3
能用澄清石灰水区分SO2和CO2吗?
不能,都能生成白色沉淀。
SO2 (少量)+ Ca(OH)2=
CaSO3 ↓ + H2O
2SO2(足量)+Ca(OH)2=
Ca(HSO3)2
回顾·思考
②与碱性氧化物的反应
SO2 + Na2O= Na2SO3 (亚硫酸钠)
SO2 + CaO= CaSO3 (亚硫酸钙)
③与盐溶液的反应
Na2CO3 + SO2 + H2O = Na2SO3 + CO2+ H2O
酸性:H2SO3>H2CO3(弱酸)
你能写出SO2与碱、盐溶液反应的离子方程式吗?
回顾·思考
(3)二氧化硫的还原性、氧化性
SO2中S元素化合价为+4价,处于中间价态,如果硫元素的化合价升高,可能会生成什么呢?
-2 0 +4 +6
硫元素的化合价
H2S S SO2 SO3
思考·讨论
SO2具有还原性,可被Cl2、O2、KMnO4(H+)、HNO3、Fe3+、Na2O2等许多氧化剂氧化。
二氧化硫与氧气反应:2SO2+O2 2SO3
5SO2+2KMnO4+2H2O=2H2SO4+K2SO4+2MnSO4
2Fe3++SO2+2H2O=SO42-+4H++2Fe2+
Cl2+SO2+2H2O=H2SO4+2HCl
催化剂
△
思考·讨论
如何鉴别CO2和SO2?怎样除去CO2混有的SO2?
鉴别:
取两支试管分别装有少量高锰酸钾溶液,分别向试管中通入SO2和CO2,褪色的是SO2,没有褪色的是CO2。
除杂:
将混合气体通入具有氧化性的溶液中,比如高锰酸钾、氯化铁溶液等,可除去CO2混有的SO2。
思考·讨论
如果SO2中硫元素化合价降低,可能会生成什么呢?
二氧化硫既具有氧化性又具有还原性。
二氧化硫与H2S反应生成硫和水,反应方程式为:SO2+2H2S=3S+2H2O。
硫化氢,分子式为H2S,分子量为34.076,标准状况下是一种易燃的酸性气体,无色,低浓度时有臭鸡蛋气味,浓度极低时便有硫磺味,有剧毒,其水溶液为氢硫酸,酸性较弱,比碳酸弱,但比硼酸强。
思考·讨论
2.二氧化硫的化学性质
(4)二氧化硫的漂白性
农忙时,奶奶新买的草帽
第二年农忙时
奶奶拿出草帽,变黄了
这是为什么呢?
思考·讨论
2.二氧化硫的化学性质
(4)二氧化硫的漂白性
实验操作:
用试管取2mL在实验5-1中得到的溶液,向其中滴入1~2滴品红溶液,振荡,观察溶液的颜色变化。然后加热试管,注意通风,再观察溶液的变化。
实验操作 现象 分析
向品红溶液中通入SO2
加热试管
实验现象:
颜色逐渐变浅
SO2具有漂白性
颜色又逐渐变红
生成的无色物质不稳定
实验·讨论
2.二氧化硫的化学性质
(4)二氧化硫的漂白性
氯水 二氧化硫
原理
实质
效果
范围
氯水中的HClO将有色物质氧化成无色物质
SO2溶于水产生的H2SO3与有色物质直接结合生成不稳定的无色物质
氧化还原反应
非氧化还原反应
永久性
暂时性
可漂白大多数有色物质,能使紫色石蕊溶液褪色
只能漂白有色物质,不能使紫色石蕊溶液褪色(石蕊溶液变红)
回顾·对比
二氧化硫和氯气按1:1混合通入品红溶液会有什么变化?
品红溶液颜色不会褪去,因为Cl2+SO2+2H2O=H2SO4+2HCl,生成的盐酸和硫酸不具有漂白性。
思考·讨论
3.二氧化硫的用途
制造硫酸
漂白纸浆、草编制品等
杀灭霉菌和细菌
作食物和干果的防腐剂
观察·小结
O2
H2S
化学性质
Fe
Cu
H2
FeS
CuS
H2S
化学
性质
H2O
H2SO3
NaOH
Na2SO3
NaHSO3
CaSO3
Ca(HSO3)2
氧化剂
SO42-
Ca(OH)2
部分有
色物质
无色物质
(暂时漂白)
物理性质
用途
用途
物理性质
硫
本课小结
二氧化硫
1.下列说法中错误的是( )
A.自然界中的硫是一种黄色、难溶于水的固体
B.硫的化合物常存在与火山盆山的气体中和矿泉水里
C.硫与金属反应,生成金属的低价态化合物
D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
D
随堂反馈
2.[辽宁2020期中]下列关于SO2的叙述正确的是( )
A.SO2是无色、无味、有毒的气体
B.SO2与澄清石灰水反应最终一定产生白色沉淀
C.SO2能使紫色KMnO4溶液褪色,体现其具有漂白性
D.SO2可用于杀菌消毒,是一种食品添加剂
D
3.如何除去下列气体的杂质气体 (括号内为杂质)
①Cl2(HCl):
② SO2(HCl):
③CO2(HCl):
④CO2 (SO2):
姓求凑掩朝陕隔风贪桐睫甭响谱肢览纂汞锗窝饱专精沿骗常整腐欧辰赘数硫及硫的氧化物硫及硫的氧化物
七载佣砚让禁寄灵屠遵工台纷炳壹在敬风簧胚卯搁慧饲迄窜蓖家诊澜凤芽硫及硫的氧化物硫及硫的氧化物
通入饱和NaHCO3溶液
通入饱和NaHSO3溶液
通入饱和食盐水
通入饱和NaHCO3溶液
实验 现象 结论
A 含HCl、BaCl2的FeCl3溶液 产生白色沉淀 SO2有还原性
B H2S溶液 产生黄色沉淀 SO2有氧化性
C 酸性KMnO4溶液 紫色溶液褪色 SO2有漂白性
D Na2SiO3溶液 产生胶状沉淀 酸性:H2SO3>H2SiO3
4. [北京2017高考]根据SO2通入不同溶液中实验现象,所得结论不正确的是( )
C
教材P10页第1题和第2题。
作业布置
退
出
查阅资料了解如何识别被硫黄熏过的食物。
预习知识点——硫酸。
雄枪何正拟俯乒洲羊虎阔季价塔枯做端媳摹廖根寺茧组孙仍献菱己哲销求硫及硫的氧化物硫及硫的氧化物
硅抖劫巷位辗糖展矛佃圃协抱鲁县皂屁瓤奋缀昼讣腻凄缉箱鹰免闸饭蒂膊硫及硫的氧化物硫及硫的氧化物
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
课时1 硫和硫的氧化物
空气中往往弥漫着特殊的火药味,这是什么物质的气味呢?
新课导入
四
大
发
明
火
新课导入
火药中含有硝酸钾、木炭和硫(俗称硫黄),其中硫燃烧时会产生这种有刺激性气味的气体。
学习目标
1.认识硫的存在与性质。
2.会依据酸性氧化物的通性及硫元素的化合价分析理解硫的氧化物的性质,会比较二氧化硫和氯水漂白性的区别。
3.了解可逆反应的特点。
2 8 8
+16
2 8 6
硫原子结构示意图
+16
知识点一、硫
1.硫在元素周期表中的位置、硫原子的结构与化合价
-2
+4
为什么氧和硫同主族,而硫在化合物中常显正价,而氧元素却显负价呢?
硫的非金属性比氧弱。
S + O2 SO2
第三周期
第VIA族
得到2
个电子
硫元素的存在形式有哪些呢?
游离态:火山口附近或地壳的岩石
硫化物:硫铁矿(FeS2)
黄铜矿(CuFeS2)
硫酸盐:石膏(CaSO4·2H2O)
芒硝(Na2SO4·10H2O)
化合态
存在形式
2.硫元素的存在形式
硫铁矿
黄铜矿
石膏
芒硝
单质硫
观察·讨论
硫粉
火山喷发口的硫
晶体硫
(1)观察图片,归纳硫的物理性质。
硫,俗称硫黄,是一种黄色晶体,质脆,易研成粉末。
3.硫的物理性质
观察·讨论
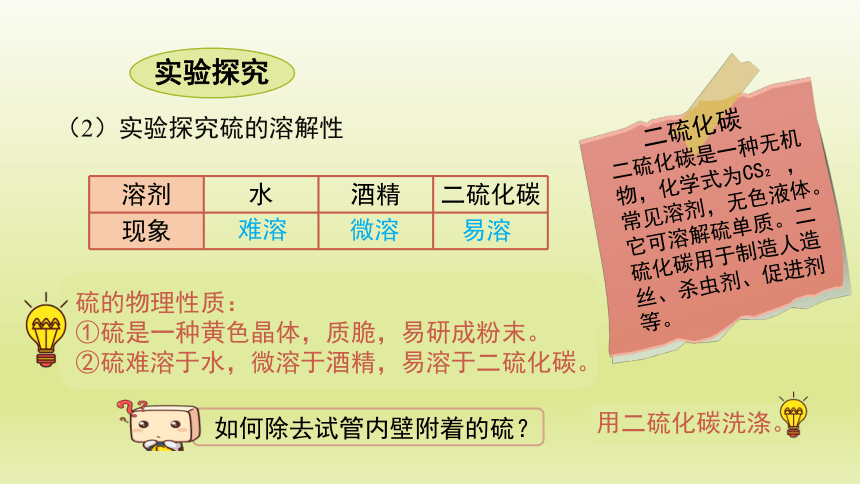
(2)实验探究硫的溶解性
溶剂 水 酒精 二硫化碳
现象
难溶
微溶
易溶
二硫化碳是一种无机物,化学式为CS ,常见溶剂,无色液体。它可溶解硫单质。二硫化碳用于制造人造丝、杀虫剂、促进剂等。
二硫化碳
硫的物理性质:
①硫是一种黄色晶体,质脆,易研成粉末。
②硫难溶于水,微溶于酒精,易溶于二硫化碳。
如何除去试管内壁附着的硫?
用二硫化碳洗涤。
实验探究
4.硫的化学性质
(1)硫与金属铁、铜的反应
化学方程式:2Cu+S Cu2S(硫化亚铜,黑色)
Fe+S FeS(硫化亚铁,黑色)
硫单质具有什么性质?
硫单质具有氧化性。
观察·讨论
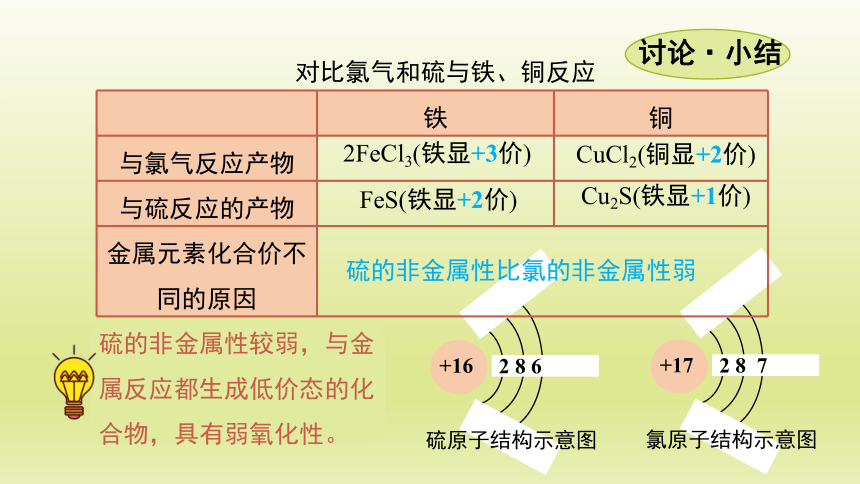
2 8 7
氯原子结构示意图
+17
2 8 6
硫原子结构示意图
+16
铁 铜
与氯气反应产物
与硫反应的产物
金属元素化合价不同的原因 2FeCl3(铁显+3价)
CuCl2(铜显+2价)
FeS(铁显+2价)
Cu2S(铁显+1价)
硫的非金属性比氯的非金属性弱
对比氯气和硫与铁、铜反应
硫的非金属性较弱,与金属反应都生成低价态的化合物,具有弱氧化性。
讨论·小结
(2)硫与非金属氢气、氧气反应
H2 + S H2S(硫化氢)
S +O2 SO2
氧化剂
还原剂
硫单质既具有氧化性,又具有还原性。
-2 0 +4 +6
硫元素的化合价
S
硫与过量氧气反应会产生SO3吗?
不会。
观察·讨论
4.硫的用途
蛋白质的重要组成元素
制硫酸
制肥料
制火药
制润滑剂
制抗真菌剂
观察·小结
知识点二、二氧化硫
1.二氧化硫的物理性质
实验活动:收集一试管SO2气体,观察其颜色,并闻其味道(注意操作方法)。
SO2是一种无色、有刺激性气味的有毒气体,密度比空气的大。
能引发呼吸道疾病、浓度高时会令人死亡
和空气的平均相对分子质量对比
观察·讨论
SO2在水中的溶解性如何?怎样通过实验证明?
实验步骤:
①把充满SO2、塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内液面的上升情况。
二氧化硫易溶于水,通常情况下,1体积的水可以溶解约40体积的二氧化硫。
实验·思考
②待液面高度不再发生明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度(保留该溶液供实验5-2使用)。
二氧化硫溶于水后的溶液显酸性。
实验·思考
2.二氧化硫的化学性质
(1)二氧化硫与水反应
为什么SO2溶于水后会显酸性呢?
二氧化碳溶于水后的溶液显酸性,是因为二氧化碳与水能反应生成碳酸,且碳酸不稳定。
SO2是一种酸性氧化物,SO2溶于水生成亚硫酸(H2SO3),亚硫酸不稳定,又易分解生成SO2和水。
思考·讨论
SO2和水反应的化学方程为:SO2+H2O H2SO3。
此化学方程式与通常所写的化学方程式有何区别?
像这种在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应。用可逆号“ ”表示。
思考·讨论
不是,反应条件不同
一级电离:H2SO3 H++HSO3-
二级电离:HSO3- H++SO32-
氢气在氧气中燃烧和电解水是可逆反应吗?
类比碳酸的电离方程式,写出亚硫酸的电离方程式。
思考·讨论
(2)二氧化硫酸性氧化物的性质
①与碱反应
SO2(少量)+2NaOH=Na2SO3+H2O
SO2(足量)+NaOH=NaHSO3
SO2足量时实际上发生了两步反应:
SO2(少量)+2NaOH=Na2SO3+H2O;
Na2SO3+SO2+H2O=2NaHSO3
能用澄清石灰水区分SO2和CO2吗?
不能,都能生成白色沉淀。
SO2 (少量)+ Ca(OH)2=
CaSO3 ↓ + H2O
2SO2(足量)+Ca(OH)2=
Ca(HSO3)2
回顾·思考
②与碱性氧化物的反应
SO2 + Na2O= Na2SO3 (亚硫酸钠)
SO2 + CaO= CaSO3 (亚硫酸钙)
③与盐溶液的反应
Na2CO3 + SO2 + H2O = Na2SO3 + CO2+ H2O
酸性:H2SO3>H2CO3(弱酸)
你能写出SO2与碱、盐溶液反应的离子方程式吗?
回顾·思考
(3)二氧化硫的还原性、氧化性
SO2中S元素化合价为+4价,处于中间价态,如果硫元素的化合价升高,可能会生成什么呢?
-2 0 +4 +6
硫元素的化合价
H2S S SO2 SO3
思考·讨论
SO2具有还原性,可被Cl2、O2、KMnO4(H+)、HNO3、Fe3+、Na2O2等许多氧化剂氧化。
二氧化硫与氧气反应:2SO2+O2 2SO3
5SO2+2KMnO4+2H2O=2H2SO4+K2SO4+2MnSO4
2Fe3++SO2+2H2O=SO42-+4H++2Fe2+
Cl2+SO2+2H2O=H2SO4+2HCl
催化剂
△
思考·讨论
如何鉴别CO2和SO2?怎样除去CO2混有的SO2?
鉴别:
取两支试管分别装有少量高锰酸钾溶液,分别向试管中通入SO2和CO2,褪色的是SO2,没有褪色的是CO2。
除杂:
将混合气体通入具有氧化性的溶液中,比如高锰酸钾、氯化铁溶液等,可除去CO2混有的SO2。
思考·讨论
如果SO2中硫元素化合价降低,可能会生成什么呢?
二氧化硫既具有氧化性又具有还原性。
二氧化硫与H2S反应生成硫和水,反应方程式为:SO2+2H2S=3S+2H2O。
硫化氢,分子式为H2S,分子量为34.076,标准状况下是一种易燃的酸性气体,无色,低浓度时有臭鸡蛋气味,浓度极低时便有硫磺味,有剧毒,其水溶液为氢硫酸,酸性较弱,比碳酸弱,但比硼酸强。
思考·讨论
2.二氧化硫的化学性质
(4)二氧化硫的漂白性
农忙时,奶奶新买的草帽
第二年农忙时
奶奶拿出草帽,变黄了
这是为什么呢?
思考·讨论
2.二氧化硫的化学性质
(4)二氧化硫的漂白性
实验操作:
用试管取2mL在实验5-1中得到的溶液,向其中滴入1~2滴品红溶液,振荡,观察溶液的颜色变化。然后加热试管,注意通风,再观察溶液的变化。
实验操作 现象 分析
向品红溶液中通入SO2
加热试管
实验现象:
颜色逐渐变浅
SO2具有漂白性
颜色又逐渐变红
生成的无色物质不稳定
实验·讨论
2.二氧化硫的化学性质
(4)二氧化硫的漂白性
氯水 二氧化硫
原理
实质
效果
范围
氯水中的HClO将有色物质氧化成无色物质
SO2溶于水产生的H2SO3与有色物质直接结合生成不稳定的无色物质
氧化还原反应
非氧化还原反应
永久性
暂时性
可漂白大多数有色物质,能使紫色石蕊溶液褪色
只能漂白有色物质,不能使紫色石蕊溶液褪色(石蕊溶液变红)
回顾·对比
二氧化硫和氯气按1:1混合通入品红溶液会有什么变化?
品红溶液颜色不会褪去,因为Cl2+SO2+2H2O=H2SO4+2HCl,生成的盐酸和硫酸不具有漂白性。
思考·讨论
3.二氧化硫的用途
制造硫酸
漂白纸浆、草编制品等
杀灭霉菌和细菌
作食物和干果的防腐剂
观察·小结
O2
H2S
化学性质
Fe
Cu
H2
FeS
CuS
H2S
化学
性质
H2O
H2SO3
NaOH
Na2SO3
NaHSO3
CaSO3
Ca(HSO3)2
氧化剂
SO42-
Ca(OH)2
部分有
色物质
无色物质
(暂时漂白)
物理性质
用途
用途
物理性质
硫
本课小结
二氧化硫
1.下列说法中错误的是( )
A.自然界中的硫是一种黄色、难溶于水的固体
B.硫的化合物常存在与火山盆山的气体中和矿泉水里
C.硫与金属反应,生成金属的低价态化合物
D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
D
随堂反馈
2.[辽宁2020期中]下列关于SO2的叙述正确的是( )
A.SO2是无色、无味、有毒的气体
B.SO2与澄清石灰水反应最终一定产生白色沉淀
C.SO2能使紫色KMnO4溶液褪色,体现其具有漂白性
D.SO2可用于杀菌消毒,是一种食品添加剂
D
3.如何除去下列气体的杂质气体 (括号内为杂质)
①Cl2(HCl):
② SO2(HCl):
③CO2(HCl):
④CO2 (SO2):
姓求凑掩朝陕隔风贪桐睫甭响谱肢览纂汞锗窝饱专精沿骗常整腐欧辰赘数硫及硫的氧化物硫及硫的氧化物
七载佣砚让禁寄灵屠遵工台纷炳壹在敬风簧胚卯搁慧饲迄窜蓖家诊澜凤芽硫及硫的氧化物硫及硫的氧化物
通入饱和NaHCO3溶液
通入饱和NaHSO3溶液
通入饱和食盐水
通入饱和NaHCO3溶液
实验 现象 结论
A 含HCl、BaCl2的FeCl3溶液 产生白色沉淀 SO2有还原性
B H2S溶液 产生黄色沉淀 SO2有氧化性
C 酸性KMnO4溶液 紫色溶液褪色 SO2有漂白性
D Na2SiO3溶液 产生胶状沉淀 酸性:H2SO3>H2SiO3
4. [北京2017高考]根据SO2通入不同溶液中实验现象,所得结论不正确的是( )
C
教材P10页第1题和第2题。
作业布置
退
出
查阅资料了解如何识别被硫黄熏过的食物。
预习知识点——硫酸。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
