2022-2023学年鲁科版高中化学必修1 3.3氮及其化合物(共20张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版高中化学必修1 3.3氮及其化合物(共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-20 11:09:07 | ||
图片预览






文档简介
(共20张PPT)
氮气、一氧化氮、二氧化氮
学习目标:
1、通过对NO2与水反应产物的探究,发展学生证据推理的核心素养;
2、从价-类二维设计NO2的转化路线,引导学生从物质类别和价态变化的角度 实现不同价态含氮物质的转化,形成解决污染问题的一般思路模型;
3、树立绿色化学理念,在解决NO2污染的问题中,体会化学学科的社会价值,培养学生的科学精神与社会责任。
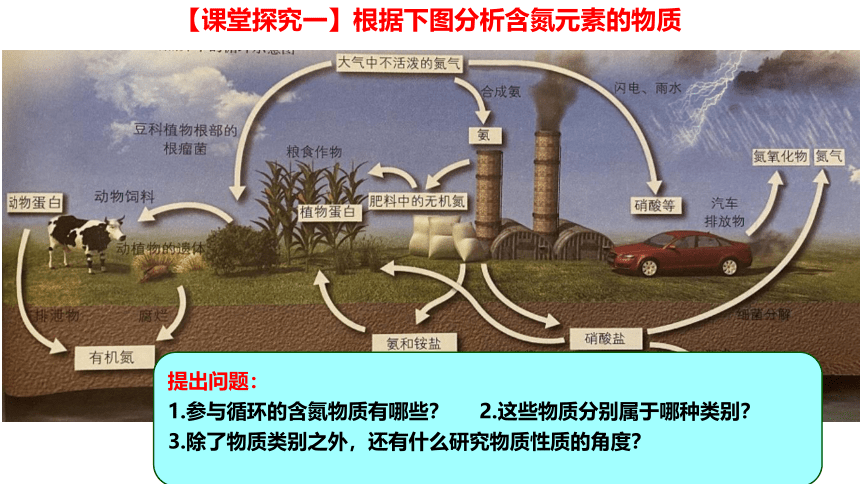
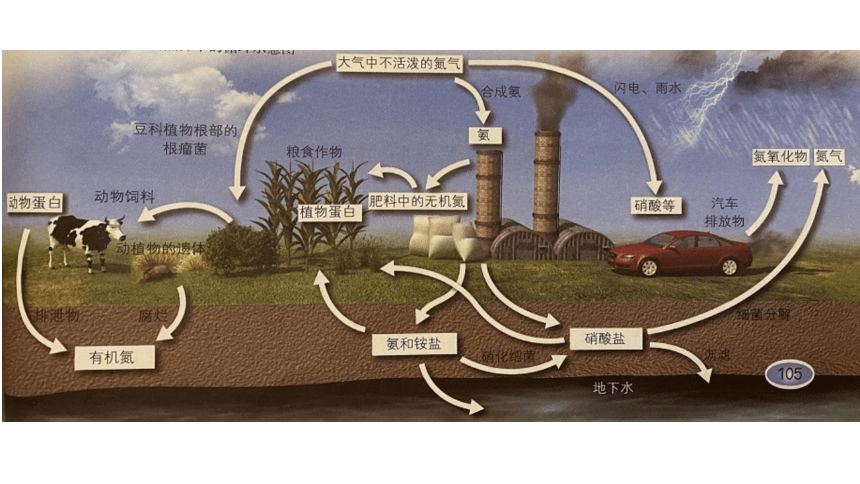
【课堂探究一】根据下图分析含氮元素的物质
氮在自然界中的循环示意图
提出问题:
1.参与循环的含氮物质有哪些? 2.这些物质分别属于哪种类别?
3.除了物质类别之外,还有什么研究物质性质的角度?
【阅读材料】氮气保护技术通常应用于珍贵文物的保存和保护,国内外不乏先例。美国的《独立宣言》就密封在氮气环境中;中国博物馆和中南海毛主席故居纪念馆也是应用氮气保护法;北京房山云居寺“99石经回藏”也是氮气保护的成功典范。
【课堂探究二】 氮气的性质
1.宏观辨识:为什么氮气可以作为保护气
原因:氮气性质稳定,常温下不与物质发生反应,故可作保护气。
2. 微观探析:请运用氮元素的原子结构知识,解释氮气的化学性质
氮元素位于元素周期表中第二周期第_____族,原子结构示意图为 ,最外层有_____个电子。
VA
+7
2
5
5
3. 证据推理:
键能 N2 :946KJ/mol;O2:493KJ/mol;Cl2: 247KJ/mol 。
模型认知:
运用元素的原子结构知识,可以预测和解释物质的性质
N
N
N
N
4.【阅读材料】汽车尾气所含污染物主要是: CO 、碳氢化合物(CH) 、氮氧化合物(NO和NO2) 、SO2、颗粒物以及含铅化合物。
思考:NOx是如何产生的?尝试用方程式表示
2NO+O2=2NO2
N2+O2 = 2NO
高温
5.氮的固定:把空气中游离态的氮转变为氮的化合物的过程。
分类:
(1)自然固氮:大自然通过闪电释放的能量将空气中的氮气转化为含氮的化合物,或豆科植物根瘤菌将氮气转化为氨。
(2)人工固氮:如工业合成氨。
1909年,德国化学家哈伯经过反复的实验研究后发现,在500~600℃、17.5~20.0MPa和锇为催化剂的条件下,反应后氨的含量可达到6%以上,具备了工业化生产的可能性。
哈伯
(F.Haber,1868-1934)
为了把哈伯合成氨的实验室方法转化为规模化的工业生产,德国工程师博施作出了重要贡献。由于合成氨工业生产的实现和相关研究对化学理论与技术发展的推动,哈伯和博施都获得了诺贝尔化学奖。
合成氨是人类科学技术发展史上的一项重大成就。
人 工 固 氮
合 成 氨
氮的固定【科学史话】
① 还原性:_____________________________
N2+O2 2NO
放电或高温
==========
② 氧化性
a. N2与H2反应生成NH3,化学方程式为 。
b. 在点燃条件下与Mg反应,方程式为 。
催化剂
高温、高压
N2 + 3H2 2NH3
N2 + 3Mg Mg3N2
点燃
【课堂探究三】 氮的氧化物的性质
1. 如何减少主要污染源氮氧化合物(NO和NO2),谈谈你的想法
从源头杜绝,不产生源排放污染物NOx
——汽车限行、使用清洁能源汽车
若已经产生了污染源的气体,利用其性质将其消除掉
(1)从物质类别角度:
(2)从氧化-还原角度:用氧化剂或还原剂吸收
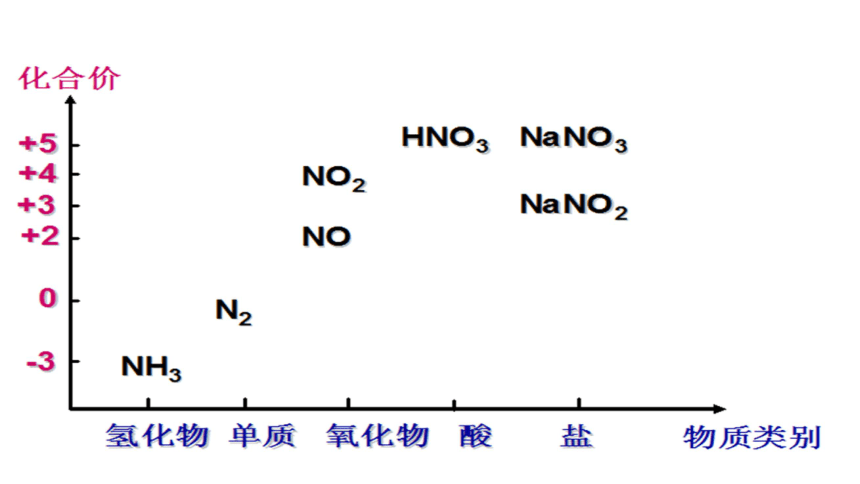
2.从“物质类别”和“氧化还原”两个认识角度预测NO2的化学性质?
物质类别:NO2与水、与碱溶液可能反应;
化合价: 既有氧化性又有还原性。
水吸收
碱吸收或氧化剂
还原剂
应用氮元素的二维图设计转化方案,
实现氮氧化物的无害化处理
3.实验探究——NO2溶于水的实验过程
实验操作 实验现象 实验结论
在一支50 mL的注射器里充入20 mL NO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器
打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹
振荡注射器
无明显现象
NO不溶于水
无色气体变为红棕色,注射器活塞向左移动
NO与O2 反应生成红棕色的 NO2
红棕色气体变为无色,
注射器活塞继续向左移动
NO2 溶于水生成无色的NO
思考如下问题:
(1)振荡注射器后, NO2反应还是溶解?理论分析产物
(2)如何证明产物?(设计实验方案,实验验证产物)
(3)在表格中书写相关方程式
将充满NO2的试管倒置在装满水的水槽里,会有什么现象?最终试管里剩余气体占试管体积的几分之几?
红棕色逐渐褪去,水槽里的水倒吸入试管中,最终气体占1/3
4.设计实验:如何将NOx完全转化为硝酸?
15
环节五 工业治理 NO2 污染方案
变废为宝——制造硝酸
3NO2+H2O=2HNO3+NO
2NO+O2=2NO2
4NO2+O2+2H2O=4HNO3
:
将一充满 NO 的试管倒置于水槽中,同时不断地缓慢通入O2 ,最终液体充满整个试管,该过程的总反应式可表示为:____________
4NO+3O2+2H2O=4HNO3
2NO2+2NaOH=
NaNO3+NaNO2+H2O
3NO2+H2O=2HNO3+NO
成NO和NO2。
写出NO2与NaOH反应的化学方程式
NO2与SO2的性质相比具有差异性和特殊性
NO2是不是酸性氧化物呢?
三元催化下汽车尾气净化原理
还原法:
氧化物
盐
还原性
氧化性
N的化合物
与碱性物质
与氧化剂
元素化合物学习的两个角度
+5
环节设计意图:运用模型分析、解决实际问题。
与还原剂
N2
知识导图
氮气、一氧化氮、二氧化氮
学习目标:
1、通过对NO2与水反应产物的探究,发展学生证据推理的核心素养;
2、从价-类二维设计NO2的转化路线,引导学生从物质类别和价态变化的角度 实现不同价态含氮物质的转化,形成解决污染问题的一般思路模型;
3、树立绿色化学理念,在解决NO2污染的问题中,体会化学学科的社会价值,培养学生的科学精神与社会责任。
【课堂探究一】根据下图分析含氮元素的物质
氮在自然界中的循环示意图
提出问题:
1.参与循环的含氮物质有哪些? 2.这些物质分别属于哪种类别?
3.除了物质类别之外,还有什么研究物质性质的角度?
【阅读材料】氮气保护技术通常应用于珍贵文物的保存和保护,国内外不乏先例。美国的《独立宣言》就密封在氮气环境中;中国博物馆和中南海毛主席故居纪念馆也是应用氮气保护法;北京房山云居寺“99石经回藏”也是氮气保护的成功典范。
【课堂探究二】 氮气的性质
1.宏观辨识:为什么氮气可以作为保护气
原因:氮气性质稳定,常温下不与物质发生反应,故可作保护气。
2. 微观探析:请运用氮元素的原子结构知识,解释氮气的化学性质
氮元素位于元素周期表中第二周期第_____族,原子结构示意图为 ,最外层有_____个电子。
VA
+7
2
5
5
3. 证据推理:
键能 N2 :946KJ/mol;O2:493KJ/mol;Cl2: 247KJ/mol 。
模型认知:
运用元素的原子结构知识,可以预测和解释物质的性质
N
N
N
N
4.【阅读材料】汽车尾气所含污染物主要是: CO 、碳氢化合物(CH) 、氮氧化合物(NO和NO2) 、SO2、颗粒物以及含铅化合物。
思考:NOx是如何产生的?尝试用方程式表示
2NO+O2=2NO2
N2+O2 = 2NO
高温
5.氮的固定:把空气中游离态的氮转变为氮的化合物的过程。
分类:
(1)自然固氮:大自然通过闪电释放的能量将空气中的氮气转化为含氮的化合物,或豆科植物根瘤菌将氮气转化为氨。
(2)人工固氮:如工业合成氨。
1909年,德国化学家哈伯经过反复的实验研究后发现,在500~600℃、17.5~20.0MPa和锇为催化剂的条件下,反应后氨的含量可达到6%以上,具备了工业化生产的可能性。
哈伯
(F.Haber,1868-1934)
为了把哈伯合成氨的实验室方法转化为规模化的工业生产,德国工程师博施作出了重要贡献。由于合成氨工业生产的实现和相关研究对化学理论与技术发展的推动,哈伯和博施都获得了诺贝尔化学奖。
合成氨是人类科学技术发展史上的一项重大成就。
人 工 固 氮
合 成 氨
氮的固定【科学史话】
① 还原性:_____________________________
N2+O2 2NO
放电或高温
==========
② 氧化性
a. N2与H2反应生成NH3,化学方程式为 。
b. 在点燃条件下与Mg反应,方程式为 。
催化剂
高温、高压
N2 + 3H2 2NH3
N2 + 3Mg Mg3N2
点燃
【课堂探究三】 氮的氧化物的性质
1. 如何减少主要污染源氮氧化合物(NO和NO2),谈谈你的想法
从源头杜绝,不产生源排放污染物NOx
——汽车限行、使用清洁能源汽车
若已经产生了污染源的气体,利用其性质将其消除掉
(1)从物质类别角度:
(2)从氧化-还原角度:用氧化剂或还原剂吸收
2.从“物质类别”和“氧化还原”两个认识角度预测NO2的化学性质?
物质类别:NO2与水、与碱溶液可能反应;
化合价: 既有氧化性又有还原性。
水吸收
碱吸收或氧化剂
还原剂
应用氮元素的二维图设计转化方案,
实现氮氧化物的无害化处理
3.实验探究——NO2溶于水的实验过程
实验操作 实验现象 实验结论
在一支50 mL的注射器里充入20 mL NO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器
打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹
振荡注射器
无明显现象
NO不溶于水
无色气体变为红棕色,注射器活塞向左移动
NO与O2 反应生成红棕色的 NO2
红棕色气体变为无色,
注射器活塞继续向左移动
NO2 溶于水生成无色的NO
思考如下问题:
(1)振荡注射器后, NO2反应还是溶解?理论分析产物
(2)如何证明产物?(设计实验方案,实验验证产物)
(3)在表格中书写相关方程式
将充满NO2的试管倒置在装满水的水槽里,会有什么现象?最终试管里剩余气体占试管体积的几分之几?
红棕色逐渐褪去,水槽里的水倒吸入试管中,最终气体占1/3
4.设计实验:如何将NOx完全转化为硝酸?
15
环节五 工业治理 NO2 污染方案
变废为宝——制造硝酸
3NO2+H2O=2HNO3+NO
2NO+O2=2NO2
4NO2+O2+2H2O=4HNO3
:
将一充满 NO 的试管倒置于水槽中,同时不断地缓慢通入O2 ,最终液体充满整个试管,该过程的总反应式可表示为:____________
4NO+3O2+2H2O=4HNO3
2NO2+2NaOH=
NaNO3+NaNO2+H2O
3NO2+H2O=2HNO3+NO
成NO和NO2。
写出NO2与NaOH反应的化学方程式
NO2与SO2的性质相比具有差异性和特殊性
NO2是不是酸性氧化物呢?
三元催化下汽车尾气净化原理
还原法:
氧化物
盐
还原性
氧化性
N的化合物
与碱性物质
与氧化剂
元素化合物学习的两个角度
+5
环节设计意图:运用模型分析、解决实际问题。
与还原剂
N2
知识导图
