5.1.1元素周期律的发现之旅 课件(共19张PPT) 2022-2023学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 5.1.1元素周期律的发现之旅 课件(共19张PPT) 2022-2023学年高一上学期化学苏教版(2019)必修第一册 |
|
|
| 格式 | pptx | ||
| 文件大小 | 12.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-19 00:00:00 | ||
图片预览


文档简介
(共19张PPT)
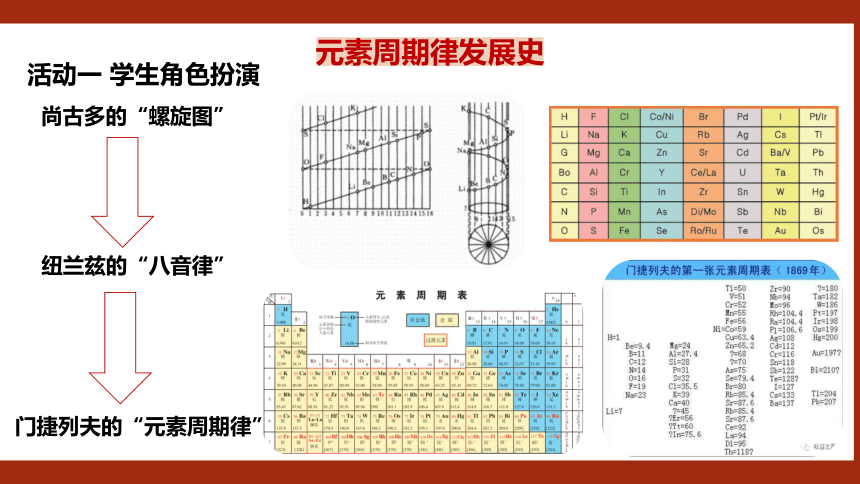
元素周期律发展史
尚古多的“螺旋图”
纽兰兹的“八音律”
门捷列夫的“元素周期律”
活动一 学生角色扮演
元素周期律的发现之旅
专题5 第一单元
元素周期律和元素周期表
学校:漳州市第五中学
授课人:莫亚楠
开课班级:高一4班
第一课时
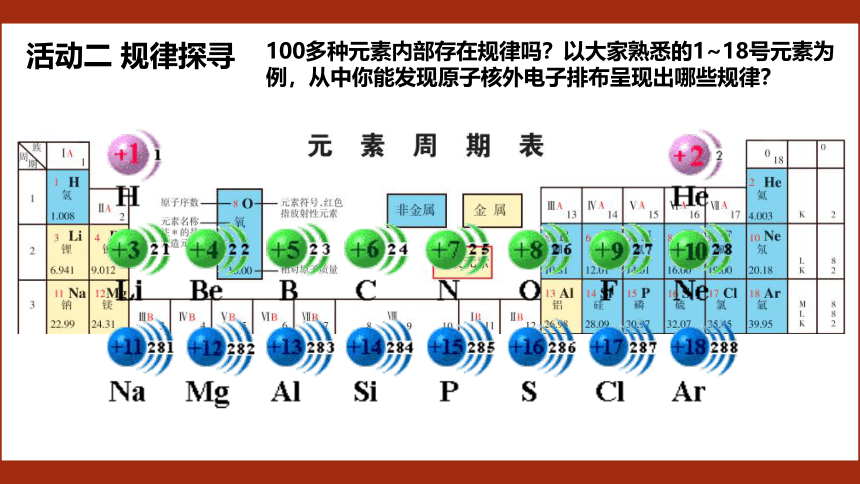
活动二 规律探寻
100多种元素内部存在规律吗?以大家熟悉的1~18号元素为例,从中你能发现原子核外电子排布呈现出哪些规律?
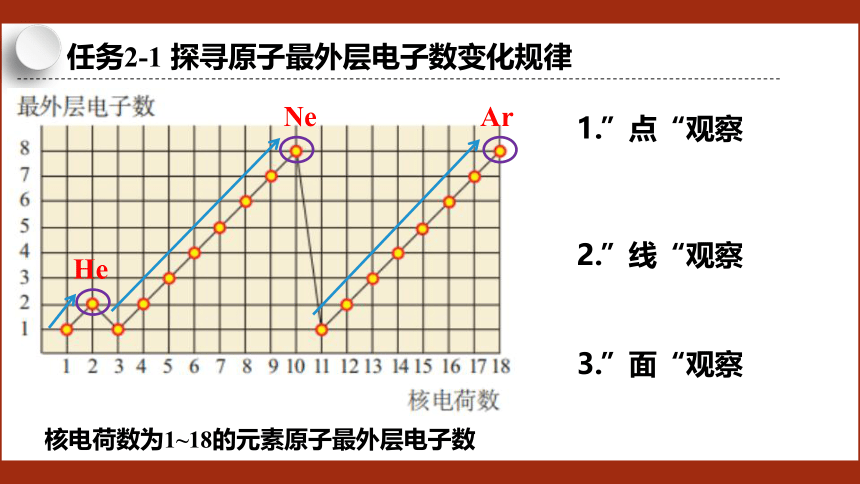
任务2-1 探寻原子最外层电子数变化规律
核电荷数为1~18的元素原子最外层电子数
1.”点“观察
2.”线“观察
3.”面“观察
Ne
He
Ar
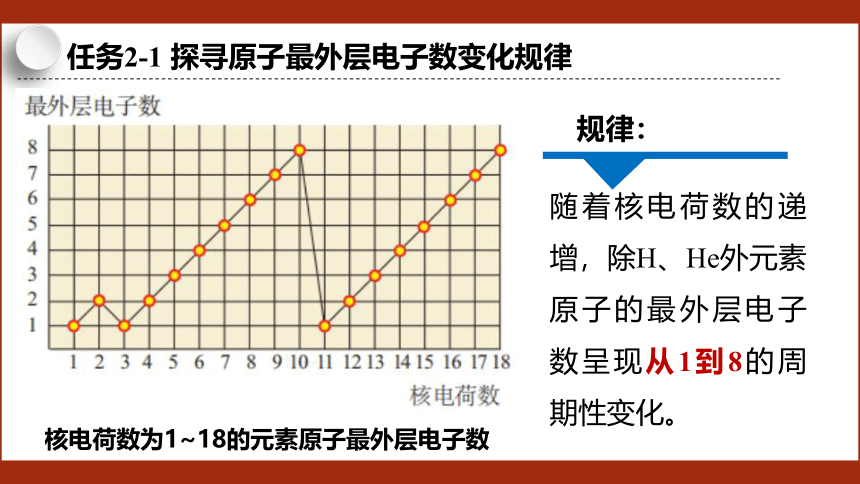
任务2-1 探寻原子最外层电子数变化规律
核电荷数为1~18的元素原子最外层电子数
随着核电荷数的递增,除H、He外元素原子的最外层电子数呈现从1到8的周期性变化。
规律:
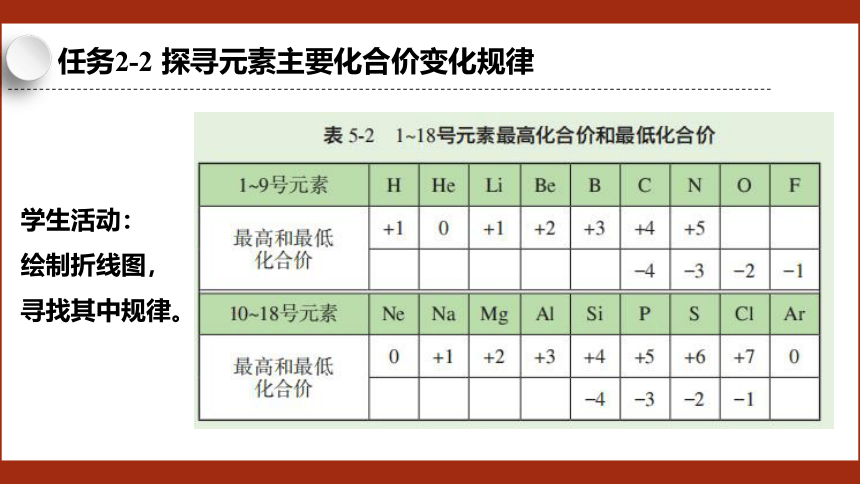
任务2-2 探寻元素主要化合价变化规律
学生活动:
绘制折线图,寻找其中规律。
1.”点“观察:
2.”线“观察:
3.”面“观察:
最高正价=最外层电子数(O、F及稀有气体除外)=主族序数
元素的最低负化合价=最外层电子数-8
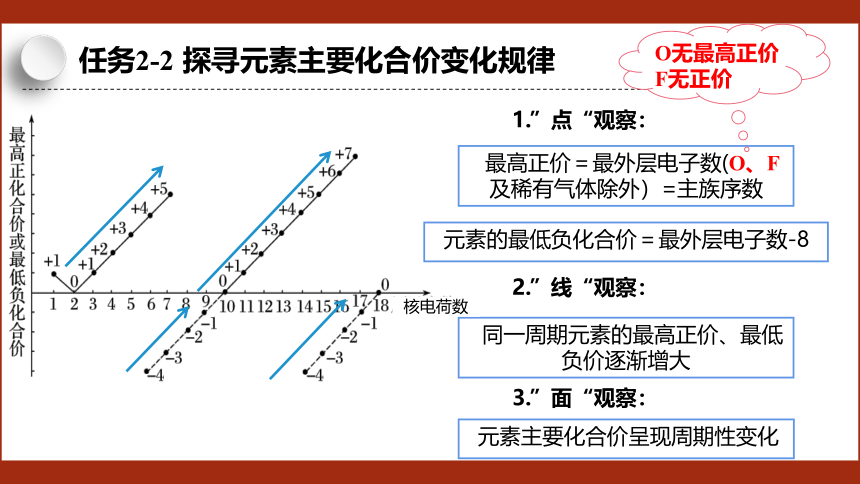
任务2-2 探寻元素主要化合价变化规律
同一周期元素的最高正价、最低负价逐渐增大
元素主要化合价呈现周期性变化
O无最高正价
F无正价
核电荷数
周期性变化
原子的核外电子排布呈周期性变化。
任务2-2 探寻元素主要化合价变化规律
核电荷数
任务2-3 探寻元素原子半径变化规律
核电荷数
(稀有气体除外)
任务2-3 探寻元素原子半径变化规律
1.”点“观察:
2.”线“观察:
3.”面“观察:
原子的半径大小与电子层数、核电荷数等有关
同一周期元素原子半径逐渐减小
元素原子半径呈周期性变化
周期性变化
原子的核外电子排布呈周期性变化。
核电荷数
(稀有气体除外)
微粒半径大小的比较
例如:Li任务2-3 探寻元素的原子半径变化规律
1.原子半径的比较
(1)同一周期, 电子层数相同, ,随核电荷数递增,原子半径逐渐减小。
例如:Na>Mg>Al>Si>P>S>Cl。
(2)同一主族,最外层电子数相同, ,随电子层递增,原子半径逐渐增大。
影响半径
主要因素
核电荷数
电子层数
从左到右
从上到下
短周期元素中,原子半径最大的元素是?
所有元素中,原子半径最小的元素是?
【学以致用】比较下列原子半径的大小。
(1) Na与S
(稀有气体除外)
(2)O与S
Na> S
S > O
同一周期
同一主族
(3)Na与O
Na> O
交叉位置关系
S
规律:找出两种原子在元素周期表中的位置关系;
既不同周期又不同主族,找中间参照对比元素。
1.原子半径的比较
(提示:考虑元素在周期表中位置关系)
【交流与讨论1】比较:Cl Cl-半径的大小
>
<
原子半径 < 对应阴离子半径;
2.同种元素原子与离子半径的比较
任务2-3 探寻元素的原子半径变化规律
【交流与讨论2】比较Na Na+半径的大小。
原子半径 > 对应阳离子半径。
规律:
核电荷数相同时,电子层数越多,半径越大;
电子层数与核电荷数均相同,核外电子数越多,半径越大。
任务2-3 探寻元素的原子半径变化规律
3.具有相同电子层结构的离子半径比较
+X
2
8
X可能为多少?
X=10
原子-Ne 稀有气体不考虑
X>10
X<10
阳离子
Na+、Mg2+、Al3+
阴离子
O2-、F-
结论:O2->F->Na+>Mg2+>Al3+
规律:具有相同电子层结构的离子,核电荷数越大,离子半径越小。
由大到小排序
找一找Ar原子的左邻右舍,具有此结构的微粒有哪些?
课后任务
+X
2
8
8
X=18 Ar
课堂小结
核电荷数
最外层电子数
元素主要化合价
原子半径
引起
呈现
周期性变化
THANKS YOU
1、下列微粒半径大小比较正确的是( )
A.NaC.S>Br>I D.NB
2、下列各组微粒半径的比较错误的是( )
A.Cl-Mg2+>Na+
C.Rb>K>Na D.P>S>O
B
强化巩固
元素周期律发展史
尚古多的“螺旋图”
纽兰兹的“八音律”
门捷列夫的“元素周期律”
活动一 学生角色扮演
元素周期律的发现之旅
专题5 第一单元
元素周期律和元素周期表
学校:漳州市第五中学
授课人:莫亚楠
开课班级:高一4班
第一课时
活动二 规律探寻
100多种元素内部存在规律吗?以大家熟悉的1~18号元素为例,从中你能发现原子核外电子排布呈现出哪些规律?
任务2-1 探寻原子最外层电子数变化规律
核电荷数为1~18的元素原子最外层电子数
1.”点“观察
2.”线“观察
3.”面“观察
Ne
He
Ar
任务2-1 探寻原子最外层电子数变化规律
核电荷数为1~18的元素原子最外层电子数
随着核电荷数的递增,除H、He外元素原子的最外层电子数呈现从1到8的周期性变化。
规律:
任务2-2 探寻元素主要化合价变化规律
学生活动:
绘制折线图,寻找其中规律。
1.”点“观察:
2.”线“观察:
3.”面“观察:
最高正价=最外层电子数(O、F及稀有气体除外)=主族序数
元素的最低负化合价=最外层电子数-8
任务2-2 探寻元素主要化合价变化规律
同一周期元素的最高正价、最低负价逐渐增大
元素主要化合价呈现周期性变化
O无最高正价
F无正价
核电荷数
周期性变化
原子的核外电子排布呈周期性变化。
任务2-2 探寻元素主要化合价变化规律
核电荷数
任务2-3 探寻元素原子半径变化规律
核电荷数
(稀有气体除外)
任务2-3 探寻元素原子半径变化规律
1.”点“观察:
2.”线“观察:
3.”面“观察:
原子的半径大小与电子层数、核电荷数等有关
同一周期元素原子半径逐渐减小
元素原子半径呈周期性变化
周期性变化
原子的核外电子排布呈周期性变化。
核电荷数
(稀有气体除外)
微粒半径大小的比较
例如:Li
1.原子半径的比较
(1)同一周期, 电子层数相同, ,随核电荷数递增,原子半径逐渐减小。
例如:Na>Mg>Al>Si>P>S>Cl。
(2)同一主族,最外层电子数相同, ,随电子层递增,原子半径逐渐增大。
影响半径
主要因素
核电荷数
电子层数
从左到右
从上到下
短周期元素中,原子半径最大的元素是?
所有元素中,原子半径最小的元素是?
【学以致用】比较下列原子半径的大小。
(1) Na与S
(稀有气体除外)
(2)O与S
Na> S
S > O
同一周期
同一主族
(3)Na与O
Na> O
交叉位置关系
S
规律:找出两种原子在元素周期表中的位置关系;
既不同周期又不同主族,找中间参照对比元素。
1.原子半径的比较
(提示:考虑元素在周期表中位置关系)
【交流与讨论1】比较:Cl Cl-半径的大小
>
<
原子半径 < 对应阴离子半径;
2.同种元素原子与离子半径的比较
任务2-3 探寻元素的原子半径变化规律
【交流与讨论2】比较Na Na+半径的大小。
原子半径 > 对应阳离子半径。
规律:
核电荷数相同时,电子层数越多,半径越大;
电子层数与核电荷数均相同,核外电子数越多,半径越大。
任务2-3 探寻元素的原子半径变化规律
3.具有相同电子层结构的离子半径比较
+X
2
8
X可能为多少?
X=10
原子-Ne 稀有气体不考虑
X>10
X<10
阳离子
Na+、Mg2+、Al3+
阴离子
O2-、F-
结论:O2->F->Na+>Mg2+>Al3+
规律:具有相同电子层结构的离子,核电荷数越大,离子半径越小。
由大到小排序
找一找Ar原子的左邻右舍,具有此结构的微粒有哪些?
课后任务
+X
2
8
8
X=18 Ar
课堂小结
核电荷数
最外层电子数
元素主要化合价
原子半径
引起
呈现
周期性变化
THANKS YOU
1、下列微粒半径大小比较正确的是( )
A.Na
2、下列各组微粒半径的比较错误的是( )
A.Cl-
C.Rb>K>Na D.P>S>O
B
强化巩固
