湖南省长沙市部分中学2022-2023学年高二下学期第一次月考化学试题(含解析)
文档属性
| 名称 | 湖南省长沙市部分中学2022-2023学年高二下学期第一次月考化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-19 15:36:26 | ||
图片预览


文档简介
长沙市部分中学2022-2023学年高二下学期第一次月考
化学
一、选择题:本大题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活密切相关,下列说法错误的是( )
A.工业制粗硅、电镀、钢铁的锈蚀、制玻璃均发生氧化还原反应
B.跨临界直接制冰使用的是由极性键构成的非极性分子
C.德尔塔(Delta)是新冠变异毒株,其成分含蛋白质
D.激光、荧光、LED灯光都与电子跃迁释放能量有关
2.下列化学用语或图示表达正确的是( )
A.基态铜原子的价层电子排布图:
B.二氧化硅的分子式:
C.HClO的空间填充模型:
D.中的键电子云轮廓图:
3.设为阿伏加德罗常数的值,下列叙述正确的是( )
A.中键的数目为
B.标准状况下,溶于水,溶液中、和的微粒数之和小于
C.电解精炼铜阳极质量减少6.4g时,转移电子数为
D.31g基态P原子中含有的未成对电子数为
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.由水电离的溶液中:、、、
B.使甲基橙变红的溶液中:、、、
C.无色透明溶液中:、、、
D.透明溶液中:、、、
5.下列用于解释事实的方程式书写错误的是( )
A.氨水溶解氯化银:
B.在HCl气流中加热得到无水:
C.溶液中加足量的烧碱溶液:
D.用KI溶液将AgCl转化为AgI:
6.物质的组成与结构决定了物质的性质与变化。下列说法正确的是( )
A.MgO的熔点高于NaCl的熔点
B.金刚石与碳化硅晶体结构相似,金刚石的硬度小于碳化硅
C.的酸性比的酸性强
D.HF晶体沸点高于HCl,是因为HCl共价键键能小于HF
7.下表中关于各微粒的描述完全正确的一项是( )
选项 A B C D
分子或离子的化学式
中心原子的杂化轨道类型
VSEPR模型名称 直线形 平面三角形 平面三角形 正四面体形
分子或离子的空间结构 直线形 平面三角形 V形 三角锥形
8.下列对实验操作和现象的解释与结论正确的是( )
操作和现象 解释与结论
A 常温下用pH试纸测得:溶液的pH为9,溶液的pH为8
B 向配合物的水溶液中滴加硝酸银溶液,无沉淀产生 中的配位数为6
C 室温下,向密闭容器中充入,达平衡后,再慢慢扩大容器体积,最终容器中气体颜色比初次平衡时浅 (无色)该平衡正向移动
D 向溶液中加入溶液,有白色沉淀生成 与发生了剧烈的双水解反应
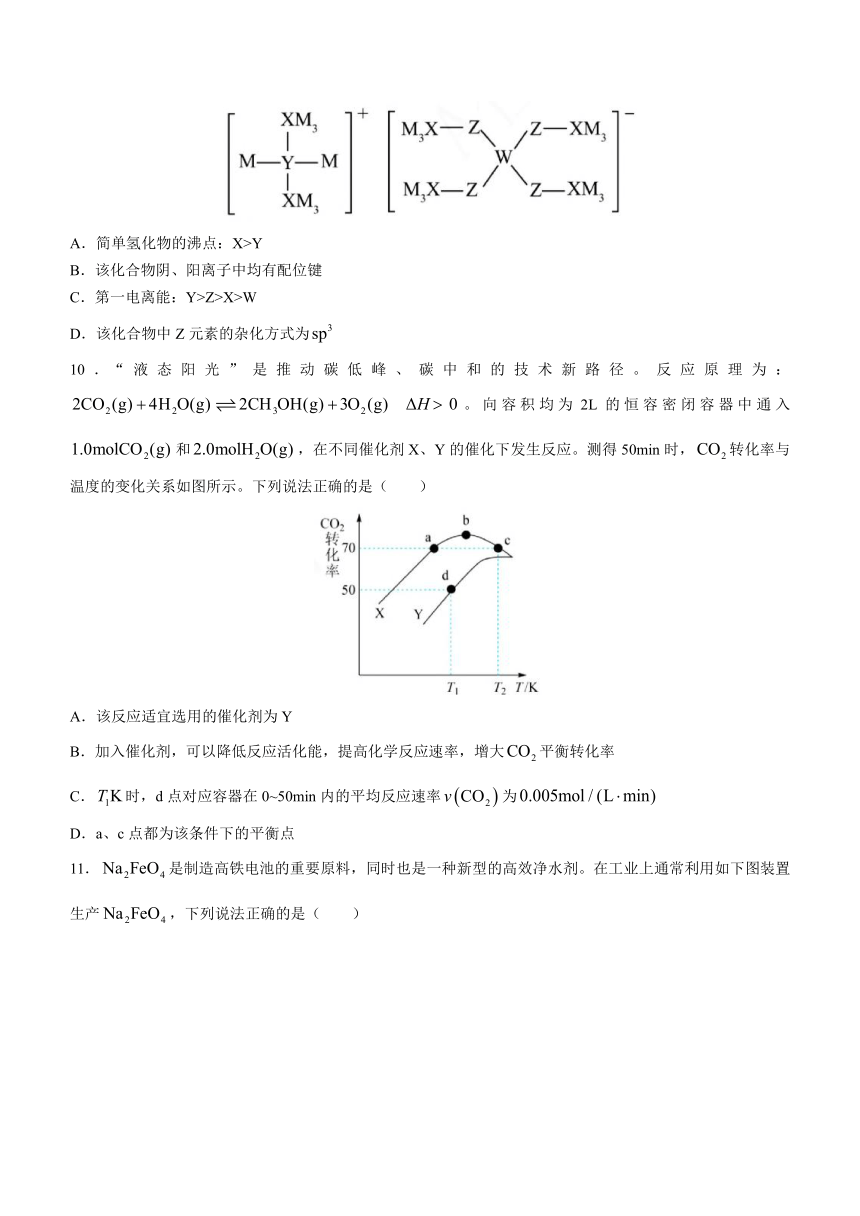
9.某多孔储氢材料前驱体结构如下图,M、W、X、Y、Z五种短周期元素的原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列叙述错误的是( )
A.简单氢化物的沸点:X>Y
B.该化合物阴、阳离子中均有配位键
C.第一电离能:Y>Z>X>W
D.该化合物中Z元素的杂化方式为
10.“液态阳光”是推动碳低峰、碳中和的技术新路径。反应原理为:。向容积均为2L的恒容密闭容器中通入和,在不同催化剂X、Y的催化下发生反应。测得50min时,转化率与温度的变化关系如图所示。下列说法正确的是( )
A.该反应适宜选用的催化剂为Y
B.加入催化剂,可以降低反应活化能,提高化学反应速率,增大平衡转化率
C.时,d点对应容器在0~50min内的平均反应速率为
D.a、c点都为该条件下的平衡点
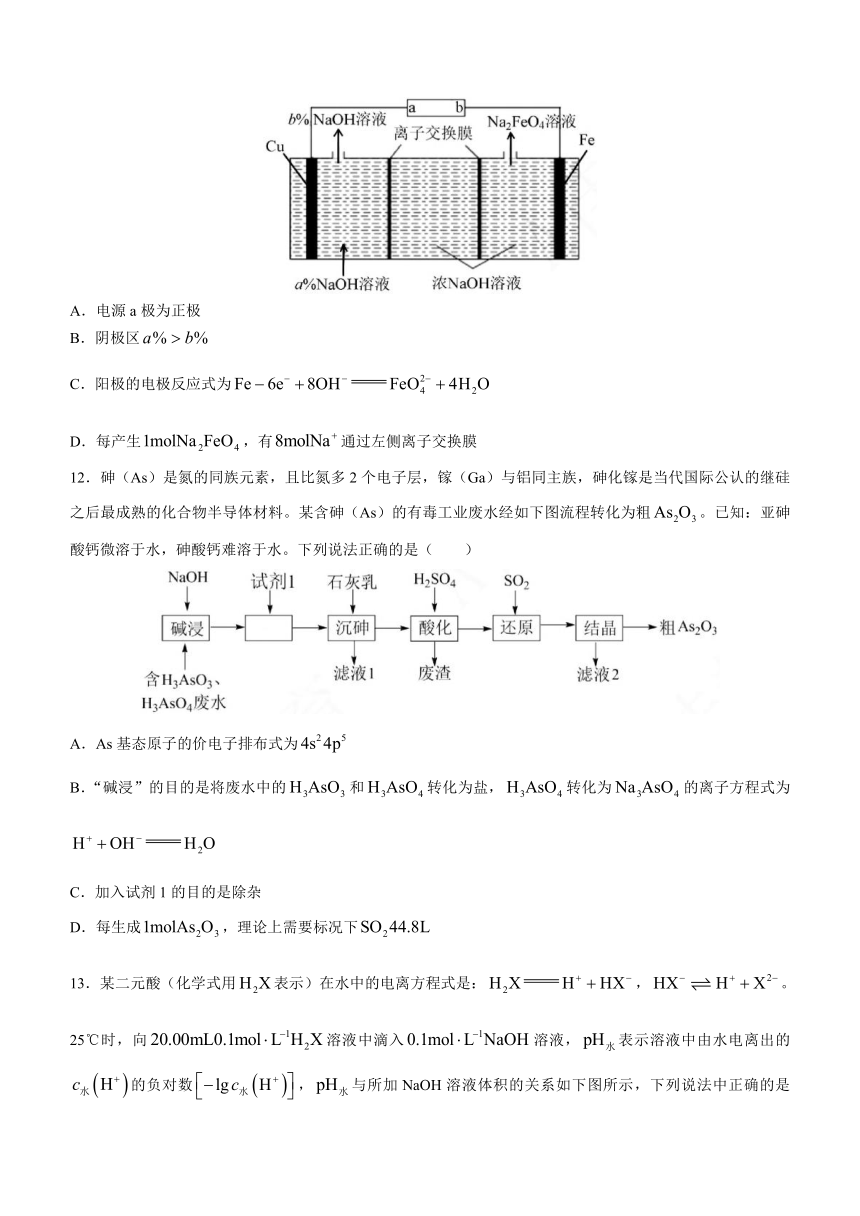
11.是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如下图装置生产,下列说法正确的是( )
A.电源a极为正极
B.阴极区
C.阳极的电极反应式为
D.每产生,有通过左侧离子交换膜
12.砷(As)是氮的同族元素,且比氮多2个电子层,镓(Ga)与铝同主族,砷化镓是当代国际公认的继硅之后最成熟的化合物半导体材料。某含砷(As)的有毒工业废水经如下图流程转化为粗。已知:亚砷酸钙微溶于水,砷酸钙难溶于水。下列说法正确的是( )
A.As基态原子的价电子排布式为
B.“碱浸”的目的是将废水中的和转化为盐,转化为的离子方程式为
C.加入试剂1的目的是除杂
D.每生成,理论上需要标况下
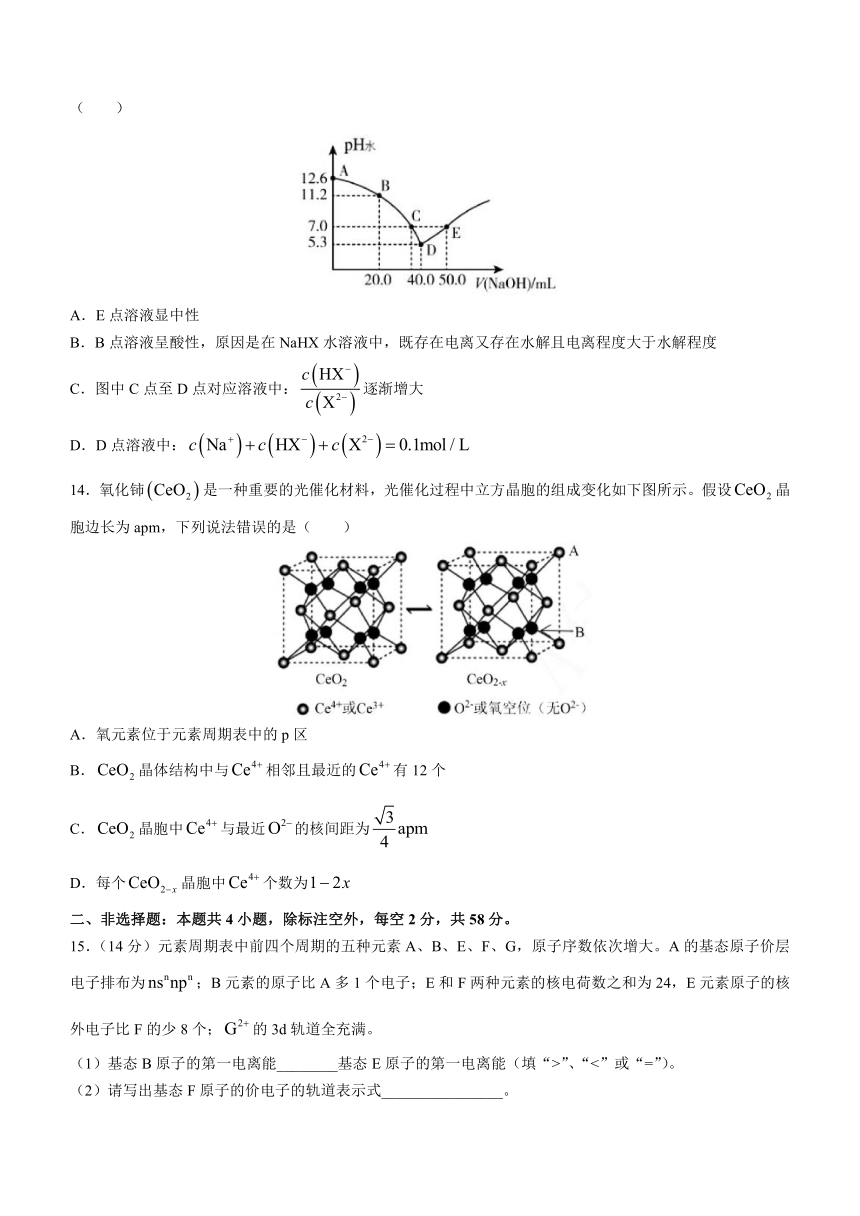
13.某二元酸(化学式用表示)在水中的电离方程式是:,。25℃时,向溶液中滴入溶液,表示溶液中由水电离出的的负对数,与所加NaOH溶液体积的关系如下图所示,下列说法中正确的是( )
A.E点溶液显中性
B.B点溶液呈酸性,原因是在NaHX水溶液中,既存在电离又存在水解且电离程度大于水解程度
C.图中C点至D点对应溶液中:逐渐增大
D.D点溶液中:
14.氧化铈是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如下图所示。假设晶胞边长为apm,下列说法错误的是( )
A.氧元素位于元素周期表中的p区
B.晶体结构中与相邻且最近的有12个
C.晶胞中与最近的核间距为
D.每个晶胞中个数为
二、非选择题:本题共4小题,除标注空外,每空2分,共58分。
15.(14分)元素周期表中前四个周期的五种元素A、B、E、F、G,原子序数依次增大。A的基态原子价层电子排布为;B元素的原子比A多1个电子;E和F两种元素的核电荷数之和为24,E元素原子的核外电子比F的少8个;的3d轨道全充满。
(1)基态B原子的第一电离能________基态E原子的第一电离能(填“>”、“<”或“=”)。
(2)请写出基态F原子的价电子的轨道表示式________________。
(3)E的一种氢化物()是常用的氧化剂,其分子结构如下图所示,两个氢原子犹如在半展开的书的两面上,该氢化物能与水混溶,却不溶于,请予以解释________。
(4)元素G、与金元素(Au)均能与形成配离子,已知与形成配离子时配位数为4;与形成配离子时配位数为2。工业上常用与形成的配离子与G单质反应,生成与形成的配离子和金单质,写出上述反应的离子方程式________________。中元素A采取sp杂化,则A与B形成的化学键中含有的键与键的数目之比为________。
(5)元素F与元素G形成的化合物是一种半导体材料,其晶胞结构如下图所示,该晶体的化学式为________(写出具体的化学式)。
若晶胞的边长为,设为阿伏伽德罗常数的值,该晶体的密度为________(已知:)。
16.(14分)四氯化锡常用作媒染剂、某些有机聚合反应的催化剂等。金属锡(熔点231℃)在300℃左右能直接与氯气作用生成无水四氯化锡,某兴趣小组用如下图装置合成。
已知:
①无水四氯化锡为无色液体,因溶有氯气而略显黄绿色,极易水解,在潮湿的空气中发烟。
②无水四氯化锡熔点-33℃,沸点114℃。
实验步骤:
Ⅰ.组装好装置,检查装置气密性良好;
Ⅱ.称取稍过量放入装置A中,向装置A中加入12mL试剂a,装置B、C、F、G中分别加入……;
Ⅲ.另取0.8g切成丝状的Sn,放入反应器②中,仪器③和⑤中都装入冷水;
Ⅳ.点燃酒精灯,待反应器②中Sn大部分反应完毕后停止加热。
请回答:
(1)仪器①中导管的作用是________________。装置A烧瓶中发生反应的离子方程式为________________________。
(2)B中试剂是________。
(3)下列有关操作的说法正确的是________。
A.先点燃酒精灯,待Sn熔化后,打开仪器①的活塞,并控制适当流速
B.若无装置F,产物中混有因水解而产生的副产物,而导致产物纯度降低
C.装置G的主要作用是防止空气中的水蒸气影响制备
D.反应结束后,大部分会在仪器④中收集
(4)提纯:将粗产品用如下图所示的装置进行提纯。请给出操作顺序:将粗产品加入圆底烧瓶,连接好装置,关闭安全瓶上旋塞,打开抽气泵、加热器→(________)→(________)→(________)→(________)→将产品转至干燥器中保存。(共2分)
a.打开安全瓶上的旋塞,关闭抽气泵
b.关闭加热器,待烧瓶冷却至室温
c.控温到114℃
d.控温到30℃
(5)纯化过程加热并抽气的原因是________________________。
(6)经过提纯,获得产品1.5g,则产率为________(保留2位有效数字)。
17.(14分)铬铁矿是岩浆作用的矿物,常产于超基性岩中,与橄榄石共生,也见于砂矿中。在冶金工业上,铬铁矿主要用来生产铬铁合金和金属铬。工业上以铬铁矿(主要成分为)为原料制备金属铬的工艺流程如下图所示:
请回答下列问题:
(1)步骤①是在空气中发生煅烧,写出化学方程式________________。
(2)步骤②研磨的目的是________________________。
(3)步骤③中加入硫酸酸化,发生反应:,酸化时用硫酸而不选用盐酸,可能的原因是________________________。
(4)加入KCl固体经一系列操作能析出晶体的原因是________________。
(5)煅烧后所得固体的质量是反应前总质量的76%,则所得氧化物的化学式为________。
(6)电解也能将铬酸钾转化为重铬酸钾,装置如下图所示,阳极的电极反应式为________________;测定阳极液中钾与铬的原子个数比为x,则此时铬酸钾的转化率为________。
18.(16分)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。科学家对反应进行了大量研究。回答下列问题:
(1)在632K时,气体混合物中碘化氢的物质的量分数与反应时间t的关系如下表:
t/min 0 20 40 60 80 100
1 0.901 0.842 0.810 0.800 0.800
①根据上述实验结果,该反应的平衡常数K为________(可用分数表示)。
②上述反应中,正反应速率为,逆反应速率为,其中、为速率常数,则为________(以K和表示)。若,则________。
(2)实验测定和计算了在136℃~180℃范围内下列反应的分压平衡常数。
Ⅰ.
Ⅱ.
得到和均为线性关系,如下图所示:
①由图可知,反应的________0(填“大于”或“小于”)。
②反应的________(用、表示);该反应的________0(填“大于”或“小于”)。
(3)1530K恒温条件下,将和置于预先抽成真空的特制1L密闭容器中,起始总压强为,体系达到平衡后,总压强为。体系中存在如下反应关系:
Ⅰ.
Ⅱ.
①计算1530K平衡体系中的分压________bar。
②计算________(可用分数表示)。
(已知:分压=总压x该组分物质的量分数,对于反应,其中,、、、为各组分的平衡分压)。
长沙市部分中学2022-2023学年高二下学期第一次月考
化学参考答案
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.A【解析】A.制普通玻璃过程中没有发生氧化还原反应,A错误;B.的结构为O=C=O,该分子中只存在极性键,为直线形分子,正负电荷重心重合,为非极性分子,B正确;C.根据消毒液可以使蛋白质变性从而杀死病毒可知德尔塔(Delta)毒株成分含蛋白质,C正确;D.电子跃迁本质上是组成物质的粒子(原子、离子或分子)中电子的一种能量变化,激光、荧光、LED灯发光时原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因而能使光呈现颜色,与电子跃迁有关,D正确。
2.C【解析】铜元素的原子序数为29,价层电子排布式为,价层电子排布图为,故A错误;属于共价晶体,没有分子式,是化学式,故B错误;HClO的结构式为,空间填充模型为,故C正确;Cl原子的价层电子排布式为,p轨道上有1个未成对电子,p轨道通过“头碰头”的方式重叠形成键,故D错误。
3.B【解析】中与之间有四个配位键是键,分子内有三个键,所以键的数目为,故A错误;标准状况下,物质的量为,根据S原子守恒,应有、、和的微粒数之和等于,则溶液中、和的微粒数之和小于,故B正确;电解精炼铜时,阳极为粗铜(含有锌等金属单质),因此无法根据质量减少量计算参加反应的金属的物质的量,故C错误;31g基态P原子中含有的未成对电子数为,故D错误。
4.D【解析】A.由水电离的溶液中,可以是酸溶液,也可以是碱溶液,酸性条件下,碳酸氢根离子会反应,不能大量共存,碱性条件下,钙离子、碳酸氢根离子会发生反应,不能大量共存,故A错误;B.使甲基橙变红的溶液呈酸性,、不能大量共存,B错误;C.无色透明溶液中,、发生剧烈的双水解不能大量共存,C错误;D.透明溶液中:、、、能大量共存,D正确。
5.C【解析】AgCl溶解并生成,故A正确;HCl能抑制氯化镁水解,加热得到无水氯化镁,,故B正确;溶液中加足量的烧碱溶液会生成氢氧化镁,,故C错误;难溶的AgCl能转化为更难溶的转化为AgI,,故D正确。
6.A【解析】MgO、NaCl均为离子晶体,半径、,且、所带电荷多,MgO晶体中晶格能大,故熔点高,A正确;金刚石与碳化硅都是原子晶体,结构相似,碳原子半径小于硅原子半径,则键长:,键长越短,键能越大,则金刚石的硬度大于碳化硅,B错误;中-为供电子基团,其羧基上的氢较难电离,因此丁酸的酸性弱于乙酸,C错误;HF和HCl属于分子晶体,分子晶体的相对分子质量越大,其沸点越高,但是HF分子间存在氢键,故HF晶体沸点高于HCl,D错误。
7.C【解析】离子中氟原子的价层电子对数为4,则离子的VSEPR模型为四面体形,故A错误;三氯化磷分子中磷原子的价层电子对数为4,孤对电子对数为1,则分子的VSEPR模型为四面体形、分子的空间构型为三角锥形,故B错误;亚硝酸根离子中氮原子的价层电子对数为3,孤对电子对数为1,则原子的杂化方式为杂化,离子的VSEPR模型为平面三角形、分子的空间构型为V形,故C正确;D.四氢合硼离子中硼原子的价层电子对数为4,孤对电子对数为0,则离子的空间构型为正四面体形,故D错误。
8.B【解析】A.和溶液的浓度未知,应测定等浓度盐溶液的pH来比较对应酸的,故A错误;B.向配合物溶液中加入硝酸银,无沉淀生成,说明、与形成配位键,即的配位数为6,故B正确;C.慢慢扩大容器体积,无论是否发生平衡移动,浓度均比原来的小,则由现象不能判定平衡的移动,故C错误;D.溶液中加入溶液发生的反应为:反应的原理是强酸制弱酸,而非双水解,D错误。
9.A【解析】Z能形成2条键,根据题干条件,Z应为O;阳离子中心原子Y形成4条键,带一个单位正电荷,Y为N;X为C;阴离子中心原子Z形成4条键,带一个单位负电荷,W为B;M为H;简单氢化物的沸点:,故A错误;该化合物阴离子中心原子B可以提供空轨道,B与O的孤对电子形成配位键,阳离子中N最外层五个电子,其中一对孤对电子与形成配位键,故B正确;第一电离能:,故C正确;该化合物中Z周围有2条键,同时存在两对孤对电子,Z价层电子对数为4,故Z的杂化方式为,故D正确。
10.C【解析】A.由图可知,相同温度时,选用催化剂X时,的转化率较高,该反应适宜选用的催化剂为X,A错误;B.加入催化剂,可以降低反应活化能,提高化学反应速率,不能增大的平衡转化率,B错误;C.时,d点对应容器在0~50min内的平均反应速率;C正确;D.催化剂只能改变反应速率,不能改变的平衡转化率,当的转化率最高时,说明反应达到平衡状态,则b点是平衡点,故a、c点都为该条件下的平衡点错误,D错误。
11.C【解析】A.根据Fe电极失去电子,Fe电极作阳极,电源b级为正极,A错误;B.阴极区发生的电极反应为,中间浓NaOH溶液通过阳离子交换膜进入左侧,致使NaOH溶液浓度增大,,B错误;C.阳极的电极反应式为,C正确;D.每产生电路中转移了,阳极产生,为了使电荷守恒,有通过左侧离子交换膜,D错误。
12.D【解析】A.砷(As)是氮的同族元素,且比氮多2个电子层,价电子是5,故As基态原子的价电子排布式为,A错误;B.“碱浸”过程,是弱酸,转化为的离子方程式为,B错误;C.亚砷酸钙微溶于水,砷酸钙难溶于水,加入试剂1的目的是将氧化生成,有利于提高砷的利用率,C错误;D.每生成,得到,需要还原剂,标况下体积为44.8L,D正确。
13.D【解析】A.E点溶液中溶质为NaOH和,的水解程度与NaOH的抑制程度相等,使,但过量的NaOH使溶液显碱性,故A错误;B.滴入氢氧化钠40mL时溶质对水的促进作用达到最大,则说明D点溶液只有,推知B点溶质为NaHX,因二元酸在水中的电离方程式为:,,所以B点时NaHX只存在电离平衡,不存在水解平衡,B错误;C.随着NaOH溶液的加入,从C点到D点的过程中,逐渐增大,逐渐减小,则同一溶液中逐渐减小,故C错误。D.D点时,酸碱恰好完全反应,其溶液溶质为,根据消耗的氢氧化钠的体积可知,加入的氢氧化钠的浓度为0.1mol/L,根据物料守恒可知,D点溶液中:,,所以,D正确。
14.D【解析】氧是ⅥA族的主族元素,其核外电子排布式为,属于p区元素,故A正确;由图2可知,以任一顶点的为例,距离其最近的位于该顶点所在的三个面的面心,一个顶点被8个晶胞共用,则距离最近的的个数为,故B正确;C.胞中与最近的核间距为晶胞对角线长度的,即,故C正确;D.假设中的和的个数分别为m和n,则,由化合价代数和为0可得,解得,由晶胞结构可知,位于顶点和面心的或个数为,所以每个晶胞中的个数为,故D错误。
三、非选择题:本题共4小题,除标注空外,每空2分,共58分。
15.(14分)【答案】
(1)> (2)
(3)是极性分子,是极性分子且能与形成氢键,而 是非极性分子
(4) 1∶2
(5)ZnS
【解析】A、B、E、F、G分别是C、N、O、S、Zn。(1)基态N原子的价电子排布式为,2p轨道半充满,能量较低较稳定,故第一电离能N>O。(2)基态S原子的价电子排布式为,根据洪特规则与泡利不相容原理,轨道表示式为。(3)是极性分子,是极性分子且能与形成氢键,而是非极性分子。(4)根据题意可知离子方程式为。中元素A采取sp杂化,则A与B之间形成碳氮三键,含一个键,2个键,故比值为1∶2。(5)元素G是元素,位于8个顶点与6个面心,故Zn的数目为:个;元素F为S元素,位于立方体中,故S的数目为:4个;二者个数的最简整数比即为化学式,故该晶体化学式为ZnS。
。
16.(14分)【答案】
(1)平衡气压,便于液体顺利流下
(2)饱和食盐水 (3)BD (4)d c b a
(5)降低在中的溶解度,加快氯气从中逸出
(6)85%
【解析】(1)仪器①用于滴加浓盐酸,但随反应的进行,蒸馏烧瓶内气体的压强增大,液体难以流出,所以分液漏斗中添加导管,其作用是:平衡气压,便于液体顺利流下。装置A中烧瓶内,与浓盐酸反应,生成、、KCl等,反应的离子方程式为。(2)B的作用是除去氯气中含有的HCl杂质,防止HCl与金属Sn发生反应,影响的纯度。(3)根据题意,四氯化锡极易水解,制备前需要排尽装置中的水蒸气,因此先通氯气排尽装置中的空气,使整个装置中充满黄绿色气体时再点燃酒精灯,故A错误。装置F中盛有浓硫酸,用于防止装置G中溶液挥发出的水蒸气进入装置E,造成四氯化锡水解,故B正确。装置G是为了防止过量的氯气逸散至空气中,造成空气污染,一般选用较浓的NaOH溶液,故C错误。仪器④浸在盛有冷水的烧杯中,便于冷凝热的产物蒸汽,且上方仪器③同时具备冷凝回流的作用,故D正确。(4)操作顺序为:d(除去溶解的)→c(让产物进入U形管)→b(蒸馏结束)→a(打开安全瓶的旋塞,关闭抽气泵)。(5)加热是降低在中的溶解度,抽气是加快从中逸出。(6)
17.(14分)【答案】(1)
(2)增大接触面积,使尽可能多地溶于水,提高浸取率
(3)盐酸中的氯为价,具有还原性,会被氧化成
(4)的溶解度比小,且温度对氯化钠的溶解度影响较小,但对重铬酸钾的溶解度影响较大,利用复分解反应在低温下可以得到重铬酸钾
(5)
(6)
【解析】(1)由产物可知铁元素与铬元素价态升高被氧化,故空气中的作氧化剂发生氧化还原反应。则有。(2)增大接触面积,使尽可能多地溶于水,提高浸取率。(3)具有氧化性,会将氯离子氧化为氯气。(4)的溶解度比小,且温度对氯化钠的溶解度影响较小,但对重铬酸钾的溶解度影响较大,利用复分解反应在低温下可以得到重铬酸钾。(5)的相对质量是100,加热放出氧气24g,氧原子减少1.5mol,剩余氧原子1.5mol,则所得氧化物中Cr与O原子个数比为1∶1.5即2∶3。故所得氧化物为。(6)设开始时的物质的量是,当铬酸钾的转化率达到b时,根据铬元素守恒可知,反应消耗、生成为、反应后为,则阳极区的钾离子为:,铬为:;,则。
18.(16分)【答案】
(1)(或0.016或) ② 0.16
(2)①大于 ② 大于
(3)①7.5 ②(或0.33)
【解析】该反应为等积反应,则有:
起始物质的量分数 1 0 0
平衡物质的量分数 0.80 0.10 0.10
则632K时该反应的平衡常数。反应达到平衡时,,将速率方程代入可得:,整理得:,即,。(2)由于与的线性关系图可知①温度越高,越小,越大,即越大,说明升高温度平衡正向移动,则该反应的大于0;②由信息可知反应Ⅰ与反应Ⅱ相加便得到:,则该反应的平衡常数,,由图像可知升高温度时减小较慢,而增大较快,因此随温度升高而增大,因此该反应为吸热反应,即大于0。(3)发生两个反应Ⅰ.、Ⅱ.,其中Ⅱ是等积反应,总压增大2.5bar,可知在Ⅰ反应中分压减小2.5bar,的分压增加为5bar。
Ⅰ.
平衡分压 p 5bar
平衡时,由Ⅰ原子守恒得,再由H守恒得。
Ⅱ.
平衡分压 7.5bar 10bar 5bar
化学
一、选择题:本大题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活密切相关,下列说法错误的是( )
A.工业制粗硅、电镀、钢铁的锈蚀、制玻璃均发生氧化还原反应
B.跨临界直接制冰使用的是由极性键构成的非极性分子
C.德尔塔(Delta)是新冠变异毒株,其成分含蛋白质
D.激光、荧光、LED灯光都与电子跃迁释放能量有关
2.下列化学用语或图示表达正确的是( )
A.基态铜原子的价层电子排布图:
B.二氧化硅的分子式:
C.HClO的空间填充模型:
D.中的键电子云轮廓图:
3.设为阿伏加德罗常数的值,下列叙述正确的是( )
A.中键的数目为
B.标准状况下,溶于水,溶液中、和的微粒数之和小于
C.电解精炼铜阳极质量减少6.4g时,转移电子数为
D.31g基态P原子中含有的未成对电子数为
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.由水电离的溶液中:、、、
B.使甲基橙变红的溶液中:、、、
C.无色透明溶液中:、、、
D.透明溶液中:、、、
5.下列用于解释事实的方程式书写错误的是( )
A.氨水溶解氯化银:
B.在HCl气流中加热得到无水:
C.溶液中加足量的烧碱溶液:
D.用KI溶液将AgCl转化为AgI:
6.物质的组成与结构决定了物质的性质与变化。下列说法正确的是( )
A.MgO的熔点高于NaCl的熔点
B.金刚石与碳化硅晶体结构相似,金刚石的硬度小于碳化硅
C.的酸性比的酸性强
D.HF晶体沸点高于HCl,是因为HCl共价键键能小于HF
7.下表中关于各微粒的描述完全正确的一项是( )
选项 A B C D
分子或离子的化学式
中心原子的杂化轨道类型
VSEPR模型名称 直线形 平面三角形 平面三角形 正四面体形
分子或离子的空间结构 直线形 平面三角形 V形 三角锥形
8.下列对实验操作和现象的解释与结论正确的是( )
操作和现象 解释与结论
A 常温下用pH试纸测得:溶液的pH为9,溶液的pH为8
B 向配合物的水溶液中滴加硝酸银溶液,无沉淀产生 中的配位数为6
C 室温下,向密闭容器中充入,达平衡后,再慢慢扩大容器体积,最终容器中气体颜色比初次平衡时浅 (无色)该平衡正向移动
D 向溶液中加入溶液,有白色沉淀生成 与发生了剧烈的双水解反应
9.某多孔储氢材料前驱体结构如下图,M、W、X、Y、Z五种短周期元素的原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列叙述错误的是( )
A.简单氢化物的沸点:X>Y
B.该化合物阴、阳离子中均有配位键
C.第一电离能:Y>Z>X>W
D.该化合物中Z元素的杂化方式为
10.“液态阳光”是推动碳低峰、碳中和的技术新路径。反应原理为:。向容积均为2L的恒容密闭容器中通入和,在不同催化剂X、Y的催化下发生反应。测得50min时,转化率与温度的变化关系如图所示。下列说法正确的是( )
A.该反应适宜选用的催化剂为Y
B.加入催化剂,可以降低反应活化能,提高化学反应速率,增大平衡转化率
C.时,d点对应容器在0~50min内的平均反应速率为
D.a、c点都为该条件下的平衡点
11.是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如下图装置生产,下列说法正确的是( )
A.电源a极为正极
B.阴极区
C.阳极的电极反应式为
D.每产生,有通过左侧离子交换膜
12.砷(As)是氮的同族元素,且比氮多2个电子层,镓(Ga)与铝同主族,砷化镓是当代国际公认的继硅之后最成熟的化合物半导体材料。某含砷(As)的有毒工业废水经如下图流程转化为粗。已知:亚砷酸钙微溶于水,砷酸钙难溶于水。下列说法正确的是( )
A.As基态原子的价电子排布式为
B.“碱浸”的目的是将废水中的和转化为盐,转化为的离子方程式为
C.加入试剂1的目的是除杂
D.每生成,理论上需要标况下
13.某二元酸(化学式用表示)在水中的电离方程式是:,。25℃时,向溶液中滴入溶液,表示溶液中由水电离出的的负对数,与所加NaOH溶液体积的关系如下图所示,下列说法中正确的是( )
A.E点溶液显中性
B.B点溶液呈酸性,原因是在NaHX水溶液中,既存在电离又存在水解且电离程度大于水解程度
C.图中C点至D点对应溶液中:逐渐增大
D.D点溶液中:
14.氧化铈是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如下图所示。假设晶胞边长为apm,下列说法错误的是( )
A.氧元素位于元素周期表中的p区
B.晶体结构中与相邻且最近的有12个
C.晶胞中与最近的核间距为
D.每个晶胞中个数为
二、非选择题:本题共4小题,除标注空外,每空2分,共58分。
15.(14分)元素周期表中前四个周期的五种元素A、B、E、F、G,原子序数依次增大。A的基态原子价层电子排布为;B元素的原子比A多1个电子;E和F两种元素的核电荷数之和为24,E元素原子的核外电子比F的少8个;的3d轨道全充满。
(1)基态B原子的第一电离能________基态E原子的第一电离能(填“>”、“<”或“=”)。
(2)请写出基态F原子的价电子的轨道表示式________________。
(3)E的一种氢化物()是常用的氧化剂,其分子结构如下图所示,两个氢原子犹如在半展开的书的两面上,该氢化物能与水混溶,却不溶于,请予以解释________。
(4)元素G、与金元素(Au)均能与形成配离子,已知与形成配离子时配位数为4;与形成配离子时配位数为2。工业上常用与形成的配离子与G单质反应,生成与形成的配离子和金单质,写出上述反应的离子方程式________________。中元素A采取sp杂化,则A与B形成的化学键中含有的键与键的数目之比为________。
(5)元素F与元素G形成的化合物是一种半导体材料,其晶胞结构如下图所示,该晶体的化学式为________(写出具体的化学式)。
若晶胞的边长为,设为阿伏伽德罗常数的值,该晶体的密度为________(已知:)。
16.(14分)四氯化锡常用作媒染剂、某些有机聚合反应的催化剂等。金属锡(熔点231℃)在300℃左右能直接与氯气作用生成无水四氯化锡,某兴趣小组用如下图装置合成。
已知:
①无水四氯化锡为无色液体,因溶有氯气而略显黄绿色,极易水解,在潮湿的空气中发烟。
②无水四氯化锡熔点-33℃,沸点114℃。
实验步骤:
Ⅰ.组装好装置,检查装置气密性良好;
Ⅱ.称取稍过量放入装置A中,向装置A中加入12mL试剂a,装置B、C、F、G中分别加入……;
Ⅲ.另取0.8g切成丝状的Sn,放入反应器②中,仪器③和⑤中都装入冷水;
Ⅳ.点燃酒精灯,待反应器②中Sn大部分反应完毕后停止加热。
请回答:
(1)仪器①中导管的作用是________________。装置A烧瓶中发生反应的离子方程式为________________________。
(2)B中试剂是________。
(3)下列有关操作的说法正确的是________。
A.先点燃酒精灯,待Sn熔化后,打开仪器①的活塞,并控制适当流速
B.若无装置F,产物中混有因水解而产生的副产物,而导致产物纯度降低
C.装置G的主要作用是防止空气中的水蒸气影响制备
D.反应结束后,大部分会在仪器④中收集
(4)提纯:将粗产品用如下图所示的装置进行提纯。请给出操作顺序:将粗产品加入圆底烧瓶,连接好装置,关闭安全瓶上旋塞,打开抽气泵、加热器→(________)→(________)→(________)→(________)→将产品转至干燥器中保存。(共2分)
a.打开安全瓶上的旋塞,关闭抽气泵
b.关闭加热器,待烧瓶冷却至室温
c.控温到114℃
d.控温到30℃
(5)纯化过程加热并抽气的原因是________________________。
(6)经过提纯,获得产品1.5g,则产率为________(保留2位有效数字)。
17.(14分)铬铁矿是岩浆作用的矿物,常产于超基性岩中,与橄榄石共生,也见于砂矿中。在冶金工业上,铬铁矿主要用来生产铬铁合金和金属铬。工业上以铬铁矿(主要成分为)为原料制备金属铬的工艺流程如下图所示:
请回答下列问题:
(1)步骤①是在空气中发生煅烧,写出化学方程式________________。
(2)步骤②研磨的目的是________________________。
(3)步骤③中加入硫酸酸化,发生反应:,酸化时用硫酸而不选用盐酸,可能的原因是________________________。
(4)加入KCl固体经一系列操作能析出晶体的原因是________________。
(5)煅烧后所得固体的质量是反应前总质量的76%,则所得氧化物的化学式为________。
(6)电解也能将铬酸钾转化为重铬酸钾,装置如下图所示,阳极的电极反应式为________________;测定阳极液中钾与铬的原子个数比为x,则此时铬酸钾的转化率为________。
18.(16分)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。科学家对反应进行了大量研究。回答下列问题:
(1)在632K时,气体混合物中碘化氢的物质的量分数与反应时间t的关系如下表:
t/min 0 20 40 60 80 100
1 0.901 0.842 0.810 0.800 0.800
①根据上述实验结果,该反应的平衡常数K为________(可用分数表示)。
②上述反应中,正反应速率为,逆反应速率为,其中、为速率常数,则为________(以K和表示)。若,则________。
(2)实验测定和计算了在136℃~180℃范围内下列反应的分压平衡常数。
Ⅰ.
Ⅱ.
得到和均为线性关系,如下图所示:
①由图可知,反应的________0(填“大于”或“小于”)。
②反应的________(用、表示);该反应的________0(填“大于”或“小于”)。
(3)1530K恒温条件下,将和置于预先抽成真空的特制1L密闭容器中,起始总压强为,体系达到平衡后,总压强为。体系中存在如下反应关系:
Ⅰ.
Ⅱ.
①计算1530K平衡体系中的分压________bar。
②计算________(可用分数表示)。
(已知:分压=总压x该组分物质的量分数,对于反应,其中,、、、为各组分的平衡分压)。
长沙市部分中学2022-2023学年高二下学期第一次月考
化学参考答案
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.A【解析】A.制普通玻璃过程中没有发生氧化还原反应,A错误;B.的结构为O=C=O,该分子中只存在极性键,为直线形分子,正负电荷重心重合,为非极性分子,B正确;C.根据消毒液可以使蛋白质变性从而杀死病毒可知德尔塔(Delta)毒株成分含蛋白质,C正确;D.电子跃迁本质上是组成物质的粒子(原子、离子或分子)中电子的一种能量变化,激光、荧光、LED灯发光时原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因而能使光呈现颜色,与电子跃迁有关,D正确。
2.C【解析】铜元素的原子序数为29,价层电子排布式为,价层电子排布图为,故A错误;属于共价晶体,没有分子式,是化学式,故B错误;HClO的结构式为,空间填充模型为,故C正确;Cl原子的价层电子排布式为,p轨道上有1个未成对电子,p轨道通过“头碰头”的方式重叠形成键,故D错误。
3.B【解析】中与之间有四个配位键是键,分子内有三个键,所以键的数目为,故A错误;标准状况下,物质的量为,根据S原子守恒,应有、、和的微粒数之和等于,则溶液中、和的微粒数之和小于,故B正确;电解精炼铜时,阳极为粗铜(含有锌等金属单质),因此无法根据质量减少量计算参加反应的金属的物质的量,故C错误;31g基态P原子中含有的未成对电子数为,故D错误。
4.D【解析】A.由水电离的溶液中,可以是酸溶液,也可以是碱溶液,酸性条件下,碳酸氢根离子会反应,不能大量共存,碱性条件下,钙离子、碳酸氢根离子会发生反应,不能大量共存,故A错误;B.使甲基橙变红的溶液呈酸性,、不能大量共存,B错误;C.无色透明溶液中,、发生剧烈的双水解不能大量共存,C错误;D.透明溶液中:、、、能大量共存,D正确。
5.C【解析】AgCl溶解并生成,故A正确;HCl能抑制氯化镁水解,加热得到无水氯化镁,,故B正确;溶液中加足量的烧碱溶液会生成氢氧化镁,,故C错误;难溶的AgCl能转化为更难溶的转化为AgI,,故D正确。
6.A【解析】MgO、NaCl均为离子晶体,半径、,且、所带电荷多,MgO晶体中晶格能大,故熔点高,A正确;金刚石与碳化硅都是原子晶体,结构相似,碳原子半径小于硅原子半径,则键长:,键长越短,键能越大,则金刚石的硬度大于碳化硅,B错误;中-为供电子基团,其羧基上的氢较难电离,因此丁酸的酸性弱于乙酸,C错误;HF和HCl属于分子晶体,分子晶体的相对分子质量越大,其沸点越高,但是HF分子间存在氢键,故HF晶体沸点高于HCl,D错误。
7.C【解析】离子中氟原子的价层电子对数为4,则离子的VSEPR模型为四面体形,故A错误;三氯化磷分子中磷原子的价层电子对数为4,孤对电子对数为1,则分子的VSEPR模型为四面体形、分子的空间构型为三角锥形,故B错误;亚硝酸根离子中氮原子的价层电子对数为3,孤对电子对数为1,则原子的杂化方式为杂化,离子的VSEPR模型为平面三角形、分子的空间构型为V形,故C正确;D.四氢合硼离子中硼原子的价层电子对数为4,孤对电子对数为0,则离子的空间构型为正四面体形,故D错误。
8.B【解析】A.和溶液的浓度未知,应测定等浓度盐溶液的pH来比较对应酸的,故A错误;B.向配合物溶液中加入硝酸银,无沉淀生成,说明、与形成配位键,即的配位数为6,故B正确;C.慢慢扩大容器体积,无论是否发生平衡移动,浓度均比原来的小,则由现象不能判定平衡的移动,故C错误;D.溶液中加入溶液发生的反应为:反应的原理是强酸制弱酸,而非双水解,D错误。
9.A【解析】Z能形成2条键,根据题干条件,Z应为O;阳离子中心原子Y形成4条键,带一个单位正电荷,Y为N;X为C;阴离子中心原子Z形成4条键,带一个单位负电荷,W为B;M为H;简单氢化物的沸点:,故A错误;该化合物阴离子中心原子B可以提供空轨道,B与O的孤对电子形成配位键,阳离子中N最外层五个电子,其中一对孤对电子与形成配位键,故B正确;第一电离能:,故C正确;该化合物中Z周围有2条键,同时存在两对孤对电子,Z价层电子对数为4,故Z的杂化方式为,故D正确。
10.C【解析】A.由图可知,相同温度时,选用催化剂X时,的转化率较高,该反应适宜选用的催化剂为X,A错误;B.加入催化剂,可以降低反应活化能,提高化学反应速率,不能增大的平衡转化率,B错误;C.时,d点对应容器在0~50min内的平均反应速率;C正确;D.催化剂只能改变反应速率,不能改变的平衡转化率,当的转化率最高时,说明反应达到平衡状态,则b点是平衡点,故a、c点都为该条件下的平衡点错误,D错误。
11.C【解析】A.根据Fe电极失去电子,Fe电极作阳极,电源b级为正极,A错误;B.阴极区发生的电极反应为,中间浓NaOH溶液通过阳离子交换膜进入左侧,致使NaOH溶液浓度增大,,B错误;C.阳极的电极反应式为,C正确;D.每产生电路中转移了,阳极产生,为了使电荷守恒,有通过左侧离子交换膜,D错误。
12.D【解析】A.砷(As)是氮的同族元素,且比氮多2个电子层,价电子是5,故As基态原子的价电子排布式为,A错误;B.“碱浸”过程,是弱酸,转化为的离子方程式为,B错误;C.亚砷酸钙微溶于水,砷酸钙难溶于水,加入试剂1的目的是将氧化生成,有利于提高砷的利用率,C错误;D.每生成,得到,需要还原剂,标况下体积为44.8L,D正确。
13.D【解析】A.E点溶液中溶质为NaOH和,的水解程度与NaOH的抑制程度相等,使,但过量的NaOH使溶液显碱性,故A错误;B.滴入氢氧化钠40mL时溶质对水的促进作用达到最大,则说明D点溶液只有,推知B点溶质为NaHX,因二元酸在水中的电离方程式为:,,所以B点时NaHX只存在电离平衡,不存在水解平衡,B错误;C.随着NaOH溶液的加入,从C点到D点的过程中,逐渐增大,逐渐减小,则同一溶液中逐渐减小,故C错误。D.D点时,酸碱恰好完全反应,其溶液溶质为,根据消耗的氢氧化钠的体积可知,加入的氢氧化钠的浓度为0.1mol/L,根据物料守恒可知,D点溶液中:,,所以,D正确。
14.D【解析】氧是ⅥA族的主族元素,其核外电子排布式为,属于p区元素,故A正确;由图2可知,以任一顶点的为例,距离其最近的位于该顶点所在的三个面的面心,一个顶点被8个晶胞共用,则距离最近的的个数为,故B正确;C.胞中与最近的核间距为晶胞对角线长度的,即,故C正确;D.假设中的和的个数分别为m和n,则,由化合价代数和为0可得,解得,由晶胞结构可知,位于顶点和面心的或个数为,所以每个晶胞中的个数为,故D错误。
三、非选择题:本题共4小题,除标注空外,每空2分,共58分。
15.(14分)【答案】
(1)> (2)
(3)是极性分子,是极性分子且能与形成氢键,而 是非极性分子
(4) 1∶2
(5)ZnS
【解析】A、B、E、F、G分别是C、N、O、S、Zn。(1)基态N原子的价电子排布式为,2p轨道半充满,能量较低较稳定,故第一电离能N>O。(2)基态S原子的价电子排布式为,根据洪特规则与泡利不相容原理,轨道表示式为。(3)是极性分子,是极性分子且能与形成氢键,而是非极性分子。(4)根据题意可知离子方程式为。中元素A采取sp杂化,则A与B之间形成碳氮三键,含一个键,2个键,故比值为1∶2。(5)元素G是元素,位于8个顶点与6个面心,故Zn的数目为:个;元素F为S元素,位于立方体中,故S的数目为:4个;二者个数的最简整数比即为化学式,故该晶体化学式为ZnS。
。
16.(14分)【答案】
(1)平衡气压,便于液体顺利流下
(2)饱和食盐水 (3)BD (4)d c b a
(5)降低在中的溶解度,加快氯气从中逸出
(6)85%
【解析】(1)仪器①用于滴加浓盐酸,但随反应的进行,蒸馏烧瓶内气体的压强增大,液体难以流出,所以分液漏斗中添加导管,其作用是:平衡气压,便于液体顺利流下。装置A中烧瓶内,与浓盐酸反应,生成、、KCl等,反应的离子方程式为。(2)B的作用是除去氯气中含有的HCl杂质,防止HCl与金属Sn发生反应,影响的纯度。(3)根据题意,四氯化锡极易水解,制备前需要排尽装置中的水蒸气,因此先通氯气排尽装置中的空气,使整个装置中充满黄绿色气体时再点燃酒精灯,故A错误。装置F中盛有浓硫酸,用于防止装置G中溶液挥发出的水蒸气进入装置E,造成四氯化锡水解,故B正确。装置G是为了防止过量的氯气逸散至空气中,造成空气污染,一般选用较浓的NaOH溶液,故C错误。仪器④浸在盛有冷水的烧杯中,便于冷凝热的产物蒸汽,且上方仪器③同时具备冷凝回流的作用,故D正确。(4)操作顺序为:d(除去溶解的)→c(让产物进入U形管)→b(蒸馏结束)→a(打开安全瓶的旋塞,关闭抽气泵)。(5)加热是降低在中的溶解度,抽气是加快从中逸出。(6)
17.(14分)【答案】(1)
(2)增大接触面积,使尽可能多地溶于水,提高浸取率
(3)盐酸中的氯为价,具有还原性,会被氧化成
(4)的溶解度比小,且温度对氯化钠的溶解度影响较小,但对重铬酸钾的溶解度影响较大,利用复分解反应在低温下可以得到重铬酸钾
(5)
(6)
【解析】(1)由产物可知铁元素与铬元素价态升高被氧化,故空气中的作氧化剂发生氧化还原反应。则有。(2)增大接触面积,使尽可能多地溶于水,提高浸取率。(3)具有氧化性,会将氯离子氧化为氯气。(4)的溶解度比小,且温度对氯化钠的溶解度影响较小,但对重铬酸钾的溶解度影响较大,利用复分解反应在低温下可以得到重铬酸钾。(5)的相对质量是100,加热放出氧气24g,氧原子减少1.5mol,剩余氧原子1.5mol,则所得氧化物中Cr与O原子个数比为1∶1.5即2∶3。故所得氧化物为。(6)设开始时的物质的量是,当铬酸钾的转化率达到b时,根据铬元素守恒可知,反应消耗、生成为、反应后为,则阳极区的钾离子为:,铬为:;,则。
18.(16分)【答案】
(1)(或0.016或) ② 0.16
(2)①大于 ② 大于
(3)①7.5 ②(或0.33)
【解析】该反应为等积反应,则有:
起始物质的量分数 1 0 0
平衡物质的量分数 0.80 0.10 0.10
则632K时该反应的平衡常数。反应达到平衡时,,将速率方程代入可得:,整理得:,即,。(2)由于与的线性关系图可知①温度越高,越小,越大,即越大,说明升高温度平衡正向移动,则该反应的大于0;②由信息可知反应Ⅰ与反应Ⅱ相加便得到:,则该反应的平衡常数,,由图像可知升高温度时减小较慢,而增大较快,因此随温度升高而增大,因此该反应为吸热反应,即大于0。(3)发生两个反应Ⅰ.、Ⅱ.,其中Ⅱ是等积反应,总压增大2.5bar,可知在Ⅰ反应中分压减小2.5bar,的分压增加为5bar。
Ⅰ.
平衡分压 p 5bar
平衡时,由Ⅰ原子守恒得,再由H守恒得。
Ⅱ.
平衡分压 7.5bar 10bar 5bar
同课章节目录
