6.1.1 化学反应与热能课件(共18张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.1 化学反应与热能课件(共18张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-20 15:00:15 | ||
图片预览




文档简介
(共18张PPT)
第六章 化学反应与能量
第一节第1课时 化学反应与热能
不用电不用火
自助加热饭盒
你知道其中的原理吗?这种自动加热饭盒与我们化学反应有关吗?
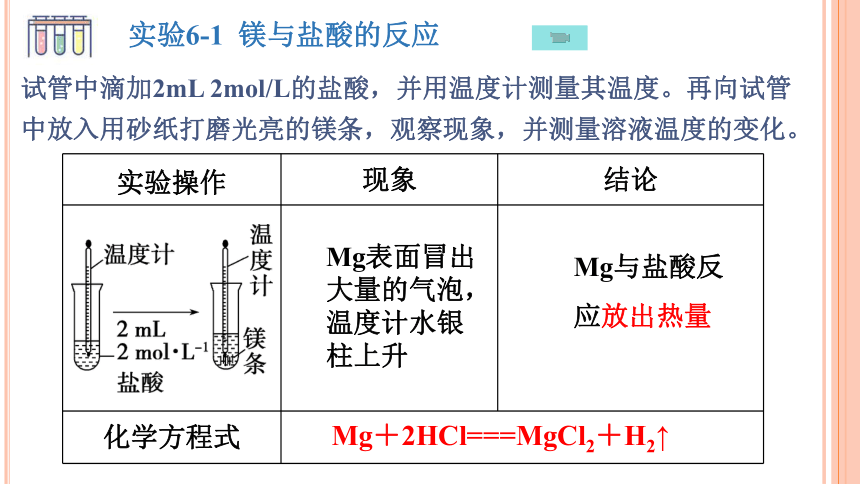
实验操作 现象 结论
化学方程式 Mg表面冒出大量的气泡,温度计水银柱上升
Mg与盐酸反
应放出热量
实验6-1 镁与盐酸的反应
试管中滴加2mL 2mol/L的盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
Mg+2HCl===MgCl2+H2↑
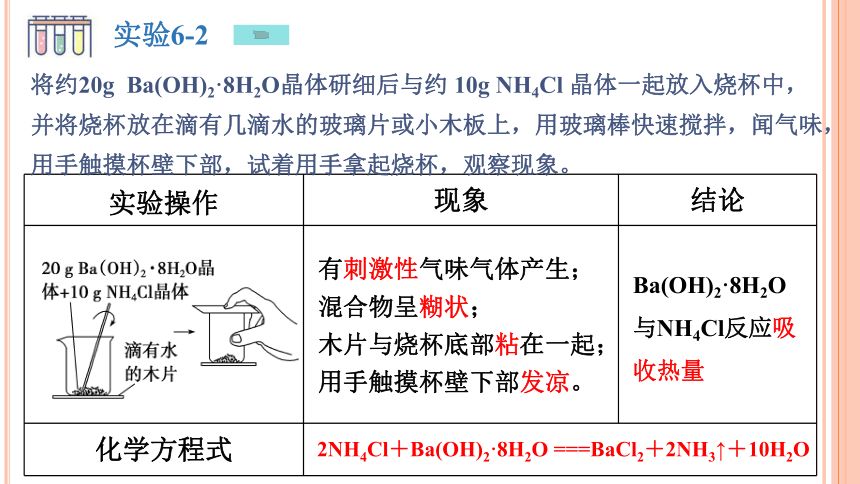
实验操作 现象 结论
化学方程式 有刺激性气味气体产生;混合物呈糊状; 木片与烧杯底部粘在一起;用手触摸杯壁下部发凉。
Ba(OH)2·8H2O与NH4Cl反应吸收热量
2NH4Cl+Ba(OH)2·8H2O ===BaCl2+2NH3↑+10H2O
实验6-2
将约20g Ba(OH)2·8H2O晶体研细后与约 10g NH4Cl 晶体一起放入烧杯中,并将烧杯放在滴有几滴水的玻璃片或小木板上,用玻璃棒快速搅拌,闻气味,用手触摸杯壁下部,试着用手拿起烧杯,观察现象。
放热反应:反应过程中有热量放出的化学反应。
吸热反应:反应过程中吸收热量的化学反应。
一、放热反应和吸热反应
吸热反应
放热反应
化学反应
常见的吸热反应和放热反应
放热反应
燃料的燃烧反应
中 和 反 应
活泼金属与水或酸的反应(钠与水)
大部分化合反应(生石灰和水)
物质的缓慢氧化
铝热反应
C/CO/H2与氧化物的反应
(如:C+CO2 C+H2O )
铵盐与碱的反应
大部分分解反应
NaHCO3与盐酸的反应
吸热反应
化学反应过程中为什么会有能量变化?为什么有的化学反应释放热量,有的化学反应吸收热量?
H ·
→
Cl
··
··
H
··
··
+
H—H
Cl —Cl
H—Cl
H2 + Cl2 == 2HCl
点燃
··
· Cl
··
··
化学反应的实质:旧化学键断裂和新化学键形成。
吸收能量
断开
断开
吸收能量
形成
放出能量
化学键的断裂和形成是化学反应中能量变化的主要原因。
二、化学反应中能量变化的分析
1、从化学键的观点来分析能量的变化(微观)
旧化学键断裂 新化学键形成
吸收能量
放出能量
思考:一个化学反应是放出能量还是吸收能量取决于什么?
断键吸收的总能量与形成新键放出的总能量的相对大小
吸热反应
放热反应
从外界获取能量
向外界释放能量
断键吸收总能 > 成键放出总能
断键吸收总能 < 成键放出总能
各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。
冰
水
水蒸气
温度不断升高,自身能量不断增大,固态 < 液态 < 气态
能量越低越稳定
2、化学反应中能量变化的决定因素(宏观)
水由高处向低处流要释放能量(势能转换为动能)
反应物的总能量 > 生成物的总能量
思考:反应物本身所具有的总能量和生成物本身所具有的总能量之间的相对大小与反应放热、吸热的关系如何?
化学反应放出能量
将水由低处抽向高处需提供能量
(电能转换为机械能,再转换为势能)
反应物的总能量 < 生成物的总能量
化学反应吸收能量
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
规律
一个化学反应吸收能量还是放出能量的决定因素(宏观)
反应物总能量与生成物总能量的相对大小
能量
反应过程
反应过程
反应物
生成物
能量
放热反应
吸热反应
反应物
生成物
一个化学反应是吸收能量还是放出能量,还可取决于反应物的总能量与生成物的总能量的相对大小。
放出能量
吸收能量
放热反应
吸热反应
(2)若E反< E生
(1)若E反> E生
反应物的能量之和:E反
生成物的能量之和:E生
化学反应与能量变化
反应物的总能量与生成物的总能量不相等
断键吸能>成键放能 (微观)
反应物的总能量< 生成物的总能量(宏观)
吸收
热量
断键吸能<成键放能(微观)
反应物的总能量> 生成物的总能量(宏观)
放出
热量
结
总
1. 现阶段人类获取热能的主要途径
煤的燃烧
石油的燃烧
其他物质的燃烧
天然气的燃烧
主要形式
三、人类利用能源的三个阶段
储量有限,短期内不可再生
影响环境
煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源
2. 化石燃料利用过程面临的问题
3. 能源可持续发展的措施
提高燃料的燃烧效率
提高能源的利用率
开发使用新能源
第六章 化学反应与能量
第一节第1课时 化学反应与热能
不用电不用火
自助加热饭盒
你知道其中的原理吗?这种自动加热饭盒与我们化学反应有关吗?
实验操作 现象 结论
化学方程式 Mg表面冒出大量的气泡,温度计水银柱上升
Mg与盐酸反
应放出热量
实验6-1 镁与盐酸的反应
试管中滴加2mL 2mol/L的盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
Mg+2HCl===MgCl2+H2↑
实验操作 现象 结论
化学方程式 有刺激性气味气体产生;混合物呈糊状; 木片与烧杯底部粘在一起;用手触摸杯壁下部发凉。
Ba(OH)2·8H2O与NH4Cl反应吸收热量
2NH4Cl+Ba(OH)2·8H2O ===BaCl2+2NH3↑+10H2O
实验6-2
将约20g Ba(OH)2·8H2O晶体研细后与约 10g NH4Cl 晶体一起放入烧杯中,并将烧杯放在滴有几滴水的玻璃片或小木板上,用玻璃棒快速搅拌,闻气味,用手触摸杯壁下部,试着用手拿起烧杯,观察现象。
放热反应:反应过程中有热量放出的化学反应。
吸热反应:反应过程中吸收热量的化学反应。
一、放热反应和吸热反应
吸热反应
放热反应
化学反应
常见的吸热反应和放热反应
放热反应
燃料的燃烧反应
中 和 反 应
活泼金属与水或酸的反应(钠与水)
大部分化合反应(生石灰和水)
物质的缓慢氧化
铝热反应
C/CO/H2与氧化物的反应
(如:C+CO2 C+H2O )
铵盐与碱的反应
大部分分解反应
NaHCO3与盐酸的反应
吸热反应
化学反应过程中为什么会有能量变化?为什么有的化学反应释放热量,有的化学反应吸收热量?
H ·
→
Cl
··
··
H
··
··
+
H—H
Cl —Cl
H—Cl
H2 + Cl2 == 2HCl
点燃
··
· Cl
··
··
化学反应的实质:旧化学键断裂和新化学键形成。
吸收能量
断开
断开
吸收能量
形成
放出能量
化学键的断裂和形成是化学反应中能量变化的主要原因。
二、化学反应中能量变化的分析
1、从化学键的观点来分析能量的变化(微观)
旧化学键断裂 新化学键形成
吸收能量
放出能量
思考:一个化学反应是放出能量还是吸收能量取决于什么?
断键吸收的总能量与形成新键放出的总能量的相对大小
吸热反应
放热反应
从外界获取能量
向外界释放能量
断键吸收总能 > 成键放出总能
断键吸收总能 < 成键放出总能
各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。
冰
水
水蒸气
温度不断升高,自身能量不断增大,固态 < 液态 < 气态
能量越低越稳定
2、化学反应中能量变化的决定因素(宏观)
水由高处向低处流要释放能量(势能转换为动能)
反应物的总能量 > 生成物的总能量
思考:反应物本身所具有的总能量和生成物本身所具有的总能量之间的相对大小与反应放热、吸热的关系如何?
化学反应放出能量
将水由低处抽向高处需提供能量
(电能转换为机械能,再转换为势能)
反应物的总能量 < 生成物的总能量
化学反应吸收能量
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
规律
一个化学反应吸收能量还是放出能量的决定因素(宏观)
反应物总能量与生成物总能量的相对大小
能量
反应过程
反应过程
反应物
生成物
能量
放热反应
吸热反应
反应物
生成物
一个化学反应是吸收能量还是放出能量,还可取决于反应物的总能量与生成物的总能量的相对大小。
放出能量
吸收能量
放热反应
吸热反应
(2)若E反< E生
(1)若E反> E生
反应物的能量之和:E反
生成物的能量之和:E生
化学反应与能量变化
反应物的总能量与生成物的总能量不相等
断键吸能>成键放能 (微观)
反应物的总能量< 生成物的总能量(宏观)
吸收
热量
断键吸能<成键放能(微观)
反应物的总能量> 生成物的总能量(宏观)
放出
热量
结
总
1. 现阶段人类获取热能的主要途径
煤的燃烧
石油的燃烧
其他物质的燃烧
天然气的燃烧
主要形式
三、人类利用能源的三个阶段
储量有限,短期内不可再生
影响环境
煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源
2. 化石燃料利用过程面临的问题
3. 能源可持续发展的措施
提高燃料的燃烧效率
提高能源的利用率
开发使用新能源
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
