强化练4 氧化还原反应 (含解析)江苏省2023高考化学三轮冲刺突破强化练
文档属性
| 名称 | 强化练4 氧化还原反应 (含解析)江苏省2023高考化学三轮冲刺突破强化练 |

|
|
| 格式 | docx | ||
| 文件大小 | 344.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-19 00:00:00 | ||
图片预览



文档简介
强化练4 氧化还原反应
1.焦亚硫酸钠(Na2S2O5)可用作食品抗氧化剂,下列说法正确的是 ( )
A.Na2S2O5中S元素只有还原性
B.葡萄酒中Na2S2O5残留量可用碘标准液滴定法测量
C.食品抗氧化剂必须是有氧化性的物质
D.由Na2S2O5制Na2SO4需添加还原剂
2.(2022·上海华师大二附中高三模拟)用酸性KMnO4溶液处理Cu2S,发生反应:Mn+Cu2S+H+Cu2++S+Mn2++H2O(未配平),下列说法正确的是 ( )
A.反应中Cu2S既是氧化剂又是还原剂
B.反应中每生成1 mol S,转移电子的物质的量为8 mol
C.可以用单质直接化合的方法制备Cu2S
D.Cu2+、S为还原产物,Mn2+为氧化产物
3.(2022·辽宁一模)向FeBr2溶液中通入Cl2时,随参加反应的Cl2物质的量的变化,溶液中某些离子的浓度变化情况如图所示。下列说法正确的是 ( )
A.当n(Cl2)B.当n(Cl2)=M mol时,离子浓度关系:c(Fe3+)∶c(Br-)∶c(Cl-)=2∶1∶1
C.当n(Cl2)=2M mol时,离子浓度大小关系:c(Cl-)>c(Br-)
D.当通入Cl2的物质的量等于原FeBr2的物质的量时,Br-开始被氧化
4.在催化剂的作用下,NH3和NO2发生反应生成N2和H2O,下列说法正确的是 ( )
A.NO2是氧化剂,H2O是还原产物
B.每生成7 mol N2转移电子数为21 mol
C.在NH3与NO2的反应中,44.8 L NH3最多可以生成1.75 mol N2
D.在一定条件下,CO也可以和NO2发生氧化还原反应
5.(2022·河北保定一模)三氧化二铬(Cr2O3)是一种深绿色的固体,熔点很高,难溶于水,其化学性质类似于Al2O3,水溶液中Cr(Ⅲ)具有还原性。下列关于Cr2O3的说法错误的是 ( )
A.与稀硫酸反应:Cr2O3+3H2SO4Cr2(SO4)3+3H2O
B.与NaOH溶液反应:Cr2O3+3H2O+2OH-2[Cr(OH)4]-
C.碱性条件下被H2O2氧化为Cr(Ⅵ):Cr2O3+3H2O2+2OH-Cr2+
4H2O
D.铝的金属性强于铬,且铬的熔点较高,故可用铝热法还原Cr2O3制取金属铬
6.(2022·广东深圳一模)部分含铁微粒所带的电荷数与其中铁元素化合价的关系如图所示,由该图可预测含铁微粒间相互转化时所需试剂。下列推断不合理的是 ( )
A.M一定为FeO
B.若R为单质,则常温下浓硫酸可使R钝化
C.若Q为金属阳离子,则可用K3[Fe(CN)6]溶液检验
D.Fe3+与氧化剂在碱性条件下反应可生成Fe
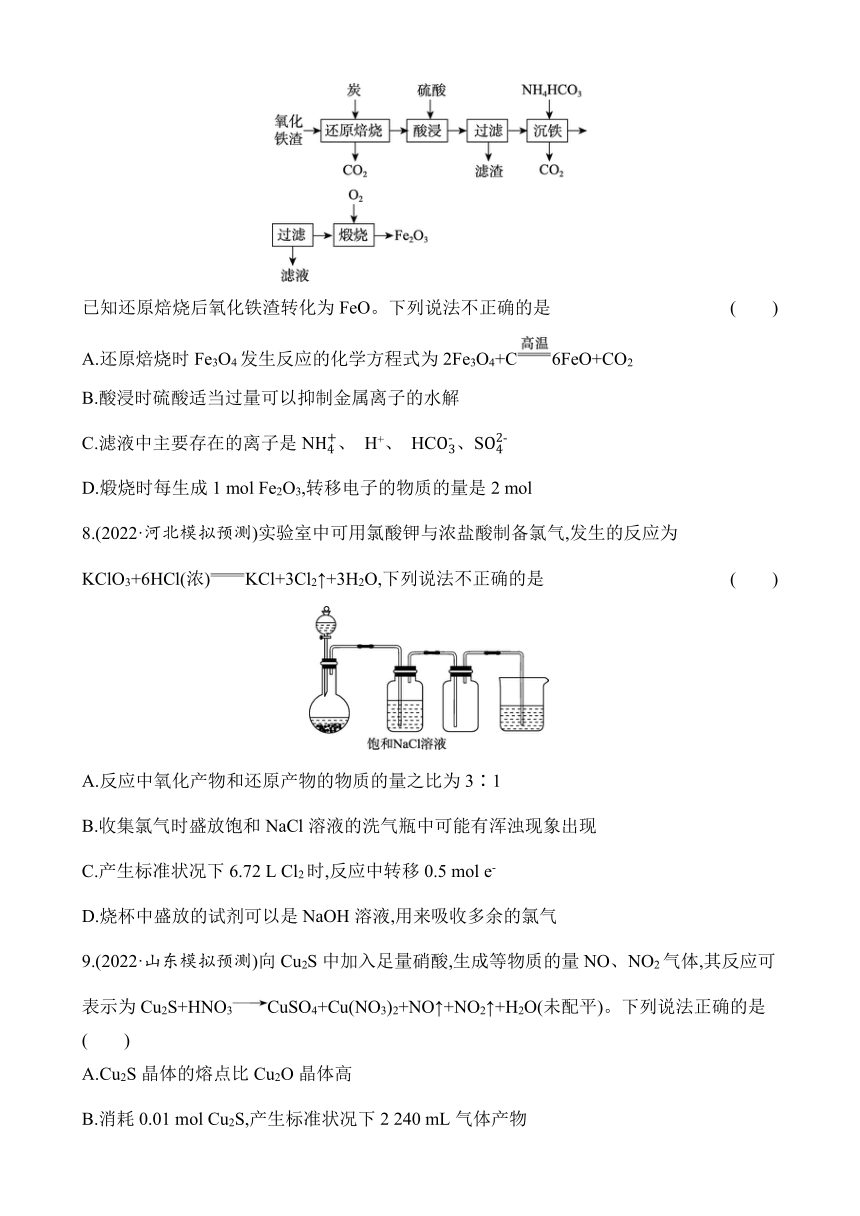
7.(2022·如皋期末调研)以氧化铁渣(主要含Fe3O4和Fe2O3)制取氧化铁的流程如图:
已知还原焙烧后氧化铁渣转化为FeO。下列说法不正确的是 ( )
A.还原焙烧时Fe3O4发生反应的化学方程式为2Fe3O4+C6FeO+CO2
B.酸浸时硫酸适当过量可以抑制金属离子的水解
C.滤液中主要存在的离子是N、 H+、 HC、S
D.煅烧时每生成1 mol Fe2O3,转移电子的物质的量是2 mol
8.(2022·河北模拟预测)实验室中可用氯酸钾与浓盐酸制备氯气,发生的反应为KClO3+6HCl(浓)KCl+3Cl2↑+3H2O,下列说法不正确的是 ( )
A.反应中氧化产物和还原产物的物质的量之比为3∶1
B.收集氯气时盛放饱和NaCl溶液的洗气瓶中可能有浑浊现象出现
C.产生标准状况下6.72 L Cl2时,反应中转移0.5 mol e-
D.烧杯中盛放的试剂可以是NaOH溶液,用来吸收多余的氯气
9.(2022·山东模拟预测)向Cu2S中加入足量硝酸,生成等物质的量NO、NO2气体,其反应可表示为Cu2S+HNO3CuSO4+Cu(NO3)2+NO↑+NO2↑+H2O(未配平)。下列说法正确的是( )
A.Cu2S晶体的熔点比Cu2O晶体高
B.消耗0.01 mol Cu2S,产生标准状况下2 240 mL气体产物
C.氧化剂和还原剂的物质的量之比为7∶1
D.0.1 mol Cu2S参与反应,产生的气体与一定量的O2混合后通入水中完全反应生成硝酸,消耗O2的质量为8 g
10.部分含氯物质的分类与相应化合价关系如图所示。下列说法错误的是( )
A.工业上通过电解g的水溶液制备b
B.用a、d制备1 mol b时转移的电子数为5NA
C.c具有漂白性,见光分解
D.e可用于自来水消毒
11.固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图:
下列叙述正确的是 ( )
A.反应①②③均为氧化还原反应
B.转化过程中所涉及的元素均呈现了两种价态
C.假设每一步均完全转化,每生成1 mol NH3,同时生成0.75 mol O2
D.参与反应的物质中含有的化学键有离子键、共价键和氢键
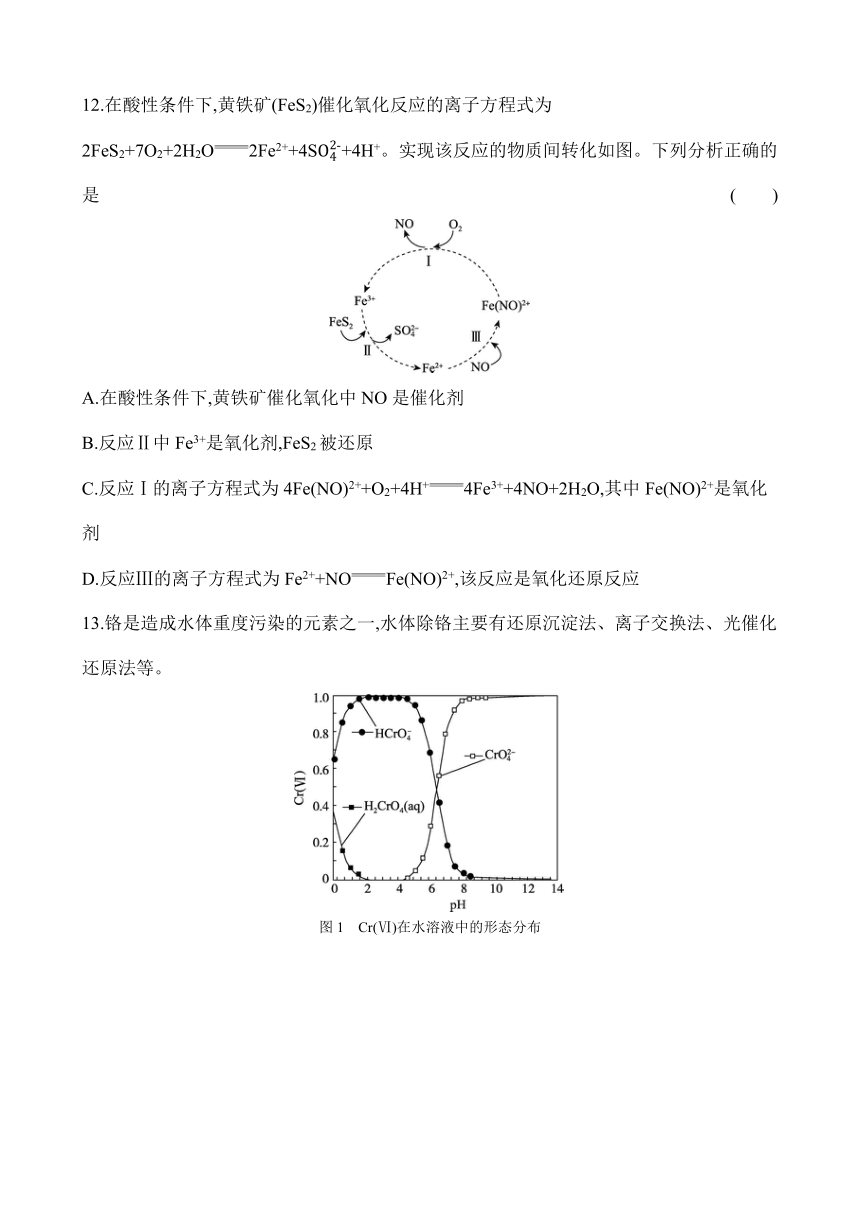
12.在酸性条件下,黄铁矿(FeS2)催化氧化反应的离子方程式为2FeS2+7O2+2H2O2Fe2++4S+4H+。实现该反应的物质间转化如图。下列分析正确的是 ( )
A.在酸性条件下,黄铁矿催化氧化中NO是催化剂
B.反应Ⅱ中Fe3+是氧化剂,FeS2被还原
C.反应Ⅰ的离子方程式为4Fe(NO)2++O2+4H+4Fe3++4NO+2H2O,其中Fe(NO)2+是氧化剂
D.反应Ⅲ的离子方程式为Fe2++NOFe(NO)2+,该反应是氧化还原反应
13.铬是造成水体重度污染的元素之一,水体除铬主要有还原沉淀法、离子交换法、光催化还原法等。
图1 Cr(Ⅵ)在水溶液中的形态分布
图2 Cr(Ⅲ)在水溶液中的形态分布
还原沉淀法:向水体中加入FeSO4、CaSO3等将高毒性 Cr(Ⅵ)还原为低毒性Cr(Ⅲ),再调节pH使Cr(Ⅲ)生成Cr(OH)3沉淀除去。
(1)Cr(Ⅵ)在水溶液中的存在形态分布如图1所示。向pH=1.5的含Cr(Ⅵ)污水中加入FeSO4,发生的主要反应的离子方程式为 。
(2)Cr(Ⅲ)在水溶液中的存在形态分布如图2所示。当pH>12时,铬去除率下降的原因可用离子方程式表示为 。
强化练4 氧化还原反应
1.B 解析:Na2S2O5中S元素的化合价为+4价,属于中间价态,因此Na2S2O5中S元素既有氧化性又有还原性,选项A错误;根据葡萄酒中二氧化硫可以用碘量法进行测量,所以葡萄酒中Na2S2O5残留量可用碘标准液滴定法测量,选项B正确;食品抗氧化剂必须是有还原性的物质,选项C错误;Na2S2O5中S元素化合价为+4价,Na2SO4中S元素化合价为+6价,S元素化合价升高,所以由Na2S2O5制Na2SO4需添加氧化剂,选项D错误。
2.C 解析:Cu2S中铜元素、硫元素化合价均升高,发生氧化反应,是还原剂,A错误;反应中只有锰元素得到电子化合价降低,根据得失电子守恒配平:2Mn+Cu2S+8H+2Cu2++S+2Mn2++4H2O,可知2Mn~10e-~S,则反应中每生成1molS,转移电子的物质的量为10mol,B错误;硫的氧化性较弱,和铜单质反应生成Cu2S,C正确;铜元素、硫元素化合价均升高被氧化,得到氧化产物:Cu2+、S,Mn2+为还原产物,D错误。
3.C 解析:据图可知:当n(Cl2)Mmol时Br-与Cl2反应,发生反应的离子方程式为2Br-+Cl2Br2+2Cl-。根据分析知,当n(Cl2)c(Br-),C正确;根据分析可知,通入Cl2的物质的量大于Mmol时,Br-开始被氧化,根据B选项分析可知FeBr2的物质的量为2Mmol,D错误。
4.D 解析:在催化剂的作用下,NH3和NO2发生反应生成氮气和水,反应的化学方程式为8NH3+6NO27N2+12H2O,NH3是还原剂,NO2是氧化剂,N2既是氧化产物又是还原产物,H2O既不是氧化产物也不是还原产物,选项A错误;二氧化氮中氮元素价态降低,根据得失电子守恒可知每生成7molN2需转移6×4mol=24mol电子,选项B错误;未注明44.8LNH3所处状况,无法进行计算,选项C错误;CO具有还原性,NO2具有氧化性,则在一定条件下,CO也可以和NO2发生氧化还原反应,选项D正确。
5.C 解析:Al2O3为两性氧化物,与强酸硫酸反应生成硫酸铝和水,与强碱氢氧化钠反应生成偏铝酸钠和水,根据Cr2O3和Al2O3化学性质类比解答。由分析可知,Cr2O3与稀硫酸反应生成Cr2(SO4)3和水,化学方程式为Cr2O3+3H2SO4Cr2(SO4)3+3H2O,故A正确;根据分析,Cr2O3与NaOH溶液反应生成Na[Cr(OH)4]和水,化学方程式为Cr2O3+3H2O+2OH-2[Cr(OH)4]-,故B正确;由于2Cr+2H+Cr2+H2O,故碱性条件下被H2O2氧化:Cr2O3+3H2O2+4OH-2Cr+5H2O,故C错误;利用铝的还原性和铝转化为氧化铝能放出大量的热,工业上常用铝热法还原Cr2O3制取金属铬,故D正确。
6.A 解析:M中含有+2价铁,且所含电荷数为0,可能是FeO或Fe(OH)2,A不合理;R为0价铁元素,且为单质,则为Fe单质,常温下浓硫酸可以使Fe钝化,B合理;若Q为金属阳离子,化合价为+2价,则为Fe2+,与K3[Fe(CN)6]反应会生成蓝色沉淀,可用K3[Fe(CN)6]溶液检验,C合理;Fe中Fe元素为+6价,据图可知Fe在碱性环境中稳定存在,所以Fe3+与氧化剂在碱性条件下反应可生成Fe,D合理。
7.C 解析:还原焙烧时Fe3O4被C还原生成FeO和二氧化碳,根据得失电子守恒和原子守恒可得反应的化学方程式为2Fe3O4+C6FeO+CO2,A正确;酸浸时反应生成硫酸亚铁盐,硫酸适当过量可以抑制亚铁离子的水解,B正确;H+和HC反应,不能大量共存,C错误;煅烧时Fe(OH)2中铁元素由+2价升高为Fe2O3中的+3价,故每生成1molFe2O3,转移电子的物质的量是2mol,D正确。
8.A 解析:氯酸钾与浓盐酸制备氯气反应中,1mol氯酸钾中Cl元素由+5价降至0价,转移5mol电子,生成0.5molCl2,5molHCl中Cl元素化合价由-1价升高到0价,则生成2.5molCl2为氧化产物,还原产物Cl2的物质的量为0.5mol,二者之比为5∶1,A错误;浓盐酸易挥发,生成的Cl2中伴有挥发出的HCl,利用盛有饱和食盐水的洗气瓶吸收HCl,随着HCl的溶解,NaCl晶体可能析出,洗气瓶中可能出现浑浊现象,B正确;产生标准状况下6.72L(即0.3mol)Cl2,反应中转移0.5mole-,C正确;最后的尾气处理装置,可以利用反应Cl2+2NaOHNaCl+NaClO+H2O吸收多余的氯气,D正确。
9.D 解析:Cu2S晶体和Cu2O晶体都属于离子晶体,S2-的半径比O2-的半径大,故Cu2S晶体的熔点低,A错误;根据得失电子守恒,配平化学方程式为2Cu2S+14HNO32CuSO4+2Cu(NO3)2+5NO↑+5NO2↑+7H2O,由化学方程式可知,消耗0.01molCu2S,产生标准状况下1120mL气体,B错误;由化学方程式计算可得,氧化剂和还原剂的物质的量之比为5∶1,C错误;HNO3得到Cu2S失去的电子转化为NO、NO2,NO、NO2的电子又被O2得到,可以看作Cu2S失去的电子被O2得到,根据得失电子守恒可得关系式Cu2S~2.5O2,所以消耗的氧气的质量为0.1mol×2.5×32g·mol-1=8g,D正确。
10.B 解析:根据氯元素的价态以及物质所属类别可知,a为HCl,b为Cl2,c为HClO,d为NaClO3(或其他氯酸盐),e为ClO2,g为NaCl(或其他氯化物)。工业上通过电解NaCl的水溶液可以得到氯气、氢气和NaOH,A正确;HCl与NaClO3反应的离子方程式为5Cl-+Cl+6H+Cl2↑+3H3O,生成1mol氯气时,转移mol电子,B错误;HClO有强氧化性,具有漂白性,见光易分解为HCl和氧气,C正确;e为ClO2,具有强氧化性,可以消毒杀菌,是一种高效的自来水消毒剂,D正确。
11.C 解析:反应②为Li3N+3H2ONH3↑+3LiOH,属于非氧化还原反应,A错误;转化过程中H始终呈+1价,B错误;假设每一步均完全转化,每生成1molNH3转移了3mol电子,则生成0.75molO2,C正确;氢键不属于化学键,D错误。
12.A 解析:由总反应2FeS2+7O2+2H2O2Fe2++4S+4H+可知,一氧化氮未参加反应,但转化图上参与了反应,说明NO反应前后性质和质量不变,符合催化剂概念,A正确;反应Ⅱ中F由+3价变成+2价,FeS2中硫元素化合价升高,所以反应Ⅱ的氧化剂是F,FeS2被氧化,B错误;由图可知,反应Ⅰ中Fe(NO中铁由+2价变+3价,氧气中氧由0价变成-2价,根据得失为电子守恒,反应的离子方程式为4Fe(NO+O2+4H+4F+4NO+2H2O,Fe(NO是还原剂,C错误;反应Ⅲ的离子方程式为F+NOFe(NO,无元素化合价变化,所以反应Ⅲ是非氧化还原反应,D错误。
13.解析:(1)由图1可知,在pH为1.5时,Cr元素的存在状态为HCr,在反应过程中,Fe2+被氧化为Fe3+,HCr被还原为Cr3+,根据得失电子守恒、电荷守恒以及原子个数守恒可写出反应的离子方程式。(2)由图2可知,在pH>12时,Cr元素主要以Cr(OH形态存在,故导致铬去除率下降的原因是Cr(OH)3转变为Cr(OH。
答案:(1)3Fe2++HCr+7H+3Fe3++Cr3++4H2O
(2)Cr(OH)3+OH-Cr(OH
1.焦亚硫酸钠(Na2S2O5)可用作食品抗氧化剂,下列说法正确的是 ( )
A.Na2S2O5中S元素只有还原性
B.葡萄酒中Na2S2O5残留量可用碘标准液滴定法测量
C.食品抗氧化剂必须是有氧化性的物质
D.由Na2S2O5制Na2SO4需添加还原剂
2.(2022·上海华师大二附中高三模拟)用酸性KMnO4溶液处理Cu2S,发生反应:Mn+Cu2S+H+Cu2++S+Mn2++H2O(未配平),下列说法正确的是 ( )
A.反应中Cu2S既是氧化剂又是还原剂
B.反应中每生成1 mol S,转移电子的物质的量为8 mol
C.可以用单质直接化合的方法制备Cu2S
D.Cu2+、S为还原产物,Mn2+为氧化产物
3.(2022·辽宁一模)向FeBr2溶液中通入Cl2时,随参加反应的Cl2物质的量的变化,溶液中某些离子的浓度变化情况如图所示。下列说法正确的是 ( )
A.当n(Cl2)
C.当n(Cl2)=2M mol时,离子浓度大小关系:c(Cl-)>c(Br-)
D.当通入Cl2的物质的量等于原FeBr2的物质的量时,Br-开始被氧化
4.在催化剂的作用下,NH3和NO2发生反应生成N2和H2O,下列说法正确的是 ( )
A.NO2是氧化剂,H2O是还原产物
B.每生成7 mol N2转移电子数为21 mol
C.在NH3与NO2的反应中,44.8 L NH3最多可以生成1.75 mol N2
D.在一定条件下,CO也可以和NO2发生氧化还原反应
5.(2022·河北保定一模)三氧化二铬(Cr2O3)是一种深绿色的固体,熔点很高,难溶于水,其化学性质类似于Al2O3,水溶液中Cr(Ⅲ)具有还原性。下列关于Cr2O3的说法错误的是 ( )
A.与稀硫酸反应:Cr2O3+3H2SO4Cr2(SO4)3+3H2O
B.与NaOH溶液反应:Cr2O3+3H2O+2OH-2[Cr(OH)4]-
C.碱性条件下被H2O2氧化为Cr(Ⅵ):Cr2O3+3H2O2+2OH-Cr2+
4H2O
D.铝的金属性强于铬,且铬的熔点较高,故可用铝热法还原Cr2O3制取金属铬
6.(2022·广东深圳一模)部分含铁微粒所带的电荷数与其中铁元素化合价的关系如图所示,由该图可预测含铁微粒间相互转化时所需试剂。下列推断不合理的是 ( )
A.M一定为FeO
B.若R为单质,则常温下浓硫酸可使R钝化
C.若Q为金属阳离子,则可用K3[Fe(CN)6]溶液检验
D.Fe3+与氧化剂在碱性条件下反应可生成Fe
7.(2022·如皋期末调研)以氧化铁渣(主要含Fe3O4和Fe2O3)制取氧化铁的流程如图:
已知还原焙烧后氧化铁渣转化为FeO。下列说法不正确的是 ( )
A.还原焙烧时Fe3O4发生反应的化学方程式为2Fe3O4+C6FeO+CO2
B.酸浸时硫酸适当过量可以抑制金属离子的水解
C.滤液中主要存在的离子是N、 H+、 HC、S
D.煅烧时每生成1 mol Fe2O3,转移电子的物质的量是2 mol
8.(2022·河北模拟预测)实验室中可用氯酸钾与浓盐酸制备氯气,发生的反应为KClO3+6HCl(浓)KCl+3Cl2↑+3H2O,下列说法不正确的是 ( )
A.反应中氧化产物和还原产物的物质的量之比为3∶1
B.收集氯气时盛放饱和NaCl溶液的洗气瓶中可能有浑浊现象出现
C.产生标准状况下6.72 L Cl2时,反应中转移0.5 mol e-
D.烧杯中盛放的试剂可以是NaOH溶液,用来吸收多余的氯气
9.(2022·山东模拟预测)向Cu2S中加入足量硝酸,生成等物质的量NO、NO2气体,其反应可表示为Cu2S+HNO3CuSO4+Cu(NO3)2+NO↑+NO2↑+H2O(未配平)。下列说法正确的是( )
A.Cu2S晶体的熔点比Cu2O晶体高
B.消耗0.01 mol Cu2S,产生标准状况下2 240 mL气体产物
C.氧化剂和还原剂的物质的量之比为7∶1
D.0.1 mol Cu2S参与反应,产生的气体与一定量的O2混合后通入水中完全反应生成硝酸,消耗O2的质量为8 g
10.部分含氯物质的分类与相应化合价关系如图所示。下列说法错误的是( )
A.工业上通过电解g的水溶液制备b
B.用a、d制备1 mol b时转移的电子数为5NA
C.c具有漂白性,见光分解
D.e可用于自来水消毒
11.固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图:
下列叙述正确的是 ( )
A.反应①②③均为氧化还原反应
B.转化过程中所涉及的元素均呈现了两种价态
C.假设每一步均完全转化,每生成1 mol NH3,同时生成0.75 mol O2
D.参与反应的物质中含有的化学键有离子键、共价键和氢键
12.在酸性条件下,黄铁矿(FeS2)催化氧化反应的离子方程式为2FeS2+7O2+2H2O2Fe2++4S+4H+。实现该反应的物质间转化如图。下列分析正确的是 ( )
A.在酸性条件下,黄铁矿催化氧化中NO是催化剂
B.反应Ⅱ中Fe3+是氧化剂,FeS2被还原
C.反应Ⅰ的离子方程式为4Fe(NO)2++O2+4H+4Fe3++4NO+2H2O,其中Fe(NO)2+是氧化剂
D.反应Ⅲ的离子方程式为Fe2++NOFe(NO)2+,该反应是氧化还原反应
13.铬是造成水体重度污染的元素之一,水体除铬主要有还原沉淀法、离子交换法、光催化还原法等。
图1 Cr(Ⅵ)在水溶液中的形态分布
图2 Cr(Ⅲ)在水溶液中的形态分布
还原沉淀法:向水体中加入FeSO4、CaSO3等将高毒性 Cr(Ⅵ)还原为低毒性Cr(Ⅲ),再调节pH使Cr(Ⅲ)生成Cr(OH)3沉淀除去。
(1)Cr(Ⅵ)在水溶液中的存在形态分布如图1所示。向pH=1.5的含Cr(Ⅵ)污水中加入FeSO4,发生的主要反应的离子方程式为 。
(2)Cr(Ⅲ)在水溶液中的存在形态分布如图2所示。当pH>12时,铬去除率下降的原因可用离子方程式表示为 。
强化练4 氧化还原反应
1.B 解析:Na2S2O5中S元素的化合价为+4价,属于中间价态,因此Na2S2O5中S元素既有氧化性又有还原性,选项A错误;根据葡萄酒中二氧化硫可以用碘量法进行测量,所以葡萄酒中Na2S2O5残留量可用碘标准液滴定法测量,选项B正确;食品抗氧化剂必须是有还原性的物质,选项C错误;Na2S2O5中S元素化合价为+4价,Na2SO4中S元素化合价为+6价,S元素化合价升高,所以由Na2S2O5制Na2SO4需添加氧化剂,选项D错误。
2.C 解析:Cu2S中铜元素、硫元素化合价均升高,发生氧化反应,是还原剂,A错误;反应中只有锰元素得到电子化合价降低,根据得失电子守恒配平:2Mn+Cu2S+8H+2Cu2++S+2Mn2++4H2O,可知2Mn~10e-~S,则反应中每生成1molS,转移电子的物质的量为10mol,B错误;硫的氧化性较弱,和铜单质反应生成Cu2S,C正确;铜元素、硫元素化合价均升高被氧化,得到氧化产物:Cu2+、S,Mn2+为还原产物,D错误。
3.C 解析:据图可知:当n(Cl2)
4.D 解析:在催化剂的作用下,NH3和NO2发生反应生成氮气和水,反应的化学方程式为8NH3+6NO27N2+12H2O,NH3是还原剂,NO2是氧化剂,N2既是氧化产物又是还原产物,H2O既不是氧化产物也不是还原产物,选项A错误;二氧化氮中氮元素价态降低,根据得失电子守恒可知每生成7molN2需转移6×4mol=24mol电子,选项B错误;未注明44.8LNH3所处状况,无法进行计算,选项C错误;CO具有还原性,NO2具有氧化性,则在一定条件下,CO也可以和NO2发生氧化还原反应,选项D正确。
5.C 解析:Al2O3为两性氧化物,与强酸硫酸反应生成硫酸铝和水,与强碱氢氧化钠反应生成偏铝酸钠和水,根据Cr2O3和Al2O3化学性质类比解答。由分析可知,Cr2O3与稀硫酸反应生成Cr2(SO4)3和水,化学方程式为Cr2O3+3H2SO4Cr2(SO4)3+3H2O,故A正确;根据分析,Cr2O3与NaOH溶液反应生成Na[Cr(OH)4]和水,化学方程式为Cr2O3+3H2O+2OH-2[Cr(OH)4]-,故B正确;由于2Cr+2H+Cr2+H2O,故碱性条件下被H2O2氧化:Cr2O3+3H2O2+4OH-2Cr+5H2O,故C错误;利用铝的还原性和铝转化为氧化铝能放出大量的热,工业上常用铝热法还原Cr2O3制取金属铬,故D正确。
6.A 解析:M中含有+2价铁,且所含电荷数为0,可能是FeO或Fe(OH)2,A不合理;R为0价铁元素,且为单质,则为Fe单质,常温下浓硫酸可以使Fe钝化,B合理;若Q为金属阳离子,化合价为+2价,则为Fe2+,与K3[Fe(CN)6]反应会生成蓝色沉淀,可用K3[Fe(CN)6]溶液检验,C合理;Fe中Fe元素为+6价,据图可知Fe在碱性环境中稳定存在,所以Fe3+与氧化剂在碱性条件下反应可生成Fe,D合理。
7.C 解析:还原焙烧时Fe3O4被C还原生成FeO和二氧化碳,根据得失电子守恒和原子守恒可得反应的化学方程式为2Fe3O4+C6FeO+CO2,A正确;酸浸时反应生成硫酸亚铁盐,硫酸适当过量可以抑制亚铁离子的水解,B正确;H+和HC反应,不能大量共存,C错误;煅烧时Fe(OH)2中铁元素由+2价升高为Fe2O3中的+3价,故每生成1molFe2O3,转移电子的物质的量是2mol,D正确。
8.A 解析:氯酸钾与浓盐酸制备氯气反应中,1mol氯酸钾中Cl元素由+5价降至0价,转移5mol电子,生成0.5molCl2,5molHCl中Cl元素化合价由-1价升高到0价,则生成2.5molCl2为氧化产物,还原产物Cl2的物质的量为0.5mol,二者之比为5∶1,A错误;浓盐酸易挥发,生成的Cl2中伴有挥发出的HCl,利用盛有饱和食盐水的洗气瓶吸收HCl,随着HCl的溶解,NaCl晶体可能析出,洗气瓶中可能出现浑浊现象,B正确;产生标准状况下6.72L(即0.3mol)Cl2,反应中转移0.5mole-,C正确;最后的尾气处理装置,可以利用反应Cl2+2NaOHNaCl+NaClO+H2O吸收多余的氯气,D正确。
9.D 解析:Cu2S晶体和Cu2O晶体都属于离子晶体,S2-的半径比O2-的半径大,故Cu2S晶体的熔点低,A错误;根据得失电子守恒,配平化学方程式为2Cu2S+14HNO32CuSO4+2Cu(NO3)2+5NO↑+5NO2↑+7H2O,由化学方程式可知,消耗0.01molCu2S,产生标准状况下1120mL气体,B错误;由化学方程式计算可得,氧化剂和还原剂的物质的量之比为5∶1,C错误;HNO3得到Cu2S失去的电子转化为NO、NO2,NO、NO2的电子又被O2得到,可以看作Cu2S失去的电子被O2得到,根据得失电子守恒可得关系式Cu2S~2.5O2,所以消耗的氧气的质量为0.1mol×2.5×32g·mol-1=8g,D正确。
10.B 解析:根据氯元素的价态以及物质所属类别可知,a为HCl,b为Cl2,c为HClO,d为NaClO3(或其他氯酸盐),e为ClO2,g为NaCl(或其他氯化物)。工业上通过电解NaCl的水溶液可以得到氯气、氢气和NaOH,A正确;HCl与NaClO3反应的离子方程式为5Cl-+Cl+6H+Cl2↑+3H3O,生成1mol氯气时,转移mol电子,B错误;HClO有强氧化性,具有漂白性,见光易分解为HCl和氧气,C正确;e为ClO2,具有强氧化性,可以消毒杀菌,是一种高效的自来水消毒剂,D正确。
11.C 解析:反应②为Li3N+3H2ONH3↑+3LiOH,属于非氧化还原反应,A错误;转化过程中H始终呈+1价,B错误;假设每一步均完全转化,每生成1molNH3转移了3mol电子,则生成0.75molO2,C正确;氢键不属于化学键,D错误。
12.A 解析:由总反应2FeS2+7O2+2H2O2Fe2++4S+4H+可知,一氧化氮未参加反应,但转化图上参与了反应,说明NO反应前后性质和质量不变,符合催化剂概念,A正确;反应Ⅱ中F由+3价变成+2价,FeS2中硫元素化合价升高,所以反应Ⅱ的氧化剂是F,FeS2被氧化,B错误;由图可知,反应Ⅰ中Fe(NO中铁由+2价变+3价,氧气中氧由0价变成-2价,根据得失为电子守恒,反应的离子方程式为4Fe(NO+O2+4H+4F+4NO+2H2O,Fe(NO是还原剂,C错误;反应Ⅲ的离子方程式为F+NOFe(NO,无元素化合价变化,所以反应Ⅲ是非氧化还原反应,D错误。
13.解析:(1)由图1可知,在pH为1.5时,Cr元素的存在状态为HCr,在反应过程中,Fe2+被氧化为Fe3+,HCr被还原为Cr3+,根据得失电子守恒、电荷守恒以及原子个数守恒可写出反应的离子方程式。(2)由图2可知,在pH>12时,Cr元素主要以Cr(OH形态存在,故导致铬去除率下降的原因是Cr(OH)3转变为Cr(OH。
答案:(1)3Fe2++HCr+7H+3Fe3++Cr3++4H2O
(2)Cr(OH)3+OH-Cr(OH
同课章节目录
