专题1 物质的转化、制备、性质与用途 课件(共89张PPT)江苏省2023高考三轮冲刺练
文档属性
| 名称 | 专题1 物质的转化、制备、性质与用途 课件(共89张PPT)江苏省2023高考三轮冲刺练 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-19 21:04:40 | ||
图片预览









文档简介
(共89张PPT)
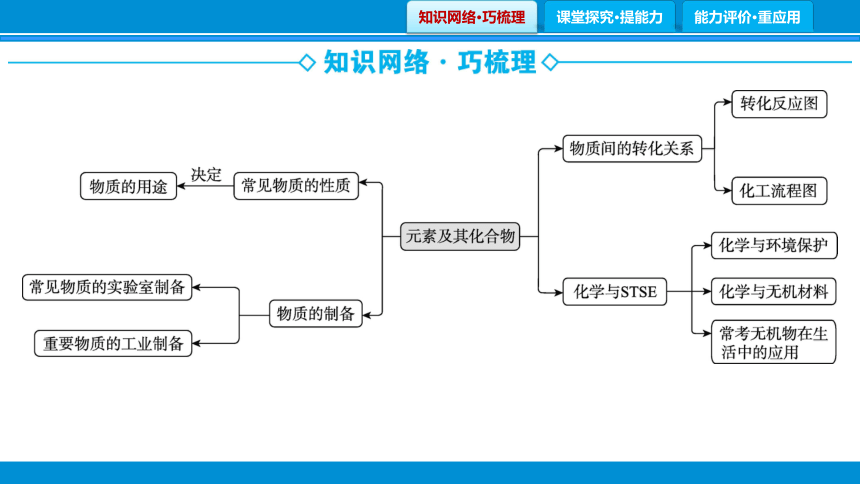
专题1 物质的转化、制备、性质与用途
能力点1 物质间的转化关系
1.(2022·江苏卷)氮及其化合物的转化具有重要应用。下列说法不正确的是( )
A.自然固氮、人工固氮都是将N2转化为NH3
B.侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl
C.工业上通过NH3催化氧化等反应过程生产HNO3
D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
A
解析:自然固氮是将N2转化为含氮化合物,但不一定是转化为NH3,比如雷雨时的自然固氮是将N2转化为NO,A项说法错误;侯氏制碱法以H2O、NH3、CO2、NaCl为原料首先制备NaHCO3和NH4Cl,反应的化学方程式为H2O+NH3+CO2+NaCl══NaHCO3↓+NH4Cl,然后使NaHCO3受热分解转化为Na2CO3,B项说法正确;工业上通过NH3催化氧化等反应生产HNO3,相关的化学反应方程式为4NH3+5O2 4NO+6H2O、2NO+O2
══2NO2、3NO2+H2O══2HNO3+NO、4NO2+O2+2H2O══4HNO3,C项说法正确;氮元素在自然界中既有游离态又有化合态,多种形态的氮及其化合物间的转化形成了自然界的“氮循环”,D项说法正确;故选A。
2.(2021·江苏卷)在指定条件下,下列选项所示物质间的转化能实现的是( )
C
解析:NO不溶于水也不与水反应,A错误;稀HNO3与Cu反应得到硝酸铜、水和NO,得不到NO2,B错误;NO有氧化性,CO有还原性,在高温、催化剂条件下二者可发生氧化还原反应转化为无毒的N2和CO2,C正确;O3有强氧化性,不能将硝酸根离子还原为N2,D错误。
3.(2020·江苏卷)下列选项所示的物质间转化均能实现的是( )
C
解析:石灰水中Ca(OH)2浓度较小,一般用氯气和石灰乳反应制取漂白粉,故A错误;碳酸的酸性弱于盐酸,所以将二氧化碳通入氯化钠溶液中不会生成NaHCO3,故B错误;氧化性:Cl2>Br2>I2,所以氯气可以氧化溴化钠得到溴单质,溴单质可以氧化碘化钠得到碘单质,故C正确;电解氯化镁溶液无法得到镁单质,阳极氯离子放电生成氯气,阴极水电离出的氢离子放电产生氢气,同时产生大量氢氧根,与镁离子产生沉淀,故D错误。
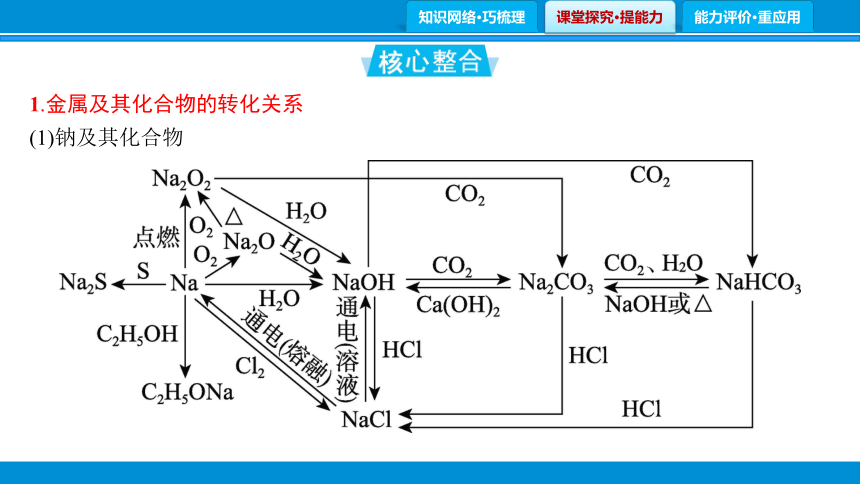
1.金属及其化合物的转化关系
(1)钠及其化合物
写出下列反应的离子方程式。
①Na和H2O的反应: 。
②Na和CH3COOH的反应: 。
③Na2O2和H2O的反应: 。
④NaH和水的反应: 。
⑤向NaOH溶液中通入过量CO2: 。
⑥将Na2CO3溶液与石灰乳混合: 。
⑦向Na2CO3溶液中通入过量CO2: 。
2Na+2H2O══2Na++2OH-+H2↑
2Na+2CH3COOH══2CH3COO-+2Na++H2↑
2Na2O2+2H2O══4Na++4OH-+O2↑
NaH+H2O══Na++OH-+H2↑
⑧将Na2CO3溶液和Ca(HCO3)2溶液混合: 。
⑨将等物质的量浓度的NaHCO3溶液和NaOH溶液等体积混合:
。
⑩将等物质的量浓度的NaHCO3溶液与澄清石灰水等体积混合:
。
将NaHCO3溶液与少量澄清石灰水混合:
。
向饱和Na2CO3溶液中通入过量CO2气体:
。
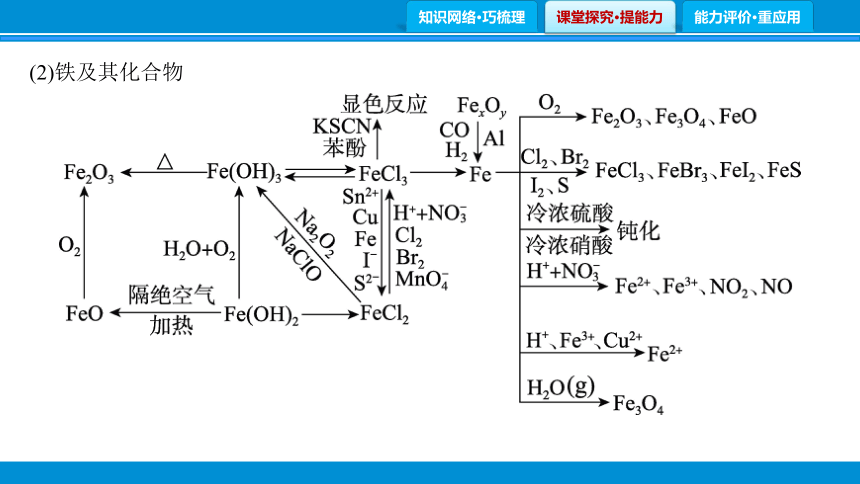
(2)铁及其化合物
写出下列反应的方程式,是离子反应的写离子方程式。
①Fe和过量稀HNO3的反应: 。
②Fe在高温下和水蒸气的反应: 。
③Fe2O3和Al的反应: 。
④Fe2O3和CO的反应: 。
⑤FeCl3溶液和Cu的反应: 。
⑥FeCl3溶液与KSCN溶液的反应: 。
⑦向FeCl2溶液中加入等物质的量的Na2O2:
。
⑧向FeCl2溶液中加入NaClO: 。
⑨Fe(OH)2长时间置于空气中: 。
⑩Fe3O4和HCl的反应: 。
3Fe+4H2O(g) Fe3O4+4H2
Fe2O3+2Al 2Fe+Al2O3
Fe2O3+3CO 2Fe+3CO2
2Fe3++Cu══2Fe2++Cu2+
Fe3++3SCN-══Fe(SCN)3
4Fe2++4Na2O2+6H2O══4Fe(OH)3↓+8Na++O2↑
2Fe2++ClO-+4OH-+H2O══2Fe(OH)3↓+Cl-
4Fe(OH)2+O2+2H2O══4Fe(OH)3
Fe3O4+8H+══2Fe3++Fe2++4H2O
Fe3O4和稀HNO3的反应: 。
FeO和HCl的反应: 。
FeO和稀HNO3的反应: 。
Fe(OH)2和HCl的反应: 。
Fe(OH)2和稀HNO3的反应: 。
Fe(OH)3和HI的反应: 。
FeBr2和少量Cl2的反应: 。
FeBr2和Cl2等物质的量的反应: 。
FeBr2和过量Cl2的反应: 。
FeO+2H+══Fe2++H2O
Fe(OH)2+2H+══Fe2++2H2O
2Fe(OH)3+6H++2I-══2Fe2++I2+6H2O
2Fe2++Cl2══2Fe3++2Cl-
2Fe2++2Br-+2Cl2══2Fe3++Br2+4Cl-
2Fe2++4Br-+3Cl2══2Fe3++2Br2+6Cl-
(3)铝及其化合物
写出下列反应的离子方程式。
①Al和NaOH溶液的反应: 。
②Al(OH)3和NaOH溶液的反应: 。
③Al(OH)3和盐酸的反应: 。
④Al2O3和NaOH溶液的反应: 。
⑤Al2O3和盐酸的反应: 。
⑥NaAlO2和过量盐酸的反应: 。
⑦向NaAlO2溶液中通入过量CO2气体: 。
⑧将NaAlO2溶液与NaHCO3溶液混合: 。
⑨将NaAlO2溶液与AlCl3溶液混合: 。
⑩向AlCl3溶液中加入过量NaOH溶液: 。
向AlCl3溶液中加入过量氨水: 。
将AlCl3溶液与NaHCO3溶液混合: 。
Al(OH)3+3H+══Al3++3H2O
Al2O3+6H+══2Al3++3H2O
2.非金属及其化合物的转化关系
(1)氯及其化合物
写出下列反应的方程式,是离子反应的写离子方程式。
①Cl2和H2O的反应: 。
②Cl2和NaOH溶液的反应: 。
③Cl2和石灰乳的反应: 。
④把Cl2通入到Na2SO3溶液中: 。
⑤将Cl2和SO2混合通入H2O中: 。
⑥将Cl2通入到H2S溶液中: 。
⑦将浓盐酸和MnO2混合加热: 。
⑧电解饱和食盐水: 。
⑨将浓盐酸与漂白液混合: 。
Cl2+H2O H++Cl-+HClO
Cl2+2OH-══Cl-+ClO-+H2O
2Cl2+2Ca(OH)2══2Ca2++2Cl-+2ClO-+2H2O
Cl2+H2S══S↓+2H++2Cl-
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl-+ClO-+2H+══Cl2↑+H2O
⑩将浓盐酸与KClO3溶液混合: 。
向KMnO4固体中滴加浓盐酸: 。
向漂白粉溶液中通入少量CO2气体: 。
向漂白粉溶液中通入少量SO2气体: 。
向漂白粉溶液中通入过量SO2气体:
。
Ca2++2ClO-+CO2+H2O══CaCO3↓+2HClO
Ca2++3ClO-+SO2+H2O══CaSO4↓+Cl-+2HClO
(2)硫及其化合物
写出下列反应的方程式,是离子反应的写离子方程式。
①S和热NaOH溶液的反应: 。
②把H2S气体通入CuSO4溶液中: 。
③FeS和稀H2SO4反应: 。
④FeS和稀HNO3反应: 。
⑤将SO2气体通入到氢硫酸中: 。
⑥把H2S气体通入到FeCl3溶液中: 。
⑦把H2SO4、Na2SO3、Na2S三种溶液混合: 。
⑧把SO2气体通入到酸性KMnO4溶液中: 。
H2S+Cu2+══CuS↓+2H+
FeS+2H+══Fe2++H2S↑
SO2+2H2S══3S↓+2H2O
H2S+2Fe3+══S↓+2Fe2++2H+
⑨Cu和浓硫酸的反应: 。
⑩C和浓硫酸的反应: 。
把浓H2SO4滴到Na2SO3固体上: 。
将少量NaHSO4滴到Ba(OH)2溶液中: 。
将Ba(OH)2溶液滴加到NaHSO4溶液中至溶液呈中性:
。
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
H2SO4(浓)+Na2SO3══Na2SO4+H2O+SO2↑
(3)氮及其化合物
写出下列反应的方程式,是离子反应的写离子方程式。
①N2和H2的反应: 。
②把NH3通入水中: 。
③实验室利用NH4Cl固体、Ca(OH)2固体混合加热制备NH3:
。
④NH4HCO3溶液与少量NaOH溶液的反应: 。
⑤NH4HCO3溶液与少量Ba(OH)2溶液的反应:
。
⑥Mg3N2与H2O的反应: 。
⑦Cu和稀HNO3的反应: 。
⑧Cu和浓HNO3的反应: 。
N2+3H2 2NH3
2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2
Mg3N2+6H2O══3Mg(OH)2↓+2NH3↑
⑨Fe和少量稀HNO3的反应: 。
⑩Fe和过量稀HNO3的反应: 。
C和浓HNO3的反应: 。
S和浓HNO3的反应: 。
(4)碳、硅及其化合物
写出下列反应的方程式,是离子反应的写离子方程式。
①Si和NaOH溶液的反应: 。
②SiO2和NaOH溶液的反应: 。
③SiO2和C的反应: 。
④向Na2SiO3溶液中通入过量CO2气体: 。
⑤Si和氢氟酸的反应: 。
⑥Mg在CO2中燃烧: 。
⑦向苯酚钠溶液中通入少量CO2气体: 。
⑧向澄清石灰水中通入少量CO2气体: 。
SiO2+2C Si+2CO↑
Si+4HF══SiF4↑+2H2↑
2Mg+CO2 2MgO+C
Ca2++2OH-+CO2══CaCO3↓+H2O
⑨向澄清石灰水中通入过量CO2气体: 。
⑩除去CO2中的CO: 。
Na2CO3和SiO2的反应: 。
CaO和MgCl2溶液的反应: 。
CO+CuO CO2+Cu
Na2CO3+SiO2 Na2SiO3+CO2↑
CaO+Mg2++H2O══Mg(OH)2↓+Ca2+
1.(2022·江苏调研)As2O3俗称砒霜,是一种两性氧化物,可用于治疗癌症。As2O5是一种酸性氧化物。水体中含有一定浓度的H3AsO3和H3AsO4时会破坏水质,需要通过一定的方法除去。下列转化在指定条件下能够实现的是( )
C
解析:As2O3是一种两性氧化物,和盐酸反应生成AsCl3而不是生成酸,A错误;As2O5是最高价砷元素的氧化物,次氯酸钠具有氧化性,二者不能发生氧化还原反应,B错误;H3AsO4为三元酸,可以和过量的氢氧化钠反应生成正盐Na3AsO4,C正确;As2O5是一种酸性氧化物,可以和水反应生成H3AsO4,D错误。
2.(2022·南通基地大联考)在指定条件下,下列含氯物质的转化不能实现的是( )
A
解析:盐酸的酸性强于碳酸,往氯化钠溶液中通入过量二氧化碳不会生成碳酸氢钠,选项A符合题目要求;浓盐酸与二氧化锰共热生成氯化锰、氯气和水,转化可以完成,选项B不符合题目要求;在氯化氢氛围中加热氯化镁晶体,可得到无水氯化镁,转化可以完成,选项C不符合题目要求;次氯酸受热分解生成HCl和氧气,转化可以完成,选项D不符合题目要求。
3.在指定条件下,下列铁及其化合物之间的转化能实现的是( )
A
解析:铁单质与水蒸气在高温下反应生成四氧化三铁,A正确;铁单质与盐酸反应生成氯化亚铁而不是生成氯化铁,B错误;氢氧化亚铁与足量稀硝酸反应生成硝酸铁,而不是生成硝酸亚铁,C错误;二氧化硫与水反应生成亚硫酸而不是生成硫酸,D错误。
能力点2 常见物质的实验室制法与化工生产
1.(2022·江苏卷)实验室制取少量SO2水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是( )
A.用装置甲制取SO2气体
B.用装置乙制取SO2水溶液
C.用装置丙吸收尾气中的SO2
D.用干燥pH试纸检验SO2水溶液的酸性
C
解析:60%硫酸和NaHSO3(s)可发生反应:H2SO4+2NaHSO3══Na2SO4+2SO2↑+2H2O,因此用装置甲可以制取SO2气体,A项不符合题目要求;气体通入液体时“长进短出”,用装置乙可以制取SO2水溶液,B项不符合题目要求;SO2在饱和NaHSO3溶液中溶解度很小,因此用装置丙不能吸收尾气中的SO2,C项符合题目要求;SO2水溶液显酸性,可用干燥的pH试纸检验其酸性,D项不符合题目要求;答案选C。
2.(2021·江苏卷)下列由废铜屑制取CuSO4·5H2O的实验原理与装置不能达到实验目的的是( )
A.用装置甲除去废铜屑表面的油污
B.用装置乙在加热的条件下溶解废铜屑
C.用装置丙过滤得到CuSO4溶液
D.用装置丁蒸干溶液获得CuSO4·5H2O
D
解析:碳酸钠溶液显碱性,在加热的条件下可以除去铜屑表面的油污,A项不符合题目要求;在酸性条件下,铜与双氧水发生氧化还原反应生成硫酸铜,B项不符合题目要求;装置丙为过滤装置,过滤可以除去难溶性杂质,得到硫酸铜溶液,C项不符合题目要求;用装置丁蒸干溶液得到的是CuSO4,而不是CuSO4·5H2O,D项符合题目要求。
3.(2020·江苏卷)实验室以CaCO3为原料,制备CO2并获得CaCl2·6H2O晶体。下列图示装置和原理不能达到实验目的的是( )
D
解析:碳酸钙盛放在锥形瓶中,盐酸盛放在分液漏斗中,打开分液漏斗活塞,盐酸与碳酸钙反应生成氯化钙、二氧化碳和水,故A项不符合题目要求;二氧化碳密度比空气大,可以用向上排空气法收集二氧化碳气体,故B项不符合题目要求;加入的盐酸与碳酸钙反应后,部分碳酸钙未反应完,碳酸钙是难溶物,因此可以用过滤的方法分离,故C项不符合题目要求;CaCl2·6H2O易失去结晶水,因此不能通过加热蒸发得到,可冷却氯化钙的热饱和溶液析出六水氯化钙结晶水合物,故D项符合题目要求。
4.(2021·河北卷)BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
下列说法错误的是( )
A.酸浸工序中分次加入稀HNO3可降低反应剧烈程度
B.转化工序中加入稀HCl可抑制生成BiONO3
C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度
D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成
D
核心知识1 常见物质的制备知识网络
核心知识2 常见物质的实验室制法
核心知识3 重要的工业生产
1.(2022·南通基地大联考)以菱镁矿(主要成分是MgCO3,含少量FeCO3)为原料制取高纯氧化镁需要经历酸浸、调pH、过滤、灼烧等操作。下列实验装置和原理能达到实验目的的是( )
A.用装置甲配制稀H2SO4
B.用装置乙测定溶液的pH
C.用装置丙过滤悬浊液
D.用装置丁灼烧Mg(OH)2固体
C
解析:容量瓶属于玻璃精量器,不能在容量瓶中直接稀释浓硫酸,选项A错误;测定溶液的pH时不能将pH试纸直接放进溶液中,应用玻璃棒蘸取溶液点在试纸上,再与标准比色卡对比读数,选项B错误;用装置丙过滤悬浊液,装置及操作均正确,选项C正确;灼烧固体时应选用坩埚,用试管加热固体物质时试管口应该向下倾斜,选项D错误。
2.(2022·江苏常州期末检测)铁元素的常见价态有+2、+3价,实验室可用赤血盐(K3[Fe(CN)6])溶液检验Fe2+,黄血盐(K4[Fe(CN)6])溶液检验Fe3+。Fe2O3是重要的化工原料,Au/Fe2O3可用作反应CO(g)+H2O(g)══CO2(g)+H2(g)的催化剂。硫铁矿烧渣中含有大量Fe2O3,工业上常用于制取绿矾(FeSO4·7H2O)。由硫铁矿烧渣(主要含Fe2O3、Al2O3、SiO2)制取绿矾的流程如图:
下列有关说法不正确的是( )
A.“酸溶”时先将烧渣粉碎并不断搅拌,
可提高铁元素的浸出率
B.“反应”时发生的主要反应为
2Fe3++Fe══3Fe2+
C.“检验”时可用K4[Fe(CN)6]溶液检验上一步“反应”是否进行完全
D.将第二次“过滤”所得滤液加热,经蒸发结晶可以制得绿矾
D
解析:由题给流程可知,硫铁矿烧渣加入稀硫酸酸溶时,氧化铁、氧化铝溶于稀硫酸得到可溶性硫酸盐,二氧化硅不与稀硫酸反应,过滤得到含有二氧化硅的滤渣和含有可溶性硫酸盐的滤液;向滤液中加入适量铁粉,将铁离子完全转化为亚铁离子,取溶液少许加入K4[Fe(CN)6]溶液检验溶液中不存在铁离子后,加入氢氧化钠溶液调节溶液pH,将铝离子完全转化为氢氧化铝沉淀,过滤得到氢氧化铝滤渣和硫酸亚铁溶液;硫酸亚铁溶液经蒸发浓缩、冷却结晶等步骤制得绿矾。酸溶时先将烧渣粉碎并不断搅拌,可增大反应物的接触面积,使反应物充分反应,从而提高铁元素的浸出率,A项说法正确;由分析可知,反应步骤发生的反应为溶液中铁离子与铁反应生成亚铁离子,反应的离子方程式为2Fe3++Fe══3Fe2+,B项说法正确;由分析可知,检验“反应”步骤中铁离子是否完全反应,可以加入K4[Fe(CN)6]溶液检验,C项说法正确;由分析可知,将第二次过滤所得滤液硫酸亚铁溶液经蒸发浓缩、冷却结晶等步骤制得绿矾,D项说法错误。
能力点3 常见物质的性质与用途
1.(2022·江苏卷)我国古代就掌握了青铜(铜-锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料,下列物质性质与用途具有对应关系的是( )
A.石墨能导电,可用作润滑剂
B.单晶硅熔点高,可用作半导体材料
C.青铜比纯铜熔点低、硬度大,古代用青铜铸剑
D.含铅化合物颜色丰富,可用作电极材料
C
解析:石墨是层状结构,层与层之间易滑动,质软,可用作润滑剂,故A错误;单晶硅可用作半导体材料与熔点高无关,故B错误;青铜是铜合金,比纯铜熔点低、硬度大,易于锻造,古代用青铜铸剑,C正确;含铅化合物可在正极得到电子发生还原反应,所以可用作电极材料,与含铅化合物颜色丰富无关,故D错误;故选C。
2.(2021·江苏卷)下列有关物质的性质与用途不具有对应关系的是( )
A.铁粉能与O2反应,可用作食品保存的吸氧剂
B.纳米Fe3O4能与酸反应,可用作铁磁性材料
C.FeCl3具有氧化性,可用于腐蚀印刷电路板上的Cu
D.聚合硫酸铁能水解并形成胶体,可用于净水
B
解析:因为铁粉能与O2反应,所以可用作食品保存的吸氧剂,A项不符合题目要求;纳米Fe3O4具有磁性,可用作铁磁性材料,B项符合题目要求;FeCl3与Cu反应生成FeCl2和CuCl2,主要利用其氧化性,C项不符合题目要求;聚合硫酸铁能水解并形成胶体,胶体具有吸附性,可用于净水,D项不符合题目要求。
3.(2020·江苏卷)下列有关物质的性质与用途具有对应关系的是( )
A.铝的金属活泼性强,可用于制作铝金属制品
B.氧化铝熔点高,可用作电解冶炼铝的原料
C.氢氧化铝受热分解,可用于中和过多的胃酸
D.明矾溶于水并水解形成胶体,可用于净水
D
解析:铝在空气中可以与氧气反应生成致密的氧化铝薄膜,致密氧化铝薄膜包裹在铝表面阻止铝进一步反应,铝具有延展性,故铝可用于制作铝金属制品,A项不符合题目要求;氧化铝为离子化合物,可用作电解冶炼铝的原料,B项不符合题目要求;氢氧化铝为两性氢氧化物,可以用于中和过多的胃酸,C项不符合题目要求;明矾溶于水后电离出的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体能吸附水中的悬浮物,可用于净水,D项符合题目要求。
核心知识1 常见物质的性质
反应物 条件或试剂 主要产物或现象
Na+O2 常温 Na2O(白色)
加热或点燃 Na2O2(淡黄色)
Fe(或Al)+H2SO4(浓) 常温 钝化(无明显现象)
Fe(或Al)+HNO3(浓) 常温 钝化(无明显现象)
Fe+HNO3(稀) HNO3过量 Fe(NO3)3
Fe+HNO3(稀) 铁过量 Fe(NO3)2
Fe+HCl(稀) HCl过量或不足 均生成FeCl2
Fe+H2SO4(稀) H2SO4过量或不足 均生成FeSO4
Cu+HNO3(浓) 浓硝酸 有红棕色气体(NO2)生成
反应物 条件或试剂 主要产物或现象
Cu+HNO3(稀) 稀硝酸 有无色气体(NO)生成,在瓶口变为红棕色(NO2)
Cu+H2SO4(浓) 常温 不反应
Cu+H2SO4(浓) 加热 有无色刺激性气味的气体(SO2)生成
MnO2+HCl(浓) 加热 有黄绿色气体(Cl2)生成
MnO2+HCl(稀) 加热 不反应
SO2与氨水 氨水过量(少量) (NH4)2SO3 (NH4HSO3)
SO2与NaOH SO2少量(过量) Na2SO3(NaHSO3)
AlCl3与氨水 氨水过量(少量) 均生成Al(OH)3
FeCl3与沸水 煮沸 有红褐色Fe(OH)3胶体生成
FeCl3与氨水(或NaOH) 有Fe(OH)3沉淀生成
KAl(SO4)2·12H2O溶于水 有Al(OH)3胶体生成
KAl(SO4)2·12H2O与氨水 有Al(OH)3沉淀生成
核心知识2 常见物质的俗名
胆矾、蓝矾:CuSO4·5H2O;
钡餐、重晶石:BaSO4;
烧碱、火碱、苛性钠:NaOH ;
芒硝:Na2SO4·10H2O;
熟石灰、消石灰:Ca(OH)2;
熟石膏:2CaSO4·H2O;
铜绿、孔雀石:Cu2(OH)2CO3;
明矾:KAl(SO4)2·12H2O;
水玻璃、泡花碱:Na2SiO3溶液;
铁红:Fe2O3;
碱石灰:CaO与NaOH的混合物。
1.(2022·江苏新高考基地大联考)下列有关物质的性质与用途具有对应关系的是( )
A.MgO难溶于水,可用作耐火材料
B.ClO2具有氧化性,可用于自来水的杀菌消毒
C.浓H2SO4具有脱水性,可用于干燥气体
D.NaHCO3受热易分解,可用于制抗酸药物
B
解析:MgO是离子化合物,熔点较高,因此可用作耐火材料,用作耐火材料与其难溶于水的性质无关,A项不符合题目要求;ClO2具有氧化性,能够使水中的细菌、病毒的蛋白质分子结构发生改变而失去其生理活性,因此可用于自来水的杀菌消毒,B项符合题目要求;由于浓H2SO4具有吸水性,故可用于干燥气体,C项不符合题目要求;NaHCO3能够与胃酸(盐酸)发生反应,从而降低胃酸的浓度,故可用作抗酸药物,这与其受热易分解的性质无关,D项不符合题目要求。
2.(2022·苏州相城陆慕中学模拟)氮、磷、砷元素广泛应用于生产、生活中。下列氮及其化合物的性质与用途的对应关系不正确的是( )
A.氯化铵溶液显酸性,可用作除锈剂
B.氨气易液化,可用作制冷剂
C.氮气的化学性质不活泼,食品袋中充氮气来防氧化
D.常温下,浓硝酸不跟铁发生化学反应,可以用铁制容器装浓硝酸
D
解析:氯化铵是强酸弱碱盐,在溶液中水解使溶液呈酸性,水解生成的氢离子能与铁锈的主要成分氧化铁反应达到除锈的目的,所以氯化铵溶液常用作除锈剂,故A项不符合题目要求;氨气易液化,液氨汽化时会吸收大量的热,降低周围环境的温度达到制冷的作用,所以液氨可用作制冷剂,故B项不符合题目要求;氮气的化学性质不活泼,性质稳定,可做保护气,所以食品袋中充氮气可以形成无氧环境,防止食品被氧化,故C项不符合题目要求;浓硝酸具有强氧化性,常温下能使铁钝化,阻碍反应的继续进行,所以可以用铁制容器装浓硝酸,故D项符合题目要求。
能力点4 化学与STSE
1.(2022·江苏卷)我国为人类科技发展作出巨大贡献。下列成果研究的物质属于蛋白质的是( )
A.陶瓷烧制 B.黑火药
C.造纸术 D.合成结晶牛胰岛素
D
解析:陶瓷的主要成分是硅酸盐,陶瓷烧制研究的物质是硅的化合物,A项不符合题目要求;黑火药研究的物质是硫、碳和硝酸钾,B项不符合题目要求;造纸术研究的物质是纤维素,C项不符合题目要求;结晶牛胰岛素的成分是蛋白质,故合成结晶牛胰岛素研究的物质是蛋白质,D项符合题目要求;答案选D。
2.(2020·江苏卷)打赢蓝天保卫战,提高空气质量。下列物质不属于空气污染物的是
( )
A.PM2.5 B.O2
C.SO2 D.NO
B
解析:PM2.5是指环境空气中空气动力学当量直径小于等于2.5微米的颗粒物,PM2.5粒径小,面积大,活性强,易附带有毒、有害物质,且在大气中的停留时间长、输送距离远,因而对人体健康和大气环境质量的影响大,其在空气中含量浓度越高,就代表空气污染越严重,PM2.5属于空气污染物,A项不符合题目要求;O2是空气的主要成分之一,是人类维持生命不可缺少的物质,不属于空气污染物,B项符合题目要求;SO2引起的典型环境问题是形成硫酸型酸雨,SO2属于空气污染物,C项不符合题目要求;NO引起的典型环境问题有:硝酸型酸雨、光化学烟雾、破坏臭氧层等,NO属于空气污染物,D项不符合题目要求。
核心知识1 化学与环境保护
1.绿色化学:核心是利用化学原理从源头上减少和消除化工生产对环境的污染;原则是原子利用率为100%。
污染名称 主要污染物及形成原理
酸雨 指pH小于5.6的雨雾或其他形式的大气降水。SO2、NOx是形成酸雨的主要原因:SO2+H2O══H2SO3,2H2SO3+O2══2H2SO4(或2SO2+O2 2SO3, SO3+H2O══H2SO4);2NO+O2══2NO2,3NO2+H2O══2HNO3+NO
臭氧空洞 冰箱中使用的制冷剂氟利昂(氟氯代烷)、汽车尾气中的NOx等与臭氧发生作用,导致臭氧层的损耗
水体污染 化肥、农药的过度使用,工业“三废”和生活污水的随意排放,导致水体中富含大量含N、P等元素的营养物质,造成水体富营养化;水体富营养化可导致“水华”或“赤潮”
温室效应 化石燃料的大量使用,大气中CO2、CH4等气体的大量增加,使地球气温上升
白色污染 各种塑料垃圾对环境造成的污染,它们很难降解,会破坏土壤结构
2.环境污染
核心知识2 化学与无机材料
材料 举例 说明
金属材料 铝合金、不锈钢、青铜、黄铜 铝合金具有强度高、密度小、耐腐蚀等优点;利用电化学原理保护金属要使被保护的金属作原电池的正极或电解池的阴极
无机非金 属材料 水泥、玻璃、陶瓷、光导纤维、新型陶瓷材料 传统硅酸盐材料有水泥、玻璃和陶瓷
核心知识3 常考无机物在生活中的应用
物质性质 生活中的应用
生石灰、无水氯化钙能与水反应 可用作食品干燥剂
P2O5能与水反应 可用作干燥剂(不可用作食品干燥剂)
硅胶能吸收水分 可用作袋装食品干燥剂
ClO2具有较强的氧化性 用于自来水的杀菌消毒
次氯酸(盐)具有强氧化性 可作杀菌消毒剂,还可作漂白剂
碘酸钾在常温下稳定 食盐中的加碘物质
水玻璃(Na2SiO3的水溶液)不燃不爆 可用作防火材料
硅酸钠的水溶液是一种无机黏合剂 盛放碱性溶液的试剂瓶不能用玻璃塞
锂质量轻、比能量大 可用作电池负极材料
Al具有良好的延展性和抗腐蚀性 常用铝箔包装物品
常温下铝、铁遇浓硫酸、浓硝酸钝化 铝或铁制容器可盛装或运输浓硫酸、浓硝酸
物质性质 生活中的应用
铝有还原性,与氧化铁反应放出大量的热 可用于焊接铁轨
MgO、Al2O3熔点高 作耐高温材料
明矾溶液中Al3+水解生成氢氧化铝胶体,具有吸附性 明矾作净水剂(混凝剂)
小苏打和硫酸铝反应生成二氧化碳 可以用于泡沫灭火器
明矾溶液显酸性 中国古代利用明矾溶液清除铜镜表面的铜锈
Al(OH)3有弱碱性 可用于中和胃酸
镁铝合金质量轻、强度大 可用作高铁车厢材料
K2FeO4是强氧化剂,还原产物Fe3+水解生成氢氧化铁胶体 K2FeO4作新型净水剂
CuSO4使蛋白质变性 误服CuSO4溶液,喝蛋清或豆浆解毒
BaSO4不溶于水,不与胃酸反应 医疗上进行胃部造影前,BaSO4做患者服用的
“钡餐”
1.(2022·江苏南通如东期末学情检测)2020年11月,中国“奋斗者”号载人潜水器在马里亚纳海沟深度10 909 m处成功坐底,并进行了一系列的深海探测科考活动。下列说法不正确的是( )
A.“奋斗者”号使用的深海水下超高压光纤微缆属于新型有机高分子材料
B.“奋斗者”号使用的锂离子电池工作时Li+向正极移动
C.未来对海底“可燃冰”(主要成分为甲烷)的开采将有助于缓解能源危机
D.制造潜水器载人球舱的钛合金比纯金属钛具有更高的强度
A
解析:超高压光纤微缆的主要成分是二氧化硅,属于新型无机非金属材料,A项说法错误;原电池中,阳离子向正极移动,因此锂离子电池工作时 Li+向正极移动,B项说法正确;“可燃冰”作为一种天然气水合物,属于新能源,未来对海底“可燃冰”的开采将有助于缓解能源危机,C项说法正确;合金的硬度比纯金属的大,钛合金属于合金材料,比纯金属钛具有更高的强度,D项说法正确。
2.(2022·江苏如皋期末检测)《新修本草》中描述“青矾”为“本来绿色,新出窟未见风者,正如琉璃……烧之赤色……”。青矾加热时的反应为2(FeSO4·7H2O) Fe2O3+SO2↑+H2SO4+13H2O。下列说法正确的是( )
A.产物中含有3种非金属氧化物
B.所得赤色物质为FeSO4
C.反应为分解反应
D.铁元素发生还原反应
C
解析:由反应方程式可知,产物中含有SO2和H2O两种非金属氧化物,A项错误;FeSO4·7H2O为绿色固体而不是赤色,所得赤色物质应该为Fe2O3,B项错误;由反应方程式可知,一种物质生成四种物质,该反应为分解反应,C项正确;由反应方程式可知,反应中铁元素的化合价由+2价升高到+3价,失去电子,发生氧化反应,D项错误。
1.(2022·江苏南京、盐城二模)2021年12月9日,我国宇航员在中国空间站直播了泡腾片水球实验。泡腾片中含有柠檬酸(结构如图所示)和碳酸钠等,溶于水产生气泡。下列说法不正确的是( )
A.柠檬酸属于有机物
B.碳酸钠溶液呈碱性
C.产生的气体为CO2
D.碳酸钠与柠檬酸发生了氧化还原反应
D
解析:根据柠檬酸的结构简式可知,柠檬酸含有C、H、O元素,属于有机物,A项说法正确;碳酸钠属于强碱弱酸盐,其水溶液显碱性,B项说法正确;柠檬酸分子中含有羧基,酸性比碳酸酸性强,与碳酸钠反应生成CO2,C项说法正确;该反应中各元素的化合价没有变化,属于非氧化还原反应,其原理是用酸性强的酸制取酸性弱的酸,D项说法错误。
2.(2022·江苏泰州高三期末考试)在指定条件下,下列选项所示的物质间转化能实现的是
( )
B
解析:钠和氧气在常温下反应生成氧化钠,不能生成过氧化钠,故物质间的转化不能实现,A项错误;氮气和氧气在放电条件下反应生成一氧化氮,一氧化氮与氧气、水反应生成硝酸,即物质间的转化能实现,B项正确;硫在氧气中燃烧只能生成二氧化硫,不能生成三氧化硫,即物质间的转化不能实现,C项错误;铁在高温下与水蒸气反应生成四氧化三铁和氢气,不能生成氧化铁,即物质间的转化不能实现,D项错误。
3.(2021·广东卷)部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.a可与e反应生成b
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
C
解析:题图中所示含不同化合价的铁元素的物质:a为Fe,b为FeCl2、FeSO4、Fe(NO3)2等Fe(Ⅱ)的盐类物质,c为Fe(OH)2,e为FeCl3、Fe2(SO4)3、Fe(NO3)3等Fe(Ⅲ)的盐类物质,d为Fe(OH)3。Fe与Fe(Ⅲ)的盐类物质可发生反应生成Fe(Ⅱ)的盐类物质,如Fe+2FeCl3══3FeCl2,故A不符合题意;Fe(Ⅱ)为铁元素的中间价态,既有还原性也有氧化性,因此既可被氧化,也可被还原,故B不符合题意;Fe(Ⅲ)的盐类物质与浓碱液反应生成Fe(OH)3沉淀,制备Fe(OH)3胶体操作为:向沸水中滴加饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,故C符合题意;b→c→d→e→b转化能够实现,
4.(2022·湖南卷)化学促进了科技进步和社会发展。下列叙述中没有涉及化学变化的是
( )
A.《神农本草经》中记载的“石胆能化铁为铜”
B.利用“侯氏联合制碱法”制备纯碱
C.科学家成功将CO2转化为淀粉或葡萄糖
D.北京冬奥会场馆使用CO2跨临界直冷制冰
D
解析:“石胆能化铁为铜”指的是铁可以与硫酸铜发生置换反应生成铜,发生了化学变化,A不符合题意;工业上利用“侯氏联合制碱法”制备纯碱,二氧化碳、氨气、氯化钠和水发生反应生成的碳酸氢钠晶体经加热分解生成碳酸钠(即纯碱),发生了化学变化,B不符合题意;CO2转化为淀粉或葡萄糖,有新物质生成,发生了化学变化,C不符合题意;使用CO2跨临界直冷制冰,将水直接转化为冰,没有新物质生成,只发生了物理变化,没有涉及化学变化,D符合题意;综上所述,本题选D。
5.(2022·盐城模拟)一种工业制备无水氯化镁的工艺流程如图:
下列说法错误的是( )
A.物质X常选用生石灰
B.工业上常用电解熔融MgCl2的方法制备金属镁
C.“氯化”过程中发生的反应为MgO+C+Cl2 MgCl2+CO
D.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水MgCl2
D
解析:物质X的作用是使Mg2+转化为Mg(OH)2,工业上常采用CaO,发生的反应为CaO+H2O══Ca(OH)2,Ca(OH)2+Mg2+══Mg(OH)2+Ca2+,A项说法正确;Mg是较活泼的金属,工业上常用电解熔融MgCl2的方法制备金属镁,B项说法正确;由题图可知,“氯化”过程反应物为MgO、Cl2、C,生成物之一为MgCl2,C在高温下能将二氧化碳还原为CO,则“气体”为CO,反应方程式为MgO+C+Cl2 MgCl2+CO,C项说法正确;“煅烧”后得到MgO,MgO和盐酸反应得到MgCl2溶液,由于MgCl2在溶液中水解为氢氧化镁和HCl,将所得溶液加热蒸发,HCl会逸出,MgCl2水解平衡正向移动,不能得到无水MgCl2,D项说法错误。
专题1 物质的转化、制备、性质与用途
能力点1 物质间的转化关系
1.(2022·江苏卷)氮及其化合物的转化具有重要应用。下列说法不正确的是( )
A.自然固氮、人工固氮都是将N2转化为NH3
B.侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl
C.工业上通过NH3催化氧化等反应过程生产HNO3
D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
A
解析:自然固氮是将N2转化为含氮化合物,但不一定是转化为NH3,比如雷雨时的自然固氮是将N2转化为NO,A项说法错误;侯氏制碱法以H2O、NH3、CO2、NaCl为原料首先制备NaHCO3和NH4Cl,反应的化学方程式为H2O+NH3+CO2+NaCl══NaHCO3↓+NH4Cl,然后使NaHCO3受热分解转化为Na2CO3,B项说法正确;工业上通过NH3催化氧化等反应生产HNO3,相关的化学反应方程式为4NH3+5O2 4NO+6H2O、2NO+O2
══2NO2、3NO2+H2O══2HNO3+NO、4NO2+O2+2H2O══4HNO3,C项说法正确;氮元素在自然界中既有游离态又有化合态,多种形态的氮及其化合物间的转化形成了自然界的“氮循环”,D项说法正确;故选A。
2.(2021·江苏卷)在指定条件下,下列选项所示物质间的转化能实现的是( )
C
解析:NO不溶于水也不与水反应,A错误;稀HNO3与Cu反应得到硝酸铜、水和NO,得不到NO2,B错误;NO有氧化性,CO有还原性,在高温、催化剂条件下二者可发生氧化还原反应转化为无毒的N2和CO2,C正确;O3有强氧化性,不能将硝酸根离子还原为N2,D错误。
3.(2020·江苏卷)下列选项所示的物质间转化均能实现的是( )
C
解析:石灰水中Ca(OH)2浓度较小,一般用氯气和石灰乳反应制取漂白粉,故A错误;碳酸的酸性弱于盐酸,所以将二氧化碳通入氯化钠溶液中不会生成NaHCO3,故B错误;氧化性:Cl2>Br2>I2,所以氯气可以氧化溴化钠得到溴单质,溴单质可以氧化碘化钠得到碘单质,故C正确;电解氯化镁溶液无法得到镁单质,阳极氯离子放电生成氯气,阴极水电离出的氢离子放电产生氢气,同时产生大量氢氧根,与镁离子产生沉淀,故D错误。
1.金属及其化合物的转化关系
(1)钠及其化合物
写出下列反应的离子方程式。
①Na和H2O的反应: 。
②Na和CH3COOH的反应: 。
③Na2O2和H2O的反应: 。
④NaH和水的反应: 。
⑤向NaOH溶液中通入过量CO2: 。
⑥将Na2CO3溶液与石灰乳混合: 。
⑦向Na2CO3溶液中通入过量CO2: 。
2Na+2H2O══2Na++2OH-+H2↑
2Na+2CH3COOH══2CH3COO-+2Na++H2↑
2Na2O2+2H2O══4Na++4OH-+O2↑
NaH+H2O══Na++OH-+H2↑
⑧将Na2CO3溶液和Ca(HCO3)2溶液混合: 。
⑨将等物质的量浓度的NaHCO3溶液和NaOH溶液等体积混合:
。
⑩将等物质的量浓度的NaHCO3溶液与澄清石灰水等体积混合:
。
将NaHCO3溶液与少量澄清石灰水混合:
。
向饱和Na2CO3溶液中通入过量CO2气体:
。
(2)铁及其化合物
写出下列反应的方程式,是离子反应的写离子方程式。
①Fe和过量稀HNO3的反应: 。
②Fe在高温下和水蒸气的反应: 。
③Fe2O3和Al的反应: 。
④Fe2O3和CO的反应: 。
⑤FeCl3溶液和Cu的反应: 。
⑥FeCl3溶液与KSCN溶液的反应: 。
⑦向FeCl2溶液中加入等物质的量的Na2O2:
。
⑧向FeCl2溶液中加入NaClO: 。
⑨Fe(OH)2长时间置于空气中: 。
⑩Fe3O4和HCl的反应: 。
3Fe+4H2O(g) Fe3O4+4H2
Fe2O3+2Al 2Fe+Al2O3
Fe2O3+3CO 2Fe+3CO2
2Fe3++Cu══2Fe2++Cu2+
Fe3++3SCN-══Fe(SCN)3
4Fe2++4Na2O2+6H2O══4Fe(OH)3↓+8Na++O2↑
2Fe2++ClO-+4OH-+H2O══2Fe(OH)3↓+Cl-
4Fe(OH)2+O2+2H2O══4Fe(OH)3
Fe3O4+8H+══2Fe3++Fe2++4H2O
Fe3O4和稀HNO3的反应: 。
FeO和HCl的反应: 。
FeO和稀HNO3的反应: 。
Fe(OH)2和HCl的反应: 。
Fe(OH)2和稀HNO3的反应: 。
Fe(OH)3和HI的反应: 。
FeBr2和少量Cl2的反应: 。
FeBr2和Cl2等物质的量的反应: 。
FeBr2和过量Cl2的反应: 。
FeO+2H+══Fe2++H2O
Fe(OH)2+2H+══Fe2++2H2O
2Fe(OH)3+6H++2I-══2Fe2++I2+6H2O
2Fe2++Cl2══2Fe3++2Cl-
2Fe2++2Br-+2Cl2══2Fe3++Br2+4Cl-
2Fe2++4Br-+3Cl2══2Fe3++2Br2+6Cl-
(3)铝及其化合物
写出下列反应的离子方程式。
①Al和NaOH溶液的反应: 。
②Al(OH)3和NaOH溶液的反应: 。
③Al(OH)3和盐酸的反应: 。
④Al2O3和NaOH溶液的反应: 。
⑤Al2O3和盐酸的反应: 。
⑥NaAlO2和过量盐酸的反应: 。
⑦向NaAlO2溶液中通入过量CO2气体: 。
⑧将NaAlO2溶液与NaHCO3溶液混合: 。
⑨将NaAlO2溶液与AlCl3溶液混合: 。
⑩向AlCl3溶液中加入过量NaOH溶液: 。
向AlCl3溶液中加入过量氨水: 。
将AlCl3溶液与NaHCO3溶液混合: 。
Al(OH)3+3H+══Al3++3H2O
Al2O3+6H+══2Al3++3H2O
2.非金属及其化合物的转化关系
(1)氯及其化合物
写出下列反应的方程式,是离子反应的写离子方程式。
①Cl2和H2O的反应: 。
②Cl2和NaOH溶液的反应: 。
③Cl2和石灰乳的反应: 。
④把Cl2通入到Na2SO3溶液中: 。
⑤将Cl2和SO2混合通入H2O中: 。
⑥将Cl2通入到H2S溶液中: 。
⑦将浓盐酸和MnO2混合加热: 。
⑧电解饱和食盐水: 。
⑨将浓盐酸与漂白液混合: 。
Cl2+H2O H++Cl-+HClO
Cl2+2OH-══Cl-+ClO-+H2O
2Cl2+2Ca(OH)2══2Ca2++2Cl-+2ClO-+2H2O
Cl2+H2S══S↓+2H++2Cl-
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl-+ClO-+2H+══Cl2↑+H2O
⑩将浓盐酸与KClO3溶液混合: 。
向KMnO4固体中滴加浓盐酸: 。
向漂白粉溶液中通入少量CO2气体: 。
向漂白粉溶液中通入少量SO2气体: 。
向漂白粉溶液中通入过量SO2气体:
。
Ca2++2ClO-+CO2+H2O══CaCO3↓+2HClO
Ca2++3ClO-+SO2+H2O══CaSO4↓+Cl-+2HClO
(2)硫及其化合物
写出下列反应的方程式,是离子反应的写离子方程式。
①S和热NaOH溶液的反应: 。
②把H2S气体通入CuSO4溶液中: 。
③FeS和稀H2SO4反应: 。
④FeS和稀HNO3反应: 。
⑤将SO2气体通入到氢硫酸中: 。
⑥把H2S气体通入到FeCl3溶液中: 。
⑦把H2SO4、Na2SO3、Na2S三种溶液混合: 。
⑧把SO2气体通入到酸性KMnO4溶液中: 。
H2S+Cu2+══CuS↓+2H+
FeS+2H+══Fe2++H2S↑
SO2+2H2S══3S↓+2H2O
H2S+2Fe3+══S↓+2Fe2++2H+
⑨Cu和浓硫酸的反应: 。
⑩C和浓硫酸的反应: 。
把浓H2SO4滴到Na2SO3固体上: 。
将少量NaHSO4滴到Ba(OH)2溶液中: 。
将Ba(OH)2溶液滴加到NaHSO4溶液中至溶液呈中性:
。
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
H2SO4(浓)+Na2SO3══Na2SO4+H2O+SO2↑
(3)氮及其化合物
写出下列反应的方程式,是离子反应的写离子方程式。
①N2和H2的反应: 。
②把NH3通入水中: 。
③实验室利用NH4Cl固体、Ca(OH)2固体混合加热制备NH3:
。
④NH4HCO3溶液与少量NaOH溶液的反应: 。
⑤NH4HCO3溶液与少量Ba(OH)2溶液的反应:
。
⑥Mg3N2与H2O的反应: 。
⑦Cu和稀HNO3的反应: 。
⑧Cu和浓HNO3的反应: 。
N2+3H2 2NH3
2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2
Mg3N2+6H2O══3Mg(OH)2↓+2NH3↑
⑨Fe和少量稀HNO3的反应: 。
⑩Fe和过量稀HNO3的反应: 。
C和浓HNO3的反应: 。
S和浓HNO3的反应: 。
(4)碳、硅及其化合物
写出下列反应的方程式,是离子反应的写离子方程式。
①Si和NaOH溶液的反应: 。
②SiO2和NaOH溶液的反应: 。
③SiO2和C的反应: 。
④向Na2SiO3溶液中通入过量CO2气体: 。
⑤Si和氢氟酸的反应: 。
⑥Mg在CO2中燃烧: 。
⑦向苯酚钠溶液中通入少量CO2气体: 。
⑧向澄清石灰水中通入少量CO2气体: 。
SiO2+2C Si+2CO↑
Si+4HF══SiF4↑+2H2↑
2Mg+CO2 2MgO+C
Ca2++2OH-+CO2══CaCO3↓+H2O
⑨向澄清石灰水中通入过量CO2气体: 。
⑩除去CO2中的CO: 。
Na2CO3和SiO2的反应: 。
CaO和MgCl2溶液的反应: 。
CO+CuO CO2+Cu
Na2CO3+SiO2 Na2SiO3+CO2↑
CaO+Mg2++H2O══Mg(OH)2↓+Ca2+
1.(2022·江苏调研)As2O3俗称砒霜,是一种两性氧化物,可用于治疗癌症。As2O5是一种酸性氧化物。水体中含有一定浓度的H3AsO3和H3AsO4时会破坏水质,需要通过一定的方法除去。下列转化在指定条件下能够实现的是( )
C
解析:As2O3是一种两性氧化物,和盐酸反应生成AsCl3而不是生成酸,A错误;As2O5是最高价砷元素的氧化物,次氯酸钠具有氧化性,二者不能发生氧化还原反应,B错误;H3AsO4为三元酸,可以和过量的氢氧化钠反应生成正盐Na3AsO4,C正确;As2O5是一种酸性氧化物,可以和水反应生成H3AsO4,D错误。
2.(2022·南通基地大联考)在指定条件下,下列含氯物质的转化不能实现的是( )
A
解析:盐酸的酸性强于碳酸,往氯化钠溶液中通入过量二氧化碳不会生成碳酸氢钠,选项A符合题目要求;浓盐酸与二氧化锰共热生成氯化锰、氯气和水,转化可以完成,选项B不符合题目要求;在氯化氢氛围中加热氯化镁晶体,可得到无水氯化镁,转化可以完成,选项C不符合题目要求;次氯酸受热分解生成HCl和氧气,转化可以完成,选项D不符合题目要求。
3.在指定条件下,下列铁及其化合物之间的转化能实现的是( )
A
解析:铁单质与水蒸气在高温下反应生成四氧化三铁,A正确;铁单质与盐酸反应生成氯化亚铁而不是生成氯化铁,B错误;氢氧化亚铁与足量稀硝酸反应生成硝酸铁,而不是生成硝酸亚铁,C错误;二氧化硫与水反应生成亚硫酸而不是生成硫酸,D错误。
能力点2 常见物质的实验室制法与化工生产
1.(2022·江苏卷)实验室制取少量SO2水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是( )
A.用装置甲制取SO2气体
B.用装置乙制取SO2水溶液
C.用装置丙吸收尾气中的SO2
D.用干燥pH试纸检验SO2水溶液的酸性
C
解析:60%硫酸和NaHSO3(s)可发生反应:H2SO4+2NaHSO3══Na2SO4+2SO2↑+2H2O,因此用装置甲可以制取SO2气体,A项不符合题目要求;气体通入液体时“长进短出”,用装置乙可以制取SO2水溶液,B项不符合题目要求;SO2在饱和NaHSO3溶液中溶解度很小,因此用装置丙不能吸收尾气中的SO2,C项符合题目要求;SO2水溶液显酸性,可用干燥的pH试纸检验其酸性,D项不符合题目要求;答案选C。
2.(2021·江苏卷)下列由废铜屑制取CuSO4·5H2O的实验原理与装置不能达到实验目的的是( )
A.用装置甲除去废铜屑表面的油污
B.用装置乙在加热的条件下溶解废铜屑
C.用装置丙过滤得到CuSO4溶液
D.用装置丁蒸干溶液获得CuSO4·5H2O
D
解析:碳酸钠溶液显碱性,在加热的条件下可以除去铜屑表面的油污,A项不符合题目要求;在酸性条件下,铜与双氧水发生氧化还原反应生成硫酸铜,B项不符合题目要求;装置丙为过滤装置,过滤可以除去难溶性杂质,得到硫酸铜溶液,C项不符合题目要求;用装置丁蒸干溶液得到的是CuSO4,而不是CuSO4·5H2O,D项符合题目要求。
3.(2020·江苏卷)实验室以CaCO3为原料,制备CO2并获得CaCl2·6H2O晶体。下列图示装置和原理不能达到实验目的的是( )
D
解析:碳酸钙盛放在锥形瓶中,盐酸盛放在分液漏斗中,打开分液漏斗活塞,盐酸与碳酸钙反应生成氯化钙、二氧化碳和水,故A项不符合题目要求;二氧化碳密度比空气大,可以用向上排空气法收集二氧化碳气体,故B项不符合题目要求;加入的盐酸与碳酸钙反应后,部分碳酸钙未反应完,碳酸钙是难溶物,因此可以用过滤的方法分离,故C项不符合题目要求;CaCl2·6H2O易失去结晶水,因此不能通过加热蒸发得到,可冷却氯化钙的热饱和溶液析出六水氯化钙结晶水合物,故D项符合题目要求。
4.(2021·河北卷)BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
下列说法错误的是( )
A.酸浸工序中分次加入稀HNO3可降低反应剧烈程度
B.转化工序中加入稀HCl可抑制生成BiONO3
C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度
D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成
D
核心知识1 常见物质的制备知识网络
核心知识2 常见物质的实验室制法
核心知识3 重要的工业生产
1.(2022·南通基地大联考)以菱镁矿(主要成分是MgCO3,含少量FeCO3)为原料制取高纯氧化镁需要经历酸浸、调pH、过滤、灼烧等操作。下列实验装置和原理能达到实验目的的是( )
A.用装置甲配制稀H2SO4
B.用装置乙测定溶液的pH
C.用装置丙过滤悬浊液
D.用装置丁灼烧Mg(OH)2固体
C
解析:容量瓶属于玻璃精量器,不能在容量瓶中直接稀释浓硫酸,选项A错误;测定溶液的pH时不能将pH试纸直接放进溶液中,应用玻璃棒蘸取溶液点在试纸上,再与标准比色卡对比读数,选项B错误;用装置丙过滤悬浊液,装置及操作均正确,选项C正确;灼烧固体时应选用坩埚,用试管加热固体物质时试管口应该向下倾斜,选项D错误。
2.(2022·江苏常州期末检测)铁元素的常见价态有+2、+3价,实验室可用赤血盐(K3[Fe(CN)6])溶液检验Fe2+,黄血盐(K4[Fe(CN)6])溶液检验Fe3+。Fe2O3是重要的化工原料,Au/Fe2O3可用作反应CO(g)+H2O(g)══CO2(g)+H2(g)的催化剂。硫铁矿烧渣中含有大量Fe2O3,工业上常用于制取绿矾(FeSO4·7H2O)。由硫铁矿烧渣(主要含Fe2O3、Al2O3、SiO2)制取绿矾的流程如图:
下列有关说法不正确的是( )
A.“酸溶”时先将烧渣粉碎并不断搅拌,
可提高铁元素的浸出率
B.“反应”时发生的主要反应为
2Fe3++Fe══3Fe2+
C.“检验”时可用K4[Fe(CN)6]溶液检验上一步“反应”是否进行完全
D.将第二次“过滤”所得滤液加热,经蒸发结晶可以制得绿矾
D
解析:由题给流程可知,硫铁矿烧渣加入稀硫酸酸溶时,氧化铁、氧化铝溶于稀硫酸得到可溶性硫酸盐,二氧化硅不与稀硫酸反应,过滤得到含有二氧化硅的滤渣和含有可溶性硫酸盐的滤液;向滤液中加入适量铁粉,将铁离子完全转化为亚铁离子,取溶液少许加入K4[Fe(CN)6]溶液检验溶液中不存在铁离子后,加入氢氧化钠溶液调节溶液pH,将铝离子完全转化为氢氧化铝沉淀,过滤得到氢氧化铝滤渣和硫酸亚铁溶液;硫酸亚铁溶液经蒸发浓缩、冷却结晶等步骤制得绿矾。酸溶时先将烧渣粉碎并不断搅拌,可增大反应物的接触面积,使反应物充分反应,从而提高铁元素的浸出率,A项说法正确;由分析可知,反应步骤发生的反应为溶液中铁离子与铁反应生成亚铁离子,反应的离子方程式为2Fe3++Fe══3Fe2+,B项说法正确;由分析可知,检验“反应”步骤中铁离子是否完全反应,可以加入K4[Fe(CN)6]溶液检验,C项说法正确;由分析可知,将第二次过滤所得滤液硫酸亚铁溶液经蒸发浓缩、冷却结晶等步骤制得绿矾,D项说法错误。
能力点3 常见物质的性质与用途
1.(2022·江苏卷)我国古代就掌握了青铜(铜-锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料,下列物质性质与用途具有对应关系的是( )
A.石墨能导电,可用作润滑剂
B.单晶硅熔点高,可用作半导体材料
C.青铜比纯铜熔点低、硬度大,古代用青铜铸剑
D.含铅化合物颜色丰富,可用作电极材料
C
解析:石墨是层状结构,层与层之间易滑动,质软,可用作润滑剂,故A错误;单晶硅可用作半导体材料与熔点高无关,故B错误;青铜是铜合金,比纯铜熔点低、硬度大,易于锻造,古代用青铜铸剑,C正确;含铅化合物可在正极得到电子发生还原反应,所以可用作电极材料,与含铅化合物颜色丰富无关,故D错误;故选C。
2.(2021·江苏卷)下列有关物质的性质与用途不具有对应关系的是( )
A.铁粉能与O2反应,可用作食品保存的吸氧剂
B.纳米Fe3O4能与酸反应,可用作铁磁性材料
C.FeCl3具有氧化性,可用于腐蚀印刷电路板上的Cu
D.聚合硫酸铁能水解并形成胶体,可用于净水
B
解析:因为铁粉能与O2反应,所以可用作食品保存的吸氧剂,A项不符合题目要求;纳米Fe3O4具有磁性,可用作铁磁性材料,B项符合题目要求;FeCl3与Cu反应生成FeCl2和CuCl2,主要利用其氧化性,C项不符合题目要求;聚合硫酸铁能水解并形成胶体,胶体具有吸附性,可用于净水,D项不符合题目要求。
3.(2020·江苏卷)下列有关物质的性质与用途具有对应关系的是( )
A.铝的金属活泼性强,可用于制作铝金属制品
B.氧化铝熔点高,可用作电解冶炼铝的原料
C.氢氧化铝受热分解,可用于中和过多的胃酸
D.明矾溶于水并水解形成胶体,可用于净水
D
解析:铝在空气中可以与氧气反应生成致密的氧化铝薄膜,致密氧化铝薄膜包裹在铝表面阻止铝进一步反应,铝具有延展性,故铝可用于制作铝金属制品,A项不符合题目要求;氧化铝为离子化合物,可用作电解冶炼铝的原料,B项不符合题目要求;氢氧化铝为两性氢氧化物,可以用于中和过多的胃酸,C项不符合题目要求;明矾溶于水后电离出的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体能吸附水中的悬浮物,可用于净水,D项符合题目要求。
核心知识1 常见物质的性质
反应物 条件或试剂 主要产物或现象
Na+O2 常温 Na2O(白色)
加热或点燃 Na2O2(淡黄色)
Fe(或Al)+H2SO4(浓) 常温 钝化(无明显现象)
Fe(或Al)+HNO3(浓) 常温 钝化(无明显现象)
Fe+HNO3(稀) HNO3过量 Fe(NO3)3
Fe+HNO3(稀) 铁过量 Fe(NO3)2
Fe+HCl(稀) HCl过量或不足 均生成FeCl2
Fe+H2SO4(稀) H2SO4过量或不足 均生成FeSO4
Cu+HNO3(浓) 浓硝酸 有红棕色气体(NO2)生成
反应物 条件或试剂 主要产物或现象
Cu+HNO3(稀) 稀硝酸 有无色气体(NO)生成,在瓶口变为红棕色(NO2)
Cu+H2SO4(浓) 常温 不反应
Cu+H2SO4(浓) 加热 有无色刺激性气味的气体(SO2)生成
MnO2+HCl(浓) 加热 有黄绿色气体(Cl2)生成
MnO2+HCl(稀) 加热 不反应
SO2与氨水 氨水过量(少量) (NH4)2SO3 (NH4HSO3)
SO2与NaOH SO2少量(过量) Na2SO3(NaHSO3)
AlCl3与氨水 氨水过量(少量) 均生成Al(OH)3
FeCl3与沸水 煮沸 有红褐色Fe(OH)3胶体生成
FeCl3与氨水(或NaOH) 有Fe(OH)3沉淀生成
KAl(SO4)2·12H2O溶于水 有Al(OH)3胶体生成
KAl(SO4)2·12H2O与氨水 有Al(OH)3沉淀生成
核心知识2 常见物质的俗名
胆矾、蓝矾:CuSO4·5H2O;
钡餐、重晶石:BaSO4;
烧碱、火碱、苛性钠:NaOH ;
芒硝:Na2SO4·10H2O;
熟石灰、消石灰:Ca(OH)2;
熟石膏:2CaSO4·H2O;
铜绿、孔雀石:Cu2(OH)2CO3;
明矾:KAl(SO4)2·12H2O;
水玻璃、泡花碱:Na2SiO3溶液;
铁红:Fe2O3;
碱石灰:CaO与NaOH的混合物。
1.(2022·江苏新高考基地大联考)下列有关物质的性质与用途具有对应关系的是( )
A.MgO难溶于水,可用作耐火材料
B.ClO2具有氧化性,可用于自来水的杀菌消毒
C.浓H2SO4具有脱水性,可用于干燥气体
D.NaHCO3受热易分解,可用于制抗酸药物
B
解析:MgO是离子化合物,熔点较高,因此可用作耐火材料,用作耐火材料与其难溶于水的性质无关,A项不符合题目要求;ClO2具有氧化性,能够使水中的细菌、病毒的蛋白质分子结构发生改变而失去其生理活性,因此可用于自来水的杀菌消毒,B项符合题目要求;由于浓H2SO4具有吸水性,故可用于干燥气体,C项不符合题目要求;NaHCO3能够与胃酸(盐酸)发生反应,从而降低胃酸的浓度,故可用作抗酸药物,这与其受热易分解的性质无关,D项不符合题目要求。
2.(2022·苏州相城陆慕中学模拟)氮、磷、砷元素广泛应用于生产、生活中。下列氮及其化合物的性质与用途的对应关系不正确的是( )
A.氯化铵溶液显酸性,可用作除锈剂
B.氨气易液化,可用作制冷剂
C.氮气的化学性质不活泼,食品袋中充氮气来防氧化
D.常温下,浓硝酸不跟铁发生化学反应,可以用铁制容器装浓硝酸
D
解析:氯化铵是强酸弱碱盐,在溶液中水解使溶液呈酸性,水解生成的氢离子能与铁锈的主要成分氧化铁反应达到除锈的目的,所以氯化铵溶液常用作除锈剂,故A项不符合题目要求;氨气易液化,液氨汽化时会吸收大量的热,降低周围环境的温度达到制冷的作用,所以液氨可用作制冷剂,故B项不符合题目要求;氮气的化学性质不活泼,性质稳定,可做保护气,所以食品袋中充氮气可以形成无氧环境,防止食品被氧化,故C项不符合题目要求;浓硝酸具有强氧化性,常温下能使铁钝化,阻碍反应的继续进行,所以可以用铁制容器装浓硝酸,故D项符合题目要求。
能力点4 化学与STSE
1.(2022·江苏卷)我国为人类科技发展作出巨大贡献。下列成果研究的物质属于蛋白质的是( )
A.陶瓷烧制 B.黑火药
C.造纸术 D.合成结晶牛胰岛素
D
解析:陶瓷的主要成分是硅酸盐,陶瓷烧制研究的物质是硅的化合物,A项不符合题目要求;黑火药研究的物质是硫、碳和硝酸钾,B项不符合题目要求;造纸术研究的物质是纤维素,C项不符合题目要求;结晶牛胰岛素的成分是蛋白质,故合成结晶牛胰岛素研究的物质是蛋白质,D项符合题目要求;答案选D。
2.(2020·江苏卷)打赢蓝天保卫战,提高空气质量。下列物质不属于空气污染物的是
( )
A.PM2.5 B.O2
C.SO2 D.NO
B
解析:PM2.5是指环境空气中空气动力学当量直径小于等于2.5微米的颗粒物,PM2.5粒径小,面积大,活性强,易附带有毒、有害物质,且在大气中的停留时间长、输送距离远,因而对人体健康和大气环境质量的影响大,其在空气中含量浓度越高,就代表空气污染越严重,PM2.5属于空气污染物,A项不符合题目要求;O2是空气的主要成分之一,是人类维持生命不可缺少的物质,不属于空气污染物,B项符合题目要求;SO2引起的典型环境问题是形成硫酸型酸雨,SO2属于空气污染物,C项不符合题目要求;NO引起的典型环境问题有:硝酸型酸雨、光化学烟雾、破坏臭氧层等,NO属于空气污染物,D项不符合题目要求。
核心知识1 化学与环境保护
1.绿色化学:核心是利用化学原理从源头上减少和消除化工生产对环境的污染;原则是原子利用率为100%。
污染名称 主要污染物及形成原理
酸雨 指pH小于5.6的雨雾或其他形式的大气降水。SO2、NOx是形成酸雨的主要原因:SO2+H2O══H2SO3,2H2SO3+O2══2H2SO4(或2SO2+O2 2SO3, SO3+H2O══H2SO4);2NO+O2══2NO2,3NO2+H2O══2HNO3+NO
臭氧空洞 冰箱中使用的制冷剂氟利昂(氟氯代烷)、汽车尾气中的NOx等与臭氧发生作用,导致臭氧层的损耗
水体污染 化肥、农药的过度使用,工业“三废”和生活污水的随意排放,导致水体中富含大量含N、P等元素的营养物质,造成水体富营养化;水体富营养化可导致“水华”或“赤潮”
温室效应 化石燃料的大量使用,大气中CO2、CH4等气体的大量增加,使地球气温上升
白色污染 各种塑料垃圾对环境造成的污染,它们很难降解,会破坏土壤结构
2.环境污染
核心知识2 化学与无机材料
材料 举例 说明
金属材料 铝合金、不锈钢、青铜、黄铜 铝合金具有强度高、密度小、耐腐蚀等优点;利用电化学原理保护金属要使被保护的金属作原电池的正极或电解池的阴极
无机非金 属材料 水泥、玻璃、陶瓷、光导纤维、新型陶瓷材料 传统硅酸盐材料有水泥、玻璃和陶瓷
核心知识3 常考无机物在生活中的应用
物质性质 生活中的应用
生石灰、无水氯化钙能与水反应 可用作食品干燥剂
P2O5能与水反应 可用作干燥剂(不可用作食品干燥剂)
硅胶能吸收水分 可用作袋装食品干燥剂
ClO2具有较强的氧化性 用于自来水的杀菌消毒
次氯酸(盐)具有强氧化性 可作杀菌消毒剂,还可作漂白剂
碘酸钾在常温下稳定 食盐中的加碘物质
水玻璃(Na2SiO3的水溶液)不燃不爆 可用作防火材料
硅酸钠的水溶液是一种无机黏合剂 盛放碱性溶液的试剂瓶不能用玻璃塞
锂质量轻、比能量大 可用作电池负极材料
Al具有良好的延展性和抗腐蚀性 常用铝箔包装物品
常温下铝、铁遇浓硫酸、浓硝酸钝化 铝或铁制容器可盛装或运输浓硫酸、浓硝酸
物质性质 生活中的应用
铝有还原性,与氧化铁反应放出大量的热 可用于焊接铁轨
MgO、Al2O3熔点高 作耐高温材料
明矾溶液中Al3+水解生成氢氧化铝胶体,具有吸附性 明矾作净水剂(混凝剂)
小苏打和硫酸铝反应生成二氧化碳 可以用于泡沫灭火器
明矾溶液显酸性 中国古代利用明矾溶液清除铜镜表面的铜锈
Al(OH)3有弱碱性 可用于中和胃酸
镁铝合金质量轻、强度大 可用作高铁车厢材料
K2FeO4是强氧化剂,还原产物Fe3+水解生成氢氧化铁胶体 K2FeO4作新型净水剂
CuSO4使蛋白质变性 误服CuSO4溶液,喝蛋清或豆浆解毒
BaSO4不溶于水,不与胃酸反应 医疗上进行胃部造影前,BaSO4做患者服用的
“钡餐”
1.(2022·江苏南通如东期末学情检测)2020年11月,中国“奋斗者”号载人潜水器在马里亚纳海沟深度10 909 m处成功坐底,并进行了一系列的深海探测科考活动。下列说法不正确的是( )
A.“奋斗者”号使用的深海水下超高压光纤微缆属于新型有机高分子材料
B.“奋斗者”号使用的锂离子电池工作时Li+向正极移动
C.未来对海底“可燃冰”(主要成分为甲烷)的开采将有助于缓解能源危机
D.制造潜水器载人球舱的钛合金比纯金属钛具有更高的强度
A
解析:超高压光纤微缆的主要成分是二氧化硅,属于新型无机非金属材料,A项说法错误;原电池中,阳离子向正极移动,因此锂离子电池工作时 Li+向正极移动,B项说法正确;“可燃冰”作为一种天然气水合物,属于新能源,未来对海底“可燃冰”的开采将有助于缓解能源危机,C项说法正确;合金的硬度比纯金属的大,钛合金属于合金材料,比纯金属钛具有更高的强度,D项说法正确。
2.(2022·江苏如皋期末检测)《新修本草》中描述“青矾”为“本来绿色,新出窟未见风者,正如琉璃……烧之赤色……”。青矾加热时的反应为2(FeSO4·7H2O) Fe2O3+SO2↑+H2SO4+13H2O。下列说法正确的是( )
A.产物中含有3种非金属氧化物
B.所得赤色物质为FeSO4
C.反应为分解反应
D.铁元素发生还原反应
C
解析:由反应方程式可知,产物中含有SO2和H2O两种非金属氧化物,A项错误;FeSO4·7H2O为绿色固体而不是赤色,所得赤色物质应该为Fe2O3,B项错误;由反应方程式可知,一种物质生成四种物质,该反应为分解反应,C项正确;由反应方程式可知,反应中铁元素的化合价由+2价升高到+3价,失去电子,发生氧化反应,D项错误。
1.(2022·江苏南京、盐城二模)2021年12月9日,我国宇航员在中国空间站直播了泡腾片水球实验。泡腾片中含有柠檬酸(结构如图所示)和碳酸钠等,溶于水产生气泡。下列说法不正确的是( )
A.柠檬酸属于有机物
B.碳酸钠溶液呈碱性
C.产生的气体为CO2
D.碳酸钠与柠檬酸发生了氧化还原反应
D
解析:根据柠檬酸的结构简式可知,柠檬酸含有C、H、O元素,属于有机物,A项说法正确;碳酸钠属于强碱弱酸盐,其水溶液显碱性,B项说法正确;柠檬酸分子中含有羧基,酸性比碳酸酸性强,与碳酸钠反应生成CO2,C项说法正确;该反应中各元素的化合价没有变化,属于非氧化还原反应,其原理是用酸性强的酸制取酸性弱的酸,D项说法错误。
2.(2022·江苏泰州高三期末考试)在指定条件下,下列选项所示的物质间转化能实现的是
( )
B
解析:钠和氧气在常温下反应生成氧化钠,不能生成过氧化钠,故物质间的转化不能实现,A项错误;氮气和氧气在放电条件下反应生成一氧化氮,一氧化氮与氧气、水反应生成硝酸,即物质间的转化能实现,B项正确;硫在氧气中燃烧只能生成二氧化硫,不能生成三氧化硫,即物质间的转化不能实现,C项错误;铁在高温下与水蒸气反应生成四氧化三铁和氢气,不能生成氧化铁,即物质间的转化不能实现,D项错误。
3.(2021·广东卷)部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.a可与e反应生成b
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
C
解析:题图中所示含不同化合价的铁元素的物质:a为Fe,b为FeCl2、FeSO4、Fe(NO3)2等Fe(Ⅱ)的盐类物质,c为Fe(OH)2,e为FeCl3、Fe2(SO4)3、Fe(NO3)3等Fe(Ⅲ)的盐类物质,d为Fe(OH)3。Fe与Fe(Ⅲ)的盐类物质可发生反应生成Fe(Ⅱ)的盐类物质,如Fe+2FeCl3══3FeCl2,故A不符合题意;Fe(Ⅱ)为铁元素的中间价态,既有还原性也有氧化性,因此既可被氧化,也可被还原,故B不符合题意;Fe(Ⅲ)的盐类物质与浓碱液反应生成Fe(OH)3沉淀,制备Fe(OH)3胶体操作为:向沸水中滴加饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,故C符合题意;b→c→d→e→b转化能够实现,
4.(2022·湖南卷)化学促进了科技进步和社会发展。下列叙述中没有涉及化学变化的是
( )
A.《神农本草经》中记载的“石胆能化铁为铜”
B.利用“侯氏联合制碱法”制备纯碱
C.科学家成功将CO2转化为淀粉或葡萄糖
D.北京冬奥会场馆使用CO2跨临界直冷制冰
D
解析:“石胆能化铁为铜”指的是铁可以与硫酸铜发生置换反应生成铜,发生了化学变化,A不符合题意;工业上利用“侯氏联合制碱法”制备纯碱,二氧化碳、氨气、氯化钠和水发生反应生成的碳酸氢钠晶体经加热分解生成碳酸钠(即纯碱),发生了化学变化,B不符合题意;CO2转化为淀粉或葡萄糖,有新物质生成,发生了化学变化,C不符合题意;使用CO2跨临界直冷制冰,将水直接转化为冰,没有新物质生成,只发生了物理变化,没有涉及化学变化,D符合题意;综上所述,本题选D。
5.(2022·盐城模拟)一种工业制备无水氯化镁的工艺流程如图:
下列说法错误的是( )
A.物质X常选用生石灰
B.工业上常用电解熔融MgCl2的方法制备金属镁
C.“氯化”过程中发生的反应为MgO+C+Cl2 MgCl2+CO
D.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水MgCl2
D
解析:物质X的作用是使Mg2+转化为Mg(OH)2,工业上常采用CaO,发生的反应为CaO+H2O══Ca(OH)2,Ca(OH)2+Mg2+══Mg(OH)2+Ca2+,A项说法正确;Mg是较活泼的金属,工业上常用电解熔融MgCl2的方法制备金属镁,B项说法正确;由题图可知,“氯化”过程反应物为MgO、Cl2、C,生成物之一为MgCl2,C在高温下能将二氧化碳还原为CO,则“气体”为CO,反应方程式为MgO+C+Cl2 MgCl2+CO,C项说法正确;“煅烧”后得到MgO,MgO和盐酸反应得到MgCl2溶液,由于MgCl2在溶液中水解为氢氧化镁和HCl,将所得溶液加热蒸发,HCl会逸出,MgCl2水解平衡正向移动,不能得到无水MgCl2,D项说法错误。
同课章节目录
