题型4 有机合成与推断 课件(共110张PPT)江苏省2023高考三轮冲刺练
文档属性
| 名称 | 题型4 有机合成与推断 课件(共110张PPT)江苏省2023高考三轮冲刺练 |

|
|
| 格式 | pptx | ||
| 文件大小 | 20.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-19 00:00:00 | ||
图片预览









文档简介
(共110张PPT)
题型4 有机合成与推断
1.(2022·江苏卷)精细化学品Z是X与HBr反应的主产物,X→Z的反应机理如下:
下列说法不正确的是( )
D
2.(2022·江苏卷)化合物G可用于药用多肽的结构修饰,其人工合成路线如下:
(1)A分子中碳原子的杂化轨道类型为 。
(2)B→C的反应类型为 。
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
。
①分子中含有4种不同化学环境的氢原子;②碱性条件水解,酸化后得2种产物,其中一种含苯环且有2种含氧官能团,2种产物均能被银氨溶液氧化。
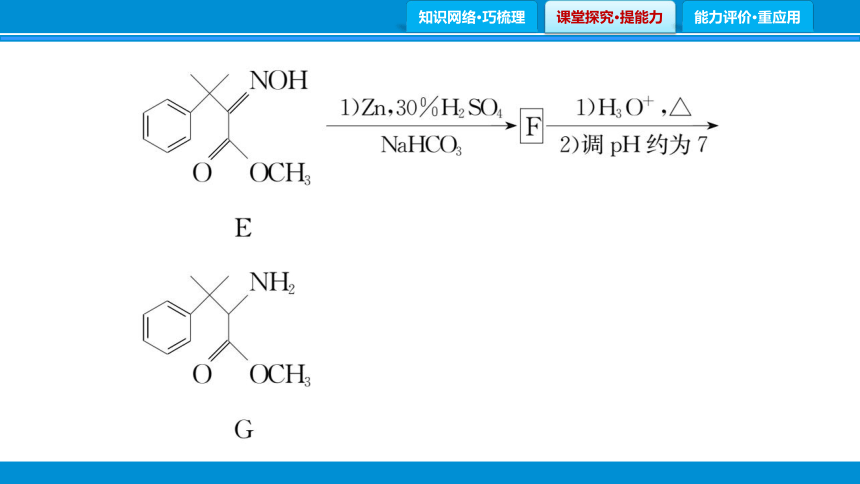
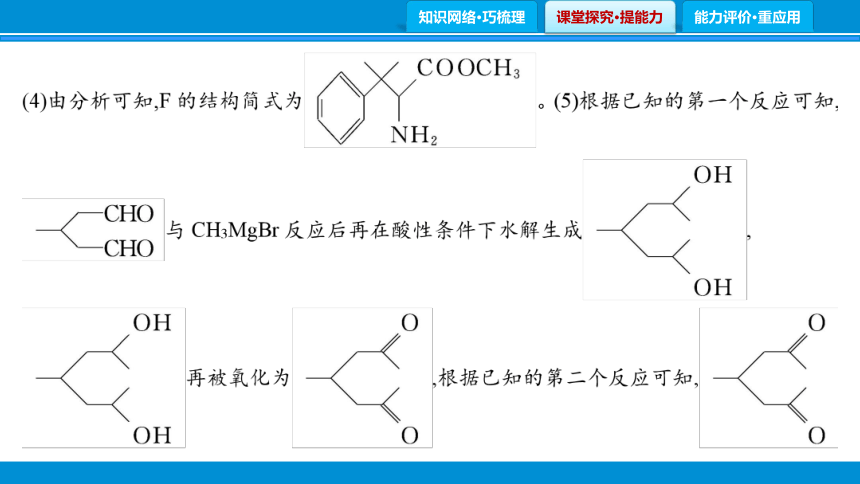
(4)F的分子式为C12H17NO2,其结构简式为 。
(1)A分子中,苯环上的碳原子和羰基、羧基上的碳原子为sp2杂化,亚甲基(—CH2—)上的碳原子为sp3杂化,即A分子中碳原子的杂化轨道类型为sp2和sp3。(2)B→C的反应中,B分子中的羟基被氯原子代替,该反应为取代反应。(3)D的分子式为C12H14O3,其一种同分异构体在碱性条件下水解,酸化后得2种产物,其中一种含苯环且有2种含氧官能团,2种产物均能被银氨溶液氧化,说明该同分异构体为酯,且水解产物都含有醛基,则水解产物中,有一种是甲酸,另外一种含有羟基和醛基,该同分异构体属于甲酸酯;同时,该同分异构体分子中含有4种不同化学环境的氢原子,则该同分异构体的结构简式为
。
3.(2021·江苏卷) F是一种天然产物,具有抗肿瘤等活性,其人工合成路线如图:
(1)A分子中采取sp2杂化的碳原子数目是 。
(2)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: 。
①分子中不同化学环境的氢原子个数比是2∶2∶2∶1。
②苯环上有4个取代基,且有两种含氧官能团。
(3)A+B→C的反应需经历A+B→X→C的过程,中间体X的分子式为C17H17NO6。X→C的反应类型为 。
(4)E→F中有一种分子式为C15H14O4的副产物生成,该副产物的结构简式为 。
解析:A和B在K2CO3作用下加热,发生反应得到C、HF和H2O,C和H2发生还原反应得到D,D发生取代反应生成E,E发生取代反应生成F。
(1)从成键方式看,形成苯环和双键的碳原子通常采用sp2杂化,醛基和苯环中的碳原子为sp2杂化,甲基中的饱和碳原子为sp3杂化,故共有7个碳原子采取sp2杂化。
(2)B的一种同分异构体,环上有4个取代基,且有两种含氧官能团,根据其不饱和度可知,这两种含氧官能团为羟基和含羰基的官能团;分子中不同化学环境的氢原子个数比是2∶2∶2∶1,说明分子结构具有一定的对称性,则该物质可能为
(3)由C的结构简式可知,C的分子式为C17H15NO5;中间体X的分子式为C17H17NO6;结合C的结构简式可知X→C生成碳碳双键,反应类型为消去反应。
(4)由E与F结构简式可知,E→F为甲氧基被—OH取代,则另一个甲氧基也可能被—OH取
代,副产物的分子式为C15H14O4,则其结构简式为: 。
4.(2020·江苏卷)化合物F是合成某种抗肿瘤药物的重要中间体,其合成路线如下:
(1)A中的含氧官能团名称为硝基、 和 。
(2)B的结构简式为 。
(3)C→D的反应类型为 。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
。
①能与FeCl3溶液发生显色反应。
②能发生水解反应,水解产物之一是α-氨基酸,另一产物分子中不同化学环境的氢原子数目比为1∶1且含苯环。
解析:(1)根据A的结构简式可知,A中的含氧官能团为硝基、(酚)羟基和醛基。
(2)根据A、C的结构简式以及B和NaBH4发生还原反应生成C,可写出B的结构简式。
(3)比较C、D的结构简式可知,C中醇羟基被溴原子代替,属于取代反应。
核心知识1 常见官能团、有机反应类型
1.官能团与反应类型
2.重要的有机反应
(1)取代反应
(2)加成反应、消去反应
(3)氧化反应、还原反应
(4)脱水反应
核心知识2 有机物之间的转化、检验辨析与答题规范
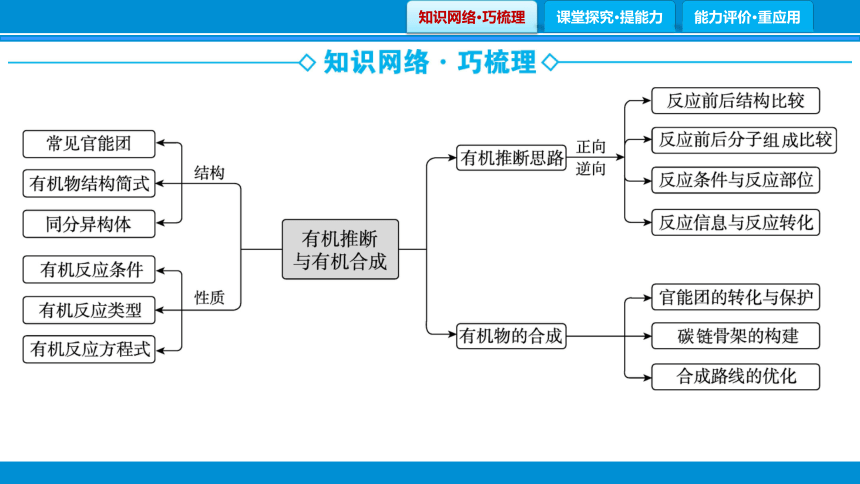
一、构建知识网络 熟记重要反应
1.构建知识网络
2.熟记重要反应
(1)CH3CH2Cl→CH2═CH2的反应方程式
二、有机物检验辨析
1.卤代烃中卤素的检验
取样,滴入NaOH 溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO3溶液,观察沉淀的颜色,确定是何种卤素。
2.烯醛中碳碳双键的检验
(1)若是纯净的液态样品,则可向所取试样中加入溴的四氯化碳溶液,若褪色,则证明含有碳碳双键。
(2)若样品为水溶液,则先向样品中加入足量的新制Cu(OH)2悬浊液,加热煮沸,充分反应后冷却过滤,向滤液中加入稀硝酸酸化,再加入溴水,若溴水褪色,则证明含有碳碳双键。
提醒:若直接向样品水溶液中滴加溴水,则会有反应:—CHO+Br2+H2O→—COOH+2HBr而使溴水褪色。
3.二糖或多糖水解产物的检验
若二糖或多糖是在稀硫酸作用下水解的,则先向冷却后的水解液中加入足量的NaOH溶液,中和稀硫酸,然后再加入银氨溶液或新制氢氧化铜悬浊液,加热(前者水浴加热),观察现象,作出判断。
4.溶解在苯中的苯酚的检验
取样,向试样中加入NaOH 溶液,振荡后静置、分液,向水溶液中加入盐酸酸化,再滴入几滴FeCl3溶液(或过量饱和溴水),若溶液呈紫色(或有白色沉淀生成),则说明有苯酚。
提醒:①若向样品中直接滴入FeCl3溶液,则由于苯酚仍溶解在苯中,不能进入水溶液中与Fe3+进行反应;若向样品中直接加入饱和溴水,则生成的三溴苯酚会溶解在苯中而看不到白色沉淀。
②若所用溴水太稀,则一方面可能由于生成溶解度相对较大的一溴苯酚或二溴苯酚,另一方面生成的三溴苯酚可能会溶解在过量的苯酚之中而看不到沉淀。
5.实验室制得乙烯气体中含有的CH2═CH2、SO2、CO2、H2O的检验
无水硫酸铜(检验水)→品红溶液(检验SO2)→饱和Fe2(SO4)3溶液(除去SO2)→品红溶液(确认SO2已除尽)→澄清石灰水(检验CO2)→溴水或溴的四氯化碳溶液或酸性高锰酸钾溶液(检验CH2═CH2)。
三、有机化学问题的答题规范
1.有机物命名要规范,熟悉简单有机物的系统命名法。请订正下列命名中的错误。
(1)(CH3)2CHC≡CH:3,甲基-1,丁炔或2-甲基-3-丁炔。3-甲基-1-丁炔。
(3)CH2Cl—CH2Cl:二氯乙烷。1,2-二氯乙烷。
2.分子式、键线式、结构式、结构简式等不能混同,勿多氢少氢。请订正下面的错误。
(1)乙醇的分子式:CH3CH2OH。C2H6O。
(2)1,4-二溴-2-丁烯的键线式:
(3)葡萄糖的结构简式:C6H12O6或C5H11O5CHO。CH2(OH)(CHOH)4CHO。
3.官能团、取代基及原子间的连接方式要规范,官能团写在左边时要特别注意。请订正下列错误。
(1)丙二醛:CHOCH2CHO。OHCCH2CHO。
4.重要有机反应的条件要记清。请填写由已知有机物生成①②等产物的反应条件。
(1)BrCH2CH2CH2OH
①CH2═CHCH2OH :NaOH、醇,加热;
②BrCH2CH═CH2:浓H2SO4,170 ℃。
(3)CH2═CHCH2OH
①BrCH2CHBrCH2OH:溴水;
②CH2═CHCHO:Cu,加热;
③CH2═CHCH2OOCCH3:浓H2SO4,加热。
(4)CH3CHBrCOOCH3
①CH3CH(OH)COOK:KOH溶液,加热;
②CH3CHBrCOOH:稀H2SO4,加热。
5.书写有机反应方程式时,有机物一般要写成结构简式或结构式,并注明反应条件,反应前后原子数目要守恒。请订正下面的错误。
核心知识3 同分异构体的书写
例如,写出同时满足下列条件的X的一种同分异构体的结构简式: 。
①能发生银镜反应
②能发生水解反应
③与FeCl3溶液发生显色反应
④分子中只有4种不同化学环境的氢
[图解过程]
核心知识4 有机合成线路设计
1.常见官能团的引入(或转化)方法
引入官能团 常用方法
—OH 烯烃与水加成反应、卤代烃水解反应、醛(酮)催化加氢反应、酯类水解反应、多糖发酵、醛(酮)与格氏试剂反应后在酸性条件下水解等
—X 烷烃与卤素单质的取代反应、烯烃α-H(或苯环上的烷基)与卤素单质光照下的取代反应、烯烃(炔烃)与卤素单质或HX的加成反应、醇类与HX的取代反应等
醇类或卤代烃的消去反应
—CHO RCH2OH(伯醇)氧化、羟醛缩合、烯烃臭氧氧化等
注:“Ar—”代表含有芳环的基团。
2.常见官能团的消除方法
官能团 常用方法
双键 加成反应
羟基 消去反应、氧化反应、酯化反应、取代反应
醛基 还原反应、氧化反应
—X 取代反应、消去反应
核心知识5 有机推断与合成中常考的重要反应
1.成环反应、开环反应
2.α-H反应
3.增长碳链与缩短碳链的反应
4.形成碳氮双键
核心知识6 有机综合推断
一、应用特征产物逆向推断
二、确定官能团的方法
1.根据试剂或特征现象推知官能团的种类
“—CHO”等结构或为苯的同系物。
(3)遇FeCl3溶液显紫色,或加入溴水出现白色沉淀,则该物质分子中含有酚羟基。
(4)遇浓硝酸变黄,则表明该物质是含有苯环结构的蛋白质。
(5)遇I2变蓝则该物质为淀粉。
(6)加入新制Cu(OH)2悬浊液,加热煮沸有砖红色沉淀生成或加入银氨溶液加热有银镜生成,表示被检物质分子中含有—CHO。
(7)加入Na放出H2,表示被检物质分子中含有—OH或—COOH。
(8)加入NaHCO3溶液产生气体,表示被检物质分子中含有—COOH。
2.根据数据确定官能团的数目
(5)某有机物与醋酸反应,相对分子质量增加42,则该有机物分子中含有1个—OH;增加84,则该有机物分子中含有2个—OH。即—OH转变为—OOCCH3。
(6)由—CHO转变为—COOH,相对分子质量增加16;若增加32,则该有机物分子中含2个—CHO。
(7)当醇被氧化成醛或酮后,相对分子质量减小2,则该醇分子中含有1个—OH;若相对分子质量减小4,则该醇分子中含有2个—OH。
3.根据性质确定官能团的位置
(1)若醇能氧化为醛或羧酸,则醇分子中应含有结构“—CH2OH”;若能氧化成酮,则醇分子中应含有结构“—CHOH—”。
(2)由消去反应的产物可确定“—OH”或“—X”的位置。
(3)由一卤代物的种类可确定碳架结构。
(4)由加氢后的碳架结构,可确定“ ”或“—C≡C—”的位置。
(5)由某有机物发生酯化反应能生成环酯或聚酯,可确定该有机物是羟基酸,并根据环的大小,可确定“—OH”与“—COOH”的相对位置。
三、有机反应类型的推断
1.判断有机反应类型的基本思路
2.根据反应条件推断反应类型
(1)在NaOH的水溶液中发生水解反应,可能是酯的水解反应或卤代烃的水解反应。
(2)在NaOH的乙醇溶液中加热,发生卤代烃的消去反应。
(3)在浓H2SO4存在的条件下加热,可能发生醇的消去反应、酯化反应、成醚反应或硝化反应等。
(4)能与溴水或溴的CCl4溶液反应,可能为烯烃、炔烃的加成反应。
(5)能与H2在Ni作用下发生反应,则为烯烃、炔烃、芳香烃、醛的加成反应或还原反应。
(6)在O2、Cu(或Ag)、加热(或CuO、加热)条件下,发生醇的氧化反应。
(7)与O2或新制Cu(OH)2悬浊液或银氨溶液反应,则该物质发生的是—CHO的氧化反应(如果连续两次出现O2,则为醇→醛→羧酸的过程)。
(8)在稀H2SO4加热条件下发生酯、低聚糖、多糖等的水解反应。
(9)在光照、X2(表示卤素单质)条件下发生烷基上的取代反应;在Fe粉(或FeX3)、X2条件下发生苯环上的取代反应。
1.化合物F是一种复合材料的组成部分,其合成路线如下:
(1)B中氮原子的杂化类型为 。
(2)C→D的反应类型为 。
(3)已知E+X F+2H2O,则化合物X的结构简式为 。
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
。
①在一定条件下能发生水解反应;
②分子中含两个苯环且含有4种不同化学环境的氢。
解析:(1)由B的结构简式可知,N原子的价电子对数=2+ =3,故N采用sp2杂化。(2)由C、D的结构简式可看出,C生成D的反应为C分子中的醇羟基被氧化为羰基的过程,该反应的类型为氧化反应。(3)将E分子中的C、N原子编号以及F中部分C、N原子编号如图所示,
则画圆圈的部分来自X,结合E的分子式以及生成一分子F的同时得到2分子H2O可知,X的结构简式为C2H5NH2。
2.(2022·江苏南通海门下学期阶段检测)奥希替尼是一种重要而昂贵的肺癌靶向药,纳入我国医保后,大大减轻了患者的经济负担。其合成路线如下图所示:
(1)H的熔点比G的低,其原因是 。
(2)F→G的反应需经历两步,第①步生成的阳离子为 ,第②步的反应类型为
。
(3)B →C中有一种分子式为C7H9ON2F的副产物生成,该副产物的结构简式为:
。
(4)G与苯甲醇发生酯化反应生成的酯( )的一种同分异构体同时
满足下列条件,写出该同分异构体的结构简式: 。
①能发生银镜反应;
②苯环上有两个取代基;
③分子中有四种化学环境不同的氢
3.(2022·江苏扬州期末检测)化合物F有抗肿瘤活性,其人工合成路线如下:
(1)B中含氧官能团的名称为 ;D中氮原子的杂化方式为 。
(2)A→B反应的可能机理为:A B,X→B。其中X是可与A互变的同分异构体,X→B为取代反应,X的结构简式为 。
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
。
①能发生银镜反应和水解反应,且水解产物之一能使FeCl3溶液显紫色;
②分子中含有两个苯环,且其中一个苯环上直接连有3个氨基;
③分子中有6种不同化学环境的氢。
解析:(1)根据B的结构简式可知,其中含氧官能团的名称为醚键、酯基;D中环上的氮原子形成两个σ键且还有一个孤电子对,属于sp2杂化;连有氢原子的氮原子形成三个σ键且还有一个孤电子对,属于sp3杂化,故D中氮原子的杂化方式为sp2、sp3。
(2)根据题意,X是可与A互变的同分异构体,X→B为取代反应,从A和B的结构分析,A生成B减少了一个O原子和一个H原子同时增加了一个Cl原子,则Cl原子取代了A中的—OH,
故X的结构简式为 。
(3)从D的结构简式得知其分子式为C15H13N3O2,其一种同分异构体:①能发生银镜反应和水解反应,且水解产物之一能使FeCl3溶液显紫色,推断含有 结构;②分子中含有两个苯环,且其中一个苯环上直接连有3个氨基;③分子中有6种不同化学环境的氢,远低于分子中H原子数,可优先推断苯环上的氨基呈对称分布;结合分子组成还有两个碳原子,可置于两个苯环之间。综上分析,该同分异构体的结构简式为:
乙醇与HCl反应可制得氯乙烷,苯环上的—CH2OH可被酸性KMnO4溶液氧化为羧基。综上所述,合成路线流程图可表示为:
题型4 有机合成与推断
1.(2022·江苏卷)精细化学品Z是X与HBr反应的主产物,X→Z的反应机理如下:
下列说法不正确的是( )
D
2.(2022·江苏卷)化合物G可用于药用多肽的结构修饰,其人工合成路线如下:
(1)A分子中碳原子的杂化轨道类型为 。
(2)B→C的反应类型为 。
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
。
①分子中含有4种不同化学环境的氢原子;②碱性条件水解,酸化后得2种产物,其中一种含苯环且有2种含氧官能团,2种产物均能被银氨溶液氧化。
(4)F的分子式为C12H17NO2,其结构简式为 。
(1)A分子中,苯环上的碳原子和羰基、羧基上的碳原子为sp2杂化,亚甲基(—CH2—)上的碳原子为sp3杂化,即A分子中碳原子的杂化轨道类型为sp2和sp3。(2)B→C的反应中,B分子中的羟基被氯原子代替,该反应为取代反应。(3)D的分子式为C12H14O3,其一种同分异构体在碱性条件下水解,酸化后得2种产物,其中一种含苯环且有2种含氧官能团,2种产物均能被银氨溶液氧化,说明该同分异构体为酯,且水解产物都含有醛基,则水解产物中,有一种是甲酸,另外一种含有羟基和醛基,该同分异构体属于甲酸酯;同时,该同分异构体分子中含有4种不同化学环境的氢原子,则该同分异构体的结构简式为
。
3.(2021·江苏卷) F是一种天然产物,具有抗肿瘤等活性,其人工合成路线如图:
(1)A分子中采取sp2杂化的碳原子数目是 。
(2)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: 。
①分子中不同化学环境的氢原子个数比是2∶2∶2∶1。
②苯环上有4个取代基,且有两种含氧官能团。
(3)A+B→C的反应需经历A+B→X→C的过程,中间体X的分子式为C17H17NO6。X→C的反应类型为 。
(4)E→F中有一种分子式为C15H14O4的副产物生成,该副产物的结构简式为 。
解析:A和B在K2CO3作用下加热,发生反应得到C、HF和H2O,C和H2发生还原反应得到D,D发生取代反应生成E,E发生取代反应生成F。
(1)从成键方式看,形成苯环和双键的碳原子通常采用sp2杂化,醛基和苯环中的碳原子为sp2杂化,甲基中的饱和碳原子为sp3杂化,故共有7个碳原子采取sp2杂化。
(2)B的一种同分异构体,环上有4个取代基,且有两种含氧官能团,根据其不饱和度可知,这两种含氧官能团为羟基和含羰基的官能团;分子中不同化学环境的氢原子个数比是2∶2∶2∶1,说明分子结构具有一定的对称性,则该物质可能为
(3)由C的结构简式可知,C的分子式为C17H15NO5;中间体X的分子式为C17H17NO6;结合C的结构简式可知X→C生成碳碳双键,反应类型为消去反应。
(4)由E与F结构简式可知,E→F为甲氧基被—OH取代,则另一个甲氧基也可能被—OH取
代,副产物的分子式为C15H14O4,则其结构简式为: 。
4.(2020·江苏卷)化合物F是合成某种抗肿瘤药物的重要中间体,其合成路线如下:
(1)A中的含氧官能团名称为硝基、 和 。
(2)B的结构简式为 。
(3)C→D的反应类型为 。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
。
①能与FeCl3溶液发生显色反应。
②能发生水解反应,水解产物之一是α-氨基酸,另一产物分子中不同化学环境的氢原子数目比为1∶1且含苯环。
解析:(1)根据A的结构简式可知,A中的含氧官能团为硝基、(酚)羟基和醛基。
(2)根据A、C的结构简式以及B和NaBH4发生还原反应生成C,可写出B的结构简式。
(3)比较C、D的结构简式可知,C中醇羟基被溴原子代替,属于取代反应。
核心知识1 常见官能团、有机反应类型
1.官能团与反应类型
2.重要的有机反应
(1)取代反应
(2)加成反应、消去反应
(3)氧化反应、还原反应
(4)脱水反应
核心知识2 有机物之间的转化、检验辨析与答题规范
一、构建知识网络 熟记重要反应
1.构建知识网络
2.熟记重要反应
(1)CH3CH2Cl→CH2═CH2的反应方程式
二、有机物检验辨析
1.卤代烃中卤素的检验
取样,滴入NaOH 溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO3溶液,观察沉淀的颜色,确定是何种卤素。
2.烯醛中碳碳双键的检验
(1)若是纯净的液态样品,则可向所取试样中加入溴的四氯化碳溶液,若褪色,则证明含有碳碳双键。
(2)若样品为水溶液,则先向样品中加入足量的新制Cu(OH)2悬浊液,加热煮沸,充分反应后冷却过滤,向滤液中加入稀硝酸酸化,再加入溴水,若溴水褪色,则证明含有碳碳双键。
提醒:若直接向样品水溶液中滴加溴水,则会有反应:—CHO+Br2+H2O→—COOH+2HBr而使溴水褪色。
3.二糖或多糖水解产物的检验
若二糖或多糖是在稀硫酸作用下水解的,则先向冷却后的水解液中加入足量的NaOH溶液,中和稀硫酸,然后再加入银氨溶液或新制氢氧化铜悬浊液,加热(前者水浴加热),观察现象,作出判断。
4.溶解在苯中的苯酚的检验
取样,向试样中加入NaOH 溶液,振荡后静置、分液,向水溶液中加入盐酸酸化,再滴入几滴FeCl3溶液(或过量饱和溴水),若溶液呈紫色(或有白色沉淀生成),则说明有苯酚。
提醒:①若向样品中直接滴入FeCl3溶液,则由于苯酚仍溶解在苯中,不能进入水溶液中与Fe3+进行反应;若向样品中直接加入饱和溴水,则生成的三溴苯酚会溶解在苯中而看不到白色沉淀。
②若所用溴水太稀,则一方面可能由于生成溶解度相对较大的一溴苯酚或二溴苯酚,另一方面生成的三溴苯酚可能会溶解在过量的苯酚之中而看不到沉淀。
5.实验室制得乙烯气体中含有的CH2═CH2、SO2、CO2、H2O的检验
无水硫酸铜(检验水)→品红溶液(检验SO2)→饱和Fe2(SO4)3溶液(除去SO2)→品红溶液(确认SO2已除尽)→澄清石灰水(检验CO2)→溴水或溴的四氯化碳溶液或酸性高锰酸钾溶液(检验CH2═CH2)。
三、有机化学问题的答题规范
1.有机物命名要规范,熟悉简单有机物的系统命名法。请订正下列命名中的错误。
(1)(CH3)2CHC≡CH:3,甲基-1,丁炔或2-甲基-3-丁炔。3-甲基-1-丁炔。
(3)CH2Cl—CH2Cl:二氯乙烷。1,2-二氯乙烷。
2.分子式、键线式、结构式、结构简式等不能混同,勿多氢少氢。请订正下面的错误。
(1)乙醇的分子式:CH3CH2OH。C2H6O。
(2)1,4-二溴-2-丁烯的键线式:
(3)葡萄糖的结构简式:C6H12O6或C5H11O5CHO。CH2(OH)(CHOH)4CHO。
3.官能团、取代基及原子间的连接方式要规范,官能团写在左边时要特别注意。请订正下列错误。
(1)丙二醛:CHOCH2CHO。OHCCH2CHO。
4.重要有机反应的条件要记清。请填写由已知有机物生成①②等产物的反应条件。
(1)BrCH2CH2CH2OH
①CH2═CHCH2OH :NaOH、醇,加热;
②BrCH2CH═CH2:浓H2SO4,170 ℃。
(3)CH2═CHCH2OH
①BrCH2CHBrCH2OH:溴水;
②CH2═CHCHO:Cu,加热;
③CH2═CHCH2OOCCH3:浓H2SO4,加热。
(4)CH3CHBrCOOCH3
①CH3CH(OH)COOK:KOH溶液,加热;
②CH3CHBrCOOH:稀H2SO4,加热。
5.书写有机反应方程式时,有机物一般要写成结构简式或结构式,并注明反应条件,反应前后原子数目要守恒。请订正下面的错误。
核心知识3 同分异构体的书写
例如,写出同时满足下列条件的X的一种同分异构体的结构简式: 。
①能发生银镜反应
②能发生水解反应
③与FeCl3溶液发生显色反应
④分子中只有4种不同化学环境的氢
[图解过程]
核心知识4 有机合成线路设计
1.常见官能团的引入(或转化)方法
引入官能团 常用方法
—OH 烯烃与水加成反应、卤代烃水解反应、醛(酮)催化加氢反应、酯类水解反应、多糖发酵、醛(酮)与格氏试剂反应后在酸性条件下水解等
—X 烷烃与卤素单质的取代反应、烯烃α-H(或苯环上的烷基)与卤素单质光照下的取代反应、烯烃(炔烃)与卤素单质或HX的加成反应、醇类与HX的取代反应等
醇类或卤代烃的消去反应
—CHO RCH2OH(伯醇)氧化、羟醛缩合、烯烃臭氧氧化等
注:“Ar—”代表含有芳环的基团。
2.常见官能团的消除方法
官能团 常用方法
双键 加成反应
羟基 消去反应、氧化反应、酯化反应、取代反应
醛基 还原反应、氧化反应
—X 取代反应、消去反应
核心知识5 有机推断与合成中常考的重要反应
1.成环反应、开环反应
2.α-H反应
3.增长碳链与缩短碳链的反应
4.形成碳氮双键
核心知识6 有机综合推断
一、应用特征产物逆向推断
二、确定官能团的方法
1.根据试剂或特征现象推知官能团的种类
“—CHO”等结构或为苯的同系物。
(3)遇FeCl3溶液显紫色,或加入溴水出现白色沉淀,则该物质分子中含有酚羟基。
(4)遇浓硝酸变黄,则表明该物质是含有苯环结构的蛋白质。
(5)遇I2变蓝则该物质为淀粉。
(6)加入新制Cu(OH)2悬浊液,加热煮沸有砖红色沉淀生成或加入银氨溶液加热有银镜生成,表示被检物质分子中含有—CHO。
(7)加入Na放出H2,表示被检物质分子中含有—OH或—COOH。
(8)加入NaHCO3溶液产生气体,表示被检物质分子中含有—COOH。
2.根据数据确定官能团的数目
(5)某有机物与醋酸反应,相对分子质量增加42,则该有机物分子中含有1个—OH;增加84,则该有机物分子中含有2个—OH。即—OH转变为—OOCCH3。
(6)由—CHO转变为—COOH,相对分子质量增加16;若增加32,则该有机物分子中含2个—CHO。
(7)当醇被氧化成醛或酮后,相对分子质量减小2,则该醇分子中含有1个—OH;若相对分子质量减小4,则该醇分子中含有2个—OH。
3.根据性质确定官能团的位置
(1)若醇能氧化为醛或羧酸,则醇分子中应含有结构“—CH2OH”;若能氧化成酮,则醇分子中应含有结构“—CHOH—”。
(2)由消去反应的产物可确定“—OH”或“—X”的位置。
(3)由一卤代物的种类可确定碳架结构。
(4)由加氢后的碳架结构,可确定“ ”或“—C≡C—”的位置。
(5)由某有机物发生酯化反应能生成环酯或聚酯,可确定该有机物是羟基酸,并根据环的大小,可确定“—OH”与“—COOH”的相对位置。
三、有机反应类型的推断
1.判断有机反应类型的基本思路
2.根据反应条件推断反应类型
(1)在NaOH的水溶液中发生水解反应,可能是酯的水解反应或卤代烃的水解反应。
(2)在NaOH的乙醇溶液中加热,发生卤代烃的消去反应。
(3)在浓H2SO4存在的条件下加热,可能发生醇的消去反应、酯化反应、成醚反应或硝化反应等。
(4)能与溴水或溴的CCl4溶液反应,可能为烯烃、炔烃的加成反应。
(5)能与H2在Ni作用下发生反应,则为烯烃、炔烃、芳香烃、醛的加成反应或还原反应。
(6)在O2、Cu(或Ag)、加热(或CuO、加热)条件下,发生醇的氧化反应。
(7)与O2或新制Cu(OH)2悬浊液或银氨溶液反应,则该物质发生的是—CHO的氧化反应(如果连续两次出现O2,则为醇→醛→羧酸的过程)。
(8)在稀H2SO4加热条件下发生酯、低聚糖、多糖等的水解反应。
(9)在光照、X2(表示卤素单质)条件下发生烷基上的取代反应;在Fe粉(或FeX3)、X2条件下发生苯环上的取代反应。
1.化合物F是一种复合材料的组成部分,其合成路线如下:
(1)B中氮原子的杂化类型为 。
(2)C→D的反应类型为 。
(3)已知E+X F+2H2O,则化合物X的结构简式为 。
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
。
①在一定条件下能发生水解反应;
②分子中含两个苯环且含有4种不同化学环境的氢。
解析:(1)由B的结构简式可知,N原子的价电子对数=2+ =3,故N采用sp2杂化。(2)由C、D的结构简式可看出,C生成D的反应为C分子中的醇羟基被氧化为羰基的过程,该反应的类型为氧化反应。(3)将E分子中的C、N原子编号以及F中部分C、N原子编号如图所示,
则画圆圈的部分来自X,结合E的分子式以及生成一分子F的同时得到2分子H2O可知,X的结构简式为C2H5NH2。
2.(2022·江苏南通海门下学期阶段检测)奥希替尼是一种重要而昂贵的肺癌靶向药,纳入我国医保后,大大减轻了患者的经济负担。其合成路线如下图所示:
(1)H的熔点比G的低,其原因是 。
(2)F→G的反应需经历两步,第①步生成的阳离子为 ,第②步的反应类型为
。
(3)B →C中有一种分子式为C7H9ON2F的副产物生成,该副产物的结构简式为:
。
(4)G与苯甲醇发生酯化反应生成的酯( )的一种同分异构体同时
满足下列条件,写出该同分异构体的结构简式: 。
①能发生银镜反应;
②苯环上有两个取代基;
③分子中有四种化学环境不同的氢
3.(2022·江苏扬州期末检测)化合物F有抗肿瘤活性,其人工合成路线如下:
(1)B中含氧官能团的名称为 ;D中氮原子的杂化方式为 。
(2)A→B反应的可能机理为:A B,X→B。其中X是可与A互变的同分异构体,X→B为取代反应,X的结构简式为 。
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
。
①能发生银镜反应和水解反应,且水解产物之一能使FeCl3溶液显紫色;
②分子中含有两个苯环,且其中一个苯环上直接连有3个氨基;
③分子中有6种不同化学环境的氢。
解析:(1)根据B的结构简式可知,其中含氧官能团的名称为醚键、酯基;D中环上的氮原子形成两个σ键且还有一个孤电子对,属于sp2杂化;连有氢原子的氮原子形成三个σ键且还有一个孤电子对,属于sp3杂化,故D中氮原子的杂化方式为sp2、sp3。
(2)根据题意,X是可与A互变的同分异构体,X→B为取代反应,从A和B的结构分析,A生成B减少了一个O原子和一个H原子同时增加了一个Cl原子,则Cl原子取代了A中的—OH,
故X的结构简式为 。
(3)从D的结构简式得知其分子式为C15H13N3O2,其一种同分异构体:①能发生银镜反应和水解反应,且水解产物之一能使FeCl3溶液显紫色,推断含有 结构;②分子中含有两个苯环,且其中一个苯环上直接连有3个氨基;③分子中有6种不同化学环境的氢,远低于分子中H原子数,可优先推断苯环上的氨基呈对称分布;结合分子组成还有两个碳原子,可置于两个苯环之间。综上分析,该同分异构体的结构简式为:
乙醇与HCl反应可制得氯乙烷,苯环上的—CH2OH可被酸性KMnO4溶液氧化为羧基。综上所述,合成路线流程图可表示为:
同课章节目录
