专题7 水溶液中的离子平衡 课件(共71张PPT)江苏省2023高考三轮冲刺练
文档属性
| 名称 | 专题7 水溶液中的离子平衡 课件(共71张PPT)江苏省2023高考三轮冲刺练 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-19 00:00:00 | ||
图片预览











文档简介
(共71张PPT)
专题7 水溶液中的离子平衡
能力点1 弱电解质的电离平衡
1.(2022·江苏卷)一种捕集烟气中CO2的过程如图所示。室温
下以0.1 mol·L-1 KOH溶液吸收CO2,若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度c总=c(H2CO3)+ 。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。下列说法正确的是( )
C
如题图所示的“吸收”“转化”过程中,发生的反应为:CO2+2KOH══K2CO3+H2O、K2CO3+CaO+H2O══CaCO3↓+2KOH(若生成KHCO3或K2CO3与KHCO3的混合物,则原理相同),二式相加得:CO2+CaO══CaCO3↓,该反应放热,溶液的温度升高,D不正确;故选C。
2.(双选)(2020·江苏卷)室温下,将两种浓度均为0.1 mol·L-1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是( )
AD
BD
核心知识1 电离平衡常数及影响因素
1.相互关系
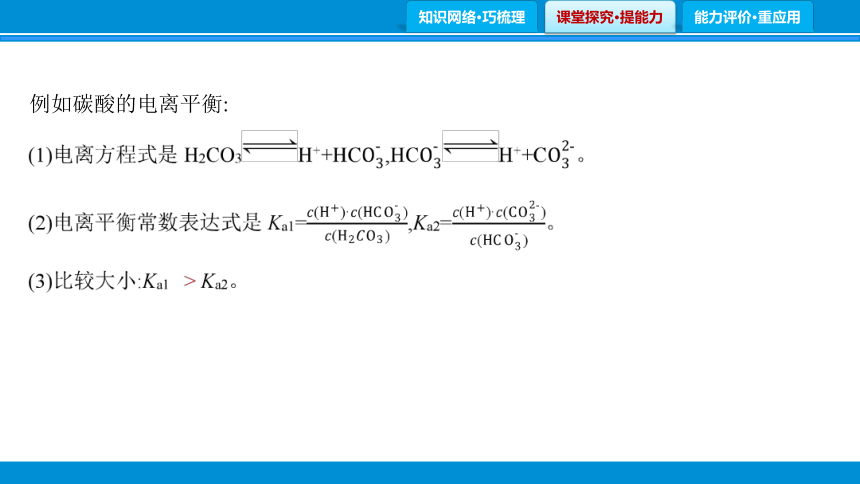
例如碳酸的电离平衡:
2.电离平衡移动
25 ℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,随着溶液pH的变化,lg c(CH3COOH)、lg c(CH3COO-)、lg c(H+)和 lg c(OH-)随pH变化的关系如图所示。
M、N、O、P代表的微粒浓度关系分别是:
M点:c(CH3COO-)=c(H+);
N点c(CH3COO-)=c(CH3COOH);
O点c(H+)=c(OH-);
P点:c(OH-)=c(CH3COOH)。
[分析] 一是根据中和反应判断各成分浓度是增大还是减小;二是根据pH等于7,H+和OH-浓度对数的交叉点,来确定氢离子和氢氧根离子浓度变化的曲线。
随着pH的升高,氢氧根离子和醋酸根离子浓度增大,醋酸和氢离子的浓度减小。根据上图分析可知,
O点pH=7时,c(H+)=c(OH-),故可推知:曲线2为 lg c(H+)随pH的变化曲线,曲线3为lg c(OH-)随pH的变化曲线;曲线1为lg c(CH3COO-)随pH的变化曲线,曲线4为lg c(CH3COOH)随pH的变化曲线。
3.Ka及pH推断
例如H2A为二元弱酸。20 ℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100 mol·L-1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。
点拨:分布系数图交点,是微粒浓度(或微粒分数)相等点,根据电离平衡常数公式不难推出,此点的pKa(pKa=-lg Ka)等于该点的pH。
核心知识2 水的电离
1.水的离子积常数Kw=c(H+)·c(OH-),其实质是水溶液中的H+和OH-浓度的乘积,不一定是水电离出的H+和OH-浓度的乘积,所以与其说Kw是水的离子积常数,不如说是水溶液中的H+和OH-的离子积常数。即Kw不仅适用于水,还适用于酸性或碱性的稀溶液。不管哪种溶液均有 。
2.水的离子积常数显示了在任何水溶液中均存在水的电离平衡,H+和OH-会共存,只是相对含量不同而已。
3.在25 ℃,水电离出的c(H+)或c(OH-)与溶液中的c(H+)或c(OH-)的关系。
核心知识3 酸碱中和滴定
1.实验原理
利用 酸碱中和 反应,用已知浓度 酸 (或 碱 )来测定未知浓度的 碱 (或 酸 )的实验方法。以标准浓度的盐酸滴定待测NaOH溶液,待测NaOH溶液的物质的量浓度为
c(NaOH)= 。
酸碱中和滴定的关键:
(1)准确确定标准液的体积。
(2)准确判断滴定终点。
2.实验用品
(1)仪器
酸式滴定管[如图(A)]、碱式滴定管[如图(B)]、滴定管夹、铁架台、锥形瓶。
(2)试剂
标准液、待测液、指示剂、蒸馏水。
(3)滴定管的使用
①酸性、氧化性的试剂一般用酸式滴定管,因为酸和氧化性物质易腐蚀橡胶管。
②碱性的试剂用碱式滴定管,因为碱性物质易腐蚀玻璃,致使活塞无法打开。
3.实验操作(以标准盐酸滴定待测NaOH溶液为例)
(1)滴定前的准备
①滴定管:查漏→洗涤→润洗→装液→调液面→记录。
②锥形瓶:注碱液→记读数→加指示剂。
(2)滴定
(3)终点判断
等到滴入最后一滴标准液,指示剂变色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录标准液的体积。
(4)数据处理
按上述操作重复二至三次,求出用去标准盐酸体积的平均值,根据c(NaOH)= 计算。
4.常用酸碱指示剂及变色范围
5.中和滴定中突跃范围与指示剂的选择
例如0.10 mol·L-1的NaOH标准液滴定20.00 mL 0.10 mol·L-1 HCl 溶液(如图所示)。
(1)滴定曲线图
(2)滴定数据
NaOH溶液从19.98 mL到20.02 mL,只增加了0.04 mL(约1滴),就使得溶液的pH改变了5.4个单位。这种在化学计量点±0.1%范围内,pH的急剧变化就称为滴定突跃。
滴定突跃范围是选择指示剂的重要依据,凡是在滴定突跃范围内能发生颜色变化的指示剂都可以用来指示滴定终点。实际分析时,为了更好地判断终点,氢氧化钠滴定盐酸通常选用酚酞作指示剂,其原因是:终点的颜色由无色变为浅红色,更容易辨别。
核心知识4 电解质溶液中微粒浓度大小比较
一、思路方法
二、典例突破
1.粒子种类的判断
判断盐溶液中粒子种类时,首先要清楚盐在溶液中的电离、水解情况,特别是多步电离和多步水解。
2.单一溶液中离子浓度的关系
(2)①酸式盐溶液的酸碱性主要取决于酸式盐中酸式酸根离子的电离能力和水解能力哪一个更强,如NaHCO3溶液中 的水解能力大于其电离能力,故溶液显碱性。
②多元弱酸的强碱正盐溶液,弱酸根离子水解以第一步为主。例如,硫化钠溶液中:
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。
(3)质子守恒式可以由电荷守恒式和物料守恒式推导出来。以KHS溶液为例,电荷守恒式为c(K+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)①,物料守恒式为c(K+)=c(HS-)+c(S2-)+c(H2S)②,由①-②得质子守恒式,消去没有参与变化的K+等。
(4)规避等量关系中的2个易失分点
②物料守恒式中,离子浓度系数不能漏写或颠倒。如Na2S溶液中的物料守恒式中,“2”表示c(Na+)是溶液中各种硫元素存在形式的硫原子总浓度的2倍。
3.酸、碱中和型离子浓度的关系
4.盐与酸(碱)混合型
首先考虑是否反应,都不反应,分析盐的水解程度和酸(碱)的电离程度的大小;若能反应,则按反应后混合溶液的组成综合考虑水解和电离两种因素。
5.不同溶液中同种离子浓度的大小比较
选好参照物,分组比较,各个击破。
如25 ℃时,相同物质的量浓度的下列物质的溶液中:①NH4Cl ②CH3COONH4 ③NH4HSO4 ④(NH4)2SO4 ⑤(NH4)2Fe(SO4)2,c( )由大到小的顺序为⑤>④>③>①>②。
分析流程为:
1.(2022·常州模拟)将0.2 mol·L-1 NaHCO3溶液与0.1 mol·L-1 KOH溶液等体积混合,下列关系正确的是( )
D
2.常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法正确的是( )
A.点①所示溶液中:
c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:
c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D
解析:点①溶液中的溶质为0.001 mol CH3COOH和0.001 mol CH3COONa,据物料守恒:c(CH3COO-)+c(CH3COOH)=2c(Na+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+
c(OH-),整理后得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),A项错误;点②溶液的pH=7,根据电荷守恒有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),又c(H+)=c(OH-),则c(Na+)=c(CH3COO-),B项错误;点③溶液中的溶质为0.002 mol CH3COONa,离子浓度大小关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),C项错误;当NaOH不足CH3COOH过量时,可能出现D项所述情况,故选D。
3.(2022·无锡月考)25 ℃时,下列说法正确的是( )
A.NaHA溶液呈酸性,可以推测H2A为强酸
B.可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐
C.0.010 mol·L-1、0.10 mol·L-1的醋酸溶液的电离度分别为α1、α2,则α1<α2
D.100 mL pH=10.00的Na2CO3溶液中,水电离出H+的物质的量为1×10-5 mol
D
解析:NaHA溶液呈酸性,可能是HA-的电离程度大于其水解程度,不能据此得出H2A为强酸的结论,A错误;可溶性正盐BA溶液呈中性,不能推测BA为强酸强碱盐,也可能是B+和A-的水解程度相同,即也可能是弱酸弱碱盐,B错误;弱酸的浓度越小,其电离程度越大,因此0.010 mol·L-1、0.10 mol·L-1的醋酸溶液的电离度分别为α1、α2,则α1>α2,C错误;100 mL pH=10.00的Na2CO3溶液中氢氧根离子的浓度是1×10-4 mol·L-1,碳酸根水解促进水的电离,则水电离出H+的浓度是1×10-4 mol·L-1,100 mL溶液中H+物质的量为0.1 L×1×10-4 mol·L-1=1×10-5 mol,D正确;故选D。
4.(2022·盐城三月模拟)HA是一元弱酸,难溶盐MA的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解。实验发现,298 K时c2(M+)-c(H+)为线性关系,如图中实线所示。
下列叙述错误的是( )
A.溶液pH=4时,c(M+)<3.0×10-4mol·L-1
B.MA的溶度积Ksp(MA)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
D.HA的电离常数Ka(HA)≈2.0×10-4
C
能力点2 沉淀溶解平衡
1.(2022·江苏卷,节选)硫铁化合物(FeS、FeS2等)应用广泛。
(1)纳米FeS可去除水中微量六价铬[Cr(Ⅵ)]。在pH=4~7的水溶液中,纳米FeS颗粒表面带正电荷,Cr(Ⅵ)主要以 形式存在,纳米FeS去除水中Cr(Ⅵ)主要经过“吸附→反应→沉淀”的过程。
已知:Ksp(FeS)=6.5×10-18,Ksp[Fe(OH)2]=5.0×10-17;H2S电离常数分别为Ka1=1.1×10-7、Ka2=1.3×10-13。①在弱碱性溶液中,FeS与 反应生成Fe(OH)3、Cr(OH)3和单质S,其离子方程式为 。
②在弱酸性溶液中,反应FeS+H+══Fe2++HS-的平衡常数K的数值为 。
③在pH=4~7的溶液中,pH越大,FeS去除水中Cr(Ⅵ)的速率越慢,原因是 。
2.(2021·江苏卷)室温下,用0.5 mol·L-1 Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知Ksp(CaSO4)=5×10-5,Ksp(CaCO3)=3×10-9。下列说法正确的是( )
C
核心知识1 沉淀溶解平衡图像题的解题策略
1.一般步骤
(1)溶解平衡曲线类似于溶解度曲线,曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和,此时有沉淀析出,曲线下方的任一点,均表示不饱和。
(2)从图像中找到数据,根据Ksp公式计算得出Ksp的值。
(3)比较溶液的Qc与Ksp的大小,判断溶液中有无沉淀析出。
(4)涉及Qc的计算时,所代入的离子浓度一定是混合溶液中的离子浓度,因此计算离子浓度时,所代入的溶液体积也必须是混合溶液的体积。
2.具体分析
(1)溶解平衡常数(Ksp)分析
典型示例 点的变化 a、c处在曲线上,Qc=Ksp,饱和溶液 b:Qc>Ksp,有沉淀生成 c:Ksp(BaSO4)=10-5×10-5=10-10 d:Qcb→c 加入1×10-5 mol·L-1 Na2SO4溶液(加水不行)
d→c 加入BaCl2固体(忽略溶液的体积变化)
c→a 曲线上变化,增大c(Ba2+)
曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液 不同曲线(T1、T2)之间变化只能通过改变温度实现 (2)沉淀溶解平衡过程分析
(3)沉淀溶解平衡直线图
例如,常温下用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的NaCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑 水解)。
核心知识2 沉淀溶解平衡的应用
1.沉淀的生成
(1)调节pH法
如除去NH4Cl溶液中的MgCl2杂质,可加入氨水调节pH至7~8,离子方程式为Mg2++2NH3·H2O══Mg(OH)2↓+2 。
(2)沉淀剂法
如用H2S沉淀Cu2+,离子方程式为H2S+Cu2+══CuS↓+2H+。
2.沉淀的溶解
(1)酸溶解法
如CaCO3溶于盐酸,离子方程式为CaCO3+2H+══Ca2++H2O+CO2↑。
(2)盐溶液溶解法
3.沉淀的转化
(1)实质:沉淀溶解平衡的移动(两种沉淀的溶解度差别越大,越容易转化)。
(2)应用:锅炉除垢、矿物转化等。
核心知识3 常考有关对数举例
1.(2022·江苏海安期末学业质量监测)室温下,通过下列实验探究NaHS溶液的性质。
实验 实验操作和现象
1 向0.1 mol·L-1 NaHS溶液中滴加几滴酚酞试剂,溶液变红
2 向0.1 mol·L-1 NaHS溶液中加入等体积0.1 mol·L-1 NaOH溶液充分混合
3 向0.1 mol·L-1 NaHS溶液中通入少量氯气,有淡黄色沉淀产生
4 向0.1 mol·L-1 NaHS溶液中加入等体积0.1 mol·L-1 HCl溶液,有气体放出
下列有关说法正确的是( )
A.实验1 0.1 mol·L-1 NaHS溶液中:c(S2-)>c(H2S)
B.实验2 所得溶液中:c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.实验3中反应的离子方程式:HS-+Cl2══S↓+H++2Cl-
D.实验4 所得溶液中:c(S2-)+c(OH-)=c(H2S)+c(H+)
C
可知NaHS溶液呈碱性,即HS-的水解程度大于其电离程度,故c(H2S)>c(S2-),A项错误;B项两溶液中的NaHS和NaOH恰好完全反应生成Na2S,据物料守恒可知c(Na+)=2[c(S2-) +c(HS-)+c(H2S)],B项错误;据C项中实验现象可知,Cl2将HS-氧化为单质硫从而产生淡黄色沉淀,其离子方程式为HS-+Cl2══S↓+H++2Cl-,C项正确;D项两溶液中的NaHS和HCl恰好完全反应生成H2S和NaCl,根据电荷守恒有:c(H+)+c(Na+)=c(HS-)+2c(S2-)+c(OH-) +c(Cl-),由于c(Na+)=c(Cl-),则c(H+)=c(HS-)+2c(S2-)+c(OH-),c(S2-)+c(OH-)=c(H2S)+c(H+)为NaHS溶液中的质子守恒,该溶液中不符合此关系,D项错误。
2.(2022·南通高三模拟)某温度下,向体积均为20.00 mL、浓度均为0.1 mol·L-1的NaCl、Na2CrO4溶液中分别滴加0.1 mol·L-1的AgNO3溶液,滴定过程中的pX(pX=-lg X,X=Cl-、
)与滴加AgNO3溶液体积关系如图所示(lg 3=0.47)。
下列说法错误的是( )
A.a=1
B.曲线Ⅰ表示NaCl溶液
C.Ksp(Ag2CrO4)=1.0×10-2b
D.M约为2c-1.47
C
3.(2022·无锡模拟)常温下,向10 mL一定浓度的硝酸银溶液中,逐滴加入0.1 mol·L-1的氨水,反应过程中-lg c(Ag+)或-lg c[ ]与加入氨水体积的关系如图所示。下列说法正确的是( )
A.原硝酸银溶液的浓度是0.05 mol·L-1
B.反应生成氢氧化银的Ksp(AgOH)的数量级为10-4
D
1.(2022·江苏苏、锡、常、镇四市下学期调研)常温下,通过下列实验探究H2S、Na2S溶液的性质。
实验1:向0.1 mol·L-1 H2S溶液中通入一定体积的NH3,测得溶液pH为7。
实验2:向0.1 mol·L-1 H2S溶液中滴加等体积同浓度的NaOH溶液,充分反应后再滴入2滴酚酞,溶液呈红色。
实验3:向5 mL 0.1 mol·L-1 Na2S溶液中滴入1 mL 0.1 mol·L-1 ZnSO4溶液,产生白色沉淀;再滴入几滴0.1 mol·L-1 CuSO4溶液,立即出现黑色沉淀。
实验4:向0.1 mol·L-1 Na2S溶液中逐滴滴加等体积同浓度的盐酸,无明显现象。
下列说法正确的是( )
B.由实验2可得出:KwC.由实验3可得出:Ksp(ZnS)>Ksp(CuS)
D.实验4得到的溶液中存在c(H+)-c(OH-)=c(S2-)-c(H2S)
D
项错误;实验3中硫化钠溶液与硫酸锌溶液反应时,硫化钠溶液过量,再加入硫酸铜溶液时,只有硫化铜沉淀的生成反应,没有硫化锌转化为硫化铜沉淀的反应发生,无法比较硫化锌和硫化铜溶度积的大小,C项错误;实验4得到的溶液为等物质的量浓度的硫氢化钠和氯化钠的混合溶液,溶液中存在质子守恒关系c(H+)+c(H2S)=c(S2-)+c(OH-),则溶液中存在c(H+)-c(OH-)=c(S2-)-c(H2S),D项正确。
2.用0.10 mol·L-1 NaOH溶液滴定20.0 mL 0.10 mol·L-1 H2A溶液,溶液pH和温度随
的变化曲线如图所示。下列说法正确的( )
A.从W至Z点,水的电离程度逐渐增大,Kw不变
C.27 ℃,H2A的电离常数Ka2=10-9.7
D.Y点为第二反应终点
C
3.化学中常用AG表示溶液的酸度 。室温下,向20.00 mL 0.100 0 mol·
L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加入稀硫酸体积的变化如图所示。下列说法正确的是( )
A.b、c、d三点对应的溶液中,水的电离程度大小为b=d>c
B.b点对应的溶液中:c(M+)-c(MOH)=2c(OH-)-2c(H+)
C.当AG=0时,溶液中存在c( )>c(M+)>c(H+)=c(OH-)
D.室温下M+的水解常数Kh=10×10-5
B
解析:c点为酸碱恰好完全反应的点,生成了强酸弱碱盐,促进了水解,从c点以后,硫酸过量,酸抑制水的电离,硫酸属于强酸,对水的电离平衡抑制程度较大,因此水的电离程度:c>b>d,A项说法错误;b点,MOH和M2SO4比为2∶1,根据电荷守恒,
4.已知:pKa=-lg Ka,25 ℃时,H2A的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 H2A溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法正确的是
( )
A.a点所得溶液中:2c(HA-)+c(A2-)=0.1 mol·L-1
B.c点所得溶液中:c(Na+)>3c(HA-)
C.当溶液的pH为7时,此时加入的NaOH溶液
体积为30 mL
D.随着NaOH溶液滴入,水的电离程度一直增大
B
随着NaOH溶液的滴入,依次发生反应H2A+OH-══HA-+H2O、HA-+OH-══A2-+H2O,水的电离程度逐渐增大,当恰好反应生成Na2A时,水的电离程度最大,继续滴入NaOH溶液,水的电离程度逐渐减小,D错误;故选B。
5.一定温度下,难溶电解质在水中存在沉淀溶解和生成的平衡,常用溶度积Ksp来表示溶解程度的大小,如Ksp(AgCl)=c(Ag+)·c(Cl-)。常温下用0.100 0 mol·L-1的AgNO3标准溶液(pH≈5)分别滴定20.00 mL 0.100 0 mol·L-1的NaCl溶液和NaBr溶液,混合溶液的pAg[定义为pAg=-lg c(Ag+)]与AgNO3溶液体积的变化关系如图所示。下列说法不正确的是( )
A.Ksp(AgCl)>Ksp(AgBr)
B.当V(AgNO3溶液)=20 mL时,NaBr溶液中:
c(Ag+)+c(H+)=c(Br-)+c(OH-)
C.当V(AgNO3溶液)=30 mL时,NaCl溶液中:
D.相同实验条件下,若改用
10.00 mL 0.200 0 mol·L-1 NaCl溶液,
则滴定曲线(滴定终点前)可能变为a
C
解析:由题图可知,当未加入AgNO3溶液时,溶液中Ag+的浓度即为AgCl、AgBr分别在0.1 mol·L-1的NaCl、NaBr溶液中的Ag+浓度,故有Ksp(AgCl)=c(Ag+)·c(Cl-)=10-9×0.1≈10-10, Ksp(AgBr)=c(Ag+)·c(Br-)=10-12×0.1≈10-13,故有Ksp(AgCl)>Ksp(AgBr),A正确;当V(AgNO3溶液)=20 mL时,即AgNO3与NaBr恰好完全反应,根据溶液中电荷守恒可知,NaBr溶液中:c(Ag+)+c(H+)=c(Br-)+c(OH-),B正确;当V(AgNO3溶液)=30 mL时,溶液为NaNO3、AgNO3和AgCl的混合体系,由题图可知,此时c(Ag+)≈10-1.5 mol·L-1,
专题7 水溶液中的离子平衡
能力点1 弱电解质的电离平衡
1.(2022·江苏卷)一种捕集烟气中CO2的过程如图所示。室温
下以0.1 mol·L-1 KOH溶液吸收CO2,若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度c总=c(H2CO3)+ 。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。下列说法正确的是( )
C
如题图所示的“吸收”“转化”过程中,发生的反应为:CO2+2KOH══K2CO3+H2O、K2CO3+CaO+H2O══CaCO3↓+2KOH(若生成KHCO3或K2CO3与KHCO3的混合物,则原理相同),二式相加得:CO2+CaO══CaCO3↓,该反应放热,溶液的温度升高,D不正确;故选C。
2.(双选)(2020·江苏卷)室温下,将两种浓度均为0.1 mol·L-1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是( )
AD
BD
核心知识1 电离平衡常数及影响因素
1.相互关系
例如碳酸的电离平衡:
2.电离平衡移动
25 ℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,随着溶液pH的变化,lg c(CH3COOH)、lg c(CH3COO-)、lg c(H+)和 lg c(OH-)随pH变化的关系如图所示。
M、N、O、P代表的微粒浓度关系分别是:
M点:c(CH3COO-)=c(H+);
N点c(CH3COO-)=c(CH3COOH);
O点c(H+)=c(OH-);
P点:c(OH-)=c(CH3COOH)。
[分析] 一是根据中和反应判断各成分浓度是增大还是减小;二是根据pH等于7,H+和OH-浓度对数的交叉点,来确定氢离子和氢氧根离子浓度变化的曲线。
随着pH的升高,氢氧根离子和醋酸根离子浓度增大,醋酸和氢离子的浓度减小。根据上图分析可知,
O点pH=7时,c(H+)=c(OH-),故可推知:曲线2为 lg c(H+)随pH的变化曲线,曲线3为lg c(OH-)随pH的变化曲线;曲线1为lg c(CH3COO-)随pH的变化曲线,曲线4为lg c(CH3COOH)随pH的变化曲线。
3.Ka及pH推断
例如H2A为二元弱酸。20 ℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100 mol·L-1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。
点拨:分布系数图交点,是微粒浓度(或微粒分数)相等点,根据电离平衡常数公式不难推出,此点的pKa(pKa=-lg Ka)等于该点的pH。
核心知识2 水的电离
1.水的离子积常数Kw=c(H+)·c(OH-),其实质是水溶液中的H+和OH-浓度的乘积,不一定是水电离出的H+和OH-浓度的乘积,所以与其说Kw是水的离子积常数,不如说是水溶液中的H+和OH-的离子积常数。即Kw不仅适用于水,还适用于酸性或碱性的稀溶液。不管哪种溶液均有 。
2.水的离子积常数显示了在任何水溶液中均存在水的电离平衡,H+和OH-会共存,只是相对含量不同而已。
3.在25 ℃,水电离出的c(H+)或c(OH-)与溶液中的c(H+)或c(OH-)的关系。
核心知识3 酸碱中和滴定
1.实验原理
利用 酸碱中和 反应,用已知浓度 酸 (或 碱 )来测定未知浓度的 碱 (或 酸 )的实验方法。以标准浓度的盐酸滴定待测NaOH溶液,待测NaOH溶液的物质的量浓度为
c(NaOH)= 。
酸碱中和滴定的关键:
(1)准确确定标准液的体积。
(2)准确判断滴定终点。
2.实验用品
(1)仪器
酸式滴定管[如图(A)]、碱式滴定管[如图(B)]、滴定管夹、铁架台、锥形瓶。
(2)试剂
标准液、待测液、指示剂、蒸馏水。
(3)滴定管的使用
①酸性、氧化性的试剂一般用酸式滴定管,因为酸和氧化性物质易腐蚀橡胶管。
②碱性的试剂用碱式滴定管,因为碱性物质易腐蚀玻璃,致使活塞无法打开。
3.实验操作(以标准盐酸滴定待测NaOH溶液为例)
(1)滴定前的准备
①滴定管:查漏→洗涤→润洗→装液→调液面→记录。
②锥形瓶:注碱液→记读数→加指示剂。
(2)滴定
(3)终点判断
等到滴入最后一滴标准液,指示剂变色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录标准液的体积。
(4)数据处理
按上述操作重复二至三次,求出用去标准盐酸体积的平均值,根据c(NaOH)= 计算。
4.常用酸碱指示剂及变色范围
5.中和滴定中突跃范围与指示剂的选择
例如0.10 mol·L-1的NaOH标准液滴定20.00 mL 0.10 mol·L-1 HCl 溶液(如图所示)。
(1)滴定曲线图
(2)滴定数据
NaOH溶液从19.98 mL到20.02 mL,只增加了0.04 mL(约1滴),就使得溶液的pH改变了5.4个单位。这种在化学计量点±0.1%范围内,pH的急剧变化就称为滴定突跃。
滴定突跃范围是选择指示剂的重要依据,凡是在滴定突跃范围内能发生颜色变化的指示剂都可以用来指示滴定终点。实际分析时,为了更好地判断终点,氢氧化钠滴定盐酸通常选用酚酞作指示剂,其原因是:终点的颜色由无色变为浅红色,更容易辨别。
核心知识4 电解质溶液中微粒浓度大小比较
一、思路方法
二、典例突破
1.粒子种类的判断
判断盐溶液中粒子种类时,首先要清楚盐在溶液中的电离、水解情况,特别是多步电离和多步水解。
2.单一溶液中离子浓度的关系
(2)①酸式盐溶液的酸碱性主要取决于酸式盐中酸式酸根离子的电离能力和水解能力哪一个更强,如NaHCO3溶液中 的水解能力大于其电离能力,故溶液显碱性。
②多元弱酸的强碱正盐溶液,弱酸根离子水解以第一步为主。例如,硫化钠溶液中:
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。
(3)质子守恒式可以由电荷守恒式和物料守恒式推导出来。以KHS溶液为例,电荷守恒式为c(K+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)①,物料守恒式为c(K+)=c(HS-)+c(S2-)+c(H2S)②,由①-②得质子守恒式,消去没有参与变化的K+等。
(4)规避等量关系中的2个易失分点
②物料守恒式中,离子浓度系数不能漏写或颠倒。如Na2S溶液中的物料守恒式中,“2”表示c(Na+)是溶液中各种硫元素存在形式的硫原子总浓度的2倍。
3.酸、碱中和型离子浓度的关系
4.盐与酸(碱)混合型
首先考虑是否反应,都不反应,分析盐的水解程度和酸(碱)的电离程度的大小;若能反应,则按反应后混合溶液的组成综合考虑水解和电离两种因素。
5.不同溶液中同种离子浓度的大小比较
选好参照物,分组比较,各个击破。
如25 ℃时,相同物质的量浓度的下列物质的溶液中:①NH4Cl ②CH3COONH4 ③NH4HSO4 ④(NH4)2SO4 ⑤(NH4)2Fe(SO4)2,c( )由大到小的顺序为⑤>④>③>①>②。
分析流程为:
1.(2022·常州模拟)将0.2 mol·L-1 NaHCO3溶液与0.1 mol·L-1 KOH溶液等体积混合,下列关系正确的是( )
D
2.常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法正确的是( )
A.点①所示溶液中:
c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:
c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D
解析:点①溶液中的溶质为0.001 mol CH3COOH和0.001 mol CH3COONa,据物料守恒:c(CH3COO-)+c(CH3COOH)=2c(Na+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+
c(OH-),整理后得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),A项错误;点②溶液的pH=7,根据电荷守恒有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),又c(H+)=c(OH-),则c(Na+)=c(CH3COO-),B项错误;点③溶液中的溶质为0.002 mol CH3COONa,离子浓度大小关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),C项错误;当NaOH不足CH3COOH过量时,可能出现D项所述情况,故选D。
3.(2022·无锡月考)25 ℃时,下列说法正确的是( )
A.NaHA溶液呈酸性,可以推测H2A为强酸
B.可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐
C.0.010 mol·L-1、0.10 mol·L-1的醋酸溶液的电离度分别为α1、α2,则α1<α2
D.100 mL pH=10.00的Na2CO3溶液中,水电离出H+的物质的量为1×10-5 mol
D
解析:NaHA溶液呈酸性,可能是HA-的电离程度大于其水解程度,不能据此得出H2A为强酸的结论,A错误;可溶性正盐BA溶液呈中性,不能推测BA为强酸强碱盐,也可能是B+和A-的水解程度相同,即也可能是弱酸弱碱盐,B错误;弱酸的浓度越小,其电离程度越大,因此0.010 mol·L-1、0.10 mol·L-1的醋酸溶液的电离度分别为α1、α2,则α1>α2,C错误;100 mL pH=10.00的Na2CO3溶液中氢氧根离子的浓度是1×10-4 mol·L-1,碳酸根水解促进水的电离,则水电离出H+的浓度是1×10-4 mol·L-1,100 mL溶液中H+物质的量为0.1 L×1×10-4 mol·L-1=1×10-5 mol,D正确;故选D。
4.(2022·盐城三月模拟)HA是一元弱酸,难溶盐MA的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解。实验发现,298 K时c2(M+)-c(H+)为线性关系,如图中实线所示。
下列叙述错误的是( )
A.溶液pH=4时,c(M+)<3.0×10-4mol·L-1
B.MA的溶度积Ksp(MA)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
D.HA的电离常数Ka(HA)≈2.0×10-4
C
能力点2 沉淀溶解平衡
1.(2022·江苏卷,节选)硫铁化合物(FeS、FeS2等)应用广泛。
(1)纳米FeS可去除水中微量六价铬[Cr(Ⅵ)]。在pH=4~7的水溶液中,纳米FeS颗粒表面带正电荷,Cr(Ⅵ)主要以 形式存在,纳米FeS去除水中Cr(Ⅵ)主要经过“吸附→反应→沉淀”的过程。
已知:Ksp(FeS)=6.5×10-18,Ksp[Fe(OH)2]=5.0×10-17;H2S电离常数分别为Ka1=1.1×10-7、Ka2=1.3×10-13。①在弱碱性溶液中,FeS与 反应生成Fe(OH)3、Cr(OH)3和单质S,其离子方程式为 。
②在弱酸性溶液中,反应FeS+H+══Fe2++HS-的平衡常数K的数值为 。
③在pH=4~7的溶液中,pH越大,FeS去除水中Cr(Ⅵ)的速率越慢,原因是 。
2.(2021·江苏卷)室温下,用0.5 mol·L-1 Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知Ksp(CaSO4)=5×10-5,Ksp(CaCO3)=3×10-9。下列说法正确的是( )
C
核心知识1 沉淀溶解平衡图像题的解题策略
1.一般步骤
(1)溶解平衡曲线类似于溶解度曲线,曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和,此时有沉淀析出,曲线下方的任一点,均表示不饱和。
(2)从图像中找到数据,根据Ksp公式计算得出Ksp的值。
(3)比较溶液的Qc与Ksp的大小,判断溶液中有无沉淀析出。
(4)涉及Qc的计算时,所代入的离子浓度一定是混合溶液中的离子浓度,因此计算离子浓度时,所代入的溶液体积也必须是混合溶液的体积。
2.具体分析
(1)溶解平衡常数(Ksp)分析
典型示例 点的变化 a、c处在曲线上,Qc=Ksp,饱和溶液 b:Qc>Ksp,有沉淀生成 c:Ksp(BaSO4)=10-5×10-5=10-10 d:Qc
d→c 加入BaCl2固体(忽略溶液的体积变化)
c→a 曲线上变化,增大c(Ba2+)
曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液 不同曲线(T1、T2)之间变化只能通过改变温度实现 (2)沉淀溶解平衡过程分析
(3)沉淀溶解平衡直线图
例如,常温下用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的NaCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑 水解)。
核心知识2 沉淀溶解平衡的应用
1.沉淀的生成
(1)调节pH法
如除去NH4Cl溶液中的MgCl2杂质,可加入氨水调节pH至7~8,离子方程式为Mg2++2NH3·H2O══Mg(OH)2↓+2 。
(2)沉淀剂法
如用H2S沉淀Cu2+,离子方程式为H2S+Cu2+══CuS↓+2H+。
2.沉淀的溶解
(1)酸溶解法
如CaCO3溶于盐酸,离子方程式为CaCO3+2H+══Ca2++H2O+CO2↑。
(2)盐溶液溶解法
3.沉淀的转化
(1)实质:沉淀溶解平衡的移动(两种沉淀的溶解度差别越大,越容易转化)。
(2)应用:锅炉除垢、矿物转化等。
核心知识3 常考有关对数举例
1.(2022·江苏海安期末学业质量监测)室温下,通过下列实验探究NaHS溶液的性质。
实验 实验操作和现象
1 向0.1 mol·L-1 NaHS溶液中滴加几滴酚酞试剂,溶液变红
2 向0.1 mol·L-1 NaHS溶液中加入等体积0.1 mol·L-1 NaOH溶液充分混合
3 向0.1 mol·L-1 NaHS溶液中通入少量氯气,有淡黄色沉淀产生
4 向0.1 mol·L-1 NaHS溶液中加入等体积0.1 mol·L-1 HCl溶液,有气体放出
下列有关说法正确的是( )
A.实验1 0.1 mol·L-1 NaHS溶液中:c(S2-)>c(H2S)
B.实验2 所得溶液中:c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.实验3中反应的离子方程式:HS-+Cl2══S↓+H++2Cl-
D.实验4 所得溶液中:c(S2-)+c(OH-)=c(H2S)+c(H+)
C
可知NaHS溶液呈碱性,即HS-的水解程度大于其电离程度,故c(H2S)>c(S2-),A项错误;B项两溶液中的NaHS和NaOH恰好完全反应生成Na2S,据物料守恒可知c(Na+)=2[c(S2-) +c(HS-)+c(H2S)],B项错误;据C项中实验现象可知,Cl2将HS-氧化为单质硫从而产生淡黄色沉淀,其离子方程式为HS-+Cl2══S↓+H++2Cl-,C项正确;D项两溶液中的NaHS和HCl恰好完全反应生成H2S和NaCl,根据电荷守恒有:c(H+)+c(Na+)=c(HS-)+2c(S2-)+c(OH-) +c(Cl-),由于c(Na+)=c(Cl-),则c(H+)=c(HS-)+2c(S2-)+c(OH-),c(S2-)+c(OH-)=c(H2S)+c(H+)为NaHS溶液中的质子守恒,该溶液中不符合此关系,D项错误。
2.(2022·南通高三模拟)某温度下,向体积均为20.00 mL、浓度均为0.1 mol·L-1的NaCl、Na2CrO4溶液中分别滴加0.1 mol·L-1的AgNO3溶液,滴定过程中的pX(pX=-lg X,X=Cl-、
)与滴加AgNO3溶液体积关系如图所示(lg 3=0.47)。
下列说法错误的是( )
A.a=1
B.曲线Ⅰ表示NaCl溶液
C.Ksp(Ag2CrO4)=1.0×10-2b
D.M约为2c-1.47
C
3.(2022·无锡模拟)常温下,向10 mL一定浓度的硝酸银溶液中,逐滴加入0.1 mol·L-1的氨水,反应过程中-lg c(Ag+)或-lg c[ ]与加入氨水体积的关系如图所示。下列说法正确的是( )
A.原硝酸银溶液的浓度是0.05 mol·L-1
B.反应生成氢氧化银的Ksp(AgOH)的数量级为10-4
D
1.(2022·江苏苏、锡、常、镇四市下学期调研)常温下,通过下列实验探究H2S、Na2S溶液的性质。
实验1:向0.1 mol·L-1 H2S溶液中通入一定体积的NH3,测得溶液pH为7。
实验2:向0.1 mol·L-1 H2S溶液中滴加等体积同浓度的NaOH溶液,充分反应后再滴入2滴酚酞,溶液呈红色。
实验3:向5 mL 0.1 mol·L-1 Na2S溶液中滴入1 mL 0.1 mol·L-1 ZnSO4溶液,产生白色沉淀;再滴入几滴0.1 mol·L-1 CuSO4溶液,立即出现黑色沉淀。
实验4:向0.1 mol·L-1 Na2S溶液中逐滴滴加等体积同浓度的盐酸,无明显现象。
下列说法正确的是( )
B.由实验2可得出:Kw
D.实验4得到的溶液中存在c(H+)-c(OH-)=c(S2-)-c(H2S)
D
项错误;实验3中硫化钠溶液与硫酸锌溶液反应时,硫化钠溶液过量,再加入硫酸铜溶液时,只有硫化铜沉淀的生成反应,没有硫化锌转化为硫化铜沉淀的反应发生,无法比较硫化锌和硫化铜溶度积的大小,C项错误;实验4得到的溶液为等物质的量浓度的硫氢化钠和氯化钠的混合溶液,溶液中存在质子守恒关系c(H+)+c(H2S)=c(S2-)+c(OH-),则溶液中存在c(H+)-c(OH-)=c(S2-)-c(H2S),D项正确。
2.用0.10 mol·L-1 NaOH溶液滴定20.0 mL 0.10 mol·L-1 H2A溶液,溶液pH和温度随
的变化曲线如图所示。下列说法正确的( )
A.从W至Z点,水的电离程度逐渐增大,Kw不变
C.27 ℃,H2A的电离常数Ka2=10-9.7
D.Y点为第二反应终点
C
3.化学中常用AG表示溶液的酸度 。室温下,向20.00 mL 0.100 0 mol·
L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加入稀硫酸体积的变化如图所示。下列说法正确的是( )
A.b、c、d三点对应的溶液中,水的电离程度大小为b=d>c
B.b点对应的溶液中:c(M+)-c(MOH)=2c(OH-)-2c(H+)
C.当AG=0时,溶液中存在c( )>c(M+)>c(H+)=c(OH-)
D.室温下M+的水解常数Kh=10×10-5
B
解析:c点为酸碱恰好完全反应的点,生成了强酸弱碱盐,促进了水解,从c点以后,硫酸过量,酸抑制水的电离,硫酸属于强酸,对水的电离平衡抑制程度较大,因此水的电离程度:c>b>d,A项说法错误;b点,MOH和M2SO4比为2∶1,根据电荷守恒,
4.已知:pKa=-lg Ka,25 ℃时,H2A的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 H2A溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法正确的是
( )
A.a点所得溶液中:2c(HA-)+c(A2-)=0.1 mol·L-1
B.c点所得溶液中:c(Na+)>3c(HA-)
C.当溶液的pH为7时,此时加入的NaOH溶液
体积为30 mL
D.随着NaOH溶液滴入,水的电离程度一直增大
B
随着NaOH溶液的滴入,依次发生反应H2A+OH-══HA-+H2O、HA-+OH-══A2-+H2O,水的电离程度逐渐增大,当恰好反应生成Na2A时,水的电离程度最大,继续滴入NaOH溶液,水的电离程度逐渐减小,D错误;故选B。
5.一定温度下,难溶电解质在水中存在沉淀溶解和生成的平衡,常用溶度积Ksp来表示溶解程度的大小,如Ksp(AgCl)=c(Ag+)·c(Cl-)。常温下用0.100 0 mol·L-1的AgNO3标准溶液(pH≈5)分别滴定20.00 mL 0.100 0 mol·L-1的NaCl溶液和NaBr溶液,混合溶液的pAg[定义为pAg=-lg c(Ag+)]与AgNO3溶液体积的变化关系如图所示。下列说法不正确的是( )
A.Ksp(AgCl)>Ksp(AgBr)
B.当V(AgNO3溶液)=20 mL时,NaBr溶液中:
c(Ag+)+c(H+)=c(Br-)+c(OH-)
C.当V(AgNO3溶液)=30 mL时,NaCl溶液中:
D.相同实验条件下,若改用
10.00 mL 0.200 0 mol·L-1 NaCl溶液,
则滴定曲线(滴定终点前)可能变为a
C
解析:由题图可知,当未加入AgNO3溶液时,溶液中Ag+的浓度即为AgCl、AgBr分别在0.1 mol·L-1的NaCl、NaBr溶液中的Ag+浓度,故有Ksp(AgCl)=c(Ag+)·c(Cl-)=10-9×0.1≈10-10, Ksp(AgBr)=c(Ag+)·c(Br-)=10-12×0.1≈10-13,故有Ksp(AgCl)>Ksp(AgBr),A正确;当V(AgNO3溶液)=20 mL时,即AgNO3与NaBr恰好完全反应,根据溶液中电荷守恒可知,NaBr溶液中:c(Ag+)+c(H+)=c(Br-)+c(OH-),B正确;当V(AgNO3溶液)=30 mL时,溶液为NaNO3、AgNO3和AgCl的混合体系,由题图可知,此时c(Ag+)≈10-1.5 mol·L-1,
同课章节目录
