第一节 酸及其性质 课件 34张幻灯片
图片预览









文档简介
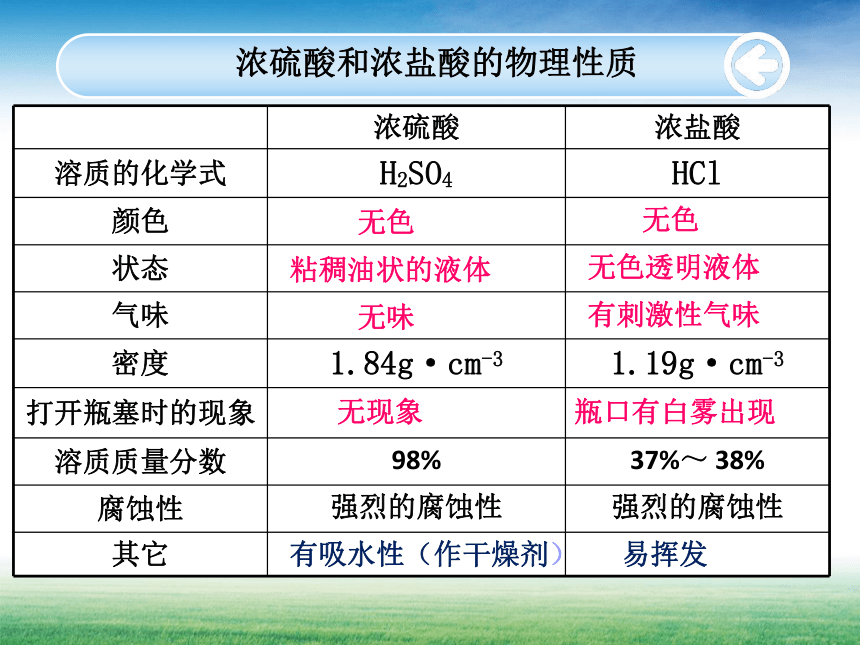
课件34张PPT。第七单元 常见的酸和碱 第一节 酸及其性质酸 (第一课时)被浓硫酸腐蚀的路面和灼伤的黑熊你知道的酸有哪些?H2CO3HClCH3COOHH2SO4探究浓硫酸和浓盐酸的物理性质 观察浓硫酸和浓盐酸的状态、颜色,质量分数等,打开瓶塞,观察发生的现象;闻一闻是否有气味?注意:闻气体的方法活动天地7-1浓硫酸和浓盐酸的物理性质无色无色无色透明液体粘稠油状的液体有刺激性气味瓶口有白雾出现无现象 无味易挥发有吸水性(作干燥剂)浓硫酸的稀释1.浓硫酸的稀释方法:
稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢注入水里,并不断搅拌。切不可将水倒进浓硫酸里!
2.浓硫酸稀释时会放出大量的热。
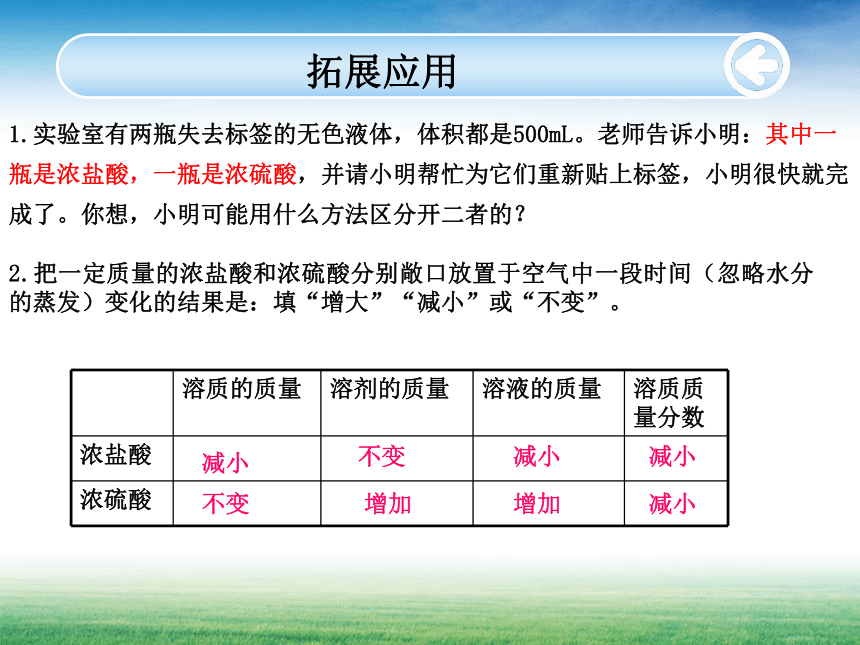
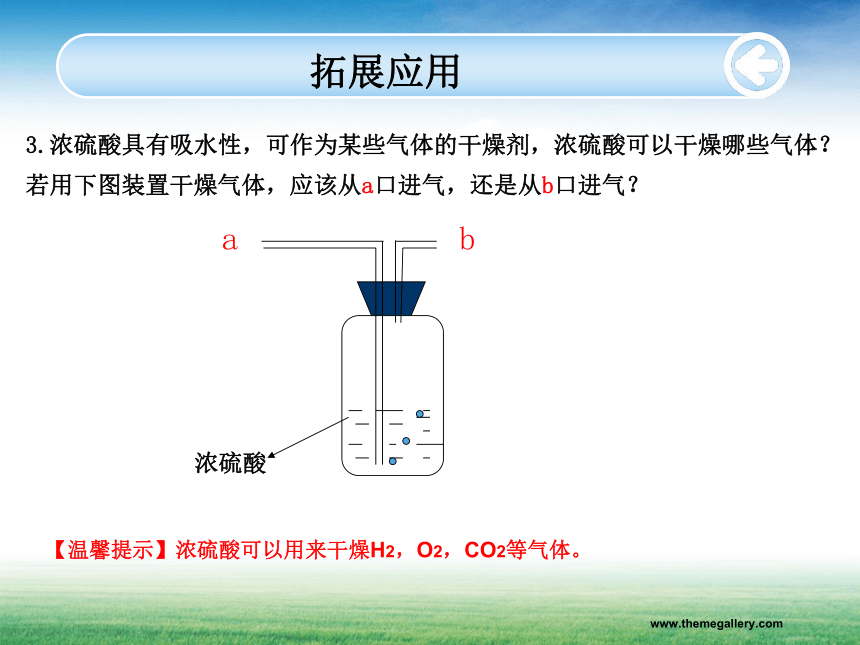
www.themegallery.com安全提示3.浓硫酸溅到皮肤上的处理方法:应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液1.实验室有两瓶失去标签的无色液体,体积都是500mL。老师告诉小明:其中一瓶是浓盐酸,一瓶是浓硫酸,并请小明帮忙为它们重新贴上标签,小明很快就完成了。你想,小明可能用什么方法区分开二者的?拓展应用2.把一定质量的浓盐酸和浓硫酸分别敞口放置于空气中一段时间(忽略水分的蒸发)变化的结果是:填“增大”“减小”或“不变”。减小不变不变增加减小增加减小减小www.themegallery.com拓展应用3.浓硫酸具有吸水性,可作为某些气体的干燥剂,浓硫酸可以干燥哪些气体?
若用下图装置干燥气体,应该从a口进气,还是从b口进气? 浓硫酸 ab【温馨提示】浓硫酸可以用来干燥H2,O2,CO2等气体。www.themegallery.com课堂总结1.浓盐酸的特性:2.浓硫酸的特性:有刺激性气味,易挥发,强烈的腐蚀性粘稠,油状的液体,吸水性和强烈的腐蚀性,脱水性当堂检测1.下列给出的化合物中,属于酸的是( )
A.NaHCO3 B.H2S
C.Fe(OH)3 D.MgSO4www.themegallery.comB当堂检测2.某研究性学习小组将溶质
质量分数不同的两瓶酸溶液,
在实验室中敞口放置,
得它们的质量与放置天数的
关系如右图所示,则a、b分别代表( )
A.浓盐酸、稀盐酸 B.稀盐酸、浓盐酸
C.浓硫酸、稀硫酸 D.浓盐酸、浓硫酸
www.themegallery.comD当堂检测3.下列说法不正确的是( )
A.浓硫酸是一种无色有刺激性气味的液体
B.浓硫酸有吸水性,在实验中常用它做干燥剂
C.浓硫酸具有强烈的腐蚀性,能是木材,纸张变黑
D.浓硫酸溶于水时放出大量的热
www.themegallery.comA当堂检测4.将浓盐酸敞口放置在空气中,它的质量会___(填“变大”“变小”或“不变”,下同),溶质质量分数会___;将浓硫酸敞口放置在空气中,它的质量会___,溶质质量分数会___;因此,浓盐酸和浓硫酸都要___保存。www.themegallery.com变小变小增大变小密封作业www.themegallery.com1.综合能力训练第一课时。
2.填写第二课时学习指导。谢谢指导 第一节 酸及其性质第七单元 常见的酸和碱酸 (第二课时)H+HCl = H+ + Cl- H2SO4 = 2H+ + SO42- 酸紫色石蕊试液变红无色酚酞试液不变色镁条溶解,有大量
气泡生成。Mg+2HCl=MgCl2+H2↑ 【实验探究7-1】盐酸能与哪些物质发生化学反应铁锈溶解,溶液变为
黄色。Fe2O3+6HCl=2FeCl3+3H2O有气泡生成,溶液慢慢
变为浅绿色。Fe+2HCl=FeCl2+H2↑ Na2CO3+2HCl=2NaCl+CO2↑+H2OAgNO3+HCl=AgCl↓+HNO3无明显现象问题探究提出问题:盐酸能够使紫色石蕊试液变红,是什么离子使石蕊变色的呢?H+,Cl-,还是H2O。请自己设计实验。
www.themegallery.com结论:物质与盐酸发生的反应,其实都是物质与盐酸电离出的氢离子发生的反应。
酸的性质实际上是氢离子的性质。 【活动天地7-2】若用稀硫酸代替稀盐酸与镁条、碳酸钠粉末和生锈的铁钉等物质反应,你会观察到哪些现象?
1.请你试着写出有关反应的化学方程式。HCl + AgNO3 = AgCl↓ + HNO3观察下列化学方程式,你发现它们有何特点?A + CAB+CDBD化合物化合物 两种化合物互相交换成分,生成另外两种化合物,这样的反应就叫做复分解反应。考考你复分解反应下列化学反应是复分解反应吗?1.Fe+2HCl=FeCl2+H2↑ 2.Fe2O3+6HCl=2FeCl3+3H2O3.CaCO3+2HCl=CaCl2+CO2↑+H2O4.Ca(OH)2+CO2 =CaCO3↓+H2OH2CO3 像NaCl、FeCl3、KNO3、Na2CO3、CaCO3、Na2SO4等由金属离子和酸根离子组成的化合物称为盐。
HCl=H+ + Cl-H2SO4=2H+ + SO42-HNO3=H+ + NO3-硫酸根 像NH4Cl﹑ (NH4)2SO4等由铵根离子(NH4+)和酸根离子组成的化合物 ,也是盐。硝酸根盐酸根H2CO3=2H+ + CO32-碳酸根1.课本选取镁、铁、生锈铁钉、碳酸钠、硝酸银和氯化钡溶液来进行酸的性质探究对比,每一种具体物质背后代表的是哪类物质?2.通过探究,你能归纳出酸类物质的共性吗?归纳小结1.酸溶液能使紫色石蕊试液变红,不能使无色酚酞试液变色。2.酸+金属Fe+2HCl=FeCl2+H2↑
Mg+2HCl=MgCl2+H2↑3.酸+金属氧化物Fe2O3+6HCl=2FeCl3+3H2O4.酸+盐CaCO3+2HCl=CaCl2+CO2↑+H2O盐+氢气盐+水新盐+新酸Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑Fe2O3+3H2SO4=Fe2(SO4)3+3H2ONa2CO3+H2SO4=Na2SO4+CO2↑+H2O酸 的 通 性AgNO3+HCl=AgCl↓+HNO3BaCl2+H2SO4=BaSO4↓+2HCl为什么酸具有相似的化学性质呢? HCl = H+ + Cl-
H2SO4 = 2H+ + SO42- 注意:不同的酸溶于水时解离出的酸根阴离子不同,其性质也存在差异。BaCl2+H2SO4=BaSO4↓+2HCl拓展应用日常生活中白醋通常盛放在哪种容器中?能不能用铁桶盛放?为什么。
通过以上探究你认为酸有哪些用途?
www.themegallery.com铁与白醋会发生化学反应作除锈剂等1.(2013·青岛)稀盐酸与稀硫酸具有相似的化学性质,其本质原因是( )
A.都能与指示剂作用 B.都能解离出酸根离子
C.都能解离出氢离子 D.都含有氢元素 C当堂检测2.(2013·广东)盐酸先生闯迷宫(如图),请你帮他选择行进路线(不发生化学反应)( )
B 当堂检测3.(2013·湛江)化学使世界变得绚丽多彩,下图是物质之间发生化学反应的颜色变化。
当堂检测(1)请你在编号处各填入一种物质。
②是____________,③是____________。
(2)根据上图可以总结出稀硫酸的五个化学性质。请你写出编号 ①稀硫酸的化学性质________________________________________________________ 铁(Fe)氧化铜(CuO)稀硫酸能使紫色石蕊试液变红 (3)若编号④的物质是盐,请你写出符合编号④的一个化学方 程式______________________________, 反应类型___________。 H2SO4+BaCl2==BaSO4↓+2HCl复分解反应当堂检测作业www.themegallery.com1.综合能力训练第二课时。
2.复习本节课内容。谢谢指导
稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢注入水里,并不断搅拌。切不可将水倒进浓硫酸里!
2.浓硫酸稀释时会放出大量的热。
www.themegallery.com安全提示3.浓硫酸溅到皮肤上的处理方法:应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液1.实验室有两瓶失去标签的无色液体,体积都是500mL。老师告诉小明:其中一瓶是浓盐酸,一瓶是浓硫酸,并请小明帮忙为它们重新贴上标签,小明很快就完成了。你想,小明可能用什么方法区分开二者的?拓展应用2.把一定质量的浓盐酸和浓硫酸分别敞口放置于空气中一段时间(忽略水分的蒸发)变化的结果是:填“增大”“减小”或“不变”。减小不变不变增加减小增加减小减小www.themegallery.com拓展应用3.浓硫酸具有吸水性,可作为某些气体的干燥剂,浓硫酸可以干燥哪些气体?
若用下图装置干燥气体,应该从a口进气,还是从b口进气? 浓硫酸 ab【温馨提示】浓硫酸可以用来干燥H2,O2,CO2等气体。www.themegallery.com课堂总结1.浓盐酸的特性:2.浓硫酸的特性:有刺激性气味,易挥发,强烈的腐蚀性粘稠,油状的液体,吸水性和强烈的腐蚀性,脱水性当堂检测1.下列给出的化合物中,属于酸的是( )
A.NaHCO3 B.H2S
C.Fe(OH)3 D.MgSO4www.themegallery.comB当堂检测2.某研究性学习小组将溶质
质量分数不同的两瓶酸溶液,
在实验室中敞口放置,
得它们的质量与放置天数的
关系如右图所示,则a、b分别代表( )
A.浓盐酸、稀盐酸 B.稀盐酸、浓盐酸
C.浓硫酸、稀硫酸 D.浓盐酸、浓硫酸
www.themegallery.comD当堂检测3.下列说法不正确的是( )
A.浓硫酸是一种无色有刺激性气味的液体
B.浓硫酸有吸水性,在实验中常用它做干燥剂
C.浓硫酸具有强烈的腐蚀性,能是木材,纸张变黑
D.浓硫酸溶于水时放出大量的热
www.themegallery.comA当堂检测4.将浓盐酸敞口放置在空气中,它的质量会___(填“变大”“变小”或“不变”,下同),溶质质量分数会___;将浓硫酸敞口放置在空气中,它的质量会___,溶质质量分数会___;因此,浓盐酸和浓硫酸都要___保存。www.themegallery.com变小变小增大变小密封作业www.themegallery.com1.综合能力训练第一课时。
2.填写第二课时学习指导。谢谢指导 第一节 酸及其性质第七单元 常见的酸和碱酸 (第二课时)H+HCl = H+ + Cl- H2SO4 = 2H+ + SO42- 酸紫色石蕊试液变红无色酚酞试液不变色镁条溶解,有大量
气泡生成。Mg+2HCl=MgCl2+H2↑ 【实验探究7-1】盐酸能与哪些物质发生化学反应铁锈溶解,溶液变为
黄色。Fe2O3+6HCl=2FeCl3+3H2O有气泡生成,溶液慢慢
变为浅绿色。Fe+2HCl=FeCl2+H2↑ Na2CO3+2HCl=2NaCl+CO2↑+H2OAgNO3+HCl=AgCl↓+HNO3无明显现象问题探究提出问题:盐酸能够使紫色石蕊试液变红,是什么离子使石蕊变色的呢?H+,Cl-,还是H2O。请自己设计实验。
www.themegallery.com结论:物质与盐酸发生的反应,其实都是物质与盐酸电离出的氢离子发生的反应。
酸的性质实际上是氢离子的性质。 【活动天地7-2】若用稀硫酸代替稀盐酸与镁条、碳酸钠粉末和生锈的铁钉等物质反应,你会观察到哪些现象?
1.请你试着写出有关反应的化学方程式。HCl + AgNO3 = AgCl↓ + HNO3观察下列化学方程式,你发现它们有何特点?A + CAB+CDBD化合物化合物 两种化合物互相交换成分,生成另外两种化合物,这样的反应就叫做复分解反应。考考你复分解反应下列化学反应是复分解反应吗?1.Fe+2HCl=FeCl2+H2↑ 2.Fe2O3+6HCl=2FeCl3+3H2O3.CaCO3+2HCl=CaCl2+CO2↑+H2O4.Ca(OH)2+CO2 =CaCO3↓+H2OH2CO3 像NaCl、FeCl3、KNO3、Na2CO3、CaCO3、Na2SO4等由金属离子和酸根离子组成的化合物称为盐。
HCl=H+ + Cl-H2SO4=2H+ + SO42-HNO3=H+ + NO3-硫酸根 像NH4Cl﹑ (NH4)2SO4等由铵根离子(NH4+)和酸根离子组成的化合物 ,也是盐。硝酸根盐酸根H2CO3=2H+ + CO32-碳酸根1.课本选取镁、铁、生锈铁钉、碳酸钠、硝酸银和氯化钡溶液来进行酸的性质探究对比,每一种具体物质背后代表的是哪类物质?2.通过探究,你能归纳出酸类物质的共性吗?归纳小结1.酸溶液能使紫色石蕊试液变红,不能使无色酚酞试液变色。2.酸+金属Fe+2HCl=FeCl2+H2↑
Mg+2HCl=MgCl2+H2↑3.酸+金属氧化物Fe2O3+6HCl=2FeCl3+3H2O4.酸+盐CaCO3+2HCl=CaCl2+CO2↑+H2O盐+氢气盐+水新盐+新酸Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑Fe2O3+3H2SO4=Fe2(SO4)3+3H2ONa2CO3+H2SO4=Na2SO4+CO2↑+H2O酸 的 通 性AgNO3+HCl=AgCl↓+HNO3BaCl2+H2SO4=BaSO4↓+2HCl为什么酸具有相似的化学性质呢? HCl = H+ + Cl-
H2SO4 = 2H+ + SO42- 注意:不同的酸溶于水时解离出的酸根阴离子不同,其性质也存在差异。BaCl2+H2SO4=BaSO4↓+2HCl拓展应用日常生活中白醋通常盛放在哪种容器中?能不能用铁桶盛放?为什么。
通过以上探究你认为酸有哪些用途?
www.themegallery.com铁与白醋会发生化学反应作除锈剂等1.(2013·青岛)稀盐酸与稀硫酸具有相似的化学性质,其本质原因是( )
A.都能与指示剂作用 B.都能解离出酸根离子
C.都能解离出氢离子 D.都含有氢元素 C当堂检测2.(2013·广东)盐酸先生闯迷宫(如图),请你帮他选择行进路线(不发生化学反应)( )
B 当堂检测3.(2013·湛江)化学使世界变得绚丽多彩,下图是物质之间发生化学反应的颜色变化。
当堂检测(1)请你在编号处各填入一种物质。
②是____________,③是____________。
(2)根据上图可以总结出稀硫酸的五个化学性质。请你写出编号 ①稀硫酸的化学性质________________________________________________________ 铁(Fe)氧化铜(CuO)稀硫酸能使紫色石蕊试液变红 (3)若编号④的物质是盐,请你写出符合编号④的一个化学方 程式______________________________, 反应类型___________。 H2SO4+BaCl2==BaSO4↓+2HCl复分解反应当堂检测作业www.themegallery.com1.综合能力训练第二课时。
2.复习本节课内容。谢谢指导
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
