鲁教版(五四制)九年级教学课件:3.3 海水“制碱”(共13张PPT)
文档属性
| 名称 | 鲁教版(五四制)九年级教学课件:3.3 海水“制碱”(共13张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 860.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-21 14:31:01 | ||
图片预览



文档简介
(共13张PPT)
第三单元 海水中的化学
第三节 海水“制碱”
造纸原料
制洗涤剂、洗衣粉
用于印染工业
碳酸钠有很多工业用途,工业上怎样制取碳酸钠呢?
制玻璃、瓷砖原料
碳酸钠(俗称:纯碱、苏打Na2CO3),白色晶体、风化成粉末;易溶于水,水溶液呈碱性。
一、课程导入
你知道吗?
20世纪初,中国所需纯碱全部依赖进口。
我国有一位专家在1926年采用先进的技术生产出纯碱,打破了西方国家对制碱技术半个多世纪的垄断。
这个人就是为世界制碱工业做出贡献的侯德榜。我们沿着科学家的足迹重温利用海水“制碱”。
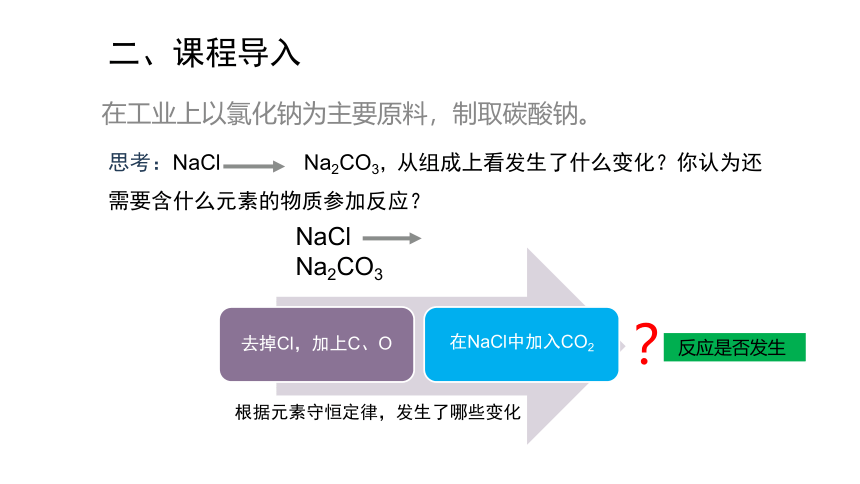
在工业上以氯化钠为主要原料,制取碳酸钠。
NaCl Na2CO3
根据元素守恒定律,发生了哪些变化
去掉Cl,加上C、O
在NaCl中加入CO2
思考:NaCl Na2CO3,从组成上看发生了什么变化?你认为还需要含什么元素的物质参加反应?
二、课程导入
反应是否发生
?
饱和食盐水
氨盐水
通CO2
过滤、洗涤
沉淀:NaHCO3
滤液:NH4Cl 、NaCl
煅烧
Na2CO3 产品
CO2
(循环使用)
加Ca(OH)2
NH3
CaCl2和NaCl
通
NH3
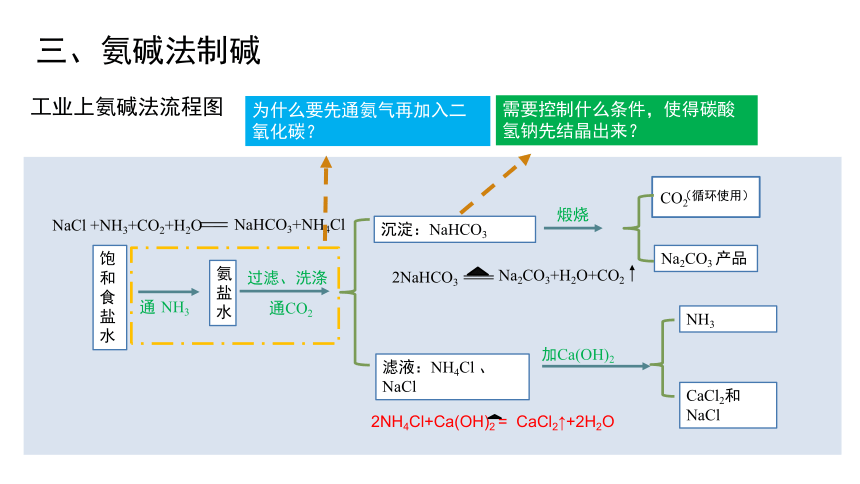
NaCl +NH3+CO2+H2O
NaHCO3+NH4Cl
2NaHCO3
Na2CO3+H2O+CO2
工业上氨碱法流程图
为什么要先通氨气再加入二氧化碳?
需要控制什么条件,使得碳酸氢钠先结晶出来?
2NH4Cl+Ca(OH)2 = CaCl2↑+2H2O
三、氨碱法制碱
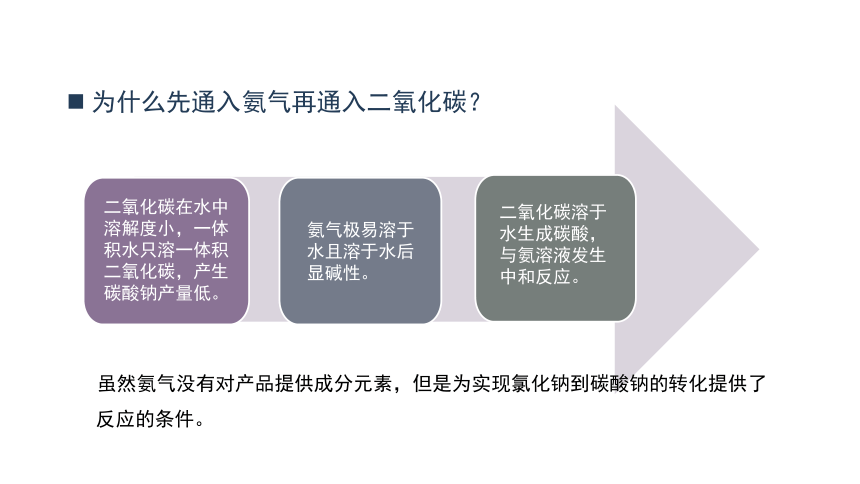
为什么先通入氨气再通入二氧化碳?
二氧化碳在水中溶解度小,一体积水只溶一体积二氧化碳,产生碳酸钠产量低。
氨气极易溶于水且溶于水后显碱性。
二氧化碳溶于水生成碳酸,与氨溶液发生中和反应。
虽然氨气没有对产品提供成分元素,但是为实现氯化钠到碳酸钠的转化提供了
反应的条件。
氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先析出?为什么?
NaHCO3先析出
在同一温度下NaHCO3溶解度小
你还能提出什么问题?
为什么石灰石是“制碱”的原料?
石灰石煅烧产生的二氧化碳作为氧源和碳源。
你打算怎样处理最后生成的二氧化碳?
氨碱法制碱有什么缺点?
循环使用
回收时产生的大量CaCl2用处不大,且污染环境
2NH4Cl+Ca(OH)2 = CaCl2↑+2H2O
侯氏制碱法在氨碱法的基础上,创立了更为先进的联合制碱法,即向滤出NaHCO3晶体后的氯化铵溶液中加入食盐,使其中的NH4Cl单独结晶析出,用作氮肥,NaCl溶液可循环使用。
饱和食盐水
氨盐水
合成氨工厂
NH3
CO2
通CO2
过滤、洗涤
沉淀:NaHCO3
滤液:NH4Cl 、NaCl
热解
Na2CO3 产品
CO2
(循环使用)
加NaCl,通NH3
冷却、过滤、洗涤、干燥
NH4Cl产品
饱和食盐水(循环使用)
通
NH3
NaCl +NH3+CO2+H2O
NaHCO3+NH4Cl
2NaHCO3
Na2CO3+H2O+CO2
四、侯氏制碱法制碱
比较侯氏制碱法和氨碱法,说说侯氏制碱法的优点。
氨碱法制碱
侯氏制碱法制碱
五、比较侯氏制碱法和氨碱法
氨碱法制碱有利有弊:
优点:原料经济易得,二氧化碳和氨气可回收利用,能连续生产。
缺点:缺点是回收氨时产生的大量氯化钙用处不大,且污染环境。
氨碱法和侯氏制碱法比较
侯氏制碱法扬长避短:
侯氏制碱法在氨碱法的基础上创了更为先进的联合制碱法,即向滤出的碳酸氢钠晶体后的氯化铵溶液中加入食盐,使其中的氯化铵单独结晶析出,用作氮肥,氯化钠溶液则可循环使用。
六、小结
课程总结
本节课的重点:氨碱法制碱的原料及原理
氨碱法制碱的原料: 饱和食盐水、氨气、二氧化碳
氨碱法制碱的优缺点:原料经济易得,缺点是回收氨时产生大量的氯化钙用处不大且污染环境。
侯氏制碱法: 在氨碱法基础上改进,保留氨碱法优点,克服缺点。
再见
第三单元 海水中的化学
第三节 海水“制碱”
造纸原料
制洗涤剂、洗衣粉
用于印染工业
碳酸钠有很多工业用途,工业上怎样制取碳酸钠呢?
制玻璃、瓷砖原料
碳酸钠(俗称:纯碱、苏打Na2CO3),白色晶体、风化成粉末;易溶于水,水溶液呈碱性。
一、课程导入
你知道吗?
20世纪初,中国所需纯碱全部依赖进口。
我国有一位专家在1926年采用先进的技术生产出纯碱,打破了西方国家对制碱技术半个多世纪的垄断。
这个人就是为世界制碱工业做出贡献的侯德榜。我们沿着科学家的足迹重温利用海水“制碱”。
在工业上以氯化钠为主要原料,制取碳酸钠。
NaCl Na2CO3
根据元素守恒定律,发生了哪些变化
去掉Cl,加上C、O
在NaCl中加入CO2
思考:NaCl Na2CO3,从组成上看发生了什么变化?你认为还需要含什么元素的物质参加反应?
二、课程导入
反应是否发生
?
饱和食盐水
氨盐水
通CO2
过滤、洗涤
沉淀:NaHCO3
滤液:NH4Cl 、NaCl
煅烧
Na2CO3 产品
CO2
(循环使用)
加Ca(OH)2
NH3
CaCl2和NaCl
通
NH3
NaCl +NH3+CO2+H2O
NaHCO3+NH4Cl
2NaHCO3
Na2CO3+H2O+CO2
工业上氨碱法流程图
为什么要先通氨气再加入二氧化碳?
需要控制什么条件,使得碳酸氢钠先结晶出来?
2NH4Cl+Ca(OH)2 = CaCl2↑+2H2O
三、氨碱法制碱
为什么先通入氨气再通入二氧化碳?
二氧化碳在水中溶解度小,一体积水只溶一体积二氧化碳,产生碳酸钠产量低。
氨气极易溶于水且溶于水后显碱性。
二氧化碳溶于水生成碳酸,与氨溶液发生中和反应。
虽然氨气没有对产品提供成分元素,但是为实现氯化钠到碳酸钠的转化提供了
反应的条件。
氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先析出?为什么?
NaHCO3先析出
在同一温度下NaHCO3溶解度小
你还能提出什么问题?
为什么石灰石是“制碱”的原料?
石灰石煅烧产生的二氧化碳作为氧源和碳源。
你打算怎样处理最后生成的二氧化碳?
氨碱法制碱有什么缺点?
循环使用
回收时产生的大量CaCl2用处不大,且污染环境
2NH4Cl+Ca(OH)2 = CaCl2↑+2H2O
侯氏制碱法在氨碱法的基础上,创立了更为先进的联合制碱法,即向滤出NaHCO3晶体后的氯化铵溶液中加入食盐,使其中的NH4Cl单独结晶析出,用作氮肥,NaCl溶液可循环使用。
饱和食盐水
氨盐水
合成氨工厂
NH3
CO2
通CO2
过滤、洗涤
沉淀:NaHCO3
滤液:NH4Cl 、NaCl
热解
Na2CO3 产品
CO2
(循环使用)
加NaCl,通NH3
冷却、过滤、洗涤、干燥
NH4Cl产品
饱和食盐水(循环使用)
通
NH3
NaCl +NH3+CO2+H2O
NaHCO3+NH4Cl
2NaHCO3
Na2CO3+H2O+CO2
四、侯氏制碱法制碱
比较侯氏制碱法和氨碱法,说说侯氏制碱法的优点。
氨碱法制碱
侯氏制碱法制碱
五、比较侯氏制碱法和氨碱法
氨碱法制碱有利有弊:
优点:原料经济易得,二氧化碳和氨气可回收利用,能连续生产。
缺点:缺点是回收氨时产生的大量氯化钙用处不大,且污染环境。
氨碱法和侯氏制碱法比较
侯氏制碱法扬长避短:
侯氏制碱法在氨碱法的基础上创了更为先进的联合制碱法,即向滤出的碳酸氢钠晶体后的氯化铵溶液中加入食盐,使其中的氯化铵单独结晶析出,用作氮肥,氯化钠溶液则可循环使用。
六、小结
课程总结
本节课的重点:氨碱法制碱的原料及原理
氨碱法制碱的原料: 饱和食盐水、氨气、二氧化碳
氨碱法制碱的优缺点:原料经济易得,缺点是回收氨时产生大量的氯化钙用处不大且污染环境。
侯氏制碱法: 在氨碱法基础上改进,保留氨碱法优点,克服缺点。
再见
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
