4.2配合物的形成和应用 第2课时 课件(共22张PPT) 高中化学苏教版(2019)选择性必修2
文档属性
| 名称 | 4.2配合物的形成和应用 第2课时 课件(共22张PPT) 高中化学苏教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-21 20:43:51 | ||
图片预览






文档简介
(共22张PPT)
4.2配合物的形成和应用
第二课时
一、配合物的形成对性质的影响
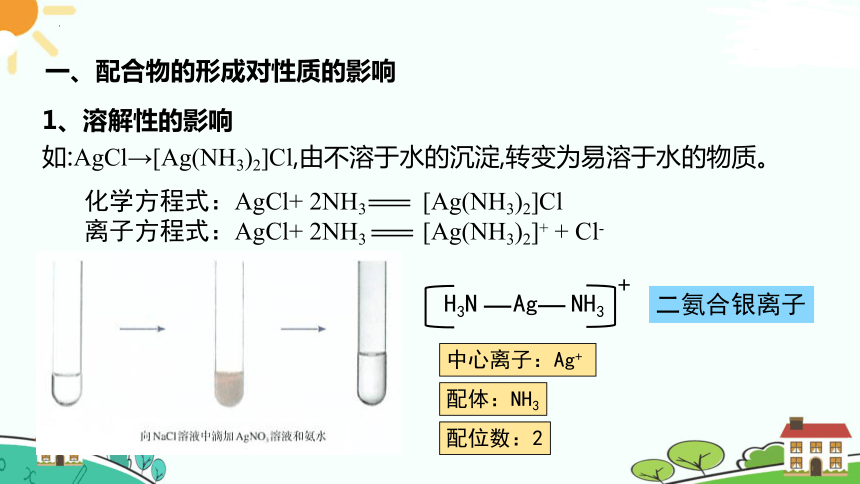
1、溶解性的影响
如:AgCl→[Ag(NH3)2]Cl,由不溶于水的沉淀,转变为易溶于水的物质。
化学方程式:AgCl+ 2NH3 [Ag(NH3)2]Cl
离子方程式:AgCl+ 2NH3 [Ag(NH3)2]+ + Cl-
Ag
NH3
H3N
+
二氨合银离子
配体:NH3
中心离子:Ag+
配位数:2
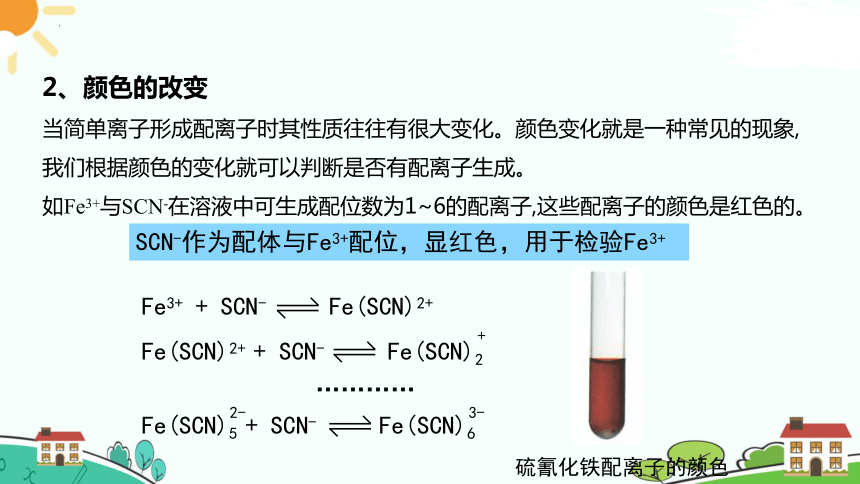
2、颜色的改变
当简单离子形成配离子时其性质往往有很大变化。颜色变化就是一种常见的现象,我们根据颜色的变化就可以判断是否有配离子生成。
如Fe3+与SCN-在溶液中可生成配位数为1~6的配离子,这些配离子的颜色是红色的。
Fe3+ + SCN- Fe(SCN)2+
Fe(SCN)2+ + SCN- Fe(SCN)2
Fe(SCN)5 + SCN- Fe(SCN)6
…………
SCN-作为配体与Fe3+配位,显红色,用于检验Fe3+
硫氰化铁配离子的颜色
2-
3-
+
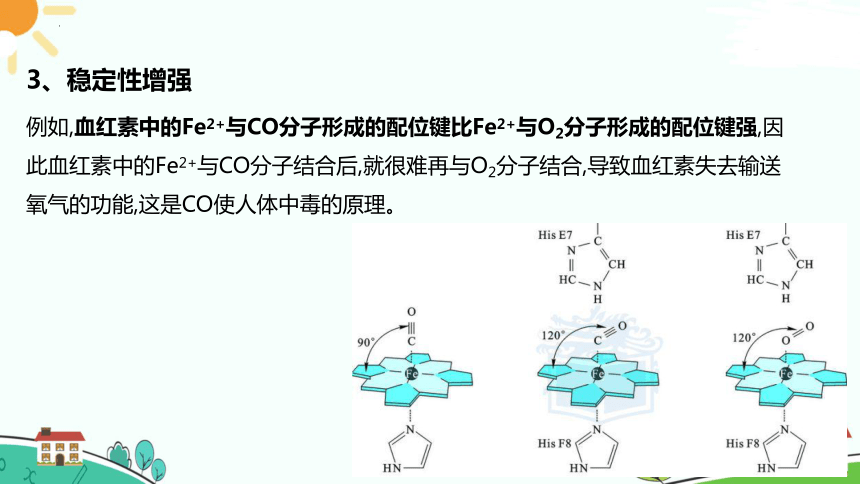
3、稳定性增强
例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,导致血红素失去输送氧气的功能,这是CO使人体中毒的原理。
思考:[Cu(H2O)4]2+和[Cu(NH3)4]2+哪个配位离子更稳定?
原因是什么?
[Cu(NH3)4]2+更稳定。
因为N和O都有孤电子对,但O电负性大,吸引孤电子对的能力强,
故NH3提供孤电子对的能力比H2O大。
思考:NH3与Cu2+形成配合物,但NF3很难与Cu2+形成配合物,
原因是什么?
电负性:F > N ,使得NH3 提供孤电子对的能力大于NF3。
配合键的稳定性
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当中心离子相同时,配合物的稳定性与配体的性质有关。
电子对给予体形成配位键的能力:NH3 > H2O
接受体形成配位键的能力:H+ > 过渡金属> 主族金属
配位键越强,配合物越稳定:
Cu2+——OH- < Cu2+——NH3 < H+——NH3
“
“
二、配合物的应用
配合物在许多方面有着广泛的应用。
在化学分析中,人们常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成。
检验Fe3+的试剂
KSCN溶液
检验醛基的试剂
银氨溶液
在生产中,配合物被广泛应用于染色、电镀、硬水软化、金属冶炼领域。
例如,夹心配位化合物二茂铁具有高度的热稳定性,常被用作燃料的催化剂和抗爆剂,它的节能消烟效果也非常好。
配位化合物在羊毛染色过程中的作用
为了使羊毛呈现不同的色彩,同时在洗涤和光照的条件下不易褪色,我们可以在染色过程中,使用金属盐(如铬、铝、铁、铜盐等)对其进行处理。因羊毛和染料中都含有可与金属离子配位的基团(—NH2、—COOH),染色时,金属离子和染料及羊毛之间发生反应,生成体积较大、溶解度小的配合物,使染料坚固地附着在纤维上,从而改变羊毛的颜色。
在生命科学、抗癌药物、催化剂研制、激光材料、超导材料等许多尖端研究领域中,配合物发挥的作用也越来越大。
配合物在生命体中有着非常重要的作用。
许多酶的作用与其结构中含有形成配位键的金属离子有关。
生物体中能量的转换、传递或电荷转移,化学键的形成或断裂以及伴随这些过程出现的能量变化和分配等,常与金属离子和有机体生成的复杂配合物所起的作用有关。
以Mg2+为中心的大环配合物叶绿素能催化光合作用,将太阳能转换成化学能。
叶绿素的结构示意图
血红素的结构示意图
能输送O2的血红素是Fe2+的卟啉配合物,铁在血红蛋白、肌红蛋白和细胞色素分子中都以Fe2+与原卟啉环形成配合物的形式存在。
生物体内的许多酶都包含锌的配合物,已报道的含锌酶有80多种,如羧肽酶A和碳酸酶等。当人体缺锌时,许多酶的活性降低,引起相关代谢紊乱,可使人体发育和生长受阻。
配位化合物在生命体中扮演着十分重要的角色,而金属中毒的一个重要原因就是高浓度的外来金属离子取代了生物分子中的已有金属元素,生成了较为稳定的配位化合物,如Be2+取代激活酶中的Mg2+使激活酶失去活性,从而使人中毒。
如果选用合适的物质(如柠檬酸钠等)提供配位体,可以减轻金属中毒对人体造成的伤害。
药物中的配合物
有些具有治疗作用的金属离子因其毒性大、刺激性强、难吸收等缺点而不能直接应用于临床实践,但若把它们变成配合物就能降低毒性和刺激性,利于吸收。
碳铂的结构模型
例如,顺铂(顺式二氯二氨合铂)是美国化学家罗森伯格(B. Rosenborg)等人于1969年发现的第一种具有抗癌活性的金属配合物。临床研究表明,它是一种有效的广谱抗癌药物,对人体的泌尿系统、生殖系统的恶性肿瘤以及甲状腺癌、食道癌、喉癌、头颈部癌等均有显著的治疗效果,但它对肾脏产生的明显伤害以及动物实验表明的致畸作用使它难以推广。20世纪80年代出现的第二代铂类抗癌药物,如碳铂等已用于临床。
固氮酶中Fe-Mo中心结构示意图
早在1888年,科学家就发现豆科植物的根瘤菌能将大气中游离的N2转化为NH3,这一直吸引着世界范围内一大批杰出科学家的高度关注。
模拟生物固氮首先要了解固氮酶的组成。化学家实现常温常压固氮的努力沿两条不同的途径进行。
一条途径是设法通过模型化合物的研究,合成生物固氮酶。1992年,J. Kim和D. C. Rees成功地分离出固氮酶并给出X射线分析的结构。
另一条途径是通过过渡金属的N2分子配合物活化 键。我们相信,通过科学家坚持不懈的努力,人工常温常压固氮一定能实现。
将大气中游离态氮转化为化合态氮的过程叫氮的固定。常温、常压下的固氮问题是对人类智慧的一次挑战。
通过研究配位化合物的结构和组成特征,人们可以发现和制备出更多具有特殊功能的配合物,以满足生产、生活的多样化需求。基于微观结构探讨物质的性质和用途,这是化学学习和研究过程中重要的科学思想。
配合物的结构及应用
当具有空轨道的过渡金属原子或离子遇到可提供孤电子对的分子或离子时,它们之间就会以配位键结合形成配位化合物。配合物的中心原子、配位体的种类和数目不同,导致其结构和性质表现出多样性和复杂性。
颜色的改变
溶解性的影响
配合物的应用
稳定性增强
配合物的形成对性质的影响
课堂小结
配合物在各方面应用
1、能区别[Co(NH3)4Cl2]Cl和[Co(NH3)4Cl2]NO3两种溶液的试剂是( )。
A.AgNO3溶液 B.NaOH溶液
C.CCl4 D.浓氨水
课堂练习
A
2、指出下列各配合物中的配离子、中心离子、配位体、配位数和配位原子。
① K3[Fe(CN)6]
① K3[Fe(CN)6] === 3K+ + [Fe(CN)6]3-
配离子:[Fe(CN)6]3-
配位体:CN- 配位原子:C
中心离子:Fe3+
配位数:6
2、指出下列各配合物中的配离子、中心离子、配位体、配位数和配位原子。
②(NH4)2[PtCl6]
② (NH4)2[PtCl6] === 2NH4 + [PtCl6]2-
配离子:[PtCl6]2-
配位体:Cl- 配位原子:Cl
中心离子:Pt4+
配位数:6
③[Cd(NH3)4](OH)2 === [Cd(NH3)4]2+ + 2OH-
配离子:[Cd(NH3)4]2+
配位体:NH3 配位原子:N
中心离子:Cd2+
配位数:4
2、指出下列各配合物中的配离子、中心离子、配位体、配位数和配位原子。
③[Cd(NH3)4](OH)2
4.2配合物的形成和应用
第二课时
一、配合物的形成对性质的影响
1、溶解性的影响
如:AgCl→[Ag(NH3)2]Cl,由不溶于水的沉淀,转变为易溶于水的物质。
化学方程式:AgCl+ 2NH3 [Ag(NH3)2]Cl
离子方程式:AgCl+ 2NH3 [Ag(NH3)2]+ + Cl-
Ag
NH3
H3N
+
二氨合银离子
配体:NH3
中心离子:Ag+
配位数:2
2、颜色的改变
当简单离子形成配离子时其性质往往有很大变化。颜色变化就是一种常见的现象,我们根据颜色的变化就可以判断是否有配离子生成。
如Fe3+与SCN-在溶液中可生成配位数为1~6的配离子,这些配离子的颜色是红色的。
Fe3+ + SCN- Fe(SCN)2+
Fe(SCN)2+ + SCN- Fe(SCN)2
Fe(SCN)5 + SCN- Fe(SCN)6
…………
SCN-作为配体与Fe3+配位,显红色,用于检验Fe3+
硫氰化铁配离子的颜色
2-
3-
+
3、稳定性增强
例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,导致血红素失去输送氧气的功能,这是CO使人体中毒的原理。
思考:[Cu(H2O)4]2+和[Cu(NH3)4]2+哪个配位离子更稳定?
原因是什么?
[Cu(NH3)4]2+更稳定。
因为N和O都有孤电子对,但O电负性大,吸引孤电子对的能力强,
故NH3提供孤电子对的能力比H2O大。
思考:NH3与Cu2+形成配合物,但NF3很难与Cu2+形成配合物,
原因是什么?
电负性:F > N ,使得NH3 提供孤电子对的能力大于NF3。
配合键的稳定性
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当中心离子相同时,配合物的稳定性与配体的性质有关。
电子对给予体形成配位键的能力:NH3 > H2O
接受体形成配位键的能力:H+ > 过渡金属> 主族金属
配位键越强,配合物越稳定:
Cu2+——OH- < Cu2+——NH3 < H+——NH3
“
“
二、配合物的应用
配合物在许多方面有着广泛的应用。
在化学分析中,人们常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成。
检验Fe3+的试剂
KSCN溶液
检验醛基的试剂
银氨溶液
在生产中,配合物被广泛应用于染色、电镀、硬水软化、金属冶炼领域。
例如,夹心配位化合物二茂铁具有高度的热稳定性,常被用作燃料的催化剂和抗爆剂,它的节能消烟效果也非常好。
配位化合物在羊毛染色过程中的作用
为了使羊毛呈现不同的色彩,同时在洗涤和光照的条件下不易褪色,我们可以在染色过程中,使用金属盐(如铬、铝、铁、铜盐等)对其进行处理。因羊毛和染料中都含有可与金属离子配位的基团(—NH2、—COOH),染色时,金属离子和染料及羊毛之间发生反应,生成体积较大、溶解度小的配合物,使染料坚固地附着在纤维上,从而改变羊毛的颜色。
在生命科学、抗癌药物、催化剂研制、激光材料、超导材料等许多尖端研究领域中,配合物发挥的作用也越来越大。
配合物在生命体中有着非常重要的作用。
许多酶的作用与其结构中含有形成配位键的金属离子有关。
生物体中能量的转换、传递或电荷转移,化学键的形成或断裂以及伴随这些过程出现的能量变化和分配等,常与金属离子和有机体生成的复杂配合物所起的作用有关。
以Mg2+为中心的大环配合物叶绿素能催化光合作用,将太阳能转换成化学能。
叶绿素的结构示意图
血红素的结构示意图
能输送O2的血红素是Fe2+的卟啉配合物,铁在血红蛋白、肌红蛋白和细胞色素分子中都以Fe2+与原卟啉环形成配合物的形式存在。
生物体内的许多酶都包含锌的配合物,已报道的含锌酶有80多种,如羧肽酶A和碳酸酶等。当人体缺锌时,许多酶的活性降低,引起相关代谢紊乱,可使人体发育和生长受阻。
配位化合物在生命体中扮演着十分重要的角色,而金属中毒的一个重要原因就是高浓度的外来金属离子取代了生物分子中的已有金属元素,生成了较为稳定的配位化合物,如Be2+取代激活酶中的Mg2+使激活酶失去活性,从而使人中毒。
如果选用合适的物质(如柠檬酸钠等)提供配位体,可以减轻金属中毒对人体造成的伤害。
药物中的配合物
有些具有治疗作用的金属离子因其毒性大、刺激性强、难吸收等缺点而不能直接应用于临床实践,但若把它们变成配合物就能降低毒性和刺激性,利于吸收。
碳铂的结构模型
例如,顺铂(顺式二氯二氨合铂)是美国化学家罗森伯格(B. Rosenborg)等人于1969年发现的第一种具有抗癌活性的金属配合物。临床研究表明,它是一种有效的广谱抗癌药物,对人体的泌尿系统、生殖系统的恶性肿瘤以及甲状腺癌、食道癌、喉癌、头颈部癌等均有显著的治疗效果,但它对肾脏产生的明显伤害以及动物实验表明的致畸作用使它难以推广。20世纪80年代出现的第二代铂类抗癌药物,如碳铂等已用于临床。
固氮酶中Fe-Mo中心结构示意图
早在1888年,科学家就发现豆科植物的根瘤菌能将大气中游离的N2转化为NH3,这一直吸引着世界范围内一大批杰出科学家的高度关注。
模拟生物固氮首先要了解固氮酶的组成。化学家实现常温常压固氮的努力沿两条不同的途径进行。
一条途径是设法通过模型化合物的研究,合成生物固氮酶。1992年,J. Kim和D. C. Rees成功地分离出固氮酶并给出X射线分析的结构。
另一条途径是通过过渡金属的N2分子配合物活化 键。我们相信,通过科学家坚持不懈的努力,人工常温常压固氮一定能实现。
将大气中游离态氮转化为化合态氮的过程叫氮的固定。常温、常压下的固氮问题是对人类智慧的一次挑战。
通过研究配位化合物的结构和组成特征,人们可以发现和制备出更多具有特殊功能的配合物,以满足生产、生活的多样化需求。基于微观结构探讨物质的性质和用途,这是化学学习和研究过程中重要的科学思想。
配合物的结构及应用
当具有空轨道的过渡金属原子或离子遇到可提供孤电子对的分子或离子时,它们之间就会以配位键结合形成配位化合物。配合物的中心原子、配位体的种类和数目不同,导致其结构和性质表现出多样性和复杂性。
颜色的改变
溶解性的影响
配合物的应用
稳定性增强
配合物的形成对性质的影响
课堂小结
配合物在各方面应用
1、能区别[Co(NH3)4Cl2]Cl和[Co(NH3)4Cl2]NO3两种溶液的试剂是( )。
A.AgNO3溶液 B.NaOH溶液
C.CCl4 D.浓氨水
课堂练习
A
2、指出下列各配合物中的配离子、中心离子、配位体、配位数和配位原子。
① K3[Fe(CN)6]
① K3[Fe(CN)6] === 3K+ + [Fe(CN)6]3-
配离子:[Fe(CN)6]3-
配位体:CN- 配位原子:C
中心离子:Fe3+
配位数:6
2、指出下列各配合物中的配离子、中心离子、配位体、配位数和配位原子。
②(NH4)2[PtCl6]
② (NH4)2[PtCl6] === 2NH4 + [PtCl6]2-
配离子:[PtCl6]2-
配位体:Cl- 配位原子:Cl
中心离子:Pt4+
配位数:6
③[Cd(NH3)4](OH)2 === [Cd(NH3)4]2+ + 2OH-
配离子:[Cd(NH3)4]2+
配位体:NH3 配位原子:N
中心离子:Cd2+
配位数:4
2、指出下列各配合物中的配离子、中心离子、配位体、配位数和配位原子。
③[Cd(NH3)4](OH)2
