第四节 酸碱中和反应学案
图片预览


文档简介
九年级化学 “任务型”教学用学案
第四节 酸碱中和反应
教师寄语:学好化学,生活会更加美好
学习任务:
1、认识中和反应的实质,学会用中和反应来改变溶液的酸碱性;
2、认识盐的组成。
3、了解中和反应在生产、生活中的应用;
任务导学
知识点一、中和反应
阅读课本P18-19页完成下列各题
1、盐酸和氢氧化钠反应的化学方程式是_______________________。
2、中和反应是指 与 作用生成 和 的反应,其实质是 。
3、由 和 组成的化合物叫盐,如 ,但有一类化合物尽管不含有金属离子而含有 ,可把这种离子看作金属离子,称为 盐。
【针对性训练一】
1、(2013.泸州市) 物质X可发生“X + 酸 → 盐 + H2O”的反应,则X可能是( )
A. Fe B. CO2 C. H2SO4 D. NaOH
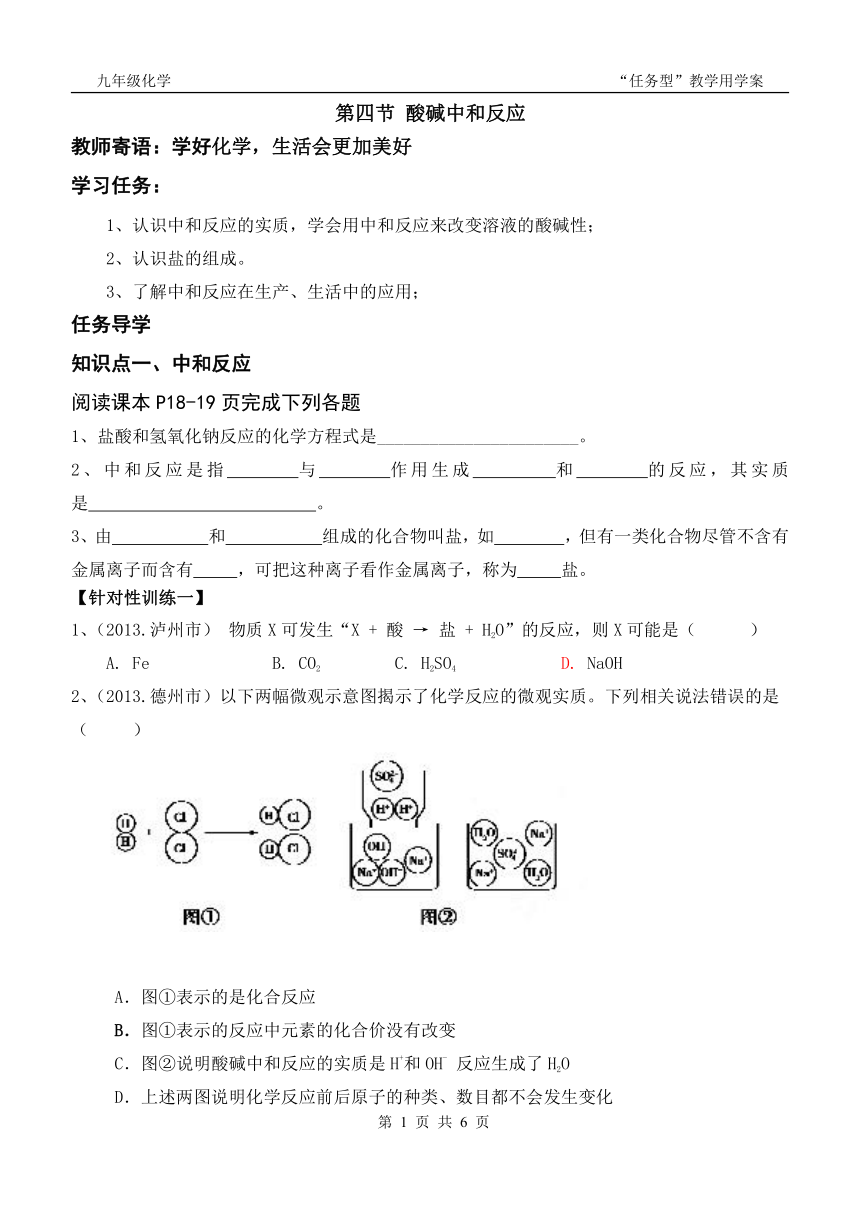
2、(2013.德州市)以下两幅微观示意图揭示了化学反应的微观实质。下列相关说法错误的是 ( )
A.图①表示的是化合反应
B.图①表示的反应中元素的化合价没有改变
C.图②说明酸碱中和反应的实质是H+和OH- 反应生成了H2O
D.上述两图说明化学反应前后原子的种类、数目都不会发生变化
3、(2013.青岛市)逻辑推理是化学学习中常用的思维方法。下列推理正确的是 ( )
A.中和反应生成盐和水,则生成盐和水的反应一定是中和反应
B.化合物是由不同种元素组成的纯净物。所以由不同种元素组成的纯净物一定是化合物
C.单质中只含有一种元素,所以只含有一种元素的物质一定是单质
D.活泼金属能与稀硫酸反应放出气体,则能与稀硫酸反应放出气体的物质一定是活泼金属
4、下列属于盐的是 ( )
A、CO2 B、HCl C、NaOH D、(NH4)2SO4
知识点二:中和反应的应用
阅读课本P20-21, 完成下列题目:
1、 将氢氧化钠溶液中滴加稀盐酸时:
(1)当滴入的盐酸量较少时,溶液中 有剩余,溶液呈碱性,PH
(2)当滴入的盐酸量与溶液中的氢氧化钠溶液完全反应时,溶液呈中性,PH
(3)当滴入的盐酸量过量时,溶液中 有剩余,溶液呈酸性,PH
2、 中和反应在工农业、生活生产中的应用
(1)
(2)
(3)
(4)
【针对性训练二】
1、(2013.苏州市)下列有关熟石灰的说法错误的是 ( )
A.熟石灰又称为消石灰 B.熟石灰由生石灰与水反应而制得
C.熟石灰的溶解度随温度升高而增大 D.熟石灰可以用来改良酸性土壤
2、(2013.苏州市)向一定体积的NaOH稀溶液中逐滴滴加稀盐酸,溶液pH变化的曲线合理的是 ( )
3、(2013.株洲市)(5分)向盛有10mL NaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如下:
加入稀盐酸的体积/mL 0 2 4 6 8 10 12 14
烧杯中溶液的pH 12.9 12.7 12.5 12.3 11.9 7.0 2.1 1.9
(1)当加入稀盐酸的体积为 mL时,NaOH溶液和稀盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3mL时,溶液显 色;当加入稀盐酸的体积为14mL时,溶液显 色。
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有: 。
思考讨论
1、 氢氧化钠溶液和稀盐酸后,溶液的PH的变化的原因是什么?
2、PH的变化能否说明酸碱之间发生了反应?
实验探究
按课本“实验探究”7-5的实验步骤完成实验。
实验记录
假设 反应情况 反应后溶质 反应后PH 低入酚酞的颜色
1 稀盐酸不足
2 恰好完全反应
3 稀盐酸过量
小组讨论
1、认真观察下图,小组讨论中和反应的实质是什么?
2、 有人说只要生成盐和水的反应就是中和反应,你同意他的观点吗?发表你的看法。
阅读分析
阅读课本P21,完成下列:
1、胃液里含有少量盐酸,可以帮助食物消化。若盐酸过多,人会感到胃不舒服。有下列几种物质:①NaOH ②Ca(OH)2 ③Al(OH)3 ④NaHCO3你认为可以用途作治疗胃酸过多的药物有( )
A.①②③④ B.①②③ C.①② D.③④
2、利用中和反应改良土壤的酸碱性
例题:一些国家正在试用碳酸水浇灌某些植物,这样做不能起到的作用
是 ( )
A.改良碱性土壤 B.改良酸性土壤
C.促进植物光合作用 D.提高农作物产量
3、经测定某种溶液的pH=4,要使溶液的pH=6,需加入下列哪种溶液( )
A、pH=2的溶液 B、 pH=7的溶液
C、 pH=10的溶液 D pH=4的溶液
【课堂小结】
1、 叫做中和反应。
2、中和反应的实质是 。
3、中和反应在工农业生产中有广泛的应用:例如
【课堂达标测试】
1、能与盐酸发生中和反应的是 ( )
A、Fe2O3 B、CaCO3 C、Zn D、NaOH
2、下列反应中属于中和反应的是 ( )
A、CaO+2HCl=CaCl2+H2O B、NaOH+HCl=NaCl+ H2O
C、Ca(OH)2+CO2=CaCO3 +H2O D、CaCO3+2HCl=CaCl2+H2O+CO2
3、下列变化不能表明盐酸与NaOH发生了反应的是 ( )
A、向NaOH溶液中加入盐酸后,混合溶液的温度升高
B、向NaOH溶液中加入盐酸后,混合溶液的质量增大
C、向NaOH溶液中加入盐酸后,混合溶液的PH<7
D、向滴有酚酞的NaOH溶液中加入盐酸后,红色褪去
4、右图是盐酸滴入氢氧化钠溶液中,有关粒子之间反应的示意图。下列说
法错误的是( )
A.盐酸溶液中含有氢离子和氯离子
B.氢氧化钠溶液中含有钠离子和氢氧根离子
C.两种溶液混合时,氢离子与氢氧根离子结合生成了水分子
D.两种溶液混合时,钠离子与氯离子结合生成了氯化钠分子
5.用稀盐酸和酚酞混合液在白纸上画图,晾干后加入下列物质能使此纸上出现红色图象的是 ( )
A.过量盐酸 B.水中溶有三氧化硫的溶液
C.过量氢氧化钠溶液 D.适量石蕊试液
6、下表列出了家庭中一些物质的PH
物质 醋 牙膏 食盐溶液 肥皂水
PH 3 9 7 10
(1)上述物质能使无色的酚酞试液变红的是 。
(2)黄蜂的刺是碱性的,若你被黄蜂刺了,应用上述的 涂在皮肤上,理由是 。
7、小华同学用pH试纸,按正确操作测定洗发剂和护发剂的pH,测得洗发剂的pH略大于7,则洗发剂显_________性;测得护发剂的pH略小于7,则护发剂显_________性。弱酸性有益于头发的健康,想一想,洗发时应先用_______剂,后用________剂。
8、某镇有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含SO2的废气和含H2SO4的酸性废水。当地的其他工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该镇环境造成极大破坏。
⑴分析该镇下酸雨的原因: 。
⑵举一例说明酸雨牟环境造成的危害: 。
⑶该镇某中学环保小组提出了治理酸雨的下列措施,你认为其中不妥的是 (选填字母)。
A.将硫酸厂搬离该镇
B.建议环保部门限令整改
C.将硫酸厂排出的废气中的SO2处理后排放
D.工厂和居民改用较清洁的燃料
⑷可用熟石灰来处理硫酸厂排出的酸性废水,处理原理的化学方程式是 。
1.(2013 滨州)下表是生活中一些物质的pH:
物质种类 厕所清洁剂 桔子汁 牛奶 草木灰水 厨房清洁剂
pH 1 3 6.5 11 12.5
有关它们的说法中正确的是( )
A. 牛奶的酸性比桔子汁强
B. 用湿润的pH试纸蘸取厕所清洁剂测其pH
C. 草木灰水显酸性
D. 胃酸过多的人不宜多吃桔子3、(2013年浙江温州市化学中考)小明在老师的指导下测一瓶稀盐酸的溶质质量分数,具体步骤如下: 步骤一:配制溶质质量分数为1%的氢氧化钠溶液.步骤二:向20克待测稀盐酸中逐滴滴入上述氢氧化钠溶液,并使用pH计记录溶液的pH变化情况,绘制图像如右图。 (1)在步骤一中需要用到的玻璃仪器有 。(写出两种) (2)请结合右图,计算该稀盐酸的溶质质量分数向一定体积的NaOH稀溶液中逐滴滴加稀盐酸,溶液pH变化的曲线合理的是.(结果精确到0.01%) (3)在往稀盐酸中逐渐滴人氢氧化钠溶液的过程中,当溶液的pH,达到2时,溶液中的溶质 。(用化学式表示)
PAGE
第 6 页 共 6 页
第四节 酸碱中和反应
教师寄语:学好化学,生活会更加美好
学习任务:
1、认识中和反应的实质,学会用中和反应来改变溶液的酸碱性;
2、认识盐的组成。
3、了解中和反应在生产、生活中的应用;
任务导学
知识点一、中和反应
阅读课本P18-19页完成下列各题
1、盐酸和氢氧化钠反应的化学方程式是_______________________。
2、中和反应是指 与 作用生成 和 的反应,其实质是 。
3、由 和 组成的化合物叫盐,如 ,但有一类化合物尽管不含有金属离子而含有 ,可把这种离子看作金属离子,称为 盐。
【针对性训练一】
1、(2013.泸州市) 物质X可发生“X + 酸 → 盐 + H2O”的反应,则X可能是( )
A. Fe B. CO2 C. H2SO4 D. NaOH
2、(2013.德州市)以下两幅微观示意图揭示了化学反应的微观实质。下列相关说法错误的是 ( )
A.图①表示的是化合反应
B.图①表示的反应中元素的化合价没有改变
C.图②说明酸碱中和反应的实质是H+和OH- 反应生成了H2O
D.上述两图说明化学反应前后原子的种类、数目都不会发生变化
3、(2013.青岛市)逻辑推理是化学学习中常用的思维方法。下列推理正确的是 ( )
A.中和反应生成盐和水,则生成盐和水的反应一定是中和反应
B.化合物是由不同种元素组成的纯净物。所以由不同种元素组成的纯净物一定是化合物
C.单质中只含有一种元素,所以只含有一种元素的物质一定是单质
D.活泼金属能与稀硫酸反应放出气体,则能与稀硫酸反应放出气体的物质一定是活泼金属
4、下列属于盐的是 ( )
A、CO2 B、HCl C、NaOH D、(NH4)2SO4
知识点二:中和反应的应用
阅读课本P20-21, 完成下列题目:
1、 将氢氧化钠溶液中滴加稀盐酸时:
(1)当滴入的盐酸量较少时,溶液中 有剩余,溶液呈碱性,PH
(2)当滴入的盐酸量与溶液中的氢氧化钠溶液完全反应时,溶液呈中性,PH
(3)当滴入的盐酸量过量时,溶液中 有剩余,溶液呈酸性,PH
2、 中和反应在工农业、生活生产中的应用
(1)
(2)
(3)
(4)
【针对性训练二】
1、(2013.苏州市)下列有关熟石灰的说法错误的是 ( )
A.熟石灰又称为消石灰 B.熟石灰由生石灰与水反应而制得
C.熟石灰的溶解度随温度升高而增大 D.熟石灰可以用来改良酸性土壤
2、(2013.苏州市)向一定体积的NaOH稀溶液中逐滴滴加稀盐酸,溶液pH变化的曲线合理的是 ( )
3、(2013.株洲市)(5分)向盛有10mL NaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如下:
加入稀盐酸的体积/mL 0 2 4 6 8 10 12 14
烧杯中溶液的pH 12.9 12.7 12.5 12.3 11.9 7.0 2.1 1.9
(1)当加入稀盐酸的体积为 mL时,NaOH溶液和稀盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3mL时,溶液显 色;当加入稀盐酸的体积为14mL时,溶液显 色。
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有: 。
思考讨论
1、 氢氧化钠溶液和稀盐酸后,溶液的PH的变化的原因是什么?
2、PH的变化能否说明酸碱之间发生了反应?
实验探究
按课本“实验探究”7-5的实验步骤完成实验。
实验记录
假设 反应情况 反应后溶质 反应后PH 低入酚酞的颜色
1 稀盐酸不足
2 恰好完全反应
3 稀盐酸过量
小组讨论
1、认真观察下图,小组讨论中和反应的实质是什么?
2、 有人说只要生成盐和水的反应就是中和反应,你同意他的观点吗?发表你的看法。
阅读分析
阅读课本P21,完成下列:
1、胃液里含有少量盐酸,可以帮助食物消化。若盐酸过多,人会感到胃不舒服。有下列几种物质:①NaOH ②Ca(OH)2 ③Al(OH)3 ④NaHCO3你认为可以用途作治疗胃酸过多的药物有( )
A.①②③④ B.①②③ C.①② D.③④
2、利用中和反应改良土壤的酸碱性
例题:一些国家正在试用碳酸水浇灌某些植物,这样做不能起到的作用
是 ( )
A.改良碱性土壤 B.改良酸性土壤
C.促进植物光合作用 D.提高农作物产量
3、经测定某种溶液的pH=4,要使溶液的pH=6,需加入下列哪种溶液( )
A、pH=2的溶液 B、 pH=7的溶液
C、 pH=10的溶液 D pH=4的溶液
【课堂小结】
1、 叫做中和反应。
2、中和反应的实质是 。
3、中和反应在工农业生产中有广泛的应用:例如
【课堂达标测试】
1、能与盐酸发生中和反应的是 ( )
A、Fe2O3 B、CaCO3 C、Zn D、NaOH
2、下列反应中属于中和反应的是 ( )
A、CaO+2HCl=CaCl2+H2O B、NaOH+HCl=NaCl+ H2O
C、Ca(OH)2+CO2=CaCO3 +H2O D、CaCO3+2HCl=CaCl2+H2O+CO2
3、下列变化不能表明盐酸与NaOH发生了反应的是 ( )
A、向NaOH溶液中加入盐酸后,混合溶液的温度升高
B、向NaOH溶液中加入盐酸后,混合溶液的质量增大
C、向NaOH溶液中加入盐酸后,混合溶液的PH<7
D、向滴有酚酞的NaOH溶液中加入盐酸后,红色褪去
4、右图是盐酸滴入氢氧化钠溶液中,有关粒子之间反应的示意图。下列说
法错误的是( )
A.盐酸溶液中含有氢离子和氯离子
B.氢氧化钠溶液中含有钠离子和氢氧根离子
C.两种溶液混合时,氢离子与氢氧根离子结合生成了水分子
D.两种溶液混合时,钠离子与氯离子结合生成了氯化钠分子
5.用稀盐酸和酚酞混合液在白纸上画图,晾干后加入下列物质能使此纸上出现红色图象的是 ( )
A.过量盐酸 B.水中溶有三氧化硫的溶液
C.过量氢氧化钠溶液 D.适量石蕊试液
6、下表列出了家庭中一些物质的PH
物质 醋 牙膏 食盐溶液 肥皂水
PH 3 9 7 10
(1)上述物质能使无色的酚酞试液变红的是 。
(2)黄蜂的刺是碱性的,若你被黄蜂刺了,应用上述的 涂在皮肤上,理由是 。
7、小华同学用pH试纸,按正确操作测定洗发剂和护发剂的pH,测得洗发剂的pH略大于7,则洗发剂显_________性;测得护发剂的pH略小于7,则护发剂显_________性。弱酸性有益于头发的健康,想一想,洗发时应先用_______剂,后用________剂。
8、某镇有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含SO2的废气和含H2SO4的酸性废水。当地的其他工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该镇环境造成极大破坏。
⑴分析该镇下酸雨的原因: 。
⑵举一例说明酸雨牟环境造成的危害: 。
⑶该镇某中学环保小组提出了治理酸雨的下列措施,你认为其中不妥的是 (选填字母)。
A.将硫酸厂搬离该镇
B.建议环保部门限令整改
C.将硫酸厂排出的废气中的SO2处理后排放
D.工厂和居民改用较清洁的燃料
⑷可用熟石灰来处理硫酸厂排出的酸性废水,处理原理的化学方程式是 。
1.(2013 滨州)下表是生活中一些物质的pH:
物质种类 厕所清洁剂 桔子汁 牛奶 草木灰水 厨房清洁剂
pH 1 3 6.5 11 12.5
有关它们的说法中正确的是( )
A. 牛奶的酸性比桔子汁强
B. 用湿润的pH试纸蘸取厕所清洁剂测其pH
C. 草木灰水显酸性
D. 胃酸过多的人不宜多吃桔子3、(2013年浙江温州市化学中考)小明在老师的指导下测一瓶稀盐酸的溶质质量分数,具体步骤如下: 步骤一:配制溶质质量分数为1%的氢氧化钠溶液.步骤二:向20克待测稀盐酸中逐滴滴入上述氢氧化钠溶液,并使用pH计记录溶液的pH变化情况,绘制图像如右图。 (1)在步骤一中需要用到的玻璃仪器有 。(写出两种) (2)请结合右图,计算该稀盐酸的溶质质量分数向一定体积的NaOH稀溶液中逐滴滴加稀盐酸,溶液pH变化的曲线合理的是.(结果精确到0.01%) (3)在往稀盐酸中逐渐滴人氢氧化钠溶液的过程中,当溶液的pH,达到2时,溶液中的溶质 。(用化学式表示)
PAGE
第 6 页 共 6 页
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
