化学人教版(2019)选择性必修3 3.4.2 羧酸衍生物——酯类(共39张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 3.4.2 羧酸衍生物——酯类(共39张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 104.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-21 08:12:37 | ||
图片预览







文档简介
(共39张PPT)
第四节 羧酸 羧酸衍生物
第2课时 酯 类
【新课导入】
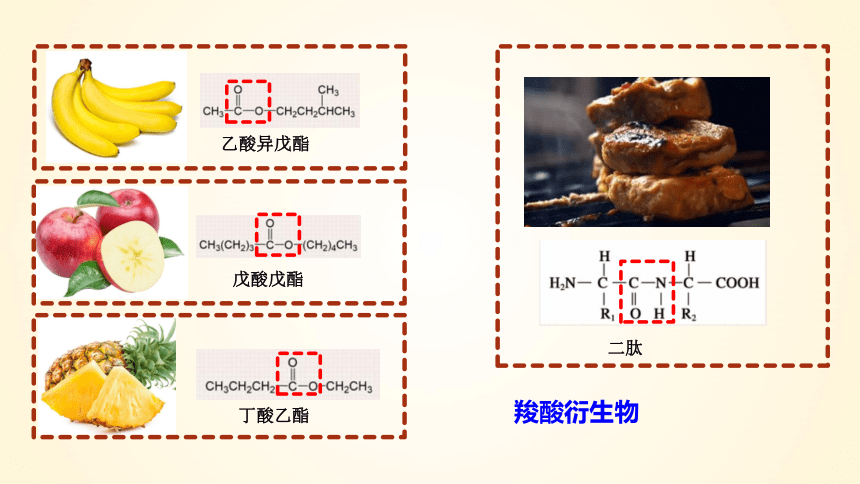
戊酸戊酯
丁酸乙酯
乙酸异戊酯
二肽
羧酸衍生物
羧酸衍生物:
如:
R-C-
O
=
酰基
R-C-OR
O
=
R-C-X
O
=
R-C-NH2
O
=
酰卤
酯
酰胺
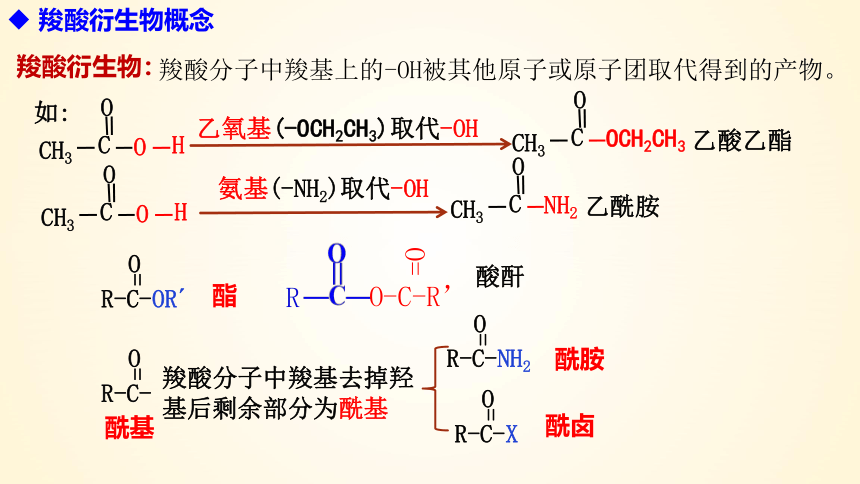
羧酸衍生物概念
羧酸分子中羧基上的-OH被其他原子或原子团取代得到的产物。
CH3
C
OCH2CH3
O
乙氧基(-OCH2CH3)取代-OH
CH3
C
O
H
O
乙酸乙酯
氨基(-NH2)取代-OH
乙酰胺
CH3
C
O
H
O
CH3
C
NH2
O
R
O-C-R’
O=
酸酐
羧酸分子中羧基去掉羟基后剩余部分为酰基
1.概念:
或“-COO-”
酯基
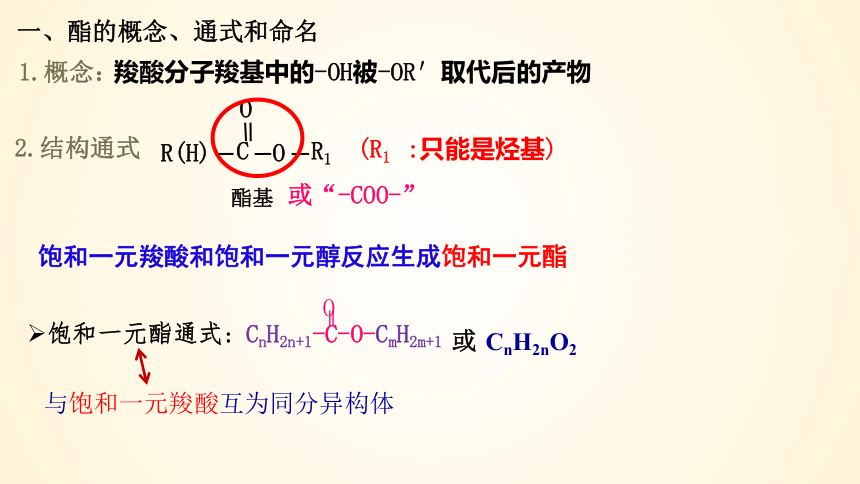
饱和一元酯通式:
与饱和一元羧酸互为同分异构体
CnH2n+1-C-O-CmH2m+1
‖
O
或
CnH2nO2
一、酯的概念、通式和命名
羧酸分子羧基中的-OH被-OR′取代后的产物
2.结构通式
(R1 :只能是烃基)
R(H)
C
O
R1
O
饱和一元羧酸和饱和一元醇反应生成饱和一元酯
酯:也可以看做是酸跟醇起反应后生成的一类化合物。
延伸:酸
(如:HNO3,H2SO4,H3PO4)
C2H5OH + HO-NO2 → C2H5O-NO2 + H2O
HCl
×
-----有机酸或无机含氧酸
【拓展延伸】
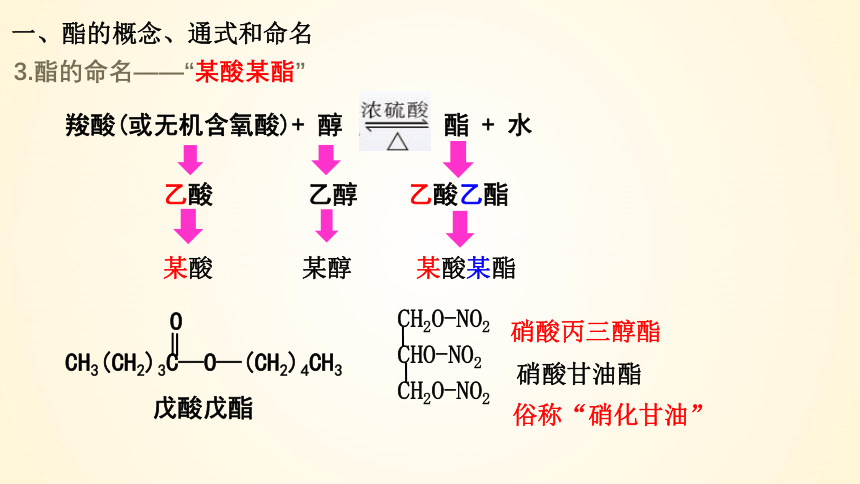
羧酸(或无机含氧酸)+ 醇 酯 + 水
乙酸 乙醇 乙酸乙酯
某酸 某醇 某酸某酯
3.酯的命名——“某酸某酯”
一、酯的概念、通式和命名
戊酸戊酯
CH3(CH2)3C—O—(CH2)4CH3
O
CH2O-NO2
CHO-NO2
CH2O-NO2
硝酸丙三醇酯
硝酸甘油酯
俗称“硝化甘油”
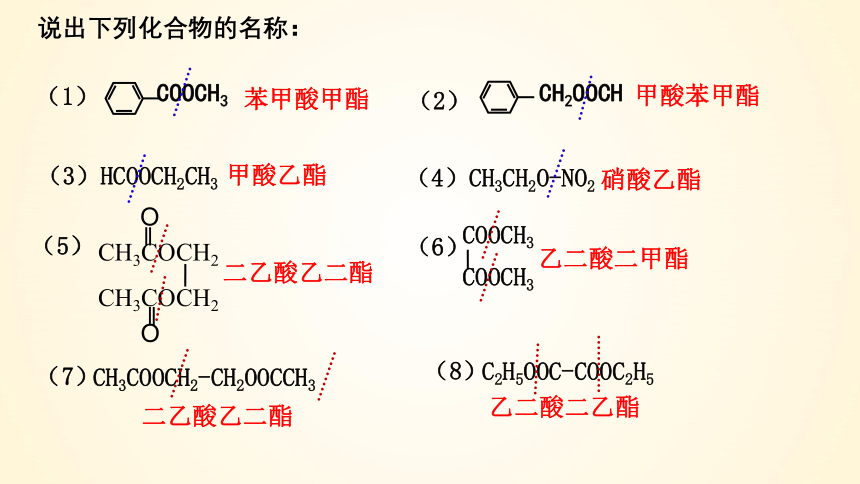
说出下列化合物的名称:
甲酸乙酯
硝酸乙酯
CH3COCH2
CH3COCH2
O
‖
O
‖
(5)
二乙酸乙二酯
COOCH3
COOCH3
乙二酸二甲酯
(6)
C2H5OOC-COOC2H5
乙二酸二乙酯
CH3COOCH2-CH2OOCCH3
(4)CH3CH2O-NO2
(3)HCOOCH2CH3
(7)
(8)
二乙酸乙二酯
苯甲酸甲酯
甲酸苯甲酯
COOCH3
CH2OOCH
(1)
(2)
例:写出化学式C4H8O2的羧酸、酯类的同分异构体
C C C
COOH
羧酸
4、同分异构现象
酯
甲酸丙酯
HCOO
C C C
HCOO
C C
C
乙酸乙酯
C COO
C C
丙酸甲酯
C C COO
C
丁酸甲酯?
6种
添H!
[C3H7—COOH]
×
还有属于其他种类的同分异构体吗?
羟基醛、羟基酮、醚醛、醚酮等
COOH
C C
C
1.分子式为C5H10O2的羧酸、酯类的同分异构体有?种
羧酸
酯
[C4H9—COOH]
丁基(C4H9—)有4种,所以C4H9—COOH有4种
甲酸丁酯
HCOO
C4H9
4种
乙酸丙酯
C COO
C3H7
2种
丙酸乙酯
C C COO
C C
1种
丁酸甲酯
C C C COO
C
C
C C COO
C
2种
=13
4
9
+
同步练习
2.写出分子式为C8H8O2属于芳香羧酸和芳香类酯的所有同分异构体
6种
4种
同步练习
二、酯的性质
浮在水面上
易溶于乙醇和乙醚等有机溶剂
③难溶于水
②密度比水小
①低级酯是具有芳香气味的液体。
1.酯的物理性质
许多酯也是常用的有机溶剂。
(阅读教材P74-75)
作溶剂
作制备饮料、糖果和糕点的酯类香料
用途
2.酯的化学性质
(教材P75)
探究①乙酸乙酯在中性、酸性和碱性溶液中的水解速率
设计实验:
已知:①乙酸乙酯在常温下水解速率很慢
②乙酸乙酯的沸点为76.5--77.5℃
可供选择的试剂:乙酸乙酯、蒸馏水、稀硫酸、30%NaOH、酚酞
注意:控制变量!!!
实验步骤
实验现象
实验结论
1.分别取等体积的水、稀硫酸、氢氧化钠溶液
放入3支试管中,然后向3支试管中分别加入等量乙酸乙酯
2.振荡均匀后,把3支试管都放入约60℃的水浴里加热
探究①乙酸乙酯在中性、酸性和碱性溶液中的水解速率
实验步骤
实验现象
实验结论
设计实验:
1.分别取等体积的水、稀硫酸、氢氧化钠溶液
放入3支试管中,然后向3支试管中分别加入等量乙酸乙酯
2.振荡均匀后,把3支试管都放入约60℃的水浴里加热
已知:①乙酸乙酯在常温下水解速率很慢
②乙酸乙酯的沸点为76.5--77.5℃
可供选择的试剂:乙酸乙酯、蒸馏水、稀硫酸、30%NaOH、酚酞
注意:控制变量!!!
加水的试管中酯层基本不变
酯层消失时间:加入稀硫酸的试管大于加入氢氧化钠溶液的试管
①酯在碱性条件下水解速率最快,其次是酸性条件,中性条件下几乎不水解;
②在强碱的溶液中酯水解趋于完全。
设计实验:
实验探究②酯在不同温度下的水解速率
实验步骤
实验现象
实验结论
1.分别取等量的乙酸乙酯放入2支试管中,然后向试管中分别加入等量的氢氧化钠溶液
2.振荡均匀后,把2支试管分别放入50~60 ℃、70~80 ℃的水浴里加热
乙酸乙酯+NaOH+酚酞
50~60 ℃
乙酸乙酯+NaOH+酚酞
70~80 ℃
酯层和香味消失慢
酯层和香味消失很快,红色退去
实验现象
设计实验:
实验探究②酯在不同温度下的水解速率
实验步骤
实验现象
实验结论
1.分别取等量的乙酸乙酯放入2支试管中,然后向试管中分别加入等量的氢氧化钠溶液
2.振荡均匀后,把2支试管分别放入50~60 ℃、70~80 ℃的水浴里加热
温度高的试管酯层消失得更快
温度越高,乙酸乙酯的水解速率越大
(水解反应是吸热反应)
⑴酯在碱性条件下水解速率最快,其次是酸性条件,中性条件下几乎不水解; 在强碱的溶液中酯水解趋于完全。
⑵温度越高,酯水解程度越大。
(水解反应是吸热反应)
酯的水解规律:
思考交流:
归纳小结
可以,但是盐酸和硝酸加热时易挥发
③酯的水解用水浴加热,能否直接加热?
②酯的酸性水解用稀硫酸,能否用浓硫酸?
①酯的酸性水解能否用盐酸或硝酸?
不能,因为浓硫酸有利于酯化反应
不能直接加热,因为酯的沸点一般较低,易挥发
乙酸乙酯的水解方程式
稀H2SO4
△
△
CH3C-O-C2H5 + H2O
=
O
CH3C-OH + C2H5OH
=
O
CH3C-O-C2H5 + NaOH
=
O
CH3C-ONa + C2H5OH
=
O
说明:
①稀硫酸的作用
[也可用其他无机酸,如盐酸、磷酸等]
无机酸
②NaOH的作用:
:催化剂
1)催化剂
2)中和水解生成的酸,促进水解趋于完全。
[归纳总结]酯的水解反应规律:
无机酸(H+)
△
△
R-C-O-R′+ H2O
=
O
R-C-OH + R′OH
=
O
R-C-O-R′ + NaOH
=
O
R-C-ONa + R′OH
=
O
CH3C-OH + H-OC2H5
=
CH3C-O-C2H5 +H2O
=
浓H2SO4
△
O
O
对比:酯化反应
催化剂和吸水剂
(可逆反应)
酯化反应与酯水解反应的比较
酯 化 水 解
反应关系 催 化 剂
催化剂的 其他作用
加热方式
反应类型
NaOH中和酯水解生成的羧酸,提高酯的水解率
CH3COOH+C2H5OH CH3COOC2H5+H2O
浓 硫 酸
稀H2SO4或NaOH
吸水,提高CH3COOH与C2H5OH的转化率
酒精灯火焰加热
热水浴加热
酯化反应(取代反应)
水解反应(取代反应)
酯化
水解
巩固练习:
1.写出下列酯分别在硫酸溶液、NaOH溶液中发生水解反应的化学方程式
COO—CH2CH3
COO—CH2CH3
+ H2O
稀H2SO4
△
+ C2H5OH
COOH
COOH
2
2
COO—CH2CH3
COO—CH2CH3
+ NaOH
△
COONa
COONa
+ C2H5OH
2
2
水解后生成乙酸和甲醇,只有乙酸和 NaOH 反应,所以需要 1mol NaOH
水解后生成苯酚和丙酸,所以需要 2mol NaOH
2. 1mol下列有机物在 NaOH 溶液中完全水解,所需 NaOH 的量是多少?
① CH3COOCH3
OOCCH2CH3
②
1.一般的酯在碱性条件下水解时,NaOH的量应大于酯的用量的1倍,这样才能使酯水解完全 ;
2.但是酚酯水解时由于产生苯酚,也能与NaOH反应,所以NaOH的用量应大于酯物质的量的2倍,才能使酯水解完全。
说明:
巩固练习:
消耗NaOH的物质的量为( )
A.3mol B.4mol C.5mol D.6mol E.8mol
与足量的NaOH(aq)充分反应,
HO
O
O
-C
=
O
-C-CH3
=
O
C
迁移练习:
HO
OH
HO
OH
-C
=
O
CH3C-OH
=
O
HO
O
O
-C
=
O
-C-CH3
=
O
6molNaOH
Cl
2molNaOH
扩展:
CH2Cl
R-Cl + NaOH R-OH + NaCl
H2O
△
1 : 1
1molNaOH
1mol
8molNaOH
① RCOOR′
1mol普通酯水解消耗 NaOH
O-C-R′
②
=
O
1mol酚酯水解消耗 NaOH
③
R-X + NaOH R-OH + NaX
H2O
△
1mol脂肪卤代烃水解消耗 NaOH
④
X
卤原子直接连苯环上时,1mol卤原子水解消耗 NaOH
归纳总结:
1mol
2mol
1mol
2mol
HO
O
O
-C
=
O
-C-CH3
=
O
Cl
CH2Cl
2mol
1mol
2mol
2mol
1mol
8molNaOH
3.下列物质中的溴原子在适当条件下都能被羟基所取代,所得产物能跟NaHCO3溶液反应的是( )
A.
B.
C.
D.
C
OH
OH
OH
OH
追问:所得产物能跟NaOH溶液反应的有( )
B C
巩固练习:
4.胆固醇是人体必需的生物活性物质,分子式为C27H46O 。一种胆固醇酯的液晶材料,分子式为C34H50O2 。合成这种胆固醇酯的羧酸是( )
A. C6H13COOH B. C6H5COOH
C. C7H15COOH D. C3H7COOH
B
C27H46O
+ 羧酸
C34H50O2
+ H2O
C7H6O2
巩固练习:
5.下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶
④除去乙醇中少量的乙酸:加足量生石灰、蒸馏
A.①② B.②④ C.③④ D.②③
B
光照时,乙烷与Cl2发生取代反应
应改用饱和碳酸氢钠溶液
巩固练习:
6、一环酯化合物,结构简式如下:
试推断:
3.此水解产物是否可能与FeCl3溶液发生显色反应?
2.写出此水解产物与金属钠反应的化学方程式;
1.该环酯化合物在酸性条件下水解的产物是什么?写出其结构简式;
能
巩固练习:
7、某羧酸的衍生物A的分子式为C6H12O2,已知:
A
NaOH(aq)
B
C
HCl
Cu,O2
E
又知:D不与Na2CO3溶液反应,C和E都不能发生银镜反应,则A的结构可能有( )
A. 1种 B. 2种 C. 3种 D. 4种
B
D
羧酸
[E是酮]
羧酸钠
醇
,C不是甲酸
酯
R1-CH-R2
OH
D的结构为:
巩固练习:
注意:醇类被催化氧化的规律:
R-CH2OH
Cu/Ag,O2
△
R-CHO
R1-CH-R2
OH
R1-C-R2
O
R1-C-OH
R3
R2
不能被氧化
醛
酮
Cu/Ag,O2
△
Cu/Ag,O2
△
7、某羧酸的衍生物A的分子式为C6H12O2,已知:
A
NaOH(aq)
B
C
HCl
Cu,O2
E
则A的结构可能有( )
B
D
[O]
C8H16O2
[醛]
[羧酸]
C、E的碳原子数和碳的骨架相同
C8H16O2
羧酸钠
醇
酯
D的结构为:
R-CH2OH
巩固练习:
A. 1种 B. 2种 C. 3种 D. 4种
8.某有机物X发生水解反应,水解产物为Y和Z,同温同压下,相同质量的Y和Z的蒸气所占的体积相同,化合物X可能是( )
A. 乙酸丙酯 B. 甲酸乙酯 C. 甲酸丙酯 D. 乙酸乙酯
AB
√
√
饱和一元羧酸与碳原子数多一个的饱和一元醇分子量相等
CnH2nO2
C(n+1)H2(n+1)+2O
9.分子式为C9H18O2的有机物A,在硫酸存在下与水反应,生成B和C,同温同压下,相同质量的B和C的蒸气所占的体积相同,则A的酯类同分异构体共有
A. 8种 B. 12种 C. 16种 D. 18种
√
A为丁酸戊醇
丁酸有2种,戊醇有8种
巩固练习:
10.分子式为C9H18O2的有机物A,在硫酸存在下与水反应,生成B和C,C经一系列氧化最终可转化为B的同类物质。
A
稀H2SO4
B
C
B的同类物质
又知:等质量的B、C的蒸气在同温同压下所占体积相同,则A的酯类同分异构体共有(包括A)( )
A. 8种 B. 12种 C. 16种 D. 18种
A
[O]
[饱和一元羧酸]
+ H2O
酯类
[C为满足RCH2OH结构的饱和一元醇]
B为丁酸C4H8O2
C为戊醇C5H12O
2种
戊醇有8种,能被氧化为羧酸的有4种
巩固练习:
11.现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
1)试剂a是 ____,试剂b是___ ;
分离方法①是_________,分离方法②是_____,分离方法③是______。
2)在得到的A中加入无水碳酸钠粉末,振荡,目的是______________。
除去乙酸乙酯中的水
饱和Na2CO3
溶液
乙酸乙酯
(含少量水)
乙酸钠
乙醇、水
蒸 馏
乙酸钠
水
乙醇
稀H2SO4
乙酸
硫酸钠、水
蒸 馏
萃取
分液
乙酸乙酯
乙 酸、乙醇、水、乙酸乙酯
稀H2SO4
萃取分液
蒸 馏
蒸 馏
饱和Na2CO3溶液
第四节 羧酸 羧酸衍生物
第2课时 酯 类
【新课导入】
戊酸戊酯
丁酸乙酯
乙酸异戊酯
二肽
羧酸衍生物
羧酸衍生物:
如:
R-C-
O
=
酰基
R-C-OR
O
=
R-C-X
O
=
R-C-NH2
O
=
酰卤
酯
酰胺
羧酸衍生物概念
羧酸分子中羧基上的-OH被其他原子或原子团取代得到的产物。
CH3
C
OCH2CH3
O
乙氧基(-OCH2CH3)取代-OH
CH3
C
O
H
O
乙酸乙酯
氨基(-NH2)取代-OH
乙酰胺
CH3
C
O
H
O
CH3
C
NH2
O
R
O-C-R’
O=
酸酐
羧酸分子中羧基去掉羟基后剩余部分为酰基
1.概念:
或“-COO-”
酯基
饱和一元酯通式:
与饱和一元羧酸互为同分异构体
CnH2n+1-C-O-CmH2m+1
‖
O
或
CnH2nO2
一、酯的概念、通式和命名
羧酸分子羧基中的-OH被-OR′取代后的产物
2.结构通式
(R1 :只能是烃基)
R(H)
C
O
R1
O
饱和一元羧酸和饱和一元醇反应生成饱和一元酯
酯:也可以看做是酸跟醇起反应后生成的一类化合物。
延伸:酸
(如:HNO3,H2SO4,H3PO4)
C2H5OH + HO-NO2 → C2H5O-NO2 + H2O
HCl
×
-----有机酸或无机含氧酸
【拓展延伸】
羧酸(或无机含氧酸)+ 醇 酯 + 水
乙酸 乙醇 乙酸乙酯
某酸 某醇 某酸某酯
3.酯的命名——“某酸某酯”
一、酯的概念、通式和命名
戊酸戊酯
CH3(CH2)3C—O—(CH2)4CH3
O
CH2O-NO2
CHO-NO2
CH2O-NO2
硝酸丙三醇酯
硝酸甘油酯
俗称“硝化甘油”
说出下列化合物的名称:
甲酸乙酯
硝酸乙酯
CH3COCH2
CH3COCH2
O
‖
O
‖
(5)
二乙酸乙二酯
COOCH3
COOCH3
乙二酸二甲酯
(6)
C2H5OOC-COOC2H5
乙二酸二乙酯
CH3COOCH2-CH2OOCCH3
(4)CH3CH2O-NO2
(3)HCOOCH2CH3
(7)
(8)
二乙酸乙二酯
苯甲酸甲酯
甲酸苯甲酯
COOCH3
CH2OOCH
(1)
(2)
例:写出化学式C4H8O2的羧酸、酯类的同分异构体
C C C
COOH
羧酸
4、同分异构现象
酯
甲酸丙酯
HCOO
C C C
HCOO
C C
C
乙酸乙酯
C COO
C C
丙酸甲酯
C C COO
C
丁酸甲酯?
6种
添H!
[C3H7—COOH]
×
还有属于其他种类的同分异构体吗?
羟基醛、羟基酮、醚醛、醚酮等
COOH
C C
C
1.分子式为C5H10O2的羧酸、酯类的同分异构体有?种
羧酸
酯
[C4H9—COOH]
丁基(C4H9—)有4种,所以C4H9—COOH有4种
甲酸丁酯
HCOO
C4H9
4种
乙酸丙酯
C COO
C3H7
2种
丙酸乙酯
C C COO
C C
1种
丁酸甲酯
C C C COO
C
C
C C COO
C
2种
=13
4
9
+
同步练习
2.写出分子式为C8H8O2属于芳香羧酸和芳香类酯的所有同分异构体
6种
4种
同步练习
二、酯的性质
浮在水面上
易溶于乙醇和乙醚等有机溶剂
③难溶于水
②密度比水小
①低级酯是具有芳香气味的液体。
1.酯的物理性质
许多酯也是常用的有机溶剂。
(阅读教材P74-75)
作溶剂
作制备饮料、糖果和糕点的酯类香料
用途
2.酯的化学性质
(教材P75)
探究①乙酸乙酯在中性、酸性和碱性溶液中的水解速率
设计实验:
已知:①乙酸乙酯在常温下水解速率很慢
②乙酸乙酯的沸点为76.5--77.5℃
可供选择的试剂:乙酸乙酯、蒸馏水、稀硫酸、30%NaOH、酚酞
注意:控制变量!!!
实验步骤
实验现象
实验结论
1.分别取等体积的水、稀硫酸、氢氧化钠溶液
放入3支试管中,然后向3支试管中分别加入等量乙酸乙酯
2.振荡均匀后,把3支试管都放入约60℃的水浴里加热
探究①乙酸乙酯在中性、酸性和碱性溶液中的水解速率
实验步骤
实验现象
实验结论
设计实验:
1.分别取等体积的水、稀硫酸、氢氧化钠溶液
放入3支试管中,然后向3支试管中分别加入等量乙酸乙酯
2.振荡均匀后,把3支试管都放入约60℃的水浴里加热
已知:①乙酸乙酯在常温下水解速率很慢
②乙酸乙酯的沸点为76.5--77.5℃
可供选择的试剂:乙酸乙酯、蒸馏水、稀硫酸、30%NaOH、酚酞
注意:控制变量!!!
加水的试管中酯层基本不变
酯层消失时间:加入稀硫酸的试管大于加入氢氧化钠溶液的试管
①酯在碱性条件下水解速率最快,其次是酸性条件,中性条件下几乎不水解;
②在强碱的溶液中酯水解趋于完全。
设计实验:
实验探究②酯在不同温度下的水解速率
实验步骤
实验现象
实验结论
1.分别取等量的乙酸乙酯放入2支试管中,然后向试管中分别加入等量的氢氧化钠溶液
2.振荡均匀后,把2支试管分别放入50~60 ℃、70~80 ℃的水浴里加热
乙酸乙酯+NaOH+酚酞
50~60 ℃
乙酸乙酯+NaOH+酚酞
70~80 ℃
酯层和香味消失慢
酯层和香味消失很快,红色退去
实验现象
设计实验:
实验探究②酯在不同温度下的水解速率
实验步骤
实验现象
实验结论
1.分别取等量的乙酸乙酯放入2支试管中,然后向试管中分别加入等量的氢氧化钠溶液
2.振荡均匀后,把2支试管分别放入50~60 ℃、70~80 ℃的水浴里加热
温度高的试管酯层消失得更快
温度越高,乙酸乙酯的水解速率越大
(水解反应是吸热反应)
⑴酯在碱性条件下水解速率最快,其次是酸性条件,中性条件下几乎不水解; 在强碱的溶液中酯水解趋于完全。
⑵温度越高,酯水解程度越大。
(水解反应是吸热反应)
酯的水解规律:
思考交流:
归纳小结
可以,但是盐酸和硝酸加热时易挥发
③酯的水解用水浴加热,能否直接加热?
②酯的酸性水解用稀硫酸,能否用浓硫酸?
①酯的酸性水解能否用盐酸或硝酸?
不能,因为浓硫酸有利于酯化反应
不能直接加热,因为酯的沸点一般较低,易挥发
乙酸乙酯的水解方程式
稀H2SO4
△
△
CH3C-O-C2H5 + H2O
=
O
CH3C-OH + C2H5OH
=
O
CH3C-O-C2H5 + NaOH
=
O
CH3C-ONa + C2H5OH
=
O
说明:
①稀硫酸的作用
[也可用其他无机酸,如盐酸、磷酸等]
无机酸
②NaOH的作用:
:催化剂
1)催化剂
2)中和水解生成的酸,促进水解趋于完全。
[归纳总结]酯的水解反应规律:
无机酸(H+)
△
△
R-C-O-R′+ H2O
=
O
R-C-OH + R′OH
=
O
R-C-O-R′ + NaOH
=
O
R-C-ONa + R′OH
=
O
CH3C-OH + H-OC2H5
=
CH3C-O-C2H5 +H2O
=
浓H2SO4
△
O
O
对比:酯化反应
催化剂和吸水剂
(可逆反应)
酯化反应与酯水解反应的比较
酯 化 水 解
反应关系 催 化 剂
催化剂的 其他作用
加热方式
反应类型
NaOH中和酯水解生成的羧酸,提高酯的水解率
CH3COOH+C2H5OH CH3COOC2H5+H2O
浓 硫 酸
稀H2SO4或NaOH
吸水,提高CH3COOH与C2H5OH的转化率
酒精灯火焰加热
热水浴加热
酯化反应(取代反应)
水解反应(取代反应)
酯化
水解
巩固练习:
1.写出下列酯分别在硫酸溶液、NaOH溶液中发生水解反应的化学方程式
COO—CH2CH3
COO—CH2CH3
+ H2O
稀H2SO4
△
+ C2H5OH
COOH
COOH
2
2
COO—CH2CH3
COO—CH2CH3
+ NaOH
△
COONa
COONa
+ C2H5OH
2
2
水解后生成乙酸和甲醇,只有乙酸和 NaOH 反应,所以需要 1mol NaOH
水解后生成苯酚和丙酸,所以需要 2mol NaOH
2. 1mol下列有机物在 NaOH 溶液中完全水解,所需 NaOH 的量是多少?
① CH3COOCH3
OOCCH2CH3
②
1.一般的酯在碱性条件下水解时,NaOH的量应大于酯的用量的1倍,这样才能使酯水解完全 ;
2.但是酚酯水解时由于产生苯酚,也能与NaOH反应,所以NaOH的用量应大于酯物质的量的2倍,才能使酯水解完全。
说明:
巩固练习:
消耗NaOH的物质的量为( )
A.3mol B.4mol C.5mol D.6mol E.8mol
与足量的NaOH(aq)充分反应,
HO
O
O
-C
=
O
-C-CH3
=
O
C
迁移练习:
HO
OH
HO
OH
-C
=
O
CH3C-OH
=
O
HO
O
O
-C
=
O
-C-CH3
=
O
6molNaOH
Cl
2molNaOH
扩展:
CH2Cl
R-Cl + NaOH R-OH + NaCl
H2O
△
1 : 1
1molNaOH
1mol
8molNaOH
① RCOOR′
1mol普通酯水解消耗 NaOH
O-C-R′
②
=
O
1mol酚酯水解消耗 NaOH
③
R-X + NaOH R-OH + NaX
H2O
△
1mol脂肪卤代烃水解消耗 NaOH
④
X
卤原子直接连苯环上时,1mol卤原子水解消耗 NaOH
归纳总结:
1mol
2mol
1mol
2mol
HO
O
O
-C
=
O
-C-CH3
=
O
Cl
CH2Cl
2mol
1mol
2mol
2mol
1mol
8molNaOH
3.下列物质中的溴原子在适当条件下都能被羟基所取代,所得产物能跟NaHCO3溶液反应的是( )
A.
B.
C.
D.
C
OH
OH
OH
OH
追问:所得产物能跟NaOH溶液反应的有( )
B C
巩固练习:
4.胆固醇是人体必需的生物活性物质,分子式为C27H46O 。一种胆固醇酯的液晶材料,分子式为C34H50O2 。合成这种胆固醇酯的羧酸是( )
A. C6H13COOH B. C6H5COOH
C. C7H15COOH D. C3H7COOH
B
C27H46O
+ 羧酸
C34H50O2
+ H2O
C7H6O2
巩固练习:
5.下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶
④除去乙醇中少量的乙酸:加足量生石灰、蒸馏
A.①② B.②④ C.③④ D.②③
B
光照时,乙烷与Cl2发生取代反应
应改用饱和碳酸氢钠溶液
巩固练习:
6、一环酯化合物,结构简式如下:
试推断:
3.此水解产物是否可能与FeCl3溶液发生显色反应?
2.写出此水解产物与金属钠反应的化学方程式;
1.该环酯化合物在酸性条件下水解的产物是什么?写出其结构简式;
能
巩固练习:
7、某羧酸的衍生物A的分子式为C6H12O2,已知:
A
NaOH(aq)
B
C
HCl
Cu,O2
E
又知:D不与Na2CO3溶液反应,C和E都不能发生银镜反应,则A的结构可能有( )
A. 1种 B. 2种 C. 3种 D. 4种
B
D
羧酸
[E是酮]
羧酸钠
醇
,C不是甲酸
酯
R1-CH-R2
OH
D的结构为:
巩固练习:
注意:醇类被催化氧化的规律:
R-CH2OH
Cu/Ag,O2
△
R-CHO
R1-CH-R2
OH
R1-C-R2
O
R1-C-OH
R3
R2
不能被氧化
醛
酮
Cu/Ag,O2
△
Cu/Ag,O2
△
7、某羧酸的衍生物A的分子式为C6H12O2,已知:
A
NaOH(aq)
B
C
HCl
Cu,O2
E
则A的结构可能有( )
B
D
[O]
C8H16O2
[醛]
[羧酸]
C、E的碳原子数和碳的骨架相同
C8H16O2
羧酸钠
醇
酯
D的结构为:
R-CH2OH
巩固练习:
A. 1种 B. 2种 C. 3种 D. 4种
8.某有机物X发生水解反应,水解产物为Y和Z,同温同压下,相同质量的Y和Z的蒸气所占的体积相同,化合物X可能是( )
A. 乙酸丙酯 B. 甲酸乙酯 C. 甲酸丙酯 D. 乙酸乙酯
AB
√
√
饱和一元羧酸与碳原子数多一个的饱和一元醇分子量相等
CnH2nO2
C(n+1)H2(n+1)+2O
9.分子式为C9H18O2的有机物A,在硫酸存在下与水反应,生成B和C,同温同压下,相同质量的B和C的蒸气所占的体积相同,则A的酯类同分异构体共有
A. 8种 B. 12种 C. 16种 D. 18种
√
A为丁酸戊醇
丁酸有2种,戊醇有8种
巩固练习:
10.分子式为C9H18O2的有机物A,在硫酸存在下与水反应,生成B和C,C经一系列氧化最终可转化为B的同类物质。
A
稀H2SO4
B
C
B的同类物质
又知:等质量的B、C的蒸气在同温同压下所占体积相同,则A的酯类同分异构体共有(包括A)( )
A. 8种 B. 12种 C. 16种 D. 18种
A
[O]
[饱和一元羧酸]
+ H2O
酯类
[C为满足RCH2OH结构的饱和一元醇]
B为丁酸C4H8O2
C为戊醇C5H12O
2种
戊醇有8种,能被氧化为羧酸的有4种
巩固练习:
11.现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
1)试剂a是 ____,试剂b是___ ;
分离方法①是_________,分离方法②是_____,分离方法③是______。
2)在得到的A中加入无水碳酸钠粉末,振荡,目的是______________。
除去乙酸乙酯中的水
饱和Na2CO3
溶液
乙酸乙酯
(含少量水)
乙酸钠
乙醇、水
蒸 馏
乙酸钠
水
乙醇
稀H2SO4
乙酸
硫酸钠、水
蒸 馏
萃取
分液
乙酸乙酯
乙 酸、乙醇、水、乙酸乙酯
稀H2SO4
萃取分液
蒸 馏
蒸 馏
饱和Na2CO3溶液
