鲁教版化学九下导学案:7.1 酸及其性质 第一课时
文档属性
| 名称 | 鲁教版化学九下导学案:7.1 酸及其性质 第一课时 |
|
|
| 格式 | doc | ||
| 文件大小 | 43.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-21 23:27:36 | ||
图片预览


文档简介
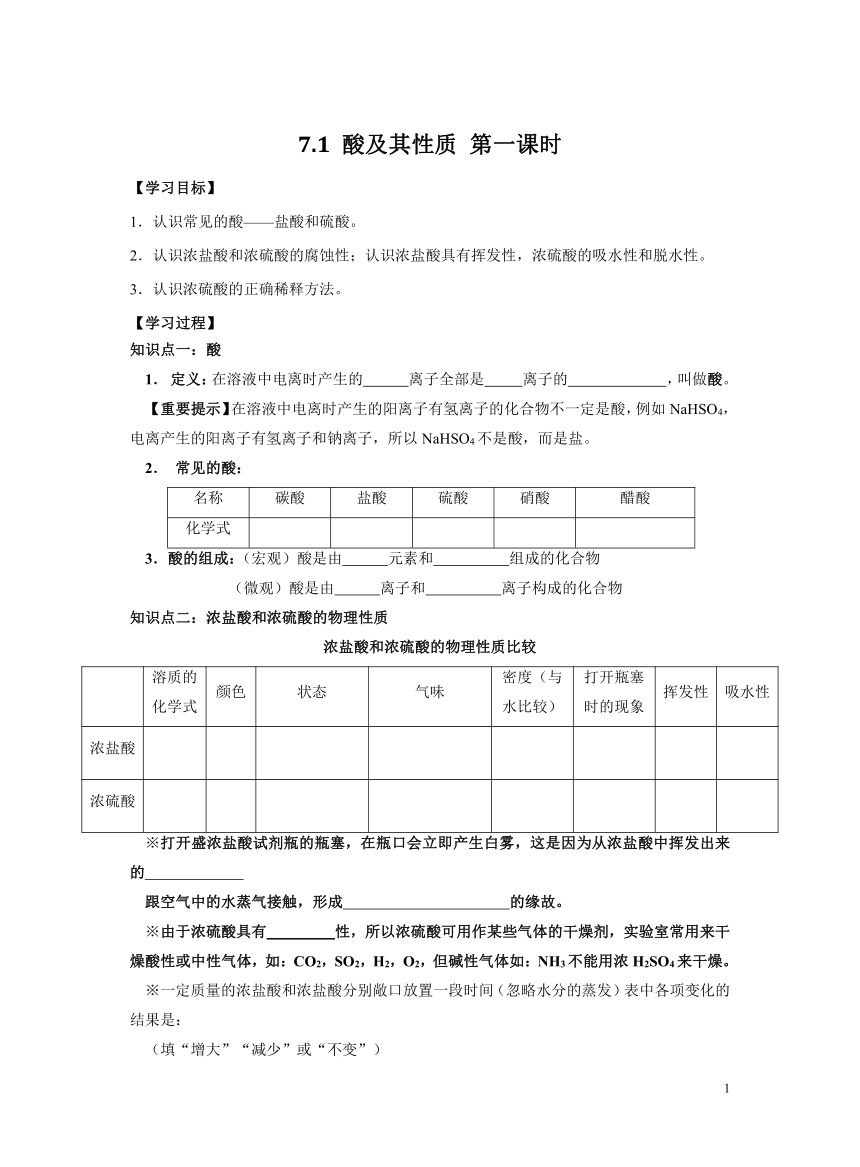
7.1 酸及其性质 第一课时
【学习目标】
1.认识常见的酸——盐酸和硫酸。
2.认识浓盐酸和浓硫酸的腐蚀性;认识浓盐酸具有挥发性,浓硫酸的吸水性和脱水性。
3.认识浓硫酸的正确稀释方法。
【学习过程】
知识点一:酸
1. 定义:在溶液中电离时产生的 离子全部是 离子的 ,叫做酸。
【重要提示】在溶液中电离时产生的阳离子有氢离子的化合物不一定是酸,例如NaHSO4,电离产生的阳离子有氢离子和钠离子,所以NaHSO4不是酸,而是盐。
2. 常见的酸:
名称 碳酸 盐酸 硫酸 硝酸 醋酸
化学式
3.酸的组成:(宏观)酸是由 元素和 组成的化合物
(微观)酸是由 离子和 离子构成的化合物
知识点二:浓盐酸和浓硫酸的物理性质
浓盐酸和浓硫酸的物理性质比较
溶质的化学式 颜色 状态 气味 密度(与水比较) 打开瓶塞时的现象 挥发性 吸水性
浓盐酸
浓硫酸
※打开盛浓盐酸试剂瓶的瓶塞,在瓶口会立即产生白雾,这是因为从浓盐酸中挥发出来的
跟空气中的水蒸气接触,形成 的缘故。
※由于浓硫酸具有 性,所以浓硫酸可用作某些气体的干燥剂,实验室常用来干燥酸性或中性气体,如:CO2,SO2,H2,O2,但碱性气体如:NH3不能用浓H2SO4来干燥。
※一定质量的浓盐酸和浓盐酸分别敞口放置一段时间(忽略水分的蒸发)表中各项变化的结果是:
(填“增大”“减少”或“不变”)
溶质质量 溶剂质量 溶液质量 溶质质量分数
浓盐酸
浓硫酸
知识点四:浓硫酸的腐蚀性
脱水性:纸、木柴、衣服等遇浓硫酸变黑,这就是因为浓硫酸的脱水性使其炭化的缘故。脱水性是浓硫酸的化学性质之一。
知识点五:浓硫酸的意外处理方法
如果浓硫酸不小心沾到皮肤或衣服上,应立即用大量的 冲洗,然后涂3%~5%的 溶液。
说明:不能先用干抹布擦除然后再用大量水冲洗,因为浓硫酸的脱水性会使干抹布炭化变黑;又由于浓硫酸溶于水放出的热被水冲洗时不会超过40℃,所以先用大量水冲洗才不会烫伤皮肤。
知识点六:浓硫酸的稀释
稀释浓硫酸时,一定要将 沿着容器壁慢慢地注入 里,并不断 ,使产生的热量迅速地 ;切不可把水倒入浓硫酸中,因为水的密度较小,会浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅。
【随堂练习】
1.化学上常对物质进行分类和研究,以下物质中属于酸的是( )
A.NaCl B.MgO C.O2 D.HNO3
2.下列物质露置于空气中,质量会变小的是( )
A.浓硫酸 B.浓盐酸 C.石灰石 D.氯化钠
3.下列物质敞口放置一段时间后,质量增加但溶质成分没有改变的是( )
A.食盐溶液 B.石灰水 C.浓硫酸 D.浓盐酸
4. 将浓盐酸和浓硫酸敞口放置在空气中,一段时间后,可以肯定的是( )
A.溶质的质量都减小 B.溶剂的质量都增大
C.溶液的质量都增大 D.溶质的质量分数都减小
5.某研究性学习小组将溶质质量分数不同的两瓶酸溶液,在实验室中敞口放置,测得它们的质量与放置天数的关系如右图所示,则a、b分别代表( )
A.浓盐酸、稀盐酸 B.稀盐酸、浓盐酸
C.浓硫酸、稀硫酸 D.浓盐酸、浓硫酸
6.下列关于溶质质量分数为98%的浓硫酸性质说法错误的是( )
A.浓硫酸的密度大于水的密度
B.浓硫酸与水混合时,溶液温度迅速升高
C.浓硫酸具有很强的吸水性,可以用于干燥CO、H2等气体
D.浓硫酸腐蚀衣物和皮肤是物理变化
7.进行化学实验必须注意安全,下列做法符合实际的是( )
A.不慎将浓硫酸沾到皮肤上,应立即用稀氨水冲洗,再涂上硼酸溶液
B.氢氧化钠有强烈的腐蚀性,实验使用时,最好戴上防护眼镜
C.在实验室里可用品尝的办法区别食盐和蔗糖晶体
D.配制稀硫酸时可先在量筒中加入一定量的浓硫酸,再慢慢注入水并不断搅拌
8.实验室中常需要使用硫酸。
(1)用小木棍蘸少量浓硫酸,放置一会儿后,可观察到 。
(2)98%的浓硫酸稀释为稀硫酸时,一定要将 沿烧杯壁缓慢地注入盛有 的烧杯里,并用 搅拌,此时若用手轻轻触碰烧杯外壁,有 的感觉。
答案
1.D 2.B 3.C 4.D 5.D 6.D 7.B
8.(1)蘸有浓硫酸的部位变黑
(2)浓硫酸;水;玻璃棒;热
1
【学习目标】
1.认识常见的酸——盐酸和硫酸。
2.认识浓盐酸和浓硫酸的腐蚀性;认识浓盐酸具有挥发性,浓硫酸的吸水性和脱水性。
3.认识浓硫酸的正确稀释方法。
【学习过程】
知识点一:酸
1. 定义:在溶液中电离时产生的 离子全部是 离子的 ,叫做酸。
【重要提示】在溶液中电离时产生的阳离子有氢离子的化合物不一定是酸,例如NaHSO4,电离产生的阳离子有氢离子和钠离子,所以NaHSO4不是酸,而是盐。
2. 常见的酸:
名称 碳酸 盐酸 硫酸 硝酸 醋酸
化学式
3.酸的组成:(宏观)酸是由 元素和 组成的化合物
(微观)酸是由 离子和 离子构成的化合物
知识点二:浓盐酸和浓硫酸的物理性质
浓盐酸和浓硫酸的物理性质比较
溶质的化学式 颜色 状态 气味 密度(与水比较) 打开瓶塞时的现象 挥发性 吸水性
浓盐酸
浓硫酸
※打开盛浓盐酸试剂瓶的瓶塞,在瓶口会立即产生白雾,这是因为从浓盐酸中挥发出来的
跟空气中的水蒸气接触,形成 的缘故。
※由于浓硫酸具有 性,所以浓硫酸可用作某些气体的干燥剂,实验室常用来干燥酸性或中性气体,如:CO2,SO2,H2,O2,但碱性气体如:NH3不能用浓H2SO4来干燥。
※一定质量的浓盐酸和浓盐酸分别敞口放置一段时间(忽略水分的蒸发)表中各项变化的结果是:
(填“增大”“减少”或“不变”)
溶质质量 溶剂质量 溶液质量 溶质质量分数
浓盐酸
浓硫酸
知识点四:浓硫酸的腐蚀性
脱水性:纸、木柴、衣服等遇浓硫酸变黑,这就是因为浓硫酸的脱水性使其炭化的缘故。脱水性是浓硫酸的化学性质之一。
知识点五:浓硫酸的意外处理方法
如果浓硫酸不小心沾到皮肤或衣服上,应立即用大量的 冲洗,然后涂3%~5%的 溶液。
说明:不能先用干抹布擦除然后再用大量水冲洗,因为浓硫酸的脱水性会使干抹布炭化变黑;又由于浓硫酸溶于水放出的热被水冲洗时不会超过40℃,所以先用大量水冲洗才不会烫伤皮肤。
知识点六:浓硫酸的稀释
稀释浓硫酸时,一定要将 沿着容器壁慢慢地注入 里,并不断 ,使产生的热量迅速地 ;切不可把水倒入浓硫酸中,因为水的密度较小,会浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅。
【随堂练习】
1.化学上常对物质进行分类和研究,以下物质中属于酸的是( )
A.NaCl B.MgO C.O2 D.HNO3
2.下列物质露置于空气中,质量会变小的是( )
A.浓硫酸 B.浓盐酸 C.石灰石 D.氯化钠
3.下列物质敞口放置一段时间后,质量增加但溶质成分没有改变的是( )
A.食盐溶液 B.石灰水 C.浓硫酸 D.浓盐酸
4. 将浓盐酸和浓硫酸敞口放置在空气中,一段时间后,可以肯定的是( )
A.溶质的质量都减小 B.溶剂的质量都增大
C.溶液的质量都增大 D.溶质的质量分数都减小
5.某研究性学习小组将溶质质量分数不同的两瓶酸溶液,在实验室中敞口放置,测得它们的质量与放置天数的关系如右图所示,则a、b分别代表( )
A.浓盐酸、稀盐酸 B.稀盐酸、浓盐酸
C.浓硫酸、稀硫酸 D.浓盐酸、浓硫酸
6.下列关于溶质质量分数为98%的浓硫酸性质说法错误的是( )
A.浓硫酸的密度大于水的密度
B.浓硫酸与水混合时,溶液温度迅速升高
C.浓硫酸具有很强的吸水性,可以用于干燥CO、H2等气体
D.浓硫酸腐蚀衣物和皮肤是物理变化
7.进行化学实验必须注意安全,下列做法符合实际的是( )
A.不慎将浓硫酸沾到皮肤上,应立即用稀氨水冲洗,再涂上硼酸溶液
B.氢氧化钠有强烈的腐蚀性,实验使用时,最好戴上防护眼镜
C.在实验室里可用品尝的办法区别食盐和蔗糖晶体
D.配制稀硫酸时可先在量筒中加入一定量的浓硫酸,再慢慢注入水并不断搅拌
8.实验室中常需要使用硫酸。
(1)用小木棍蘸少量浓硫酸,放置一会儿后,可观察到 。
(2)98%的浓硫酸稀释为稀硫酸时,一定要将 沿烧杯壁缓慢地注入盛有 的烧杯里,并用 搅拌,此时若用手轻轻触碰烧杯外壁,有 的感觉。
答案
1.D 2.B 3.C 4.D 5.D 6.D 7.B
8.(1)蘸有浓硫酸的部位变黑
(2)浓硫酸;水;玻璃棒;热
1
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
