专题8有机化合物的获得与应用检测题(含答案)2022-2023学年下学期高一化学苏教版(2019)必修第二册
文档属性
| 名称 | 专题8有机化合物的获得与应用检测题(含答案)2022-2023学年下学期高一化学苏教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 427.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-22 10:57:13 | ||
图片预览




文档简介
专题8 有机化合物的获得与应用 检测题
一、单选题
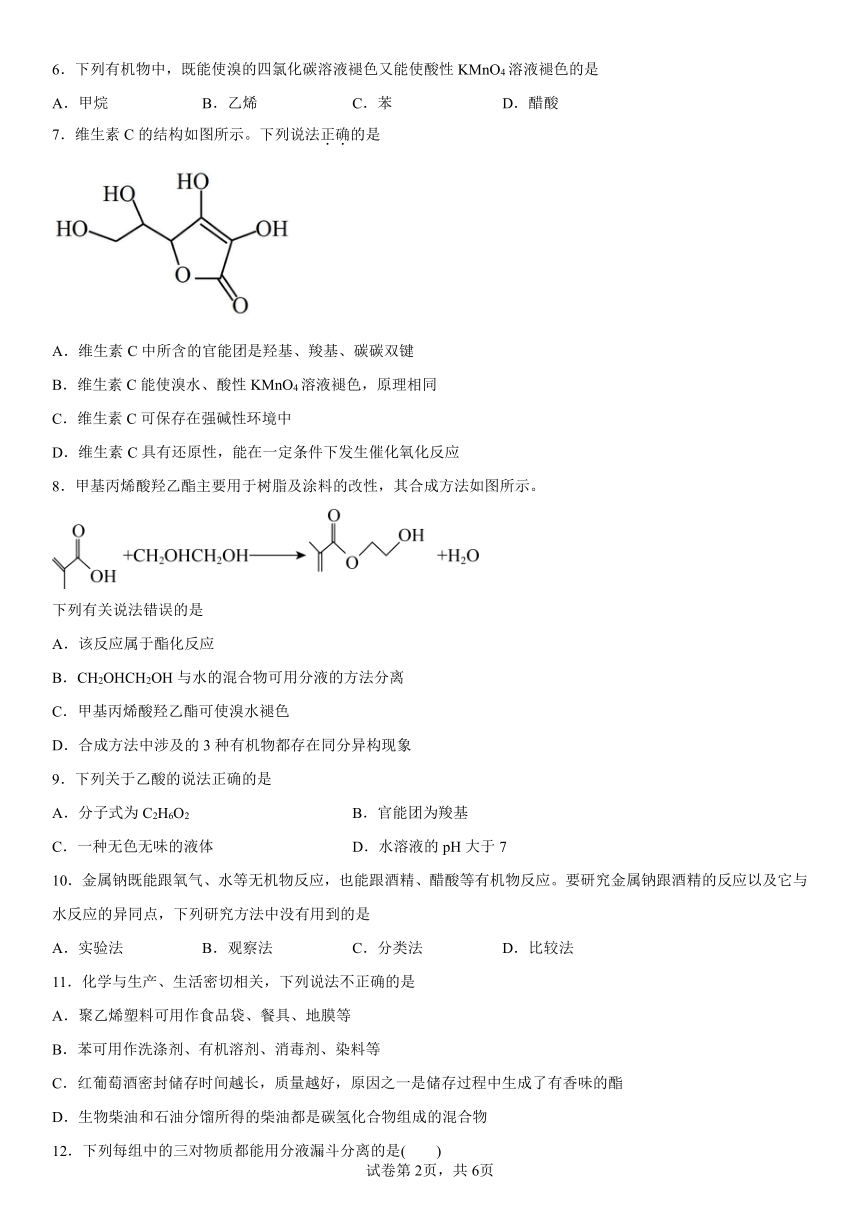
1.下列关于乙酸性质的叙述不正确的是( )
A.它的晶体里有冰,所以称为冰醋酸
B.乙酸具有酸性,能使酸碱指示剂变色
C.乙酸能使氢氧化铜沉淀或氧化铜固体溶解
D.乙酸能与碳酸盐溶液反应,产生二氧化碳气体
2.某种可用于治疗心脏病的药物X的结构简式为,下列有关X的说法错误的是
A.X可能有香味,是乙酸乙酯的同系物
B.X不溶于水,密度可能比水的小
C.遇碱溶液或酸溶液均易变质
D.与X互为同分异构体
3.设NA为阿伏加德罗常数的值,下列说法正确的是
A.1molNa2O2与足量CO2充分反应转移的电子数为0.5NA
B.0.1molCu与浓硝酸充分反应最终得到NO分子的数目为0.2NA
C.标准状况下,22.4L由SO2和CO2组成的混合气体中含有的氧原子数为2NA
D.一定量无水乙醇与足量钠反应生成0.5gH2则该无水乙醇中含有的C—H键数为2NA
4.有下列高分子化合物:
其中由两种不同单体聚合而成的是
A.①⑤ B.③④⑤ C.②④⑤ D.①②④
5.下列关于有机化合物的说法正确的是
A.乙酸和乙酸乙酯可用溶液加以区别 B.戊烷()有两种同分异构体
C.苯可以与溴水发生加成反应而使溴水褪色 D.可以通过酸性高锰酸钾溶液除去乙烷中的乙烯
6.下列有机物中,既能使溴的四氯化碳溶液褪色又能使酸性KMnO4溶液褪色的是
A.甲烷 B.乙烯 C.苯 D.醋酸
7.维生素C的结构如图所示。下列说法正确的是
A.维生素C中所含的官能团是羟基、羧基、碳碳双键
B.维生素C能使溴水、酸性KMnO4溶液褪色,原理相同
C.维生素C可保存在强碱性环境中
D.维生素C具有还原性,能在一定条件下发生催化氧化反应
8.甲基丙烯酸羟乙酯主要用于树脂及涂料的改性,其合成方法如图所示。
下列有关说法错误的是
A.该反应属于酯化反应
B.CH2OHCH2OH与水的混合物可用分液的方法分离
C.甲基丙烯酸羟乙酯可使溴水褪色
D.合成方法中涉及的3种有机物都存在同分异构现象
9.下列关于乙酸的说法正确的是
A.分子式为C2H6O2 B.官能团为羧基
C.一种无色无味的液体 D.水溶液的pH大于7
10.金属钠既能跟氧气、水等无机物反应,也能跟酒精、醋酸等有机物反应。要研究金属钠跟酒精的反应以及它与水反应的异同点,下列研究方法中没有用到的是
A.实验法 B.观察法 C.分类法 D.比较法
11.化学与生产、生活密切相关,下列说法不正确的是
A.聚乙烯塑料可用作食品袋、餐具、地膜等
B.苯可用作洗涤剂、有机溶剂、消毒剂、染料等
C.红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯
D.生物柴油和石油分馏所得的柴油都是碳氢化合物组成的混合物
12.下列每组中的三对物质都能用分液漏斗分离的是( )
A.乙酸乙酯和水、酒精和水、乙酸和水
B.溴苯和水、甲苯和苯、苯和水
C.硝基苯和水、乙醇和水、乙酸和乙醇
D.四氯化碳和水、甲苯和水、硝基苯和水
13.向装有乙醇的烧杯中投入一小块金属钠,下列对该实验现象的描述正确的是
A.刚开始钠块浮在乙醇的上面
B.钠块熔化成小球
C.钠块发出“嘶嘶”的响声
D.钠块表面有气泡产生
14.化学与生活密切相关。下列说法不正确的是
A.高温可杀灭细菌,是由于高温可使蛋白质变性
B.淀粉水解的最终产物是葡萄糖
C.油脂、蛋白质、糖类属于高分子化合物
D.维生素C常与补铁剂(有效成分中铁元素为+2价)同服,是由于它具有还原性
15.下列化学用语表达不正确的是
A.氯原子的结构示意图 B.氨分子的电子式:
C.CH4分子的球棍模型 D.乙醇的结构简式C2H6O
二、填空题
16.将一根下端绕成螺旋状的铜丝烧至表面由红变黑,迅速插入盛有乙醇的试管中,铜丝表面又由黑变红,反复多次,闻到有别于乙醇气味的特殊气味。回答下列问题。
(1)乙醇分子的官能团是____。
(2)特殊气味的产生,主要是因为反应生成了____(写结构简式)。
(3)该实验说明乙醇具有____(填“氧化”或“还原”)性。
17.(1)写出下列结构简式:
硬脂酸________三溴苯酚________对苯二甲酸________甘油_________
(2)写方程式:
乙酸乙酯在NaOH条件下的水解__________________
乙醇的催化氧化_________
环己醇的消去反应 ________
18.天然气是一种清洁能源和重要化工原料;瓦斯爆炸是煤矿开采中的重大危害。天然气和瓦斯的主要成分都是甲烷。
(1)下列事实能说明CH4分子呈正四面体结构的是___________
A.CH4分子的4个C-H共价键键长相等
B.CH4分子中每个键角都是109°28′
C.CCl4的沸点高于CH4的
D.CH2F2没有同分异构体
(2)一种瓦斯分析仪能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是___________
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,固体电解质中O2-由电极b流向电极a
C.电极a的反应式为:CH4+4O2-_8e-=CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
(3)现有a、b、c、d四种烃,分子结构如下图所示:
① 其中与甲烷的通式相同的烃是___________
② a能使溴的四氯化碳溶液褪色,写出发生反应的化学方程式___________,反应类型为___________
③ a在一定条件下能生成高分子化合物,写出发生反应的化学方程式___________,反应类型为___________
19.丙烯酸乙酯是一种食品用合成香料,工业上可以用乙烯、丙烯等石油化工产品为原科进行合成(如图):
(1)有机物A的结构简式为____。
(2)有机物B含有的官能团为___。A与B反应生成丙烯酸乙酯的化学方程式是____。
(3)下列试剂可以用来鉴别有机物A和B的是____(填字母序号)。
A.氯化钠溶液 B.酸性高锰酸钾溶液
C.溴水 D.碳酸钠溶液
(4)久置的丙烯酸乙酯自身会发生反应生成,该反应类型是____。
20.如图是利用碳原子、氢原子模型搭建的某有机物的球根模型,回答以下问题:
(1)该物质的分子式是_______,结构简式是_______。
(2)该分子中,碳原子形成的化学键有(选填序号)_______。
a.碳碳单键 b.碳碳双键 c.碳氢键
(3)某同学拼出的球棍模型如图,该结构中碳原子形成的共价键数目不正确。请从原子结构角度解释碳原子应形成4个共价键的原因_______。
21.将下列物质进行分类:①与 ②O2与O3③乙醇与甲醚(CH3OCH3)④H2O与D2O ⑤CH3CH2CH2CH2CH3与CH3CH(CH3)CH3⑥C60与C70
(1)互为同位素的是______________________(填编号、下同);
(2)互为同素异形体的是__________________;
(3)互为同分异构体的是_________________;
(4)互为同系物的是_____________________。
22.感光性高分子材料又称为“光敏性高分子材料”,是一种在彩电荧光屏及大规模集成电路制造中应用较广的新型高分子材料。其结构简式如图所示。
试回答下列问题:
(1)在一定条件下,该高聚物可发生的反应有________(填序号)。
①加成反应 ②氧化反应 ③卤代反应 ④酯化反应
(2)该高聚物在催化剂的作用下,水解后得到相对分子质量较小的产物A,则:
①A的分子式是_________;
②A在一定条件下与乙醇反应的化学方程式是_______________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A. 乙酸的熔点为16.6℃,温度低于熔点时,乙酸凝结成类似冰一样的晶体,纯净的乙酸又叫冰醋酸,属于纯净物,A符合题意;
B. 乙酸具有酸的通性,能使酸碱指示剂变色,B不符合题意;
C. 乙酸具有酸性,能与碱(如氢氧化铜)或碱性氧化物(如氧化铜)等反应生成盐和水,C不符合题意;
D. 乙酸的酸性比碳酸强,能与碳酸盐溶液反应,产生二氧化碳气体,D不符合题意。
答案选A。
2.A
【详解】A. X中含有碳环结构,不可能是乙酸乙酯的同系物,故A错误;
B. X属于酯类物质,不溶于水,密度可能比水的小,故B正确;
C. X属于酯类物质,遇碱溶液或酸溶液均会因为水解而变质,故C正确;
D. 与X分子式相同,结构不同,互为同分异构体,故D正确,
故选A。
3.C
【详解】A.Na2O2与CO2反应属于歧化反应,由转移电子关系:2Na2O2~O2~2e-,知转移电子物质的量=n(Na2O2)=1 mol,即1 NA,A错误;
B.Cu与浓硝酸反应主要得到NO2,而不是NO,B错误;
C.混合气体的物质的量n=,由于每个分子均含2个氧原子,故混合气体含有氧原子物质的量为2 mol,即2NA,C正确;
D.乙醇与Na反应的是羟基上的O—H键,由反应生成的H2可确定乙醇中O—H键数目,而不是C—H键数目,D错误;
故答案选C。
4.B
【详解】①的单体是苯乙烯;②的单体是2-氯-1,3丁二烯;③的单体是苯酚和甲醛;④的单体是乙烯和丙烯;⑤的单体是对苯二甲酸和乙二醇;故B正确。
5.A
【详解】A.乙酸和碳酸氢钠反应放出二氧化碳气体,乙酸和乙酸乙酯可用溶液加以区别,故A正确;
B.戊烷()有正戊烷、异戊烷、新戊烷三种同分异构体,故B错误;
C.苯与溴水不反应,故C错误;
D.乙烯能被酸性高锰酸钾氧化为二氧化碳,乙烷和乙烯的混合气体通过高锰酸钾溶液,会引入新杂质二氧化碳,一般用溴水除乙烷中的乙烯,故D错误;
选A。
6.B
【详解】A.甲烷属于饱和烃,不能与溴的四氯化碳溶液、酸性KMnO4溶液反应,导致溶液褪色,故A错误;
B.乙烯能使溴的四氯化碳溶液褪色,发生加成反应,也能使酸性KMnO4溶液褪色,发生氧化反应,故B正确;
C.苯的结构很稳定,不能与溴的四氯化碳溶液、酸性KMnO4溶液反应,导致溶液褪色,故C错误;
D. 醋酸显酸性,不能与溴的四氯化碳溶液、酸性KMnO4溶液反应,导致溶液褪色,故D错误;
综上所述,答案为B。
7.D
【详解】A.根据维生素C分子结构可知:其分子中所含的官能团是羟基、酯基、碳碳双键,A错误;
B.维生素C能使溴水褪色是由于发生加成反应,而使酸性KMnO4溶液褪色,发生的是氧化反应,可见二者的反应原理不相同,B错误;
C.维生素C分子中含有酯基,在碱性条件下会发生水解反应导致变质,因此不可保存在强碱性环境中,C错误;
D.维生素C分子中含有醇羟基和碳碳双键,具有还原性,能在一定条件下发生催化氧化反应,D正确;
故合理选项是D。
8.B
【详解】A.该方法涉 及的反应属于酯化反应,A项正确;
B.CH2OHCH2OH与水的混合物应用蒸馏的方法分离,B项错误;
C.甲基丙烯酸羟乙酯中含碳碳双键,C项正确;
D.3种有机物均存在同分异构现象,D项正确;
故选B。
9.B
【分析】乙酸也叫醋酸、冰醋酸,结构简式CH3COOH,常温下是一种有强烈刺激性气味的无色液体,是一种有机一元酸,易溶于水和乙醇,其水溶液呈弱酸性,pH小于7,据此分析解答。
【详解】A.根据分析,乙酸结构简式为CH3COOH,则分子式为C2H4O2,故A错误;
B.乙酸是一种有机一元酸,官能团为羧基(-COOH),故B正确;
C.根据分析,乙酸常温下是一种有强烈刺激性气味的无色液体,故C错误;
D.乙酸易溶于水和乙醇,其水溶液呈弱酸性,pH小于7,故D错误;
答案选B。
10.C
【详解】要研究金属钠跟酒精的反应以及它与水反应的异同点,需要通过观察实验现象,比较金属钠跟酒精的反应以及它与水反应的异同点,所以下列研究方法中没有用到的是分类法,故选C。
11.D
【详解】A. 聚乙烯塑料耐化学腐蚀,耐寒,可用作食品袋、餐具、地膜等,A项正确;
B. 苯是重要的化工原料,也是重要的有机溶剂,可用作洗涤剂、有机溶剂、消毒剂、染料等,B项正确;
C. 乙醇易被氧化生成乙酸,乙酸和乙醇在一定条件下反应生成具有香味的乙酸乙酯,C项正确;
D. 生物柴油的主要成分为酯类,含碳、氢、氧元素,属于烃的衍生物的混合物,石油分馏所得的柴油是碳氢化合物的混合物,D项错误;
答案选D。
12.D
【分析】根据分液漏斗可以将互不相溶的两层液体分开,一般来说:有机溶质易溶于有机溶剂,无机溶质易溶于无机溶剂,据此解答。
【详解】A.酒精和水混溶,乙酸溶于水,因此不能用分液方法分离,A错误;
B.甲苯溶于苯,不能用分液方法分离,B错误;
C.乙醇溶于水,乙酸溶于乙醇,不能用分液方法分离,C错误;
D.水与四氯化碳、甲苯、硝基苯均不溶,可以用分液方法分离,D正确;
故选D。
13.D
【分析】乙醇中含有羟基,能与金属钠缓慢反应生成氢气,乙醇的密度比钠小,比在水中反应安静,据此分析解答。
【详解】A.钠的密度大于乙醇,所以刚开始钠会沉在乙醇底部,故A错误;
B.钠和乙醇的反应缓慢,放热慢,不足以将钠融化,故B错误;
C.钠与乙醇反应缓慢,不发出“嘶嘶”的响声,故C错误;
D.钠和乙醇反应生成乙醇钠和氢气,钠表面有气体放出,故D正确;
故选D。
14.C
【详解】A.高温能破坏蛋白质分子的空间结构,使蛋白质失去原有的生理活性,发生变性,故可以用高温杀灭细菌,A正确;
B.淀粉是由葡萄糖分子聚合而成的多糖,淀粉水解的最终产物是葡萄糖,B正确;
C.蛋白质、多糖属于高分子化合物,油脂、单糖、二糖等属于小分子,C错误;
D.+2价铁元素具有还原性,易被氧化成+3价的铁元素,由于维生素C具有还原性,可防止补铁剂中+2价的铁元素被氧化,故维生素C常与补铁剂(有效成分中铁元素为+2价)同服,D正确;
选C。
15.D
【详解】A.氯原子核外有17个电子,第一层排2个电子,第二层排8个电子,第三层排7个电子,对应原子结构示意图为:,A正确;
B.NH3分子中N与H之间通过共用电子对达到稳定结构,对应电子式为:,B正确;
C.CH4中C原子与其所连4个H原子形成正四面体结构,对应球棍模型为:,C正确;
D.乙醇的结构简式为CH3CH2OH(或C2H5OH),C2H6O为乙醇分子式,D错误;
故答案选D。
16. 羟基(或-OH) CH3-CHO 还原
【详解】(1)决定有机物化学性质的原子或原子团为有机物的官能团,在乙醇中,醇羟基决定了乙醇的化学性质,故乙醇的官能团为羟基(或-OH);
(2)题目中的实验为乙醇的催化氧化实验,乙醇在Cu或Ag的催化下与空气中的O2反应生成有刺激性气味的乙醛,其结构简式为CH3-CHO;
(3)乙醇发生催化氧化反应,说明乙醇具有还原性。
17. CH3(CH2)16COOH CH3COOCH2CH3+NaOHCH3COONa+CH3CH2OH 2CH3CH2OH+O22CH3CHO + 2H2O
【详解】(1)硬脂酸的结构简式为CH3(CH2)16COOH;三溴苯酚的结构简式为;对苯二甲酸的结构简式为;甘油的结构简式为;
(2)乙酸乙酯在NaOH条件下的水解的化学方程式为CH3COOCH2CH3+NaOHCH3COONa+CH3CH2OH;
乙醇的催化氧化的化学方程式为2CH3CH2OH+O22CH3CHO + 2H2O;
环己醇的消去反应的化学方程式为。
18. BD BC cd CH2=CH2+Br2 →CH2BrCH2Br 加成反应 nCH2=CH2 加聚反应(聚合反应)
【详解】(1) A.甲烷无论是正四面体结构还是平面正方形,它的4个碳氢键的键长都相等,故A错误;
B.甲烷若为平面正方形,每个键角都是90°;现CH4分子中每个键角都是109°28′,说明甲烷分子呈正四面体结构,故B正确;
C.四氯化碳的相对分子质量大于甲烷的相对分子质量,所以甲烷无论是正四面体结构还是平面正方形,CCl4的沸点均高于CH4的沸点,不能证明CH4分子呈正四面体结构,故C错误;
D.甲烷若为平面正方形结构,则CH2F2有2种结构,即CH2F2存在同分异构体;若CH2F2没有同分异构体,可以说明CH4分子呈正四面体结构,故D正确;
故选BD;
(2)甲烷与空气组成的燃料电池,甲烷在负极发生氧化反应;氧气在正极发生还原反应;所以根据图示可知,电极a为负极,电极b为正极;电解质为固体Y2O3-Na2O;
A.电子只能从负极经过外电路流向正极,即电子由电极a流向电极b,电流的流向与之相反,但是电流不能流经内电路,故A错误;
B.结合以上分析可知,电极b是正极,阴离子向负极移动,固体电解质中O2-由电极b流向电极a,故B正确;
C.结合以上分析可知,电极a为负极,甲烷在此极发生氧化反应,反应式为:CH4+4O2-_8e-=CO2+2H2O,故C正确;
D.根据负极电极反应式:CH4+4O2-_8e-=CO2+2H2O可知,当固体电解质中有1 mol O2-通过时,电子转移2 mol,故D错误;
故选BC;
(3)根据a、b、c、d四种烃的分子结构图,可知a为乙烯,分子式为C2H4;b为苯,分子式为C6H6;c为正丁烷,分子式为C4H10;d为2-甲基丙烷,分子式为C4H10;
①烷烃通式为CnH2n+2,甲烷属于饱和烷烃,其中与甲烷的通式相同的烃是cd;
②a为乙烯,能够与溴发生加成反应,反应的化学方程式为:CH2=CH2+Br2 →CH2BrCH2Br;反应类型为加成反应;
③a为乙烯,a在一定条件下能生成高分子化合物聚乙烯,反应的化学方程式为:nCH2=CH2 ,反应类型为加聚反应(聚合反应)。
19.(1)CH3CH2OH
(2) 为碳碳双键、羧基
(3)CD
(4)加聚反应
【分析】丙烯酸乙酯由丙烯酸和乙醇经过酯化反应得到,故A为CH3CH2OH,B为CH2=CHCOOH。乙烯与水加成反应得到A,故M为H2O。
(1)
根据分析,A的结构简式为:CH3CH2OH;
(2)
B为CH2=CHCOOH,官能团为碳碳双键、羧基;丙烯酸乙酯由丙烯酸和乙醇经过酯化反应得到,方程式为:;
(3)
A. 乙醇与丙烯酸均能溶于氯化钠溶液,不能鉴别;
B. 乙醇和丙烯酸均能使酸性高锰酸钾溶液褪色,不能鉴别;
C. 乙醇与溴水互溶但不反应;丙烯酸中含双键,能与溴水发生加成反应使溴水褪色,可以鉴别;
D. 乙醇与碳酸钠溶液互溶,丙烯酸与碳酸钠溶液反应生成二氧化碳,可以鉴别;
故选CD。
(4)
丙烯酸乙酯生成聚丙烯酸乙酯,发生了加聚反应。
20.(1) C2H6 CH3CH3
(2)ac
(3)碳最外层由4个电子,则应形成4对共用电子对,达到8电子稳定结构,即应该形成4条共价键
【解析】(1)
由图中模型可知:该有机物的分子中含有2个C原子和6个H原子,故其分子式为C2H6,每个C原子与3个H原子形成3个C-H键,两个C原子之间形成C-C单键,给其结构简式为CH3CH3;
(2)
由图可知,该有机物中含有碳碳单键、碳氢单键,故合理选项是ac;
(3)
从原子结构角度解释碳原子应形成4个共价键的原因是:碳最外层由4个电子,则应形成4对共用电子对,使C原子达到最外层8电子稳定结构,即应该形成4条共价键。
21.(1)①
(2)②⑥
(3)③
(4)⑤
【详解】(1)具有相同质子数、不同中子数的原子,互为同位素;只有①与 符合具有相同质子数、不同中子数的原子,互为同位素;故答案为:①。
(2)同种元素的不同单质,互为同素异形体;只有②O2与O3 ⑥C60与C70符合同种元素的不同单质,互为同素异形体;故答案为:②⑥。
(3)分子式相同、结构不同的有机物,互为同分异构体;只有③乙醇与甲醚(CH3OCH3)符合分子式相同、结构不同的有机物,互为同分异构体;故答案为:③。
(4)结构相似,组成相差n个CH2原子团的有机物互为同系物,官能团的数目、种类应相同;只有⑤均为烷烃,符合结构相似,组成相差n个CH2原子团的有机物,二者互为同系物;故答案为:⑤。
22. ①②③
【详解】(1)该高聚物分子结构中含有碳碳双键,因此能够发生加成反应和氧化反应;该高聚物分子结构中含有苯环,因此能够发生卤代反应;该高聚物分子结构中既不含羧基也不含羟基,因此不能发生酯化反应,答案选①②③;
(2)①该高聚物在催化剂的作用下,水解后得到和,可见相对分子质量较小的产物A为,则该有机物的分子式为;
②在一定条件下能与乙醇发生酯化反应,化学方程式是。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列关于乙酸性质的叙述不正确的是( )
A.它的晶体里有冰,所以称为冰醋酸
B.乙酸具有酸性,能使酸碱指示剂变色
C.乙酸能使氢氧化铜沉淀或氧化铜固体溶解
D.乙酸能与碳酸盐溶液反应,产生二氧化碳气体
2.某种可用于治疗心脏病的药物X的结构简式为,下列有关X的说法错误的是
A.X可能有香味,是乙酸乙酯的同系物
B.X不溶于水,密度可能比水的小
C.遇碱溶液或酸溶液均易变质
D.与X互为同分异构体
3.设NA为阿伏加德罗常数的值,下列说法正确的是
A.1molNa2O2与足量CO2充分反应转移的电子数为0.5NA
B.0.1molCu与浓硝酸充分反应最终得到NO分子的数目为0.2NA
C.标准状况下,22.4L由SO2和CO2组成的混合气体中含有的氧原子数为2NA
D.一定量无水乙醇与足量钠反应生成0.5gH2则该无水乙醇中含有的C—H键数为2NA
4.有下列高分子化合物:
其中由两种不同单体聚合而成的是
A.①⑤ B.③④⑤ C.②④⑤ D.①②④
5.下列关于有机化合物的说法正确的是
A.乙酸和乙酸乙酯可用溶液加以区别 B.戊烷()有两种同分异构体
C.苯可以与溴水发生加成反应而使溴水褪色 D.可以通过酸性高锰酸钾溶液除去乙烷中的乙烯
6.下列有机物中,既能使溴的四氯化碳溶液褪色又能使酸性KMnO4溶液褪色的是
A.甲烷 B.乙烯 C.苯 D.醋酸
7.维生素C的结构如图所示。下列说法正确的是
A.维生素C中所含的官能团是羟基、羧基、碳碳双键
B.维生素C能使溴水、酸性KMnO4溶液褪色,原理相同
C.维生素C可保存在强碱性环境中
D.维生素C具有还原性,能在一定条件下发生催化氧化反应
8.甲基丙烯酸羟乙酯主要用于树脂及涂料的改性,其合成方法如图所示。
下列有关说法错误的是
A.该反应属于酯化反应
B.CH2OHCH2OH与水的混合物可用分液的方法分离
C.甲基丙烯酸羟乙酯可使溴水褪色
D.合成方法中涉及的3种有机物都存在同分异构现象
9.下列关于乙酸的说法正确的是
A.分子式为C2H6O2 B.官能团为羧基
C.一种无色无味的液体 D.水溶液的pH大于7
10.金属钠既能跟氧气、水等无机物反应,也能跟酒精、醋酸等有机物反应。要研究金属钠跟酒精的反应以及它与水反应的异同点,下列研究方法中没有用到的是
A.实验法 B.观察法 C.分类法 D.比较法
11.化学与生产、生活密切相关,下列说法不正确的是
A.聚乙烯塑料可用作食品袋、餐具、地膜等
B.苯可用作洗涤剂、有机溶剂、消毒剂、染料等
C.红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯
D.生物柴油和石油分馏所得的柴油都是碳氢化合物组成的混合物
12.下列每组中的三对物质都能用分液漏斗分离的是( )
A.乙酸乙酯和水、酒精和水、乙酸和水
B.溴苯和水、甲苯和苯、苯和水
C.硝基苯和水、乙醇和水、乙酸和乙醇
D.四氯化碳和水、甲苯和水、硝基苯和水
13.向装有乙醇的烧杯中投入一小块金属钠,下列对该实验现象的描述正确的是
A.刚开始钠块浮在乙醇的上面
B.钠块熔化成小球
C.钠块发出“嘶嘶”的响声
D.钠块表面有气泡产生
14.化学与生活密切相关。下列说法不正确的是
A.高温可杀灭细菌,是由于高温可使蛋白质变性
B.淀粉水解的最终产物是葡萄糖
C.油脂、蛋白质、糖类属于高分子化合物
D.维生素C常与补铁剂(有效成分中铁元素为+2价)同服,是由于它具有还原性
15.下列化学用语表达不正确的是
A.氯原子的结构示意图 B.氨分子的电子式:
C.CH4分子的球棍模型 D.乙醇的结构简式C2H6O
二、填空题
16.将一根下端绕成螺旋状的铜丝烧至表面由红变黑,迅速插入盛有乙醇的试管中,铜丝表面又由黑变红,反复多次,闻到有别于乙醇气味的特殊气味。回答下列问题。
(1)乙醇分子的官能团是____。
(2)特殊气味的产生,主要是因为反应生成了____(写结构简式)。
(3)该实验说明乙醇具有____(填“氧化”或“还原”)性。
17.(1)写出下列结构简式:
硬脂酸________三溴苯酚________对苯二甲酸________甘油_________
(2)写方程式:
乙酸乙酯在NaOH条件下的水解__________________
乙醇的催化氧化_________
环己醇的消去反应 ________
18.天然气是一种清洁能源和重要化工原料;瓦斯爆炸是煤矿开采中的重大危害。天然气和瓦斯的主要成分都是甲烷。
(1)下列事实能说明CH4分子呈正四面体结构的是___________
A.CH4分子的4个C-H共价键键长相等
B.CH4分子中每个键角都是109°28′
C.CCl4的沸点高于CH4的
D.CH2F2没有同分异构体
(2)一种瓦斯分析仪能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是___________
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,固体电解质中O2-由电极b流向电极a
C.电极a的反应式为:CH4+4O2-_8e-=CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
(3)现有a、b、c、d四种烃,分子结构如下图所示:
① 其中与甲烷的通式相同的烃是___________
② a能使溴的四氯化碳溶液褪色,写出发生反应的化学方程式___________,反应类型为___________
③ a在一定条件下能生成高分子化合物,写出发生反应的化学方程式___________,反应类型为___________
19.丙烯酸乙酯是一种食品用合成香料,工业上可以用乙烯、丙烯等石油化工产品为原科进行合成(如图):
(1)有机物A的结构简式为____。
(2)有机物B含有的官能团为___。A与B反应生成丙烯酸乙酯的化学方程式是____。
(3)下列试剂可以用来鉴别有机物A和B的是____(填字母序号)。
A.氯化钠溶液 B.酸性高锰酸钾溶液
C.溴水 D.碳酸钠溶液
(4)久置的丙烯酸乙酯自身会发生反应生成,该反应类型是____。
20.如图是利用碳原子、氢原子模型搭建的某有机物的球根模型,回答以下问题:
(1)该物质的分子式是_______,结构简式是_______。
(2)该分子中,碳原子形成的化学键有(选填序号)_______。
a.碳碳单键 b.碳碳双键 c.碳氢键
(3)某同学拼出的球棍模型如图,该结构中碳原子形成的共价键数目不正确。请从原子结构角度解释碳原子应形成4个共价键的原因_______。
21.将下列物质进行分类:①与 ②O2与O3③乙醇与甲醚(CH3OCH3)④H2O与D2O ⑤CH3CH2CH2CH2CH3与CH3CH(CH3)CH3⑥C60与C70
(1)互为同位素的是______________________(填编号、下同);
(2)互为同素异形体的是__________________;
(3)互为同分异构体的是_________________;
(4)互为同系物的是_____________________。
22.感光性高分子材料又称为“光敏性高分子材料”,是一种在彩电荧光屏及大规模集成电路制造中应用较广的新型高分子材料。其结构简式如图所示。
试回答下列问题:
(1)在一定条件下,该高聚物可发生的反应有________(填序号)。
①加成反应 ②氧化反应 ③卤代反应 ④酯化反应
(2)该高聚物在催化剂的作用下,水解后得到相对分子质量较小的产物A,则:
①A的分子式是_________;
②A在一定条件下与乙醇反应的化学方程式是_______________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A. 乙酸的熔点为16.6℃,温度低于熔点时,乙酸凝结成类似冰一样的晶体,纯净的乙酸又叫冰醋酸,属于纯净物,A符合题意;
B. 乙酸具有酸的通性,能使酸碱指示剂变色,B不符合题意;
C. 乙酸具有酸性,能与碱(如氢氧化铜)或碱性氧化物(如氧化铜)等反应生成盐和水,C不符合题意;
D. 乙酸的酸性比碳酸强,能与碳酸盐溶液反应,产生二氧化碳气体,D不符合题意。
答案选A。
2.A
【详解】A. X中含有碳环结构,不可能是乙酸乙酯的同系物,故A错误;
B. X属于酯类物质,不溶于水,密度可能比水的小,故B正确;
C. X属于酯类物质,遇碱溶液或酸溶液均会因为水解而变质,故C正确;
D. 与X分子式相同,结构不同,互为同分异构体,故D正确,
故选A。
3.C
【详解】A.Na2O2与CO2反应属于歧化反应,由转移电子关系:2Na2O2~O2~2e-,知转移电子物质的量=n(Na2O2)=1 mol,即1 NA,A错误;
B.Cu与浓硝酸反应主要得到NO2,而不是NO,B错误;
C.混合气体的物质的量n=,由于每个分子均含2个氧原子,故混合气体含有氧原子物质的量为2 mol,即2NA,C正确;
D.乙醇与Na反应的是羟基上的O—H键,由反应生成的H2可确定乙醇中O—H键数目,而不是C—H键数目,D错误;
故答案选C。
4.B
【详解】①的单体是苯乙烯;②的单体是2-氯-1,3丁二烯;③的单体是苯酚和甲醛;④的单体是乙烯和丙烯;⑤的单体是对苯二甲酸和乙二醇;故B正确。
5.A
【详解】A.乙酸和碳酸氢钠反应放出二氧化碳气体,乙酸和乙酸乙酯可用溶液加以区别,故A正确;
B.戊烷()有正戊烷、异戊烷、新戊烷三种同分异构体,故B错误;
C.苯与溴水不反应,故C错误;
D.乙烯能被酸性高锰酸钾氧化为二氧化碳,乙烷和乙烯的混合气体通过高锰酸钾溶液,会引入新杂质二氧化碳,一般用溴水除乙烷中的乙烯,故D错误;
选A。
6.B
【详解】A.甲烷属于饱和烃,不能与溴的四氯化碳溶液、酸性KMnO4溶液反应,导致溶液褪色,故A错误;
B.乙烯能使溴的四氯化碳溶液褪色,发生加成反应,也能使酸性KMnO4溶液褪色,发生氧化反应,故B正确;
C.苯的结构很稳定,不能与溴的四氯化碳溶液、酸性KMnO4溶液反应,导致溶液褪色,故C错误;
D. 醋酸显酸性,不能与溴的四氯化碳溶液、酸性KMnO4溶液反应,导致溶液褪色,故D错误;
综上所述,答案为B。
7.D
【详解】A.根据维生素C分子结构可知:其分子中所含的官能团是羟基、酯基、碳碳双键,A错误;
B.维生素C能使溴水褪色是由于发生加成反应,而使酸性KMnO4溶液褪色,发生的是氧化反应,可见二者的反应原理不相同,B错误;
C.维生素C分子中含有酯基,在碱性条件下会发生水解反应导致变质,因此不可保存在强碱性环境中,C错误;
D.维生素C分子中含有醇羟基和碳碳双键,具有还原性,能在一定条件下发生催化氧化反应,D正确;
故合理选项是D。
8.B
【详解】A.该方法涉 及的反应属于酯化反应,A项正确;
B.CH2OHCH2OH与水的混合物应用蒸馏的方法分离,B项错误;
C.甲基丙烯酸羟乙酯中含碳碳双键,C项正确;
D.3种有机物均存在同分异构现象,D项正确;
故选B。
9.B
【分析】乙酸也叫醋酸、冰醋酸,结构简式CH3COOH,常温下是一种有强烈刺激性气味的无色液体,是一种有机一元酸,易溶于水和乙醇,其水溶液呈弱酸性,pH小于7,据此分析解答。
【详解】A.根据分析,乙酸结构简式为CH3COOH,则分子式为C2H4O2,故A错误;
B.乙酸是一种有机一元酸,官能团为羧基(-COOH),故B正确;
C.根据分析,乙酸常温下是一种有强烈刺激性气味的无色液体,故C错误;
D.乙酸易溶于水和乙醇,其水溶液呈弱酸性,pH小于7,故D错误;
答案选B。
10.C
【详解】要研究金属钠跟酒精的反应以及它与水反应的异同点,需要通过观察实验现象,比较金属钠跟酒精的反应以及它与水反应的异同点,所以下列研究方法中没有用到的是分类法,故选C。
11.D
【详解】A. 聚乙烯塑料耐化学腐蚀,耐寒,可用作食品袋、餐具、地膜等,A项正确;
B. 苯是重要的化工原料,也是重要的有机溶剂,可用作洗涤剂、有机溶剂、消毒剂、染料等,B项正确;
C. 乙醇易被氧化生成乙酸,乙酸和乙醇在一定条件下反应生成具有香味的乙酸乙酯,C项正确;
D. 生物柴油的主要成分为酯类,含碳、氢、氧元素,属于烃的衍生物的混合物,石油分馏所得的柴油是碳氢化合物的混合物,D项错误;
答案选D。
12.D
【分析】根据分液漏斗可以将互不相溶的两层液体分开,一般来说:有机溶质易溶于有机溶剂,无机溶质易溶于无机溶剂,据此解答。
【详解】A.酒精和水混溶,乙酸溶于水,因此不能用分液方法分离,A错误;
B.甲苯溶于苯,不能用分液方法分离,B错误;
C.乙醇溶于水,乙酸溶于乙醇,不能用分液方法分离,C错误;
D.水与四氯化碳、甲苯、硝基苯均不溶,可以用分液方法分离,D正确;
故选D。
13.D
【分析】乙醇中含有羟基,能与金属钠缓慢反应生成氢气,乙醇的密度比钠小,比在水中反应安静,据此分析解答。
【详解】A.钠的密度大于乙醇,所以刚开始钠会沉在乙醇底部,故A错误;
B.钠和乙醇的反应缓慢,放热慢,不足以将钠融化,故B错误;
C.钠与乙醇反应缓慢,不发出“嘶嘶”的响声,故C错误;
D.钠和乙醇反应生成乙醇钠和氢气,钠表面有气体放出,故D正确;
故选D。
14.C
【详解】A.高温能破坏蛋白质分子的空间结构,使蛋白质失去原有的生理活性,发生变性,故可以用高温杀灭细菌,A正确;
B.淀粉是由葡萄糖分子聚合而成的多糖,淀粉水解的最终产物是葡萄糖,B正确;
C.蛋白质、多糖属于高分子化合物,油脂、单糖、二糖等属于小分子,C错误;
D.+2价铁元素具有还原性,易被氧化成+3价的铁元素,由于维生素C具有还原性,可防止补铁剂中+2价的铁元素被氧化,故维生素C常与补铁剂(有效成分中铁元素为+2价)同服,D正确;
选C。
15.D
【详解】A.氯原子核外有17个电子,第一层排2个电子,第二层排8个电子,第三层排7个电子,对应原子结构示意图为:,A正确;
B.NH3分子中N与H之间通过共用电子对达到稳定结构,对应电子式为:,B正确;
C.CH4中C原子与其所连4个H原子形成正四面体结构,对应球棍模型为:,C正确;
D.乙醇的结构简式为CH3CH2OH(或C2H5OH),C2H6O为乙醇分子式,D错误;
故答案选D。
16. 羟基(或-OH) CH3-CHO 还原
【详解】(1)决定有机物化学性质的原子或原子团为有机物的官能团,在乙醇中,醇羟基决定了乙醇的化学性质,故乙醇的官能团为羟基(或-OH);
(2)题目中的实验为乙醇的催化氧化实验,乙醇在Cu或Ag的催化下与空气中的O2反应生成有刺激性气味的乙醛,其结构简式为CH3-CHO;
(3)乙醇发生催化氧化反应,说明乙醇具有还原性。
17. CH3(CH2)16COOH CH3COOCH2CH3+NaOHCH3COONa+CH3CH2OH 2CH3CH2OH+O22CH3CHO + 2H2O
【详解】(1)硬脂酸的结构简式为CH3(CH2)16COOH;三溴苯酚的结构简式为;对苯二甲酸的结构简式为;甘油的结构简式为;
(2)乙酸乙酯在NaOH条件下的水解的化学方程式为CH3COOCH2CH3+NaOHCH3COONa+CH3CH2OH;
乙醇的催化氧化的化学方程式为2CH3CH2OH+O22CH3CHO + 2H2O;
环己醇的消去反应的化学方程式为。
18. BD BC cd CH2=CH2+Br2 →CH2BrCH2Br 加成反应 nCH2=CH2 加聚反应(聚合反应)
【详解】(1) A.甲烷无论是正四面体结构还是平面正方形,它的4个碳氢键的键长都相等,故A错误;
B.甲烷若为平面正方形,每个键角都是90°;现CH4分子中每个键角都是109°28′,说明甲烷分子呈正四面体结构,故B正确;
C.四氯化碳的相对分子质量大于甲烷的相对分子质量,所以甲烷无论是正四面体结构还是平面正方形,CCl4的沸点均高于CH4的沸点,不能证明CH4分子呈正四面体结构,故C错误;
D.甲烷若为平面正方形结构,则CH2F2有2种结构,即CH2F2存在同分异构体;若CH2F2没有同分异构体,可以说明CH4分子呈正四面体结构,故D正确;
故选BD;
(2)甲烷与空气组成的燃料电池,甲烷在负极发生氧化反应;氧气在正极发生还原反应;所以根据图示可知,电极a为负极,电极b为正极;电解质为固体Y2O3-Na2O;
A.电子只能从负极经过外电路流向正极,即电子由电极a流向电极b,电流的流向与之相反,但是电流不能流经内电路,故A错误;
B.结合以上分析可知,电极b是正极,阴离子向负极移动,固体电解质中O2-由电极b流向电极a,故B正确;
C.结合以上分析可知,电极a为负极,甲烷在此极发生氧化反应,反应式为:CH4+4O2-_8e-=CO2+2H2O,故C正确;
D.根据负极电极反应式:CH4+4O2-_8e-=CO2+2H2O可知,当固体电解质中有1 mol O2-通过时,电子转移2 mol,故D错误;
故选BC;
(3)根据a、b、c、d四种烃的分子结构图,可知a为乙烯,分子式为C2H4;b为苯,分子式为C6H6;c为正丁烷,分子式为C4H10;d为2-甲基丙烷,分子式为C4H10;
①烷烃通式为CnH2n+2,甲烷属于饱和烷烃,其中与甲烷的通式相同的烃是cd;
②a为乙烯,能够与溴发生加成反应,反应的化学方程式为:CH2=CH2+Br2 →CH2BrCH2Br;反应类型为加成反应;
③a为乙烯,a在一定条件下能生成高分子化合物聚乙烯,反应的化学方程式为:nCH2=CH2 ,反应类型为加聚反应(聚合反应)。
19.(1)CH3CH2OH
(2) 为碳碳双键、羧基
(3)CD
(4)加聚反应
【分析】丙烯酸乙酯由丙烯酸和乙醇经过酯化反应得到,故A为CH3CH2OH,B为CH2=CHCOOH。乙烯与水加成反应得到A,故M为H2O。
(1)
根据分析,A的结构简式为:CH3CH2OH;
(2)
B为CH2=CHCOOH,官能团为碳碳双键、羧基;丙烯酸乙酯由丙烯酸和乙醇经过酯化反应得到,方程式为:;
(3)
A. 乙醇与丙烯酸均能溶于氯化钠溶液,不能鉴别;
B. 乙醇和丙烯酸均能使酸性高锰酸钾溶液褪色,不能鉴别;
C. 乙醇与溴水互溶但不反应;丙烯酸中含双键,能与溴水发生加成反应使溴水褪色,可以鉴别;
D. 乙醇与碳酸钠溶液互溶,丙烯酸与碳酸钠溶液反应生成二氧化碳,可以鉴别;
故选CD。
(4)
丙烯酸乙酯生成聚丙烯酸乙酯,发生了加聚反应。
20.(1) C2H6 CH3CH3
(2)ac
(3)碳最外层由4个电子,则应形成4对共用电子对,达到8电子稳定结构,即应该形成4条共价键
【解析】(1)
由图中模型可知:该有机物的分子中含有2个C原子和6个H原子,故其分子式为C2H6,每个C原子与3个H原子形成3个C-H键,两个C原子之间形成C-C单键,给其结构简式为CH3CH3;
(2)
由图可知,该有机物中含有碳碳单键、碳氢单键,故合理选项是ac;
(3)
从原子结构角度解释碳原子应形成4个共价键的原因是:碳最外层由4个电子,则应形成4对共用电子对,使C原子达到最外层8电子稳定结构,即应该形成4条共价键。
21.(1)①
(2)②⑥
(3)③
(4)⑤
【详解】(1)具有相同质子数、不同中子数的原子,互为同位素;只有①与 符合具有相同质子数、不同中子数的原子,互为同位素;故答案为:①。
(2)同种元素的不同单质,互为同素异形体;只有②O2与O3 ⑥C60与C70符合同种元素的不同单质,互为同素异形体;故答案为:②⑥。
(3)分子式相同、结构不同的有机物,互为同分异构体;只有③乙醇与甲醚(CH3OCH3)符合分子式相同、结构不同的有机物,互为同分异构体;故答案为:③。
(4)结构相似,组成相差n个CH2原子团的有机物互为同系物,官能团的数目、种类应相同;只有⑤均为烷烃,符合结构相似,组成相差n个CH2原子团的有机物,二者互为同系物;故答案为:⑤。
22. ①②③
【详解】(1)该高聚物分子结构中含有碳碳双键,因此能够发生加成反应和氧化反应;该高聚物分子结构中含有苯环,因此能够发生卤代反应;该高聚物分子结构中既不含羧基也不含羟基,因此不能发生酯化反应,答案选①②③;
(2)①该高聚物在催化剂的作用下,水解后得到和,可见相对分子质量较小的产物A为,则该有机物的分子式为;
②在一定条件下能与乙醇发生酯化反应,化学方程式是。
答案第1页,共2页
答案第1页,共2页
