3.3.2离子晶体 课件 (共19张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.3.2离子晶体 课件 (共19张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-22 11:28:00 | ||
图片预览



文档简介
(共19张PPT)
第三章 晶体结构与性质
3.3.2离子晶体
趣味引入
盐焗鸡,由客家人迁徙途中用盐包裹的“盐煨咸鸡”演变而来,其中鸡熟了盐却没化掉。但是做菜时加一抔水盐却溶解了。
强碱、活泼金属的氧化物和过氧化物、大多数盐
由阴离子和阳离子相互作用而形成的晶体,叫做离子晶体
常见的离子晶体( 离子化合物)
概念:
构成微粒:
微粒间的作用力:
阴、阳离子(有的存在中性分子H2O,NH3)
离子键为主(静电作用:包括静电引力和静电斥力)
一、离子晶体
无方向性与饱和性
固态
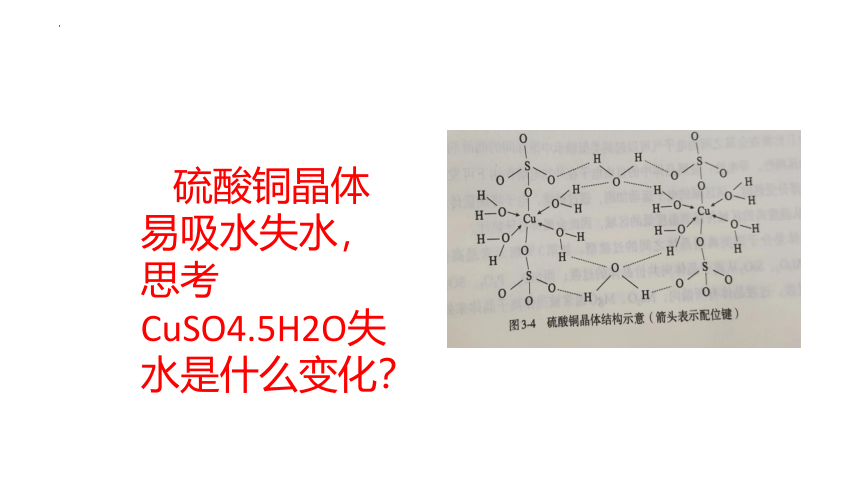
硫酸铜晶体易吸水失水,思考CuSO4.5H2O失水是什么变化?
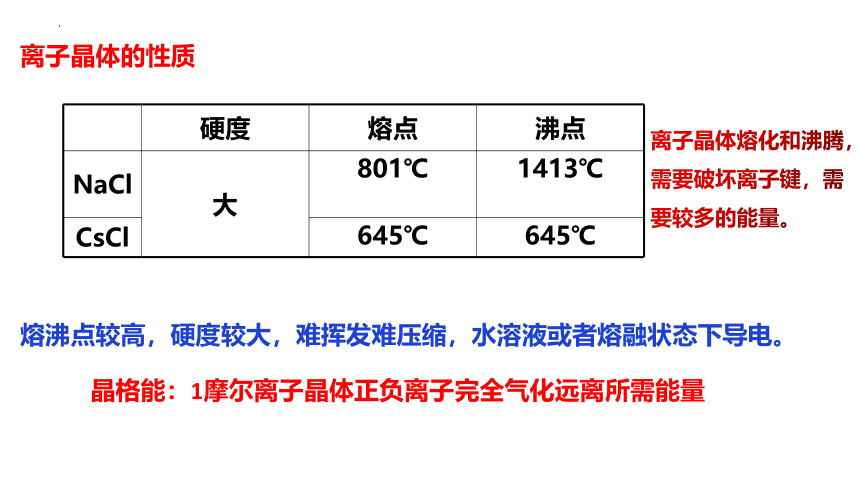
硬度 熔点 沸点
NaCl 大 801℃ 1413℃
CsCl 645℃ 645℃
离子晶体的性质
熔沸点较高,硬度较大,难挥发难压缩,水溶液或者熔融状态下导电。
离子晶体熔化和沸腾,需要破坏离子键,需要较多的能量。
晶格能:1摩尔离子晶体正负离子完全气化远离所需能量
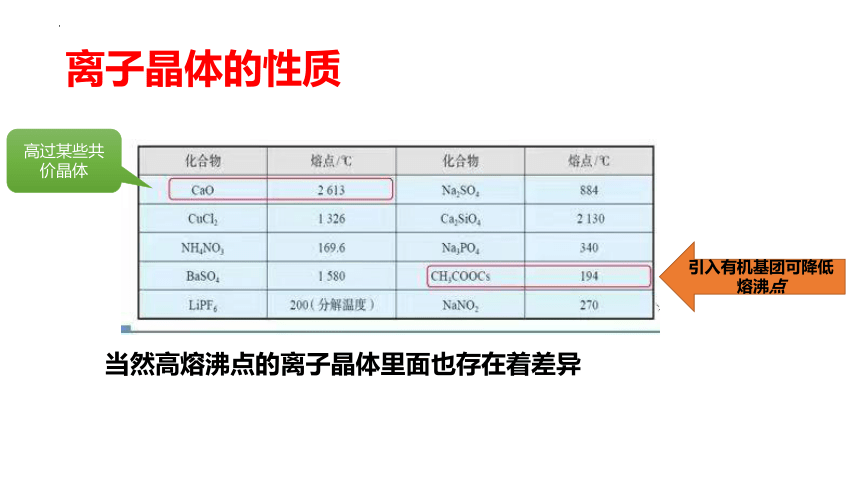
离子晶体的性质
当然高熔沸点的离子晶体里面也存在着差异
引入有机基团可降低熔沸点
高过某些共价晶体
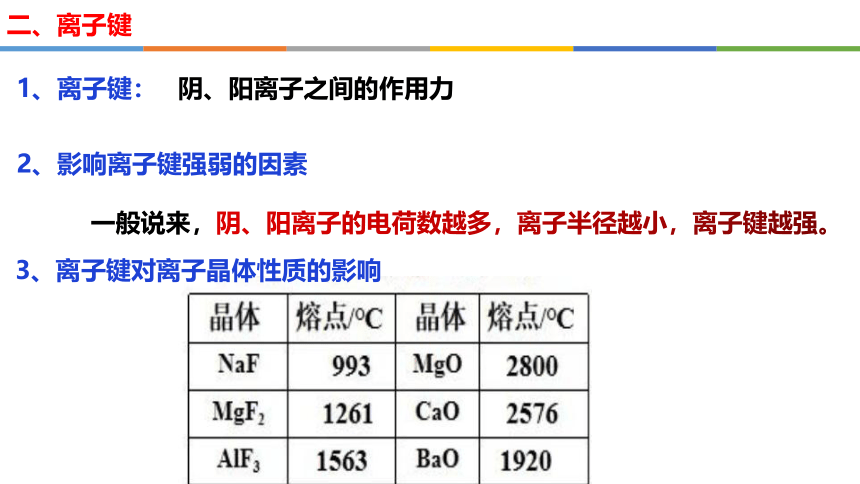
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强。
2、影响离子键强弱的因素
二、离子键
1、离子键:
3、离子键对离子晶体性质的影响
阴、阳离子之间的作用力
二、离子键
同为铝的卤化物,AlF3的熔点为1563℃,但氯化铝的只有193 ℃为什么差距如此之大呢?
氯化铝中两者电负性差距不大
(1)首先看物质的状态,一般情况下是固体>液体>气体;再看物质所属类型,一般是共价晶体>离子晶体>分子晶体
(2)结构类型相同时再根据相应规律进行判断。同类晶体熔、沸点比较思路:
分子晶体→分子间作用力→相对分子质量;
共价晶体→共价键键能→键长→原子半径;
离子晶体→离子键强弱→离子所带电荷数、离子半径;
金属晶体→金属键强弱→金属阳离子所带电荷、金属阳离子半径。
【归纳总结】比较不同晶体熔、沸点的基本思路
【归纳总结】
试一试
NaCl的晶胞示意图
CsCl的晶胞示意图
CaF2的晶胞示意图
二、离子晶体的晶胞
思考:氯化钠晶体中钠离子和氯离子分别处于晶胞的什么位置?
顶点和面心是钠离子
棱上和体心是氯离子
每个晶胞含钠离子和氯离子的个数:
钠离子和氯离子的个数比为
4、4
1:1
NaCl的晶胞
化学式:NaCl
每个Na+周围与之等距且距离最近的Cl-有___个,Na+有___个。
每个Cl-周围与之等距且距离最近的Na+有____个,Cl-有____个。
Cl-
Na+
6
12
6
12
配位数:一种离子周围最邻近的带相反电荷的离子数目
Na+的配位数为: ;
Cl-的配位数为: 。
6
6
NaCl晶体
Na+
Cl-
3
1
5
6
2
4
1
5
4
2
3
6
这几个Na+在空间构成的几何构型为__________
正八面体
NaCl晶体
(1)铯离子和氯离子的位置?
铯离子:
氯离子:
(2)每个晶胞含铯离子、氯离子的个数?
铯离子:
氯离子:
或者反之
1个;
1个。
体心
顶点
Cl-
Cs+
(3)配位数
它们所围成的空间几何构型是 。
8
正六面体
Cs+的配位数为: ;Cl-的配位数为: 。
8
CsCl晶体
每个Ca2+周围与之等距且距离最近的F-有___个,Ca2+有___个。
每个F-周围与之等距且距离最近的Ca2+有____个,F-有____个。
Ca2+的配位数为: 8 ;
F-的配位数为: 4 。
2.下列有关晶体的叙述中,错误的是( )。
A.干冰晶体中,每个CO 周围紧邻12个CO
B.氯化钠晶体中,每个Na+周围紧邻且距离相等的Na+共有6个
C.氯化铯晶体中,每个Cs周围紧邻8个CI-
D.金刚石为三维骨架结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
【学习评价】教材P102 2
B
【补充习题】
C
第三章 晶体结构与性质
3.3.2离子晶体
趣味引入
盐焗鸡,由客家人迁徙途中用盐包裹的“盐煨咸鸡”演变而来,其中鸡熟了盐却没化掉。但是做菜时加一抔水盐却溶解了。
强碱、活泼金属的氧化物和过氧化物、大多数盐
由阴离子和阳离子相互作用而形成的晶体,叫做离子晶体
常见的离子晶体( 离子化合物)
概念:
构成微粒:
微粒间的作用力:
阴、阳离子(有的存在中性分子H2O,NH3)
离子键为主(静电作用:包括静电引力和静电斥力)
一、离子晶体
无方向性与饱和性
固态
硫酸铜晶体易吸水失水,思考CuSO4.5H2O失水是什么变化?
硬度 熔点 沸点
NaCl 大 801℃ 1413℃
CsCl 645℃ 645℃
离子晶体的性质
熔沸点较高,硬度较大,难挥发难压缩,水溶液或者熔融状态下导电。
离子晶体熔化和沸腾,需要破坏离子键,需要较多的能量。
晶格能:1摩尔离子晶体正负离子完全气化远离所需能量
离子晶体的性质
当然高熔沸点的离子晶体里面也存在着差异
引入有机基团可降低熔沸点
高过某些共价晶体
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强。
2、影响离子键强弱的因素
二、离子键
1、离子键:
3、离子键对离子晶体性质的影响
阴、阳离子之间的作用力
二、离子键
同为铝的卤化物,AlF3的熔点为1563℃,但氯化铝的只有193 ℃为什么差距如此之大呢?
氯化铝中两者电负性差距不大
(1)首先看物质的状态,一般情况下是固体>液体>气体;再看物质所属类型,一般是共价晶体>离子晶体>分子晶体
(2)结构类型相同时再根据相应规律进行判断。同类晶体熔、沸点比较思路:
分子晶体→分子间作用力→相对分子质量;
共价晶体→共价键键能→键长→原子半径;
离子晶体→离子键强弱→离子所带电荷数、离子半径;
金属晶体→金属键强弱→金属阳离子所带电荷、金属阳离子半径。
【归纳总结】比较不同晶体熔、沸点的基本思路
【归纳总结】
试一试
NaCl的晶胞示意图
CsCl的晶胞示意图
CaF2的晶胞示意图
二、离子晶体的晶胞
思考:氯化钠晶体中钠离子和氯离子分别处于晶胞的什么位置?
顶点和面心是钠离子
棱上和体心是氯离子
每个晶胞含钠离子和氯离子的个数:
钠离子和氯离子的个数比为
4、4
1:1
NaCl的晶胞
化学式:NaCl
每个Na+周围与之等距且距离最近的Cl-有___个,Na+有___个。
每个Cl-周围与之等距且距离最近的Na+有____个,Cl-有____个。
Cl-
Na+
6
12
6
12
配位数:一种离子周围最邻近的带相反电荷的离子数目
Na+的配位数为: ;
Cl-的配位数为: 。
6
6
NaCl晶体
Na+
Cl-
3
1
5
6
2
4
1
5
4
2
3
6
这几个Na+在空间构成的几何构型为__________
正八面体
NaCl晶体
(1)铯离子和氯离子的位置?
铯离子:
氯离子:
(2)每个晶胞含铯离子、氯离子的个数?
铯离子:
氯离子:
或者反之
1个;
1个。
体心
顶点
Cl-
Cs+
(3)配位数
它们所围成的空间几何构型是 。
8
正六面体
Cs+的配位数为: ;Cl-的配位数为: 。
8
CsCl晶体
每个Ca2+周围与之等距且距离最近的F-有___个,Ca2+有___个。
每个F-周围与之等距且距离最近的Ca2+有____个,F-有____个。
Ca2+的配位数为: 8 ;
F-的配位数为: 4 。
2.下列有关晶体的叙述中,错误的是( )。
A.干冰晶体中,每个CO 周围紧邻12个CO
B.氯化钠晶体中,每个Na+周围紧邻且距离相等的Na+共有6个
C.氯化铯晶体中,每个Cs周围紧邻8个CI-
D.金刚石为三维骨架结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
【学习评价】教材P102 2
B
【补充习题】
C
