第1章第3节第2课时同主族元素性质递变规律课件(共25张PPT)2022-2023学年下学期高一化学鲁科版(2019)必修2
文档属性
| 名称 | 第1章第3节第2课时同主族元素性质递变规律课件(共25张PPT)2022-2023学年下学期高一化学鲁科版(2019)必修2 | 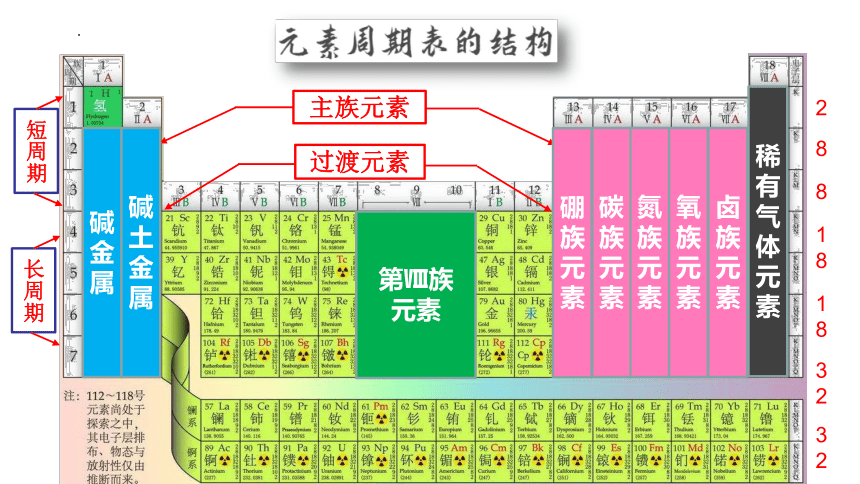 | |
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-22 16:59:51 | ||
图片预览





文档简介
(共25张PPT)
2
8
8
18
18
32
32
主族元素
碱金属
碱土金属
硼族元素
碳族元素
氮族元素
氧族元素
卤族元素
稀有气体元素
第Ⅷ族
元素
短周期
长周期
过渡元素
1
2
3
4
5
6
7
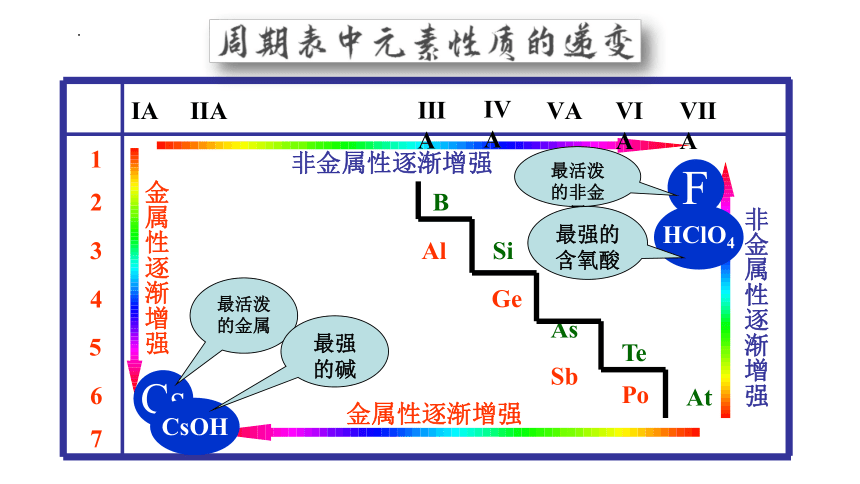
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
At
B
Al
Si
Ge
As
Sb
Te
Po
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
F
Cs
CsOH
HClO4
最活泼
的金属
最强的碱
最活泼
的非金属
最强的含氧酸
(3)根据元素氧化物对应水化物的酸碱性的强弱判断元素非金属性或金属性的强弱时,必须是其最高价氧化物的水化物。
(1)对于主族元素而言,元素的最高正化合价和主族序数相同,但是氧无最高正价,氟无正价,一般为零价或负价。
(2)判断元素非金属性或金属性的强弱,依据是元素原子在化学反应中得失电子的难易而不是得失电子的多少。
(4)同主族元素气态氢化物水溶液的酸性由上到下依次增强,和最高价氧化物水化物的酸性递变性不同 。
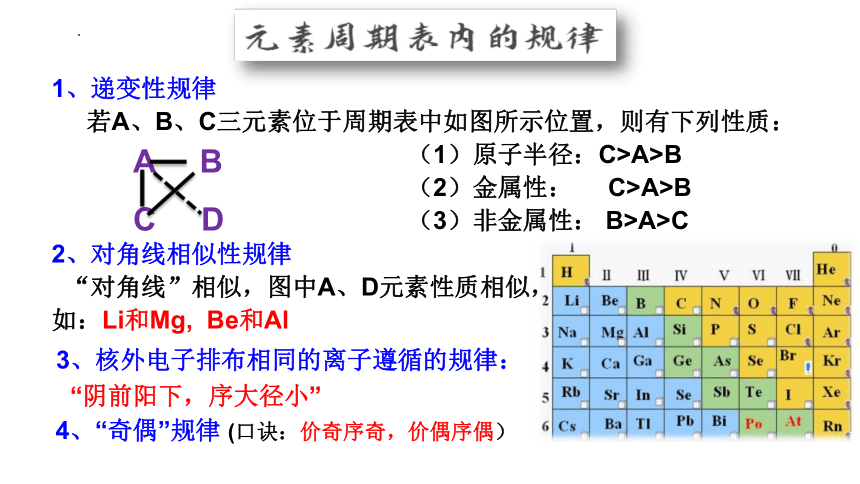
1、递变性规律
若A、B、C三元素位于周期表中如图所示位置,则有下列性质:
(1)原子半径:C>A>B
(2)金属性: C>A>B
(3)非金属性: B>A>C
2、对角线相似性规律
“对角线”相似,图中A、D元素性质相似,
如:Li和Mg, Be和Al
A B
C D
3、核外电子排布相同的离子遵循的规律:
“阴前阳下,序大径小”
4、“奇偶”规律 (口诀:价奇序奇,价偶序偶)
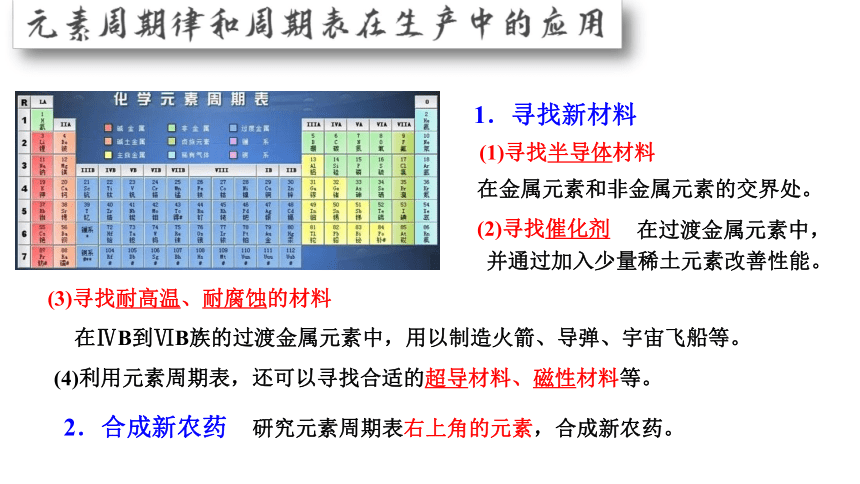
2.合成新农药 研究元素周期表右上角的元素,合成新农药。
1.寻找新材料
(1)寻找半导体材料
(2)寻找催化剂
在ⅣB到ⅥB族的过渡金属元素中,用以制造火箭、导弹、宇宙飞船等。
(4)利用元素周期表,还可以寻找合适的超导材料、磁性材料等。
在过渡金属元素中,
并通过加入少量稀土元素改善性能。
(3)寻找耐高温、耐腐蚀的材料
在金属元素和非金属元素的交界处。
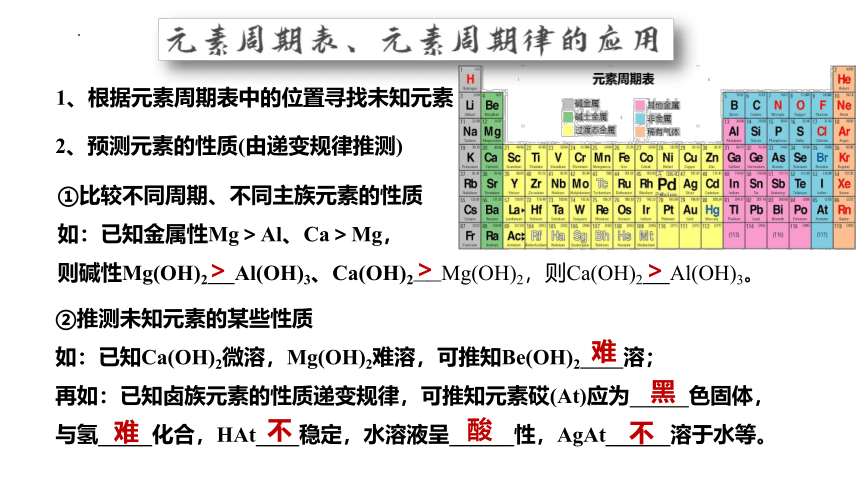
②推测未知元素的某些性质
如:已知Ca(OH)2微溶,Mg(OH)2难溶,可推知Be(OH)2 溶;
再如:已知卤族元素的性质递变规律,可推知元素砹(At)应为 色固体,
与氢_____化合,HAt____稳定,水溶液呈______性,AgAt______溶于水等。
1、根据元素周期表中的位置寻找未知元素
2、预测元素的性质(由递变规律推测)
①比较不同周期、不同主族元素的性质
如:已知金属性Mg>Al、Ca>Mg,
则碱性Mg(OH)2 Al(OH)3、Ca(OH)2——Mg(OH)2,则Ca(OH)2 Al(OH)3。
>
>
>
难
难
不
酸
不
黑
1.根据同周期、同主族元素性质的递变规律预测硅及其化合物的性质
(1)硅元素的原子结构及性质分析
原子结构 示意图 最高 正价 最低 负价 元素 类别 得电子
能力
_________ ___ ___ _______元素 _____
+4
-4
非金属
较弱
+4
-4
非金属
较弱
预测元素及其化合物的性质
硅及其化合物的化学式 化学性质预测 预测依据
能与O2、Cl2等发生化学反应
能与碱、碱性氧化物发生反应
具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸
与碳同主族,性质相似
SiO2属于酸性氧化物
硅得电子能力弱于碳和磷
能与比硅酸酸性强的一些酸反应,生成难溶于水的硅酸
硅元素得电子能力弱,硅酸酸性弱
Si
SiO2
H2SiO3
Na2SiO3
性质不太活泼
硅属于非金属单质
具有氧化性
SiO2中硅化合价为+4价
一、硅及其化合物 P29 Ⅳ A族
硅(Si)
1、含量和存在
硅元素在地壳中含量居第2位,是构成矿物和岩石的主要成分。
在自然界只以化合态存在(亲氧性),存在于SiO2和硅酸盐中
单质硅有晶体硅和无定形硅两种。
2、物理性质
晶体硅是灰黑色、硬而脆有金属光泽,熔沸点高、硬度大的固体,是重要的半导体材料。
岩石、沙子和土壤,计算机芯片、光导纤维、玻璃等,都含有硅或硅的化合物。
O、Si、Al、Fe、Ca
3、化学性质
(1)常温下,只和F2、HF、强碱反应
(2)加热时,能和Cl2、O2反应
Si+O2 == SiO2
△
Si+2Cl2 == SiCl4
△
Si+2F2 == SiF4
Si+4HF == SiF4+2H2
Si+2NaOH+H2O == Na2SiO3+2H2
常温下硅单质的化学性质不活泼
Si有亲F性(特性)
硅的工业制法
①制取粗硅原理
②粗硅提纯
Si+2Cl2 == SiCl4
SiCl4+2H2 == Si+4HCl
高温
高温
硅的应用---29页
芯片和太阳能电池
SiO2和焦炭
↑
SiO2+2C == Si+2CO
高温
↑
粗硅
1、沙子、石英、水晶的主要成分
结晶形
(石英晶体)
无定形——硅藻土
水晶
玛瑙
硅石
无色透明
彩色环带或层状
水晶
玛瑙
二氧化硅( SiO2 )
1mol SiO2
4 mol Si-O键.
( SiO2 )
物质 SiO2 CO2
状态(常温) 气体
熔点 -56.6℃
沸点 -78.5℃
溶解性 1:1
硬度
固体
1610℃
2230℃
不溶
大
2、二氧化硅的物理性质
硬度大、熔点高、难溶于水
a.SiO2+2NaOH ==Na2SiO3 +H2O
保存氢氧化钠不能用磨口的玻璃塞,应该用橡胶塞
b. SiO2 + CaO == CaSiO3
高温
②特性:与氢氟酸反应
SiO2+4HF = SiF4+2H2O
③与Na2CO3 、CaCO3高温反应
SiO2 + Na2CO3 = Na2SiO3 + CO2
高温
SiO2 + CaCO3 = CaSiO3 + CO2
高温
氢氟酸保存在塑料瓶中,不能保存在玻璃瓶中;刻蚀玻璃
碱液跟玻璃塞中的SiO2反应,生成的硅盐会把试剂瓶和玻璃塞粘连
①酸性氧化物的通性
SiO2+2C == Si+2CO
高温
↑
④弱氧化性
二氧化硅的应用-----光导纤维
二氧化硅常被用来制造高性能的现代通信材料——光导纤维(简称“光纤”)
硅酸H2SiO3
1、物理性质
白色沉淀,
2、化学性质
①硅酸不稳定,受热易分解
②与碱溶液反应
③在水中易聚合形成胶体
④硅酸制备
H2SiO3+2NaOH==Na2SiO3+2H2O
Na2SiO3+2HCl==2NaCl+H2SiO3
Na2SiO3+CO2+H2O==H2SiO3+Na2CO3
硅胶吸水分能力强,常用作干燥剂。
H2SiO3== SiO2+H2O
△
?
酸性比碳酸弱
能否用SiO2溶于水获得?
H4SiO4(原硅酸) = H2SiO3+H2O
其酸性比碳酸弱,硅酸不能使紫色石蕊溶液变红色
1.由硅、氧和金属组成的化合物的总称(二氧化硅和金属氧化物)
【表示方法】金属元素氧化物写在前面,再写SiO2,最后写H2O;
氧化物之间用“ · ”隔开。
硅酸盐
高岭石:Al2(Si2O5)(OH)4
Al2O3 ·2SiO2 · 2H2O
2.硅酸钠(Na2SiO3),其水溶液俗称水玻璃,是制备木材防火剂等的原料。
无机非金属材料
传统无机非金属材料:玻璃,水泥,陶瓷
新型无机非金属材料
高温结构陶瓷
压电陶瓷
生物陶瓷
超导陶瓷
最早使用的硅酸盐材料
玻璃 水泥 陶瓷
原料
反应 原理
主要 成分
特性
CaCO3+SiO2====CaSiO3+CO2
高温
Na2CO3+SiO2====Na2SiO3+CO2
高温
纯碱、石灰石、石英
粘土、石灰石
粘土
高温下发生复杂的物理、化学变化
烧结时发生复杂物理、化学变化
SiO2
CaSiO3
Na2SiO3
2CaO·SiO2 3CaO·SiO2 3CaO·Al2O3
硅酸盐
非晶体,透明、无固定熔点,可在一定温度范围内软化
水硬性:无论在水中还是在空气中均能硬化(是不可逆过程)
抗氧化、抗酸碱腐蚀、耐高温、绝缘
硅酸盐工业P29
碳化硅SiC(金刚砂)
氮化硅Si3N4
HF雕刻玻璃
[闪问] SiO2属于酸性氧化物,不和任何酸反应。这种说法正确吗
提示:不正确。SiO2可以与氢氟酸发生化学反应。
1.地壳中含量最多的元素或氢化物呈液态的元素 ;
2.空气中含量最多的元素或气态氢化物水溶液呈碱性的元素 ;
3.所形成化合物种类最多的元素或有单质是自然界中硬度最大的物质的元素 ;
4.地壳中含量最多的金属元素或常见氧化物、氢氧化物呈两性的元素 ;
5.最活泼的非金属元素或气态氢化物(无氧酸)可腐蚀玻璃或氢化物最稳定的元素 ;
O
N
C
Al
F
6.最活泼的金属元素或最高价氧化物对应水化物碱性最强的元素 ;
7.焰色反应呈黄色或紫色的元素 ;
8.最轻的单质的元素 ;最轻的金属元素 ;
9.元素的气态氢化物和它的最高价氧化物对应水化物能够化合的元素 ;能起氧化还原反应的元素 ;
10.元素的单质在常温下能与水反应放出气体的短周期元素; 。
11.具有漂白性的物质: 。
Cs
Na或 K
H
Li
N
S
Li Na F
氯水、二氧化硫、过氧化钠,双氧水(H2O2)
(2)Z元素的氧化物具有两性,请写出其氧化物与氢氧化钠溶液反应的离子方程式: __________________________________。
(3)Y元素的原子结构示意图:________________
(4)X元素形成的单质有石墨、金刚石等,二者互为______________(填“同素异形体”“同位素”或“同分异构体”)。
X Y
Z M
例:X、Y、Z、M是4种短周期主族元素,在周期表中的相对位置如下:
Z的单质既可以与盐酸反应也可以与氢氧化钠溶液反应,
室温下M的单质为淡黄色固体,回答下列问题:
(1)M元素在周期表中的位置是________________,X、Y元素的气态氢化物稳定性较强的是_____(填化学式)。
X Y
Z M
第三周期ⅥA族
NH3
同素异形体
Al
S
N
C
2
8
8
18
18
32
32
主族元素
碱金属
碱土金属
硼族元素
碳族元素
氮族元素
氧族元素
卤族元素
稀有气体元素
第Ⅷ族
元素
短周期
长周期
过渡元素
1
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
At
B
Al
Si
Ge
As
Sb
Te
Po
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
F
Cs
CsOH
HClO4
最活泼
的金属
最强的碱
最活泼
的非金属
最强的含氧酸
(3)根据元素氧化物对应水化物的酸碱性的强弱判断元素非金属性或金属性的强弱时,必须是其最高价氧化物的水化物。
(1)对于主族元素而言,元素的最高正化合价和主族序数相同,但是氧无最高正价,氟无正价,一般为零价或负价。
(2)判断元素非金属性或金属性的强弱,依据是元素原子在化学反应中得失电子的难易而不是得失电子的多少。
(4)同主族元素气态氢化物水溶液的酸性由上到下依次增强,和最高价氧化物水化物的酸性递变性不同 。
1、递变性规律
若A、B、C三元素位于周期表中如图所示位置,则有下列性质:
(1)原子半径:C>A>B
(2)金属性: C>A>B
(3)非金属性: B>A>C
2、对角线相似性规律
“对角线”相似,图中A、D元素性质相似,
如:Li和Mg, Be和Al
A B
C D
3、核外电子排布相同的离子遵循的规律:
“阴前阳下,序大径小”
4、“奇偶”规律 (口诀:价奇序奇,价偶序偶)
2.合成新农药 研究元素周期表右上角的元素,合成新农药。
1.寻找新材料
(1)寻找半导体材料
(2)寻找催化剂
在ⅣB到ⅥB族的过渡金属元素中,用以制造火箭、导弹、宇宙飞船等。
(4)利用元素周期表,还可以寻找合适的超导材料、磁性材料等。
在过渡金属元素中,
并通过加入少量稀土元素改善性能。
(3)寻找耐高温、耐腐蚀的材料
在金属元素和非金属元素的交界处。
②推测未知元素的某些性质
如:已知Ca(OH)2微溶,Mg(OH)2难溶,可推知Be(OH)2 溶;
再如:已知卤族元素的性质递变规律,可推知元素砹(At)应为 色固体,
与氢_____化合,HAt____稳定,水溶液呈______性,AgAt______溶于水等。
1、根据元素周期表中的位置寻找未知元素
2、预测元素的性质(由递变规律推测)
①比较不同周期、不同主族元素的性质
如:已知金属性Mg>Al、Ca>Mg,
则碱性Mg(OH)2 Al(OH)3、Ca(OH)2——Mg(OH)2,则Ca(OH)2 Al(OH)3。
>
>
>
难
难
不
酸
不
黑
1.根据同周期、同主族元素性质的递变规律预测硅及其化合物的性质
(1)硅元素的原子结构及性质分析
原子结构 示意图 最高 正价 最低 负价 元素 类别 得电子
能力
_________ ___ ___ _______元素 _____
+4
-4
非金属
较弱
+4
-4
非金属
较弱
预测元素及其化合物的性质
硅及其化合物的化学式 化学性质预测 预测依据
能与O2、Cl2等发生化学反应
能与碱、碱性氧化物发生反应
具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸
与碳同主族,性质相似
SiO2属于酸性氧化物
硅得电子能力弱于碳和磷
能与比硅酸酸性强的一些酸反应,生成难溶于水的硅酸
硅元素得电子能力弱,硅酸酸性弱
Si
SiO2
H2SiO3
Na2SiO3
性质不太活泼
硅属于非金属单质
具有氧化性
SiO2中硅化合价为+4价
一、硅及其化合物 P29 Ⅳ A族
硅(Si)
1、含量和存在
硅元素在地壳中含量居第2位,是构成矿物和岩石的主要成分。
在自然界只以化合态存在(亲氧性),存在于SiO2和硅酸盐中
单质硅有晶体硅和无定形硅两种。
2、物理性质
晶体硅是灰黑色、硬而脆有金属光泽,熔沸点高、硬度大的固体,是重要的半导体材料。
岩石、沙子和土壤,计算机芯片、光导纤维、玻璃等,都含有硅或硅的化合物。
O、Si、Al、Fe、Ca
3、化学性质
(1)常温下,只和F2、HF、强碱反应
(2)加热时,能和Cl2、O2反应
Si+O2 == SiO2
△
Si+2Cl2 == SiCl4
△
Si+2F2 == SiF4
Si+4HF == SiF4+2H2
Si+2NaOH+H2O == Na2SiO3+2H2
常温下硅单质的化学性质不活泼
Si有亲F性(特性)
硅的工业制法
①制取粗硅原理
②粗硅提纯
Si+2Cl2 == SiCl4
SiCl4+2H2 == Si+4HCl
高温
高温
硅的应用---29页
芯片和太阳能电池
SiO2和焦炭
↑
SiO2+2C == Si+2CO
高温
↑
粗硅
1、沙子、石英、水晶的主要成分
结晶形
(石英晶体)
无定形——硅藻土
水晶
玛瑙
硅石
无色透明
彩色环带或层状
水晶
玛瑙
二氧化硅( SiO2 )
1mol SiO2
4 mol Si-O键.
( SiO2 )
物质 SiO2 CO2
状态(常温) 气体
熔点 -56.6℃
沸点 -78.5℃
溶解性 1:1
硬度
固体
1610℃
2230℃
不溶
大
2、二氧化硅的物理性质
硬度大、熔点高、难溶于水
a.SiO2+2NaOH ==Na2SiO3 +H2O
保存氢氧化钠不能用磨口的玻璃塞,应该用橡胶塞
b. SiO2 + CaO == CaSiO3
高温
②特性:与氢氟酸反应
SiO2+4HF = SiF4+2H2O
③与Na2CO3 、CaCO3高温反应
SiO2 + Na2CO3 = Na2SiO3 + CO2
高温
SiO2 + CaCO3 = CaSiO3 + CO2
高温
氢氟酸保存在塑料瓶中,不能保存在玻璃瓶中;刻蚀玻璃
碱液跟玻璃塞中的SiO2反应,生成的硅盐会把试剂瓶和玻璃塞粘连
①酸性氧化物的通性
SiO2+2C == Si+2CO
高温
↑
④弱氧化性
二氧化硅的应用-----光导纤维
二氧化硅常被用来制造高性能的现代通信材料——光导纤维(简称“光纤”)
硅酸H2SiO3
1、物理性质
白色沉淀,
2、化学性质
①硅酸不稳定,受热易分解
②与碱溶液反应
③在水中易聚合形成胶体
④硅酸制备
H2SiO3+2NaOH==Na2SiO3+2H2O
Na2SiO3+2HCl==2NaCl+H2SiO3
Na2SiO3+CO2+H2O==H2SiO3+Na2CO3
硅胶吸水分能力强,常用作干燥剂。
H2SiO3== SiO2+H2O
△
?
酸性比碳酸弱
能否用SiO2溶于水获得?
H4SiO4(原硅酸) = H2SiO3+H2O
其酸性比碳酸弱,硅酸不能使紫色石蕊溶液变红色
1.由硅、氧和金属组成的化合物的总称(二氧化硅和金属氧化物)
【表示方法】金属元素氧化物写在前面,再写SiO2,最后写H2O;
氧化物之间用“ · ”隔开。
硅酸盐
高岭石:Al2(Si2O5)(OH)4
Al2O3 ·2SiO2 · 2H2O
2.硅酸钠(Na2SiO3),其水溶液俗称水玻璃,是制备木材防火剂等的原料。
无机非金属材料
传统无机非金属材料:玻璃,水泥,陶瓷
新型无机非金属材料
高温结构陶瓷
压电陶瓷
生物陶瓷
超导陶瓷
最早使用的硅酸盐材料
玻璃 水泥 陶瓷
原料
反应 原理
主要 成分
特性
CaCO3+SiO2====CaSiO3+CO2
高温
Na2CO3+SiO2====Na2SiO3+CO2
高温
纯碱、石灰石、石英
粘土、石灰石
粘土
高温下发生复杂的物理、化学变化
烧结时发生复杂物理、化学变化
SiO2
CaSiO3
Na2SiO3
2CaO·SiO2 3CaO·SiO2 3CaO·Al2O3
硅酸盐
非晶体,透明、无固定熔点,可在一定温度范围内软化
水硬性:无论在水中还是在空气中均能硬化(是不可逆过程)
抗氧化、抗酸碱腐蚀、耐高温、绝缘
硅酸盐工业P29
碳化硅SiC(金刚砂)
氮化硅Si3N4
HF雕刻玻璃
[闪问] SiO2属于酸性氧化物,不和任何酸反应。这种说法正确吗
提示:不正确。SiO2可以与氢氟酸发生化学反应。
1.地壳中含量最多的元素或氢化物呈液态的元素 ;
2.空气中含量最多的元素或气态氢化物水溶液呈碱性的元素 ;
3.所形成化合物种类最多的元素或有单质是自然界中硬度最大的物质的元素 ;
4.地壳中含量最多的金属元素或常见氧化物、氢氧化物呈两性的元素 ;
5.最活泼的非金属元素或气态氢化物(无氧酸)可腐蚀玻璃或氢化物最稳定的元素 ;
O
N
C
Al
F
6.最活泼的金属元素或最高价氧化物对应水化物碱性最强的元素 ;
7.焰色反应呈黄色或紫色的元素 ;
8.最轻的单质的元素 ;最轻的金属元素 ;
9.元素的气态氢化物和它的最高价氧化物对应水化物能够化合的元素 ;能起氧化还原反应的元素 ;
10.元素的单质在常温下能与水反应放出气体的短周期元素; 。
11.具有漂白性的物质: 。
Cs
Na或 K
H
Li
N
S
Li Na F
氯水、二氧化硫、过氧化钠,双氧水(H2O2)
(2)Z元素的氧化物具有两性,请写出其氧化物与氢氧化钠溶液反应的离子方程式: __________________________________。
(3)Y元素的原子结构示意图:________________
(4)X元素形成的单质有石墨、金刚石等,二者互为______________(填“同素异形体”“同位素”或“同分异构体”)。
X Y
Z M
例:X、Y、Z、M是4种短周期主族元素,在周期表中的相对位置如下:
Z的单质既可以与盐酸反应也可以与氢氧化钠溶液反应,
室温下M的单质为淡黄色固体,回答下列问题:
(1)M元素在周期表中的位置是________________,X、Y元素的气态氢化物稳定性较强的是_____(填化学式)。
X Y
Z M
第三周期ⅥA族
NH3
同素异形体
Al
S
N
C
