人教版(2019)高中化学必修第二册 《5.1.3 探究硫酸型酸雨的成因和防治-不同价态含硫物质的转化》名师学案(含答案)
文档属性
| 名称 | 人教版(2019)高中化学必修第二册 《5.1.3 探究硫酸型酸雨的成因和防治-不同价态含硫物质的转化》名师学案(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 184.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-23 08:55:33 | ||
图片预览


文档简介
探究酸雨的成因及防治
——不同价态含硫物质的转化
学习目标
知道含硫物质进入大气的主要途径,了解酸雨的成因及防治措施;
知道不同价态含硫物质可以相互转化,形成转化思维模型;
设计实验进行探究或验证,增强对氧化还原反应的认识。
学习过程
一、认识酸雨,发现转化关系
正常雨水的pH约为5.6,其形成过程中含碳物质的存在与转化如下图所示:
自主学习
请绘制酸雨形成过程中含硫物质的存在与转化示意图。
想一想
现有某地雨水样品500 mL,每隔一段时间测定其pH数据如下:
测定时间(小时) 0 1 2 4 8 10 12
雨水样品pH 4.70 4.62 4.56 4.55 4.55 4.55 4.55
雨水放置一段时间,pH逐渐减小后又保持不变的原因可能是什么?
二、防治酸雨,设计转化路径
思考与交流
防治酸雨,就需将燃煤烟气中的SO2气体转化为其他含硫物质。那么,可将SO2转化为哪些含硫物质呢?使用哪些试剂可以实现这些转化?
小结
物质转化思路:价态分析→转化目标→试剂选择
三、实验验证,构建转化模型
分组讨论
利用以下试剂,设计实验方案,验证SO2去除过程中发生了上述含硫物质的转化,并填写表格
试剂:SO2水溶液、酸性KMnO4溶液、H2O2溶液、Na2S溶液、稀盐酸、BaCl2溶液、
Ba(OH)2溶液
转化目标 (价态变化) 转化前的含硫物质 选择试剂 转化后的含硫物质 预期现象
+4 → +6 SO2
+4 → +6 SO2
+4 → 0 SO2
+4 → +4 SO2
小结
设计验证实验方案的原则:①现象明显;②操作简单;③安全环保
分组实验
小结 如何实现不同价态含硫物质的转化?
四、拓展延伸,应用转化模型
思考与交流
请设计出SO2转化为CaSO4的转化路径,并评价路径的优劣。
学习效果
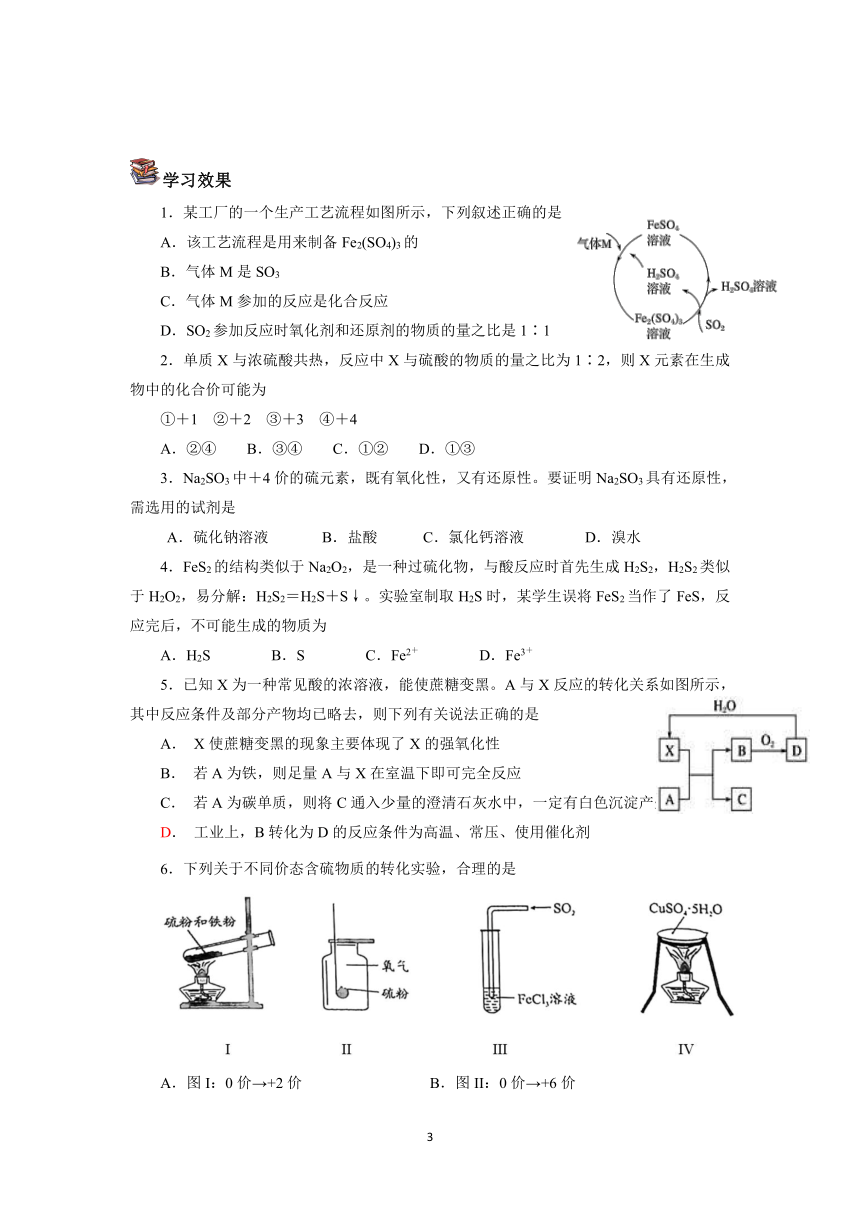
1.某工厂的一个生产工艺流程如图所示,下列叙述正确的是
A.该工艺流程是用来制备Fe2(SO4)3的
B.气体M是SO3
C.气体M参加的反应是化合反应
D.SO2参加反应时氧化剂和还原剂的物质的量之比是1∶1
2.单质X与浓硫酸共热,反应中X与硫酸的物质的量之比为1∶2,则X元素在生成物中的化合价可能为
①+1 ②+2 ③+3 ④+4
A.②④ B.③④ C.①② D.①③
3.Na2SO3中+4价的硫元素,既有氧化性,又有还原性。要证明Na2SO3具有还原性,需选用的试剂是
A.硫化钠溶液 B.盐酸 C.氯化钙溶液 D.溴水
4.FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时首先生成H2S2,H2S2类似于H2O2,易分解:H2S2=H2S+S↓。实验室制取H2S时,某学生误将FeS2当作了FeS,反应完后,不可能生成的物质为
A.H2S B.S C.Fe2+ D.Fe3+
5.已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是
A. X使蔗糖变黑的现象主要体现了X的强氧化性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水中,一定有白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
6.下列关于不同价态含硫物质的转化实验,合理的是
A.图I:0价→+2价 B.图II:0价→+6价
C.图III:+4价→+6价 D.图IV:+6价→+4价
7.已知A、B、C、D、E五种物质,它们是硫或硫的不同价态化合物,已知在一定条件下有如下未配平的转化关系。(注:每个关系式中化合价的升降都只有一处):①A+KOH→B+C+H2O ②C+E→B+H2O ③B+D→C+H2O ④C+Cl2+H2O→D+HCl,则这些物质中硫元素的化合价由低到高的顺序为( )
A.A < B < C < D < E B.D < C < A < B < E
C.E < B < A < C < D D.B < A < C < E < D
8.物质的类别和核心元素的化合价是研究物质性质的重要视角。以硫及其化合物的类别和价态变化为坐标的二维转化关系如图所示,下列说法错误的是
A.用BaCl2溶液可鉴别c和d
B.常温下,a和f的浓溶液反应可生成b和c
C.向e的水溶液中滴加几滴紫色石蕊试液,溶液先变红后褪色
D.常温下,等物质的量浓度的g、h两种钠盐溶液的pH:g>h
9.下面是几个不同价态的氮的化合物的相互转化关系(未配平),你认为一定不能实现的是
A.NO2+H2O→HNO3+NO B.NO+HNO3→N2O3+H2O
C.N2O4+H2O→HNO3+HNO2 D.NH3+NO→HNO2+H2O
10.研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。
Ⅰ.以下是硫元素形成物质的价类二维图及含硫物质相互转化的部分信息。
(1)B的化学式是___________。
(2)C有毒,实验室可以用NaOH溶液吸收,反应的化学方程式是___________。
(3)检验H中阴离子的实验操作及现象是___________。
(4)都是造成酸雨的可能途径,请写出这条转化路径的化学方程式:___________。
Ⅱ.某小组同学设计实验实现几种价态硫元素的转化。
(5)可选用的实验药品如下:①Na2SO3溶液 ②浓硫酸 ③Na2S溶液 ④稀硫酸 ⑤酸性KMnO4溶液 ⑥品红溶液 ⑦铜片
实验序号 预期转化 选择试剂(填序号) 证明实现转化的现象
ⅰ ___________ ___________
ⅱ ②、⑦、⑥
(6)实验ii中发生反应的化学方程式是___________,证明实现转化的现象是___________。
参考答案
题号 1 2 3 4 5 6 7 8 9
参考答案 D A D D D C C C D
10.(1)S (2)SO2+2NaOH=Na2SO3+H2O (3)取少量晶体于试管中,加适量水溶解,先滴加稀盐酸没有明显现象,再滴加BaCl2溶液有白色沉淀产生,则可推断该溶液中有 (4)2SO2(g)+O2(g)2SO3(g)、SO3+H2O=H2SO4 (5)①⑤ 酸性KMnO4溶液褪色 (6)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O Cu与浓硫酸混合加热,有气体放出,该气体使品红溶液褪色
1
——不同价态含硫物质的转化
学习目标
知道含硫物质进入大气的主要途径,了解酸雨的成因及防治措施;
知道不同价态含硫物质可以相互转化,形成转化思维模型;
设计实验进行探究或验证,增强对氧化还原反应的认识。
学习过程
一、认识酸雨,发现转化关系
正常雨水的pH约为5.6,其形成过程中含碳物质的存在与转化如下图所示:
自主学习
请绘制酸雨形成过程中含硫物质的存在与转化示意图。
想一想
现有某地雨水样品500 mL,每隔一段时间测定其pH数据如下:
测定时间(小时) 0 1 2 4 8 10 12
雨水样品pH 4.70 4.62 4.56 4.55 4.55 4.55 4.55
雨水放置一段时间,pH逐渐减小后又保持不变的原因可能是什么?
二、防治酸雨,设计转化路径
思考与交流
防治酸雨,就需将燃煤烟气中的SO2气体转化为其他含硫物质。那么,可将SO2转化为哪些含硫物质呢?使用哪些试剂可以实现这些转化?
小结
物质转化思路:价态分析→转化目标→试剂选择
三、实验验证,构建转化模型
分组讨论
利用以下试剂,设计实验方案,验证SO2去除过程中发生了上述含硫物质的转化,并填写表格
试剂:SO2水溶液、酸性KMnO4溶液、H2O2溶液、Na2S溶液、稀盐酸、BaCl2溶液、
Ba(OH)2溶液
转化目标 (价态变化) 转化前的含硫物质 选择试剂 转化后的含硫物质 预期现象
+4 → +6 SO2
+4 → +6 SO2
+4 → 0 SO2
+4 → +4 SO2
小结
设计验证实验方案的原则:①现象明显;②操作简单;③安全环保
分组实验
小结 如何实现不同价态含硫物质的转化?
四、拓展延伸,应用转化模型
思考与交流
请设计出SO2转化为CaSO4的转化路径,并评价路径的优劣。
学习效果
1.某工厂的一个生产工艺流程如图所示,下列叙述正确的是
A.该工艺流程是用来制备Fe2(SO4)3的
B.气体M是SO3
C.气体M参加的反应是化合反应
D.SO2参加反应时氧化剂和还原剂的物质的量之比是1∶1
2.单质X与浓硫酸共热,反应中X与硫酸的物质的量之比为1∶2,则X元素在生成物中的化合价可能为
①+1 ②+2 ③+3 ④+4
A.②④ B.③④ C.①② D.①③
3.Na2SO3中+4价的硫元素,既有氧化性,又有还原性。要证明Na2SO3具有还原性,需选用的试剂是
A.硫化钠溶液 B.盐酸 C.氯化钙溶液 D.溴水
4.FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时首先生成H2S2,H2S2类似于H2O2,易分解:H2S2=H2S+S↓。实验室制取H2S时,某学生误将FeS2当作了FeS,反应完后,不可能生成的物质为
A.H2S B.S C.Fe2+ D.Fe3+
5.已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是
A. X使蔗糖变黑的现象主要体现了X的强氧化性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水中,一定有白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
6.下列关于不同价态含硫物质的转化实验,合理的是
A.图I:0价→+2价 B.图II:0价→+6价
C.图III:+4价→+6价 D.图IV:+6价→+4价
7.已知A、B、C、D、E五种物质,它们是硫或硫的不同价态化合物,已知在一定条件下有如下未配平的转化关系。(注:每个关系式中化合价的升降都只有一处):①A+KOH→B+C+H2O ②C+E→B+H2O ③B+D→C+H2O ④C+Cl2+H2O→D+HCl,则这些物质中硫元素的化合价由低到高的顺序为( )
A.A < B < C < D < E B.D < C < A < B < E
C.E < B < A < C < D D.B < A < C < E < D
8.物质的类别和核心元素的化合价是研究物质性质的重要视角。以硫及其化合物的类别和价态变化为坐标的二维转化关系如图所示,下列说法错误的是
A.用BaCl2溶液可鉴别c和d
B.常温下,a和f的浓溶液反应可生成b和c
C.向e的水溶液中滴加几滴紫色石蕊试液,溶液先变红后褪色
D.常温下,等物质的量浓度的g、h两种钠盐溶液的pH:g>h
9.下面是几个不同价态的氮的化合物的相互转化关系(未配平),你认为一定不能实现的是
A.NO2+H2O→HNO3+NO B.NO+HNO3→N2O3+H2O
C.N2O4+H2O→HNO3+HNO2 D.NH3+NO→HNO2+H2O
10.研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。
Ⅰ.以下是硫元素形成物质的价类二维图及含硫物质相互转化的部分信息。
(1)B的化学式是___________。
(2)C有毒,实验室可以用NaOH溶液吸收,反应的化学方程式是___________。
(3)检验H中阴离子的实验操作及现象是___________。
(4)都是造成酸雨的可能途径,请写出这条转化路径的化学方程式:___________。
Ⅱ.某小组同学设计实验实现几种价态硫元素的转化。
(5)可选用的实验药品如下:①Na2SO3溶液 ②浓硫酸 ③Na2S溶液 ④稀硫酸 ⑤酸性KMnO4溶液 ⑥品红溶液 ⑦铜片
实验序号 预期转化 选择试剂(填序号) 证明实现转化的现象
ⅰ ___________ ___________
ⅱ ②、⑦、⑥
(6)实验ii中发生反应的化学方程式是___________,证明实现转化的现象是___________。
参考答案
题号 1 2 3 4 5 6 7 8 9
参考答案 D A D D D C C C D
10.(1)S (2)SO2+2NaOH=Na2SO3+H2O (3)取少量晶体于试管中,加适量水溶解,先滴加稀盐酸没有明显现象,再滴加BaCl2溶液有白色沉淀产生,则可推断该溶液中有 (4)2SO2(g)+O2(g)2SO3(g)、SO3+H2O=H2SO4 (5)①⑤ 酸性KMnO4溶液褪色 (6)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O Cu与浓硫酸混合加热,有气体放出,该气体使品红溶液褪色
1
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
