人教版(2019)高中化学必修第二册 《5.1.3 探究硫酸型酸雨的成因和防治-不同价态含硫物质的转化》名师课件(共14张PPT)
文档属性
| 名称 | 人教版(2019)高中化学必修第二册 《5.1.3 探究硫酸型酸雨的成因和防治-不同价态含硫物质的转化》名师课件(共14张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 20.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-23 09:09:19 | ||
图片预览




文档简介
(共14张PPT)
探究硫酸型酸雨的成因和防治
——不同价态含硫物质的转化
人教版必修二第五章第一节——硫及其化合物(第3课时)
SO2
SO3
H2SO3
H2SO4
+O2
+O2
+H2O
+H2O
S
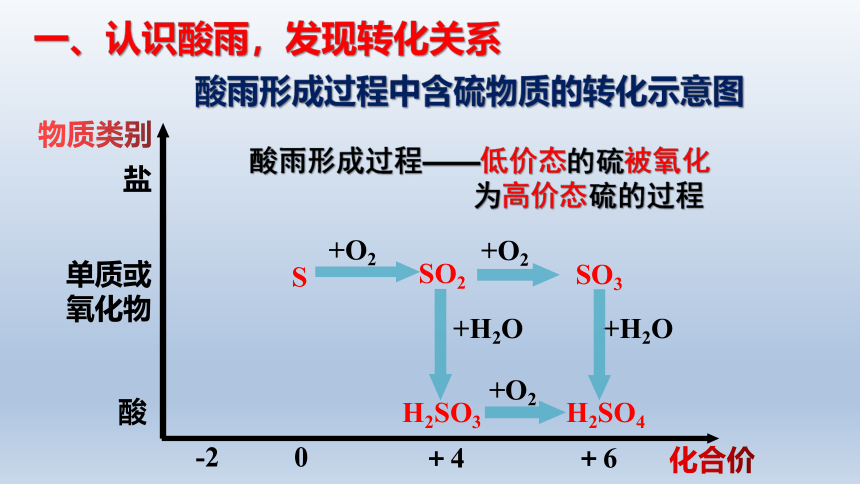
酸雨形成过程中含硫物质的转化示意图
单质或
氧化物
酸
盐
+O2
-2
0
+4
+6
化合价
物质类别
一、认识酸雨,发现转化关系
酸雨形成过程——低价态的硫被氧化
为高价态硫的过程
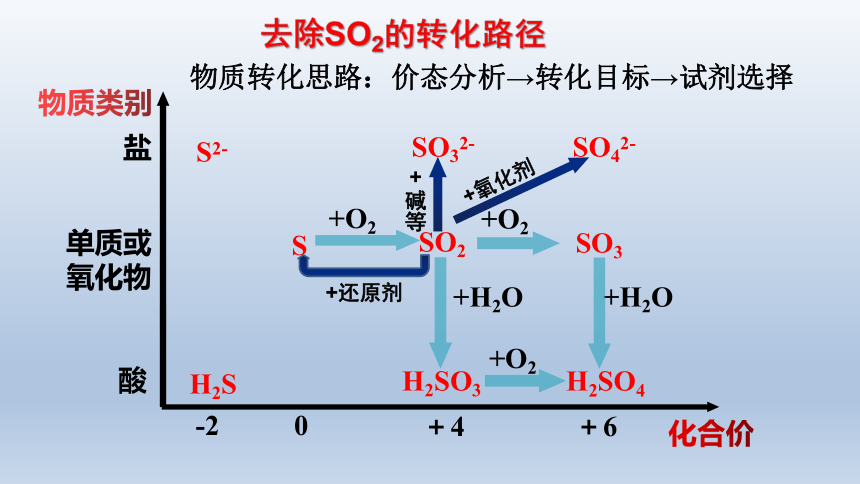
二、防治酸雨,设计转化路径
防治酸雨,就要将燃煤烟气中的SO2气体转化为其他对环境无污染或污染较小的含硫物质。那么, 可将SO2转化为哪些含硫物质?
SO2
SO3
H2SO3
H2SO4
+O2
+O2
+H2O
+H2O
S
单质或
氧化物
酸
盐
+O2
-2
0
+4
+6
化合价
物质类别
SO32-
SO42-
H2S
S2-
物质转化思路:价态分析→转化目标→试剂选择
+ 碱等
+氧化剂
+还原剂
去除SO2的转化路径
1、氧化剂能选择浓硫酸吗?
学与问
2、已知还原性的强弱顺序为:
S2->SO32-(SO2)>I->Fe2+,
则可选用哪种还原剂?
三、实验验证,构建转化模型
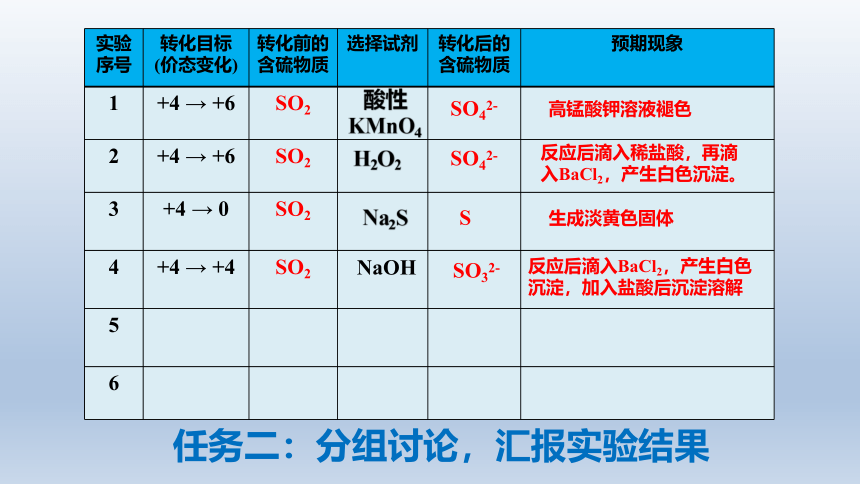
任务一:分组讨论,设计实验方案
利用以下试剂,设计实验方案,验证SO2去除过程中发生了上述含硫物质的转化,并填写表格
试剂:SO2、酸性KMnO4溶液、H2O2溶液、Na2S溶液、稀盐酸、BaCl2溶液、NaOH溶液
实验序号 转化目标 (价态变化) 转化前的含硫物质 选择试剂 转化后的含硫物质 预期现象
1 +4 → +6 SO2
2 +4 → +6 SO2
3 +4 → 0 SO2
4 +4 → +4 SO2
5
6
H2O2
生成淡黄色固体
反应后滴入BaCl2,产生白色沉淀,加入盐酸后沉淀溶解
反应后滴入稀盐酸,再滴入BaCl2,产生白色沉淀。
酸性KMnO4
SO42-
高锰酸钾溶液褪色
NaOH
S
SO42-
SO32-
Na2S
任务二:分组讨论,汇报实验结果
小结:如何实现不同价态含硫物质的转化?
S
S
S
S
-2
0
+4
+6
最低价,只有还原性
中间价,既有氧化性又有还原性
最高价,只有氧化性
化合价下降,加还原剂
化合价上升,加氧化剂
四、联系实际,应用转化模型
思考与交流
请设计出SO2转化为CaSO4的转化路径,并评价路径的优劣。
1.某工厂的一个生产工艺流程如图所示,下列叙述正确的是( )
A.该工艺流程是用来制备Fe2(SO4)3的
B.气体M是SO3
C.气体M参加的反应是化合反应
D.SO2参加反应时氧化剂和还原剂
的物质的量之比是1∶1
D
随堂检测
2.单质X与浓硫酸共热,反应中X与硫酸的物质的量之比为1∶2,则X元素在生成物中的化合价可能为( )
①+1 ②+2 ③+3 ④+4
A.②④ B.③④ C.①② D.①③
A
3.Na2SO3中+4价的硫元素,既有氧化性,又有还原性。要证明Na2SO3具有还原性,需选用的试剂是( )
A.硫化钠溶液 B.盐酸
C.氯化钙溶液 D.溴水
D
4.FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时首先生成H2S2,H2S2类似于H2O2,易分解:
H2S2=H2S+S↓。实验室制取H2S时,某学生误将FeS2当作了FeS,反应完后,不可能生成的物质为( )
A. H2S B. S
C. Fe2+ D. Fe3+
D
5.已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是
A. X使蔗糖变黑的现象主要体现了X的强氧化性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水中,一定有白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
D
探究硫酸型酸雨的成因和防治
——不同价态含硫物质的转化
人教版必修二第五章第一节——硫及其化合物(第3课时)
SO2
SO3
H2SO3
H2SO4
+O2
+O2
+H2O
+H2O
S
酸雨形成过程中含硫物质的转化示意图
单质或
氧化物
酸
盐
+O2
-2
0
+4
+6
化合价
物质类别
一、认识酸雨,发现转化关系
酸雨形成过程——低价态的硫被氧化
为高价态硫的过程
二、防治酸雨,设计转化路径
防治酸雨,就要将燃煤烟气中的SO2气体转化为其他对环境无污染或污染较小的含硫物质。那么, 可将SO2转化为哪些含硫物质?
SO2
SO3
H2SO3
H2SO4
+O2
+O2
+H2O
+H2O
S
单质或
氧化物
酸
盐
+O2
-2
0
+4
+6
化合价
物质类别
SO32-
SO42-
H2S
S2-
物质转化思路:价态分析→转化目标→试剂选择
+ 碱等
+氧化剂
+还原剂
去除SO2的转化路径
1、氧化剂能选择浓硫酸吗?
学与问
2、已知还原性的强弱顺序为:
S2->SO32-(SO2)>I->Fe2+,
则可选用哪种还原剂?
三、实验验证,构建转化模型
任务一:分组讨论,设计实验方案
利用以下试剂,设计实验方案,验证SO2去除过程中发生了上述含硫物质的转化,并填写表格
试剂:SO2、酸性KMnO4溶液、H2O2溶液、Na2S溶液、稀盐酸、BaCl2溶液、NaOH溶液
实验序号 转化目标 (价态变化) 转化前的含硫物质 选择试剂 转化后的含硫物质 预期现象
1 +4 → +6 SO2
2 +4 → +6 SO2
3 +4 → 0 SO2
4 +4 → +4 SO2
5
6
H2O2
生成淡黄色固体
反应后滴入BaCl2,产生白色沉淀,加入盐酸后沉淀溶解
反应后滴入稀盐酸,再滴入BaCl2,产生白色沉淀。
酸性KMnO4
SO42-
高锰酸钾溶液褪色
NaOH
S
SO42-
SO32-
Na2S
任务二:分组讨论,汇报实验结果
小结:如何实现不同价态含硫物质的转化?
S
S
S
S
-2
0
+4
+6
最低价,只有还原性
中间价,既有氧化性又有还原性
最高价,只有氧化性
化合价下降,加还原剂
化合价上升,加氧化剂
四、联系实际,应用转化模型
思考与交流
请设计出SO2转化为CaSO4的转化路径,并评价路径的优劣。
1.某工厂的一个生产工艺流程如图所示,下列叙述正确的是( )
A.该工艺流程是用来制备Fe2(SO4)3的
B.气体M是SO3
C.气体M参加的反应是化合反应
D.SO2参加反应时氧化剂和还原剂
的物质的量之比是1∶1
D
随堂检测
2.单质X与浓硫酸共热,反应中X与硫酸的物质的量之比为1∶2,则X元素在生成物中的化合价可能为( )
①+1 ②+2 ③+3 ④+4
A.②④ B.③④ C.①② D.①③
A
3.Na2SO3中+4价的硫元素,既有氧化性,又有还原性。要证明Na2SO3具有还原性,需选用的试剂是( )
A.硫化钠溶液 B.盐酸
C.氯化钙溶液 D.溴水
D
4.FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时首先生成H2S2,H2S2类似于H2O2,易分解:
H2S2=H2S+S↓。实验室制取H2S时,某学生误将FeS2当作了FeS,反应完后,不可能生成的物质为( )
A. H2S B. S
C. Fe2+ D. Fe3+
D
5.已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是
A. X使蔗糖变黑的现象主要体现了X的强氧化性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水中,一定有白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
D
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
