化学人教版(2019)选择性必修2 3.2.1 分子晶体(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.2.1 分子晶体(共30张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-23 10:46:50 | ||
图片预览










文档简介
(共30张PPT)
第三节 分子晶体与共价晶体
第三章 晶体结构与性质
第一课时
分子晶体
1. 熟知分子晶体的概念、结构特点及常见的分子晶体。
2. 能够从范德华力、氢键的特征,分析理解分子晶体的物理特性。
目标导航
晶体和非晶体的差异
固体 外观 微观结构 自范性 各向异性 熔点
晶体
非晶体
本质区别
鉴别 最科学的方法是用X—射线衍射实验
具有规则的几何外形
有
粒子在三维空间呈周期性有序排列
各向异性
固定
不具有规则的几何外形
没有
粒子排列相对无序
各向同性
不固定
微观粒子在三维空间是否呈现周期性有序排列
复习导课
请判断下列固体是否属于晶体?并说明理由。
雪花
食盐
钻石
玻璃
晶体
晶体
晶体
非晶体
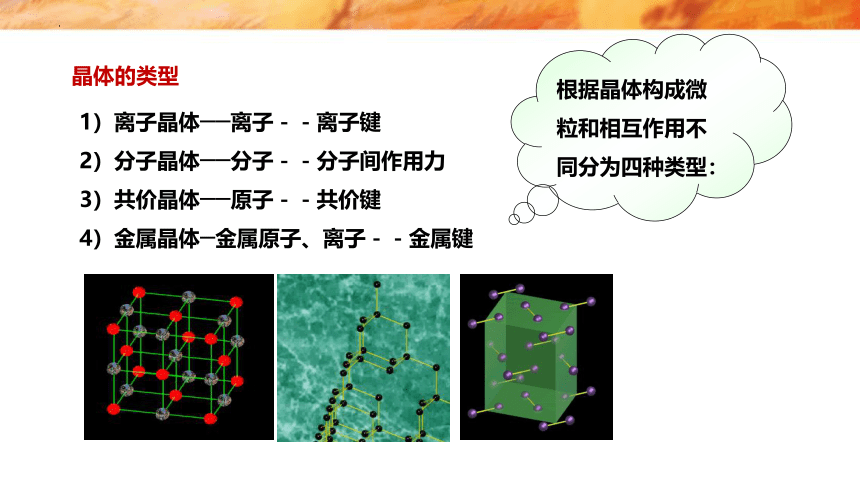
晶体的类型
1)离子晶体──离子--离子键
2)分子晶体──分子--分子间作用力
3)共价晶体──原子--共价键
4)金属晶体─金属原子、离子--金属键
根据晶体构成微粒和相互作用不同分为四种类型:
1. 概念:构成晶体的粒子是分子,粒子间以分子间作用力(范德华力,氢键)相互作用的晶体叫分子晶体。如碘晶体,I2分子,属于分子晶体。
(1)构成分子晶体的粒子是分子。
(2)粒子间的相互作用:分子内的原子间以共价键结合;而相邻分子靠分子间作用力或氢键相互吸引。
(3)范德华力远小于化学键的作用;
(4)分子晶体熔化或气化时破坏的是分子间作用力。一般不要破坏化学键
分子晶体
决定分子晶体的熔、沸点
原因:分子间作用力较弱
(1)较低的熔点和沸点,易升华;
(3)一般都是绝缘体,固态或熔融状态也不导电。有些在水溶液中可以导电;
(2)较小的硬度;
(4) 符合相似相溶(分子晶体的溶解性与溶质与溶剂的分子的极性相关 )
2.分子晶体的物理性质
注:①分子间作用力越大,熔沸点越高(相对分子质量,分子极性,氢键);② 分子晶体熔化时一般只破坏分子间作用力和氢键,不破坏化学键,也有例外,如S8。
如H2O是极性溶剂,SO2、H2S、HBr等都是极性分子,它们在水中的溶解度比N2、O2、CH4等非极性分子在水中的溶解度大
如HCl溶于水
问题探究1:分子晶体的物理性质是由什么决定的?如何比较分子晶体熔、沸点的高低?
提示:分子晶体是通过分子间相互作用力构成的,晶体在熔化时,破坏的只是分子间作用力,一般不需要破坏分子内的化学键,所以只需要外界提供较少的能量。因此,分子晶体的熔点通常较低,硬度也较小,有较强的挥发性。分子间作用力越强,分子晶体的熔、沸点越高,硬度越大。
(1)所有非金属氢化物:H2O,NH3, CH4,HX
(2)部分非金属单质:O2,S8,P4,C60 、稀有气体
(3)部分非金属氧化物:CO2,NO2,P4O6, P4O10
(4)几乎所有的酸:H2SO4,HNO3,H3PO4
(5)绝大多数有机物的晶体:乙醇,冰醋酸,蔗糖
3. 常见的分子晶体:
问题探究:分子晶体(如图)中粒子如何分布?
4.分子晶体的结构特征(分两种情况)
(1)密堆积
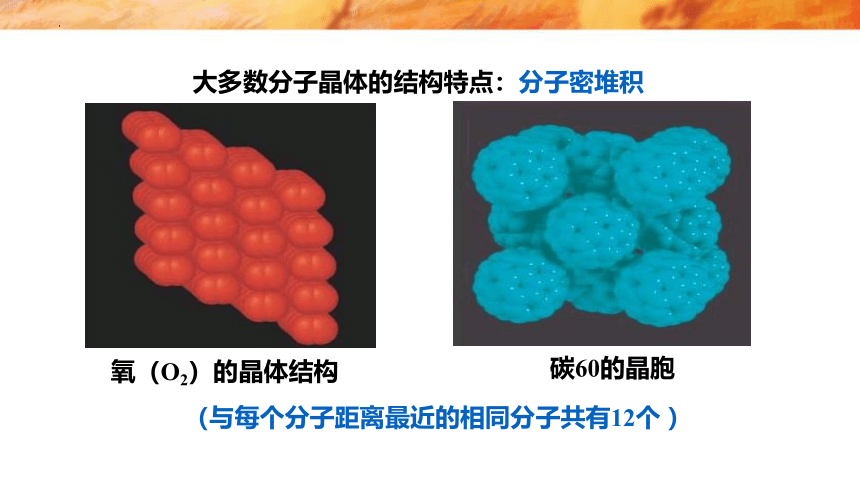
只有范德华力,无分子间氢键——分子密堆积。这类晶体每个分子周围一般有12个紧邻的分子,如:C60、干冰 、I2、O2。
(每个分子周围有12个紧邻的分子)
大多数分子晶体的结构特点:分子密堆积
(与每个分子距离最近的相同分子共有12个 )
氧(O2)的晶体结构
碳60的晶胞
分子密堆积
(与1个CO2分子距离最近的CO2分子共有____个 )
干冰的晶体结构图
12
(1)干冰
①每个晶胞中有_____个CO2分子, ________个原子。
②每个CO2分子周围等距紧邻的CO2分子有_____个。
③干冰在常压下极易升华,工业上广泛用作制冷剂。
4
12
12
4.分子晶体的结构特征(分两种情况)
(1)密堆积
(2)非密堆积
只有范德华力,无分子间氢键——分子密堆积。这类晶体每个分子周围一般有12个紧邻的分子,如:C60、干冰 、I2、O2。
(每个分子周围有12个紧邻的分子)
(每个分子周围紧邻的分子少于12个)
有分子间氢键——氢键具有方向性,使晶体中的空间利率不高,留有相当大的空隙。这种晶体不具有分子密堆积特征。如:HF 、NH3、冰(每个水分子周围只有4个紧邻的水分子)
冰中1个水分子周围有4个水分子
冰的结构
分子非密堆积
氢键具有方向性
冰中水分子之间的相互作用除范德华力外还有氢键,冰晶体主要是水分子靠氢键形成的,由于氢键具有一定的方向性,每个水分子与周围的4个水分子结合,4个水分子也按照这样的规律再与其它水分子结合。这样,每个水分子中的每个氧原子周围都有4个氢原子,氧原子与其中的2个氢原子通过共价键结合,因此他们之间的距离较近一些,与其他水分子的另外2个氢原子靠氢键结合在一起。在这种排列中,分子的间距比较大,有很多空隙,比较松散。因此,液态水变成固态水时,即水凝固成冰、雪、霜时,密度减小。
(2)冰
①水分子之间的作用力是_______、__________。
②冰中1个水分子周围有__个水分子形成四面体;属于____________。
③1mol冰中有___mol“氢键”。
氢键
范德华力
4
分子非密堆积
2
5.分子晶体的熔沸点比较规律:(比较分子间作用力)
a.分子间作用力越 ,物质的熔、沸点越 ;具有氢键的分子晶体熔、沸点反常地 。如H2O H2Te H2Se H2S。
大
高
高
>
>
>
b.组成和结构相似的分子晶体,相对分子质量越 ,熔、沸点越 ,如SnH4 GeH4 SiH4 CH4。
大
高
>
>
>
c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如CO>N2,CH3OH>CH3CH3。
d.同分异构体,支链越多,熔、沸点越低。
6.分子晶体的判断方法
(1)依据物质的类别判断
部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物都是分子晶体。
(2)依据组成晶体的粒子及粒子间作用力判断
组成分子晶体的微粒是分子,粒子间的作用力是分子间作用力。
(3)依据物质的性质判断
分子晶体的硬度小,熔、沸点低,在熔融状态或固体时均不导电。
(1)稀有气体的分子是单原子分子,由稀有气体单质形成的分子属于分子晶体。
(2)分子晶体具有熔、沸点较低,硬度较小,固态不导电等物理特性。所有在常温下呈气态的物质、常温下呈液态的物质(除汞外)、易升华的固体物质都属于分子晶体。
(3)分子间作用力的大小决定分子晶体的物理性质。分子间作用力越大,分子晶体的熔、沸点越高,硬度越大。
1. 分子晶体是否导电?什么条件下可以导电?
由于构成分子晶体的粒子是分子,不管是晶体或晶体熔化成的液体,都没有带电荷的离子存在,因此,分子晶体以及它熔化成的液体都不导电。
分子晶体溶于水时,水溶液有的能导电,如HCl溶于水,有的不导电,如C2H5OH溶于水。
深入探究
2. 为何分子晶体的硬度小,熔沸点低?
①构成晶体的微粒是分子
②分子之间以分子间作用力(主要是范德华力)相结合,范德华力远小于化学键的作用
3. 是不是在分子晶体中分子间只存在范德华力?
不对,分子间氢键也是一种分子间作用力,
如冰中就同时存在着范德华力和氢键。
4. 为何干冰的熔沸点比冰低,密度却比冰大?
由于冰中除了范德华力外还有氢键作用,破坏分子间作用力较难,所以熔沸点比干冰高。
在冰中由于氢键的方向性,导致晶体中有相当大的空隙,所以相同状况下冰的体积较大,密度比干冰小。
5. 为什么冰的密度比水的小,而4℃时的水的密度最大?
①氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙,体积较大,密度比水小
②当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度开始增大;
③超过4℃时,由于热运动加剧,分子间距离再次加大,密度又逐渐减小
6. 如何比较分子晶体熔沸点的高低?
①一般来说,分子晶体中范德华力越大,物质的熔、沸点越高。
②分子间氢键的形成使物质的熔、沸点升高;分子内氢键的形成使物质的熔、沸点降低。
许多气体可以与水形成水合物晶体。最早发现这类水合物晶体的是19世纪初的英国化学家戴维,他发现氯可形成化学式为Cl2·8H2O的水合物晶体。20世纪末,科学家发现海底存在大量天然气水合物晶体。这种晶体的主要气体成分是甲烷, 因而又称甲烷水合物。它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”………
科学视野
天然气水合物——一种潜在的能源
1. 分子晶体:由分子构成。相邻分子靠分子间作用力相互吸引。
2. 分子晶体特点:低熔沸点、升华、硬度很小等。
3. 常见分子晶体分类:(1)所有非金属氢化物;(2)部分非金属单质;(3)部分非金属氧化物;(4)几乎所有的酸(而碱和盐则是离子晶体 ) ;(5)绝大多数有机物的晶体。
4.分子晶体结构特征:(1)只有范德华力,无分子间氢键——分子密堆积(每个分子周围有12个紧邻的分子,如:C60、干冰 、O2);(2)有分子间氢键——不具有分子密堆积特征(如:HF 、冰、NH3 )。
课堂总结
1.下列物质属于分子晶体的化合物是( )
A.石英 B .硫磺 C .干冰 D .食盐
C
2.干冰气化时,下列所述内容发生变化的是( )
A.分子内共价键 B .分子间作用力
C .分子键距离 D .分子间的氢键
BC
3.冰醋酸固体中不存在的作用力是( )
A .离子键 B .极性键 C .非极性键 D .范德华力
A
当堂检测
4.水分子间存在着氢键的作用,使水分子彼此结合而
成(H2O)n。在冰中每个水分子被4个水分子包围形成变
形的正四面体,通过“氢键”相互连接成庞大的分子
晶体,其结构如图:试分析:
①1 mol 冰中有 mol 氢键?
②H2O的熔沸点比H2S高还是低?为什么?
③已知氢键也有方向性,试分析为什么冬季河水总是从水面上开始结冰?
2
氢键
提示:由于氢键的方向性,使冰晶体中每个水分子与四面体顶点的4个分子相互吸引,形成空隙较大的网状体,密度比水小,所以结的冰会浮在水面上。
第三节 分子晶体与共价晶体
第三章 晶体结构与性质
第一课时
分子晶体
1. 熟知分子晶体的概念、结构特点及常见的分子晶体。
2. 能够从范德华力、氢键的特征,分析理解分子晶体的物理特性。
目标导航
晶体和非晶体的差异
固体 外观 微观结构 自范性 各向异性 熔点
晶体
非晶体
本质区别
鉴别 最科学的方法是用X—射线衍射实验
具有规则的几何外形
有
粒子在三维空间呈周期性有序排列
各向异性
固定
不具有规则的几何外形
没有
粒子排列相对无序
各向同性
不固定
微观粒子在三维空间是否呈现周期性有序排列
复习导课
请判断下列固体是否属于晶体?并说明理由。
雪花
食盐
钻石
玻璃
晶体
晶体
晶体
非晶体
晶体的类型
1)离子晶体──离子--离子键
2)分子晶体──分子--分子间作用力
3)共价晶体──原子--共价键
4)金属晶体─金属原子、离子--金属键
根据晶体构成微粒和相互作用不同分为四种类型:
1. 概念:构成晶体的粒子是分子,粒子间以分子间作用力(范德华力,氢键)相互作用的晶体叫分子晶体。如碘晶体,I2分子,属于分子晶体。
(1)构成分子晶体的粒子是分子。
(2)粒子间的相互作用:分子内的原子间以共价键结合;而相邻分子靠分子间作用力或氢键相互吸引。
(3)范德华力远小于化学键的作用;
(4)分子晶体熔化或气化时破坏的是分子间作用力。一般不要破坏化学键
分子晶体
决定分子晶体的熔、沸点
原因:分子间作用力较弱
(1)较低的熔点和沸点,易升华;
(3)一般都是绝缘体,固态或熔融状态也不导电。有些在水溶液中可以导电;
(2)较小的硬度;
(4) 符合相似相溶(分子晶体的溶解性与溶质与溶剂的分子的极性相关 )
2.分子晶体的物理性质
注:①分子间作用力越大,熔沸点越高(相对分子质量,分子极性,氢键);② 分子晶体熔化时一般只破坏分子间作用力和氢键,不破坏化学键,也有例外,如S8。
如H2O是极性溶剂,SO2、H2S、HBr等都是极性分子,它们在水中的溶解度比N2、O2、CH4等非极性分子在水中的溶解度大
如HCl溶于水
问题探究1:分子晶体的物理性质是由什么决定的?如何比较分子晶体熔、沸点的高低?
提示:分子晶体是通过分子间相互作用力构成的,晶体在熔化时,破坏的只是分子间作用力,一般不需要破坏分子内的化学键,所以只需要外界提供较少的能量。因此,分子晶体的熔点通常较低,硬度也较小,有较强的挥发性。分子间作用力越强,分子晶体的熔、沸点越高,硬度越大。
(1)所有非金属氢化物:H2O,NH3, CH4,HX
(2)部分非金属单质:O2,S8,P4,C60 、稀有气体
(3)部分非金属氧化物:CO2,NO2,P4O6, P4O10
(4)几乎所有的酸:H2SO4,HNO3,H3PO4
(5)绝大多数有机物的晶体:乙醇,冰醋酸,蔗糖
3. 常见的分子晶体:
问题探究:分子晶体(如图)中粒子如何分布?
4.分子晶体的结构特征(分两种情况)
(1)密堆积
只有范德华力,无分子间氢键——分子密堆积。这类晶体每个分子周围一般有12个紧邻的分子,如:C60、干冰 、I2、O2。
(每个分子周围有12个紧邻的分子)
大多数分子晶体的结构特点:分子密堆积
(与每个分子距离最近的相同分子共有12个 )
氧(O2)的晶体结构
碳60的晶胞
分子密堆积
(与1个CO2分子距离最近的CO2分子共有____个 )
干冰的晶体结构图
12
(1)干冰
①每个晶胞中有_____个CO2分子, ________个原子。
②每个CO2分子周围等距紧邻的CO2分子有_____个。
③干冰在常压下极易升华,工业上广泛用作制冷剂。
4
12
12
4.分子晶体的结构特征(分两种情况)
(1)密堆积
(2)非密堆积
只有范德华力,无分子间氢键——分子密堆积。这类晶体每个分子周围一般有12个紧邻的分子,如:C60、干冰 、I2、O2。
(每个分子周围有12个紧邻的分子)
(每个分子周围紧邻的分子少于12个)
有分子间氢键——氢键具有方向性,使晶体中的空间利率不高,留有相当大的空隙。这种晶体不具有分子密堆积特征。如:HF 、NH3、冰(每个水分子周围只有4个紧邻的水分子)
冰中1个水分子周围有4个水分子
冰的结构
分子非密堆积
氢键具有方向性
冰中水分子之间的相互作用除范德华力外还有氢键,冰晶体主要是水分子靠氢键形成的,由于氢键具有一定的方向性,每个水分子与周围的4个水分子结合,4个水分子也按照这样的规律再与其它水分子结合。这样,每个水分子中的每个氧原子周围都有4个氢原子,氧原子与其中的2个氢原子通过共价键结合,因此他们之间的距离较近一些,与其他水分子的另外2个氢原子靠氢键结合在一起。在这种排列中,分子的间距比较大,有很多空隙,比较松散。因此,液态水变成固态水时,即水凝固成冰、雪、霜时,密度减小。
(2)冰
①水分子之间的作用力是_______、__________。
②冰中1个水分子周围有__个水分子形成四面体;属于____________。
③1mol冰中有___mol“氢键”。
氢键
范德华力
4
分子非密堆积
2
5.分子晶体的熔沸点比较规律:(比较分子间作用力)
a.分子间作用力越 ,物质的熔、沸点越 ;具有氢键的分子晶体熔、沸点反常地 。如H2O H2Te H2Se H2S。
大
高
高
>
>
>
b.组成和结构相似的分子晶体,相对分子质量越 ,熔、沸点越 ,如SnH4 GeH4 SiH4 CH4。
大
高
>
>
>
c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如CO>N2,CH3OH>CH3CH3。
d.同分异构体,支链越多,熔、沸点越低。
6.分子晶体的判断方法
(1)依据物质的类别判断
部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物都是分子晶体。
(2)依据组成晶体的粒子及粒子间作用力判断
组成分子晶体的微粒是分子,粒子间的作用力是分子间作用力。
(3)依据物质的性质判断
分子晶体的硬度小,熔、沸点低,在熔融状态或固体时均不导电。
(1)稀有气体的分子是单原子分子,由稀有气体单质形成的分子属于分子晶体。
(2)分子晶体具有熔、沸点较低,硬度较小,固态不导电等物理特性。所有在常温下呈气态的物质、常温下呈液态的物质(除汞外)、易升华的固体物质都属于分子晶体。
(3)分子间作用力的大小决定分子晶体的物理性质。分子间作用力越大,分子晶体的熔、沸点越高,硬度越大。
1. 分子晶体是否导电?什么条件下可以导电?
由于构成分子晶体的粒子是分子,不管是晶体或晶体熔化成的液体,都没有带电荷的离子存在,因此,分子晶体以及它熔化成的液体都不导电。
分子晶体溶于水时,水溶液有的能导电,如HCl溶于水,有的不导电,如C2H5OH溶于水。
深入探究
2. 为何分子晶体的硬度小,熔沸点低?
①构成晶体的微粒是分子
②分子之间以分子间作用力(主要是范德华力)相结合,范德华力远小于化学键的作用
3. 是不是在分子晶体中分子间只存在范德华力?
不对,分子间氢键也是一种分子间作用力,
如冰中就同时存在着范德华力和氢键。
4. 为何干冰的熔沸点比冰低,密度却比冰大?
由于冰中除了范德华力外还有氢键作用,破坏分子间作用力较难,所以熔沸点比干冰高。
在冰中由于氢键的方向性,导致晶体中有相当大的空隙,所以相同状况下冰的体积较大,密度比干冰小。
5. 为什么冰的密度比水的小,而4℃时的水的密度最大?
①氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙,体积较大,密度比水小
②当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度开始增大;
③超过4℃时,由于热运动加剧,分子间距离再次加大,密度又逐渐减小
6. 如何比较分子晶体熔沸点的高低?
①一般来说,分子晶体中范德华力越大,物质的熔、沸点越高。
②分子间氢键的形成使物质的熔、沸点升高;分子内氢键的形成使物质的熔、沸点降低。
许多气体可以与水形成水合物晶体。最早发现这类水合物晶体的是19世纪初的英国化学家戴维,他发现氯可形成化学式为Cl2·8H2O的水合物晶体。20世纪末,科学家发现海底存在大量天然气水合物晶体。这种晶体的主要气体成分是甲烷, 因而又称甲烷水合物。它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”………
科学视野
天然气水合物——一种潜在的能源
1. 分子晶体:由分子构成。相邻分子靠分子间作用力相互吸引。
2. 分子晶体特点:低熔沸点、升华、硬度很小等。
3. 常见分子晶体分类:(1)所有非金属氢化物;(2)部分非金属单质;(3)部分非金属氧化物;(4)几乎所有的酸(而碱和盐则是离子晶体 ) ;(5)绝大多数有机物的晶体。
4.分子晶体结构特征:(1)只有范德华力,无分子间氢键——分子密堆积(每个分子周围有12个紧邻的分子,如:C60、干冰 、O2);(2)有分子间氢键——不具有分子密堆积特征(如:HF 、冰、NH3 )。
课堂总结
1.下列物质属于分子晶体的化合物是( )
A.石英 B .硫磺 C .干冰 D .食盐
C
2.干冰气化时,下列所述内容发生变化的是( )
A.分子内共价键 B .分子间作用力
C .分子键距离 D .分子间的氢键
BC
3.冰醋酸固体中不存在的作用力是( )
A .离子键 B .极性键 C .非极性键 D .范德华力
A
当堂检测
4.水分子间存在着氢键的作用,使水分子彼此结合而
成(H2O)n。在冰中每个水分子被4个水分子包围形成变
形的正四面体,通过“氢键”相互连接成庞大的分子
晶体,其结构如图:试分析:
①1 mol 冰中有 mol 氢键?
②H2O的熔沸点比H2S高还是低?为什么?
③已知氢键也有方向性,试分析为什么冬季河水总是从水面上开始结冰?
2
氢键
提示:由于氢键的方向性,使冰晶体中每个水分子与四面体顶点的4个分子相互吸引,形成空隙较大的网状体,密度比水小,所以结的冰会浮在水面上。
